La tiroglobulina del lavado de aguja (Tg-PAAF) junto con la citología de la punción-aspiración con aguja fina (cito-PAAF) son procedimientos recomendados para el diagnóstico de metástasis ganglionares cervicales y recurrencias del cáncer diferenciado de tiroides. El objetivo de este estudio fue valorar la utilidad de estas técnicas en 16 lesiones cervicales de pacientes con cáncer de tiroides del epitelio folicular (CT).
Pacientes y métodoSe incluyeron 6 pacientes con CT y adenopatías laterocervicales evaluadas antes de la cirugía tiroidea inicial y 10 pacientes en seguimiento por CT ya operado y lesiones cervicales ecográficamente sospechosas y/o persistentes. Las 16 lesiones fueron sometidas a PAAF. Los resultados de la Tg-PAAF, cito-PAAF y de la combinación de ambas se compararon con el diagnóstico definitivo asignado a cada lesión.
ResultadosEn 10 lesiones comprobadamente malignas tras extirpación quirúrgica (9 metástasis ganglionares y una recurrencia en lecho), la cito-PAAF, la Tg-PAAF y la combinación de ambas técnicas permitieron llegar al diagnóstico correcto en 7, 9 y 10 casos respectivamente. En 6 lesiones consideradas benignas, la cito-PAAF pudo confirmar la benignidad de la lesión en 4, resultó no diagnóstica en una y falsamente positiva en otra, mientras que la Tg-PAAF se halló por debajo del valor de corte establecido (para considerar malignidad) en todos los casos.
ConclusionesEn pacientes con CT y lesiones cervicales sospechosas, la Tg-PAAF mejora la rentabilidad diagnóstica de la cito-PAAF aislada justificándose así su recomendación sistemática al realizar la PAAF. Quedan sin embargo por definir una estandarización universal de la técnica y unos valores de corte válidos de Tg-PAAF (de acuerdo al inmunoanálisis empleado) por encima de los cuales considerar la lesión maligna.
Thyroglobulin in the needle washout (Tg-FNA) and cytology of fine needle aspiration (cyto-FNA) are recommended for diagnosis of metastatic lymphadenopathies and recurrence of differentiated thyroid cancer. The objective of this study was to assess the value of these procedures in 16 cervical masses from patients with thyroid cancer of the follicular epithelium (TC).
Patients and methodsThe study included six patients with TC and cervical lymphadenopathies evaluated before initial thyroid surgery and 10 patients followed up after TC surgery with cervical lumps discovered. FNA was performed in all 16 masses. Results of cyto-FNA, Tg-FNA and of the combined tests were compared to the final diagnosis of each lesion.
ResultsAmong 10 lesions proven to be malignant at surgery, cyto-FNA, Tg-FNA and the combination of both allowed for adequate diagnosis in 7, 9, and 10 cases respectively. Among 6 lesions considered to be benign, cyto-FNA was able to confirm diagnosis in 4, was non-diagnostic in one, and was falsely negative in the remaining case, while Tg-FNA was below the established cut-off value (to consider malignancy) in all cases.
ConclusionsIn patients with TC and suspect cervical masses, Tg-FNA improved the diagnostic yield of cyto-FNA alone, thus warranting its routine recommendation when FNA is performed. However, universal standardization of the technique and definition of valid cut-off thyroglobulin values (depending on the immunoassay used) above which the lesion should be considered to be malignant are still pending.
Cerca del 5 al 20% de los pacientes con cáncer diferenciado de tiroides (CDT) presentan metástasis (MTS) locorregionales en cuello halladas a lo largo de su seguimiento1,2. Además, el 20 a 31% son portadores de MTS ganglionares cervicales3,4 evidenciadas con la ecografía inicial recomendada antes de la tiroidectomía por las distintas guías y consensos5,6. Muchos, aunque no todos los estudios7–9, señalan un peor pronóstico en los sujetos con MTS ganglionares al diagnóstico y con enfermedad recurrente (en forma de MTS ganglionares o de recurrencia en lecho), aconsejando la extirpación de estas lesiones10 mediante una disección ganglionar funcional en caso de MTS ganglionares11,12.
Algunos instrumentos diagnósticos, como la ecografía de cuello ultrasensible y los inmunoanálisis para la tiroglobulina sérica, gracias a su perfeccionamiento técnico, son en gran medida responsables de una importante mejoría en la identificación de la enfermedad recurrente. Así, desde los años 90, la mayor sensibilidad de los inmunoanálisis para la tiroglobulina sérica permite el diagnóstico más temprano de la enfermedad recurrente (pasada la tiroidectomía total seguida habitualmente de dosis ablativa de yodo radiactivo) y el diagnóstico de la mayoría de las recurrencias gracias a la estimulación de la tiroglobulina suspendiendo la levotiroxina o con TSH recombinante13,14. Los inconvenientes de la tiroglobulina sérica incluyen: una limitada utilidad cuando los anticuerpos (AC) antitiroglobulina séricos son positivos (en cerca del 25% de los casos de CDT15) y la falta de información acerca de la ubicación de la recidiva. A diferencia de la tiroglobulina, la ecografía de cuello es una prueba de imagen que no solo es altamente sensible para lesiones sospechosas durante el seguimiento del CDT, permitiendo así su resección potencialmente curativa, sino también para MTS ganglionares en cuello evidenciadas antes de la primera cirugía, modificando esta desde una tiroidectomía total (con o sin vaciamiento ganglionar central) a una tiroidectomía acompañada de vaciamiento ganglionar laterocervical5. La ecografía adquiere además un interés particular en el CDT por la localización en el cuello de la enfermedad recurrente en la mayoría de la ocasiones16,17. Sin embargo, su elevada resolución lleva a menudo a la identificación de adenopatías o lesiones cervicales distintas a las MTS por cáncer de tiroides como son MTS por neoplasias no tiroideas, linfadenitis específicas o linfadenitis reactivas extraordinariamente frecuentes18–20, y pese a la descripción de criterios ecográficos de sospecha de malignidad21, estos carecen en muchas ocasiones de la especificidad suficiente para el diagnóstico diferencial entre MTS por CDT y adenopatías de otras etiologías22.
Con objeto de incrementar la rentabilidad diagnóstica de la ecografía, se recomienda el estudio citológico de aquellas lesiones sospechosas con punción-aspiración con aguja fina (PAAF)6,23 que, por un lado, mejora sustancialmente el diagnóstico de MTS por cáncer de tiroides24 y, por otro, permite con frecuencia descartar la malignidad de las adenopatías estudiadas. Pese a ello, la citología de la PAAF deja sin diagnosticar un número significativo de MTS en relación con el elevado porcentaje de resultados no diagnósticos o insuficientes (5-25%)22,25,26 y falsamente negativos (6 a 8%)27,28. En estos casos, la limitación de la PAAF se debe esencialmente a la ausencia de material celular epitelial o a la degeneración celular, impidiendo el reconocimiento de las células tumorales necesarias para la confirmación diagnóstica. La falta de material celular se atribuye a distintos factores que incluyen: el pequeño tamaño de la MTS ganglionar que dificulta la adquisición correcta de material29 y la frecuente transformación quística del ganglio con MTS de carcinoma papilar que lleva a la ausencia o escasez de células para estudio en la PAAF30,31.
Basados en los buenos resultados publicados acerca de la determinación de la tiroglobulina en el lavado de la aguja con la que se realiza la PAAF de las lesiones sospechosas32–36 tanto el Consenso Europeo6 como las Guías de ATA5 recomiendan combinar la información proporcionada por la tiroglobulina del lavado de aguja (Tg-PAAF) con la de la citología (cito-PAAF).
El objetivo de este estudio fue valorar la utilidad, en nuestro centro, de la Tg-PAAF añadida a la cito-PAAF en lesiones cervicales de pacientes diagnosticados de carcinoma tiroideo originado en el epitelio folicular.
Pacientes y métodosPacientesSe incluyeron 16 pacientes con carcinoma tiroideo del epitelio folicular (uno con carcinoma insular, 12 con carcinoma papilar tiroideo [CPT] de las variantes clásica o folicular, un CPT de la variante esclerosante difusa, un CPT de la variante columnar y un CPT de variante no conocida) en los que se realizó la PAAF (para estudio citológico y determinación de tiroglobulina en lavado de aguja) de una lesión sospechosa ubicada en el cuello. Todos las PAAF se llevaron a cabo en el Hospital Universitario de Móstoles (Madrid) entre julio de 2010 y julio de 2012.
En 6 sujetos, la PAAF se realizó antes de la tiroidectomía total en adenopatías evidenciadas con ecografía previa a la cirugía. Cinco de estas adenopatías ubicadas en las cadenas laterales (niveles: ii, iii o iv) presentaban al menos un criterio radiológico de sospecha y una adenopatía, en el nivel v, presentaba un aspecto reactivo. Se consideraron sospechosos los siguientes rasgos ecográficos: la morfología redondeada en un corte transversal (cociente eje largo/eje corto inferior a 2), la pérdida del hilio graso ecogénico, la presencia de cambios quísticos, la heterogeneidad interna y un patrón de vascularización interna irregular o periférico.
En los otros 10 pacientes ya operados por cáncer de tiroides (todos sometidos al menos a una tiroidectomía total y una dosis terapéutica de yodo 131) las lesiones sometidas a PAAF se ubicaban a nivel del lecho tiroideo o próximas al mismo en 2 casos, en adenopatías laterocervicales en 7 (4 de ellas ecográficamente sospechosas y 3 persistentes en el tiempo) y en glándula parótida izquierda en un paciente. Cinco de estos 10 pacientes, en el momento de la PAAF, presentaban valores de tiroglobulina sérica basal o estimulada con TSH recombinante sugerentes de enfermedad persistente mientras que en los otros 5 casos tanto la tiroglobulina sérica basal como estimulada resultó inferior a 2ng/ml coincidiendo con valores positivos de AC antitiroglobulina tan solo en uno de ellos.
Ecografía-punción-aspiración con aguja fina y tiroglobulina-punción-aspiración con aguja finaTodas la PAAF se realizaron tras consentimiento informado bajo control ecográfico y estando el cuello del paciente en hiperextensión con una aguja de 21 a 25 gauge conectada a una jeringa de 10ml. El material obtenido se extendió en un porta para estudio citológico por el anatomopatólogo. La aguja se lavó con 1ml de suero salino fisiológico utilizando para ello la jeringa empleada durante la aspiración y repitiendo el lavado a través de la aguja hasta 3 veces para la recogida de la máxima cantidad de material. El líquido así obtenido se remitió al laboratorio en un tubo seco para la determinación de tiroglobulina. La tiroglobulina se midió en el lavado de aguja en las 16 lesiones y también en el suero de los 10 pacientes con antecedentes de tiroidectomía con inmunoanálisis de electroquimioluminiscencia (autoanalizador modular Analytics E-170 Roche Diagnostics) con límites de sensibilidad analítica y funcional de 0,1ng/ml y de 1ng/ml respectivamente. En los 10 pacientes en lo que se determinó la tiroglobulina sérica, los AC antitiroglobulina se midieron simultáneamente en suero con ensayo inmunométrico enzimático Inmulite 2000 (Siemens) con limite de sensibilidad analítica de 2,2UI/ml y valores normales inferiores a 40UI/ml.
Análisis e interpretación de los datosLos resultados de la cito-PAAF se clasificaron en 3 grupos:
- -
Cito-PAAF no diagnóstica: ausencia de células epiteliales, linfocitos o células plasmáticas con la posible presencia de células sanguíneas.
- -
Cito-PAAF negativa: linfadenitis reactiva (linfocitos con células plasmáticas ocasionales y ausencia de células epiteliales) o compatible con lesión benigna de otra etiología.
- -
Cito-PAAF positiva: compatible con carcinoma tiroideo o sospechosa por la presencia de células epiteliales atípicas o con rasgos citológicos de CPT.
Dada la descripción de valores detectables de tiroglobulina en el lavado de aguja de la PAAF de adenopatías no metastásicas por cáncer de tiroides en múltiples trabajos27,32,37–42, la Tg-PAAF se consideró positiva (indicadora de MTS por cáncer de tiroides) con valores por encima de 7,4ng/ml que fue el valor de corte empleado en el estudio de Cignarelli et al.37(equivalente a la media más 2 desviaciones estándar del valor hallado en adenopatías no metastásicas por cáncer tiroideo) y se definió como negativa (no indicadora de MTS por cáncer tiroideo) con valores inferiores a 7,4ng/ml.
Se compararon los resultados de la cito-PAAF y de la Tg-PAAF (por separado y en combinación) con el diagnóstico definitivo asignado a cada lesión. El diagnóstico definitivo de malignidad tiroidea se basó en la histopatología tras extirpación quirúrgica. El diagnóstico definitivo de benignidad se definió bien con el estudio histológico de la lesión operada bien con la evolución cronológica de la lesión (desaparición ecográfica o descenso significativo del tamaño). Para el cálculo de la rentabilidad diagnóstica de la cito-PAAF se consideraron falsos negativos todas aquellas lesiones finalmente malignas no identificadas con el estudio citológico (cito-PAAF no diagnóstica y cito-PAAF negativa).
ResultadosLesiones malignasEn 10 casos se confirmó la malignidad tras extirpación quirúrgica de las lesiones (una recurrencia en lecho y 9 MTS ganglionares) representadas por 5 adenopatías identificadas antes de la cirugía inicial y por 5 lesiones halladas durante el seguimiento de pacientes con antecedentes de CDT (tabla 1). En 4 de estos 5 pacientes, la tiroglobulina sérica basal o estimulada con TSH recombinante sugería enfermedad persistente (superior a 2ng/ml, en ausencia de AC antitiroglobulina) mientras que en uno de estos 5 casos la tiroglobulina sérica fue indetectable aunque con un título de AC antitiroglobulina de 2.902UI/ml.
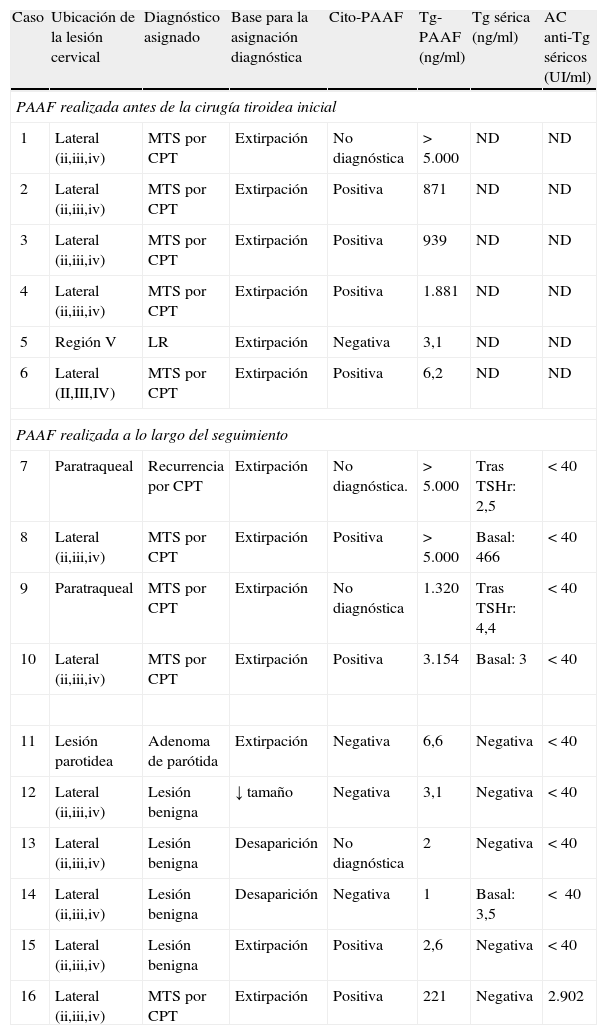
Resultados individuales de la cito-PAAF, Tg-PAAF y diagnóstico definitivo de las 16 lesiones cervicales sometidas a PAAF
| Caso | Ubicación de la lesión cervical | Diagnóstico asignado | Base para la asignación diagnóstica | Cito-PAAF | Tg-PAAF (ng/ml) | Tg sérica (ng/ml) | AC anti-Tg séricos (UI/ml) |
| PAAF realizada antes de la cirugía tiroidea inicial | |||||||
| 1 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | No diagnóstica | >5.000 | ND | ND |
| 2 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | 871 | ND | ND |
| 3 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | 939 | ND | ND |
| 4 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | 1.881 | ND | ND |
| 5 | Región V | LR | Extirpación | Negativa | 3,1 | ND | ND |
| 6 | Lateral (II,III,IV) | MTS por CPT | Extirpación | Positiva | 6,2 | ND | ND |
| PAAF realizada a lo largo del seguimiento | |||||||
| 7 | Paratraqueal | Recurrencia por CPT | Extirpación | No diagnóstica. | >5.000 | Tras TSHr: 2,5 | <40 |
| 8 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | >5.000 | Basal: 466 | <40 |
| 9 | Paratraqueal | MTS por CPT | Extirpación | No diagnóstica | 1.320 | Tras TSHr: 4,4 | <40 |
| 10 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | 3.154 | Basal: 3 | <40 |
| 11 | Lesión parotidea | Adenoma de parótida | Extirpación | Negativa | 6,6 | Negativa | <40 |
| 12 | Lateral (ii,iii,iv) | Lesión benigna | ↓ tamaño | Negativa | 3,1 | Negativa | <40 |
| 13 | Lateral (ii,iii,iv) | Lesión benigna | Desaparición | No diagnóstica | 2 | Negativa | <40 |
| 14 | Lateral (ii,iii,iv) | Lesión benigna | Desaparición | Negativa | 1 | Basal: 3,5 | < 40 |
| 15 | Lateral (ii,iii,iv) | Lesión benigna | Extirpación | Positiva | 2,6 | Negativa | <40 |
| 16 | Lateral (ii,iii,iv) | MTS por CPT | Extirpación | Positiva | 221 | Negativa | 2.902 |
LR: linfadenitis reactiva; Cito-PAAF positiva: citología con células malignas o sospechosa de malignidad; Cito-PAAF negativa: citología con resultado de benignidad; CPT: carcinoma papilar tiroideo; MTS: metástasis; ND: no determinado; PAAF: punción-aspiración con aguja fina; Tg: tiroglobulina; TSHr: TSH recombinante.
La cito-PAAF resultó positiva en 7 de 10 lesiones finalmente malignas y no diagnóstica (por falta de material celular) en los 3 casos restantes (tabla 2). La Tg-PAAF se consideró positiva en 9 de 10 lesiones malignas (tabla 2) con valores comprendidos entre 221ng/ml y>5.000ng/ml (límite superior de detección) incluido el caso de la paciente con AC antitiroglobulina positivos en suero que no se detectaron en el lavado de aguja. En un caso de MTS ganglionar por CPT (variante histológica no conocida por realizarse la cirugía tiroidea en otro centro), la Tg-PAAF con un valor de 6,2ng/ml se consideró negativa por hallarse por debajo del valor establecido de corte (tablas 1 y 2).
Diagnóstico definitivo en las 16 lesiones y comparación con el resultado de la PAAF
| Diagnóstico final (n) | Cito-PAAF | Tg-PAAF |
| MTS por CPT (10) | Positiva: 7Negativa: 0 | Positiva: 9Negativa: 1 |
| Lesión benigna (6) | Positiva: 1Negativa: 4 | Positiva: 0Negativa: 6 |
| No diagnóstico (0) | 4 | – |
Cito-PAAF: citología de la punción-aspiración con aguja fina; CPT: carcinoma papilar tiroideo; MTS: metástasis; Tg-PAAF: tiroglobulina determinada en el lavado de aguja de la punción-aspiración con aguja fina.
Las 3 lesiones malignas no identificadas por la cito-PAAF sí lo fueron con la Tg-PAAF, y en el caso del falso negativo de la Tg-PAAF la citología dio un resultado de malignidad con lo que la combinación de ambas técnicas ofreció una sensibilidad del 100%.
Lesiones benignasEl diagnóstico definitivo de 6 lesiones fue de benignidad que pudo ser confirmada tras extirpación quirúrgica en 3 casos: un adenoma pleomórfico de parótida (en una paciente en seguimiento por CPT y tiroglobulinas séricas basal y estimulada indetectables) y 2 linfadenitis reactivas (en el nivel v en una paciente con CPT pendiente de operar en el momento de la PAAF y en el nivel IIA en una paciente en seguimiento por carcinoma insular ya operado y con tiroglobulinas séricas basal y tras TSH recombinante inferior a 2ng/ml). El diagnóstico de benignidad en las 3 lesiones no operadas se basó en la desaparición ecográfica de las adenopatías radiológicamente sospechosas de pacientes en seguimiento (n=2, un caso con tiroglobulinas séricas indetectables y otro con tiroglobulina sérica basal superior a 2ng/ml, ambos con AC séricos negativos) al año o en la significativa reducción (descenso del 50%) del tamaño de la adenopatía en una ecografía a los 6 meses de la PAAF (n=1, con tiroglobulinas séricas y AC negativos) (tabla 1).
La cito-PAAF resultó negativa en 4 de estas 6 lesiones benignas (sugerente de tumor parotideo primario en un caso y de linfadenitis reactivas en 3), no diagnóstica en una lesión (por la ausencia de material celular) y falsamente positiva (presencia de células degeneradas interpretadas como epiteliales) en una adenopatía finalmente extirpada en una paciente en seguimiento por carcinoma insular operado (especificidad: 83%; tabla 2).
En todas las lesiones benignas el valor de la Tg-PAAF dio un resultado negativo (límites de 1ng/ml a 6,6ng/ml; especificidad del 100%; tablas 1 y 2).
DiscusiónLa ecografía de cuello ha adoptado un papel relevante en el CDT tanto antes de la cirugía inicial como a lo largo del seguimiento5,6,23 por su elevada sensibilidad para el reconocimiento de MTS ganglionares por cáncer de tiroides aunque carece a menudo de la especificidad suficiente para la confirmación del diagnóstico etiológico21,22. Por ello el estudio citológico del material obtenido con PAAF de aquellas lesiones ecográficamente sospechosas se ha convertido en la técnica estándar de confirmación16 si bien deja sin diagnosticar un número significativo de MTS debido a la frecuencia de los resultados insuficientes o no diagnósticos27,32. La determinación de la tiroglobulina en el lavado de la aguja con la que se realiza la PAAF representa un procedimiento añadido y simultáneo que, combinadamente, mejora la sensibilidad de la cito-PAAF aislada según señalan numeroso estudios25–27,33–37,39–44. En nuestro trabajo 9 de 10 lesiones malignas se confirmaron con la Tg-PAAF frente a 7 de 10 con la cito-PAAF, sugiriendo, en el escaso número de lesiones aquí estudiadas, una mayor sensibilidad de la Tg-PAAF que de la cito-PAAF al igual que reflejan otros estudios25-32,35–37,39,40,42,43. La alta sensibilidad de la Tg-PAAF referida por los distintos autores (81,4 a 100%) se atribuye a una elevada expresión del gen de la tiroglobulina en MTS ganglionares incluso cuando son de pequeño tamaño46 generándose concentraciones altas de la molécula tanto dentro de las células metastásicas como en su vecindad lo que permite la confirmación de la presencia de células tiroideas incluso en ausencia de la identificación de las mismas. La sensibilidad del 100% de la Tg-PAAF descrita por algunos26,32,35–37,44 no se ha confirmado en todos los estudios. Los escasos casos de falsos negativos se han asociado, en parte, a una mermada capacidad productora de tiroglobulina de algunas variantes histológicas de cáncer de tiroides. Así, en el estudio de Baloch et al.43, 8 de 15 lesiones no identificadas por la Tg-PAAF pertenecían a MTS ganglionares de un CPT de la variante de células altas, variante agresiva, en la que se ha descrito una menor expresión del gen de la tiroglobulina en las recurrencias47. En otro estudio45, las 2 adenopatías metastásicas con valores bajos de Tg-PAAF se hallaron en MTS por carcinomas oncocíticos cuyo estudio inmunohistoquimíco tras extirpación reveló una tinción muy débilmente positiva para tiroglobulina. Los 4 falsos negativos del estudio de Boi et al.34 y 2 de 4 del trabajo de Bournaud et al.25 se dieron en MTS ganglionares por carcinomas anaplásicos o pobremente diferenciados conocidos por su menor capacidad productora de la molécula.
En otro trabajo sin embargo37, la Tg-PAAF resultó positiva tanto en MTS por CDT como en MTS por carcinomas pobremente diferenciados de tiroides si bien su valor promedio fue claramente mayor en las primeras (16.225ng/PAAF frente a 503ng/PAAF; MTS por CDT versus MTS por carcinomas pobremente diferenciados) reflejando la persistente aunque disminuida producción de tiroglobulina descrita en los carcinoma anaplásicos48.El falso negativo de Tg-PAAF hallado en nuestra serie se correspondió con una MTS ganglionar por un CPT cuya variante no pudo ser documentada.
Aunque la mayoría pero no todos34,38,45 los estudios describen un sensibilidad de la Tg-PAAF mayor a la de la cito-PAAF, casi todos concluyen que la información combinada de ambos procedimientos mejora la rentabilidad diagnóstica de la cito-PAAF aislada. Como en nuestra serie, que incluye un número muy limitado de casos, en muchos estudios con mayor tamaño muestral la combinación Tg-PAAF y cito-PAAF alcanza una sensibilidad del 100%26,32,34–36,38,39 o al menos mejora sustancialmente la sensibilidad de cualquiera de los procedimientos aislados25,27,40,41,45 de forma que muchas de las lesiones no evidenciadas por un procedimiento sí lo son por el otro.
La gran especificidad de la Tg-PAAF es otro atributo potencial de la prueba. Dado que solo las células foliculares de tiroides expresan el gen de la tiroglobulina49,50, en pacientes con cáncer epitelial de tiroides, la correcta identificación de la molécula en una lesión cervical ubicada fuera de la glándula tiroides (exceptuando lesiones del conducto tirogloso) o en lecho tiroideo en sujetos con antecedentes de tiroidectomía total confirma la MTS o recurrencia de la enfermedad. Sin embargo, la designación de un valor de corte de Tg-PAAF a partir del cual considerar probable la MTS surge de la observación de valores discretamente elevados de tiroglobulina en las Tg-PAAF de linfadenitis reactivas y MTS ganglionares por neoplasias no tiroideas27,32,34–36,38,39,41,42,45 histopatológicamente comprobadas. Dos hipótesis tratan de justificar estos hallazgos: la hipótesis de la contaminación sanguínea y la hipótesis del efecto matriz. La hipótesis de la contaminación sanguínea argumentada por Frasoldati et al.27 se basa en la presencia de la tiroglobulina dentro de los vasos del ganglio sometido a la PAAF que justificaría los valores más elevados de tiroglobulina en las Tg-PAAF de ganglios de sujetos con glándula tiroidea no extirpada (y concentraciones presumiblemente altas de tiroglobulina en sangre) que en las Tg-PAAF de ganglios de pacientes tiroidectomizados (con concentraciones séricas de tiroglobulina bajas o indetectables). Apoyándose en esta hipótesis, algunos autores proponen un valor de corte de Tg-PAAF, a partir del cual considerar la lesión metastásica, distinto dependiendo de la presencia de glándula tiroidea (39,3ng/ml27 y 36ng/ml34) o de su ausencia (1,1ng/ml27 y 1,7ng/ml34). De acuerdo con este planteamiento, otros proponen como discriminatorio un valor de Tg-PAAF superior al de la tiroglobulina sérica medida simultáneamente40–42. Otros investigadores refutan la hipótesis de la contaminación sanguínea25,45,51 al hallar valores similares de Tg-PAAF en adenopatías no metastásicas por carcinoma tiroideo independientemente de la presencia o no de glándula tiroidea y tras calcular la escasa contribución relativa de la tiroglobulina sanguínea al valor de la tiroglobulina del lavado de aguja45. Estos autores postulan que el valor ligeramente positivo de la Tg-PAAF en linfadenitis reactivas o en ganglios con MTS por neoplasias no tiroideas se debe a una interferencia ocasionada por el cambio de medio en el que se realiza la medición de la tiroglobulina denominada efecto matriz52. Según esta hipótesis, la solución empleada para el lavado de aguja (suero salino fisiológico o solución libre de tiroglobulina aportada con el kit dependiendo del estudio) aunque carente de la molécula tiroglobulina se caracteriza por unas propiedades fisicoquímicas (pH, polaridad, partículas arrastradas en la PAAF de la lesión sólida…) capaces de inducir interacciones no específicas con los AC de algunos ensayos diseñados para medir tiroglobulina sérica, provocando así una luminosidad o radiactividad basal detectables25. El efecto matriz explicaría valores de tiroglobulina discretamente positivos en medios como el suero salino fisiológico39 (valores de hasta 5ng/ml) o en lipoma abdominal y músculo cuádriceps32 sometidos a PAAF con lavado de aguja (valores de 4,7 y 3,9ng/PAAF respectivamente). En el estudio de Snozek et al.35, en unas mismas adenopatías, el valor de la Tg-PAAF realizando el lavado con suero salino superó en un 25% el valor de la Tg-PAAF cuyo lavado se realizó con solución libre de tiroglobulina, confirmando una interferencia por cambio del medio de lavado. La descripción en estos trabajos de valores detectables de tiroglobulina en Tg-PAAF de adenopatías o lesiones no portadoras de tejido tiroideo obliga a establecer un valor umbral a partir del cual considerar la lesión metastásica o recurrencia por cáncer tiroideo sin que exista un criterio uniforme sobre el mejor valor de corte a emplear. Muchos adoptan como valores positivos aquellos superiores a la media más 2 desviaciones estándar de los valores hallados en el lavado de adenopatías reactivas y MTS por neoplasias no tiroideas (con valores absolutos que oscilan entre 1,1 y 39ng/ml dependiendo del líquido empleado para el lavado de aguja, del volumen del mismo así como del inmunoanálisis usado para medir la tiroglobulina27,32,37–39,41). Otros estiman indicativo de MTS de origen tiroideo valores en la Tg-PAAF superiores al valor máximo encontrado en linfadenitis reactivas24.
Pese a la probable existencia de un efecto matriz en algunos estudios, los inmunoanálisiss más modernos para la tiroglobulina sérica parecen no verse afectados por esta interferencia. Por ello, en trabajos más recientes los valores de Tg-PAAF son similares independientemente del empleo de suero salino o de solución libre de tiroglobulina para el lavado de aguja27,45. La ausencia de interferencia, en estos estudios, queda patente también por valores en la Tg-PAAF de ganglios no metastásicos por cáncer de tiroides inferiores al límite de sensibilidad funcional de la tiroglobulina definido en sangre36,45. El límite de sensibilidad funcional de la tiroglobulina sérica se utiliza entonces como valor de corte en algunos trabajos35,36.
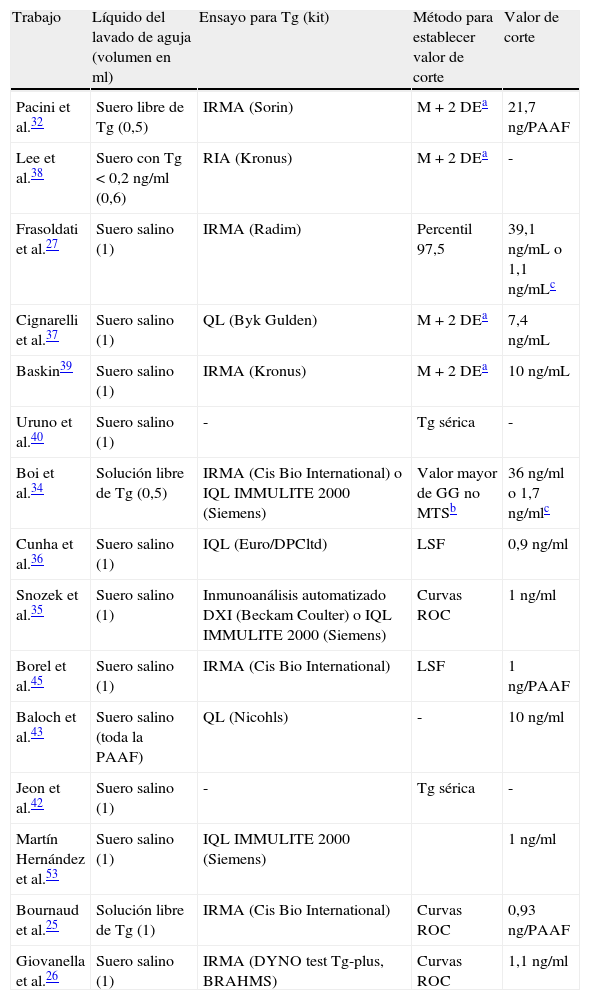
El valor umbral de tiroglobulina en la Tg-PAAF posiblemente más exacto se desprende de los estudios más recientes donde cada centro, dependiendo del inmunoanálisis utilizado y del método de lavado empleado, fija el valor de tiroglobulina que confiere la máxima sensibilidad y especificidad a través de curvas operador-receptor (curvas ROC) basadas en el valor de Tg-PAAF de lesiones malignas o benignas confirmadas histológicamente25,26,41. En la tabla 3 se recogen distintos trabajos acerca de la Tg-PAAF con el método empleado y el valor de corte de tiroglobulina considerado positivo en cada uno.
Resumen de algunos métodos de Tg-PAAF publicados
| Trabajo | Líquido del lavado de aguja (volumen en ml) | Ensayo para Tg (kit) | Método para establecer valor de corte | Valor de corte |
| Pacini et al.32 | Suero libre de Tg (0,5) | IRMA (Sorin) | M+2 DEa | 21,7ng/PAAF |
| Lee et al.38 | Suero con Tg <0,2ng/ml (0,6) | RIA (Kronus) | M+2 DEa | - |
| Frasoldati et al.27 | Suero salino (1) | IRMA (Radim) | Percentil 97,5 | 39,1ng/mL o 1,1ng/mLc |
| Cignarelli et al.37 | Suero salino (1) | QL (Byk Gulden) | M+2 DEa | 7,4ng/mL |
| Baskin39 | Suero salino (1) | IRMA (Kronus) | M+2 DEa | 10ng/mL |
| Uruno et al.40 | Suero salino (1) | - | Tg sérica | - |
| Boi et al.34 | Solución libre de Tg (0,5) | IRMA (Cis Bio International) o IQL IMMULITE 2000 (Siemens) | Valor mayor de GG no MTSb | 36ng/ml o 1,7ng/mlc |
| Cunha et al.36 | Suero salino (1) | IQL (Euro/DPCltd) | LSF | 0,9ng/ml |
| Snozek et al.35 | Suero salino (1) | Inmunoanálisis automatizado DXI (Beckam Coulter) o IQL IMMULITE 2000 (Siemens) | Curvas ROC | 1ng/ml |
| Borel et al.45 | Suero salino (1) | IRMA (Cis Bio International) | LSF | 1ng/PAAF |
| Baloch et al.43 | Suero salino (toda la PAAF) | QL (Nicohls) | - | 10ng/ml |
| Jeon et al.42 | Suero salino (1) | - | Tg sérica | - |
| Martín Hernández et al.53 | Suero salino (1) | IQL IMMULITE 2000 (Siemens) | 1ng/ml | |
| Bournaud et al.25 | Solución libre de Tg (1) | IRMA (Cis Bio International) | Curvas ROC | 0,93ng/PAAF |
| Giovanella et al.26 | Suero salino (1) | IRMA (DYNO test Tg-plus, BRAHMS) | Curvas ROC | 1,1ng/ml |
IQL: inmunoquimioluminiscente; IRMA: inmunorradiométrico; LSF: límite de sensibilidad funcional; QL: quimioluminiscente; RIA: radioinmunoanálisis; Tg: tiroglobulina.
La Tg-PAAF aportaría otra ventaja adicional. No solamente facilita el diagnóstico de localización de pacientes con enfermedad persistente sugerida por valores altos de tiroglobulina sérica sino también de pacientes con AC antitiroglobulina séricos positivos. En nuestra serie, en una paciente con tiroglobulina sérica indetectable y AC séricos positivos, la Tg-PAAF pudo confirmar la presencia de MTS ganglionar por su valor claramente positivo (221ng/ml) posiblemente debido a la falta de interferencia de los AC que resultaron indetectables en el lavado de aguja. En el estudio de Boi et al.34 en 6 pacientes en seguimiento por cáncer de tiroides y AC séricos positivos, la Tg-PAAF también dio un resultado positivo en todas la MTS ganglionares por CPT. Como en nuestra paciente, en este estudio no se identificaron AC en el lavado de aguja en 4 de 6 adenopatías, ni se identificaron en ninguna de las 17 adenopatías del trabajo de Martín Hernández et al.53 realizado en pacientes con CPT en seguimiento y AC séricos positivos. En las 2 MTS ganglionares con AC antitiroglobulina positivos en el lavado de aguja, Boi et al.34 justifican la positividad de la Tg-PAAF por la producción local masiva de tiroglobulina en el ganglio capaz de saturar los lugares de unión al AC.
ConclusiónLa Tg-PAAF es una técnica fácil de realizar, rápida y poco costosa cuya información añadida a la de la cito-PAAF mejora la rentabilidad diagnóstica de la PAAF en pacientes con CDT. Las ventajas descritas justifican su recomendación para la identificación de MTS o recurrencias por las distintos consensos y guías5,6 aunque sería deseable la estandarización de la técnica y la disponibilidad de valores de corte de Tg-PAAF de referencia en función del inmunoanálisis empleado en cada centro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.