La cromogranina A (CgA) es la granina más abundante en los tumores neuroendocrinos gastroenteropancreáticos (TNE-GEP). Como marcador tumoral es moderadamente sensible y poco específico. A pesar de las limitaciones de los métodos de medida que requieren una interpretación cuidadosa, especialmente en el caso de los gastrinomas, pacientes tratados con análogos de somatostatina y tumores pobremente diferenciados, es el mejor marcador tumoral en los TNE-GEP y puede ser útil en otros tumores con diferenciación neuroendocrina. La CgA puede ser usada como marcador en sangre o en muestra tisular mediante inmunohistoquímica. Las concentraciones se relacionan con la carga y la extensión tumoral y puede ser usada en el diagnóstico y seguimiento de los TNE-GEP, especialmente en los derivados del intestino delgado y neuroendocrinos del páncreas. Además es útil como marcador pronóstico en la detección de recidivas y en la monitorización de la respuesta a los distintos tratamientos.
Chromogranin A (CgA) is the most abundant granin in gastroenteropancreatic neuroendocrine tumors (GEP-NETs). As a tumor marker is moderately sensitive and nonspecific. Despite the limitations of testing methods, which require careful interpretation, especially in the case of gastrinomas, patients treated with somatostatin analogues, and poorly differentiated tumors, it is the best tumor marker in GEP-NETs and may be of value in other tumors with neuroendocrine differentiation. CgA may be used as a marker in blood or tissue samples through immunohistochemical techniques. CgA levels correlate with tumor burden and extension and may be used for diagnosis and monitoring of GEP-NETs, especially midgut carcinoids and endocrine pancreatic tumors. It is also useful as a prognostic marker for detection of recurrence and monitoring of response to different treatments.
La familia de las cromograninas/secretograninas está constituida por un grupo de proteínas derivadas de distintos genes pero que comparten un conjunto de características:
- 1.
Filogenéticas. Homología considerable de la secuencia génica interespecie.
- 2.
Funcionales. Se coalmacenan con las moléculas contenidas en los gránulos de secreción densos y se cosecretan mediante exocitosis por la vía regulada. A diferencia de la vía de secreción constitutiva, que se encuentra en todos los tipos celulares y se caracteriza porque las proteínas que acaban de ser sintetizadas son transportadas por la célula mediante vesículas secretoras para su liberación inmediata sin necesidad de estímulo, la vía regulada se caracteriza por encontrarse en células más especializadas (neuronales, endocrinas, neuroendocrinas y neutrófilos polimorfonucleares1) y por los gránulos secretores de núcleo denso, que es el nombre que reciben las vesículas secretoras en esta vía. Estos gránulos se caracterizan por presentar:
- a)
un proceso de maduración mediante la condensación y agregación del material proteico y la aplicación de una cubierta específica en presencia de un ambiente ácido y rico en calcio;
- b)
una carga condensada de aminas biógenas, péptidos hormonales, nucleótidos, neurotransmisores, factores de crecimiento y calcio (dependiendo del tipo celular);
- c)
tinción intensa con plata;
- d)
aspecto electrón denso en el microscopio electrónico, y
- e)
la capacidad de permanecer en la célula durante largos periodos de tiempo siendo liberados solo en respuesta a un estímulo específico para cada tipo celular, tanto en las células normales como en las tumorales.
- a)
- 3.
Estructurales. Son glucoproteínas hidrosolubles, termoestables, acídicas (por la presencia de abundantes residuos de aminoácidos ácidos, ácido glutámico y aspártico), que presentan una secuencia de 8-10 pares de aminoácidos básicos bastante conservada interespecie que representan potenciales lugares de excisión mediante proteasas y que se unen al calcio con baja afinidad pero alta capacidad2–4. El procesamiento de la proteína inicial en péptidos más pequeños tiene lugar en el medio intragranular mediante las proprotein convertasa PC1/3, PC2, la catepsina5,6 y, en menor grado, en el medio extracelular por enzimas como la plasmina7. Este procesamiento es distinto según el tipo celular y se mantiene a pesar de la transformación tumoral de la célula8,9.
El primer elemento aislado de esta familia fue la cromogranina A en 1965 en células cromafines de la médula adrenal bovina10. Posteriormente se describió la cromogranina B en feocromocitoma de rata11 y la secretogranina II en la adenohipófisis bovina12.
Los miembros principales de esta familia son la cromogranina A (CgA, algunas veces llamada parathyroid secretory protein), la cromogranina B (CgB, algunas veces llamada secretogranina I) y la secretogranina II (algunas veces llamada cromogranina C [CgC])12–18. Otros miembros de la familia son la secretogranina III (o 1B1075), IV (o HISL-19), V (o proteína neuroendocrina 7B2), VI (o NESP55) y VII (o VGF)19.
Distribución tisularLa familia de las graninas se expresa ampliamente en células:
- –
Neuronales del sistema nervioso periférico y central (cerebelo, córtex cerebral, septum, hipotálamo, hipocampo, amígdala y es posible que en las células astrogliales).
- –
Endocrinas (de médula adrenal, adenohipófisis, páncreas, sistema difuso del tracto gastrointestinal, paratiroides, las células C o parafoliculares de la glándula tiroides y las bronquiopulmonares).
- –
De diferenciación neuroendocrina (próstata, bazo, timo, corazón, mama, placenta).
- –
En los focos de inflamación en los neutrófilos.
Pero los distintos miembros de la familia de las graninas presentan diferente distribución. Por ejemplo, mientras la CgA se localiza de forma predominante en la médula adrenal, el tracto gastrointestinal y la adenohipófisis, la secretogranina II predomina en las células gonadotropas y alfapancreáticas20–22.
Clásicamente se describe la presencia de la CgA en las células neuroendocrinas como ubicua, pero según el tipo tisular su concentración varía. Las células cromafines simpaticoadrenales representan el lugar de mayor producción y almacenamiento seguidas en orden descendente por la adenohipófisis, el páncreas, el estómago, el intestino delgado (yeyuno e íleon), el córtex cerebral frontal, las paratiroides y el tiroides22.
Funciones de la cromogranina y de sus péptidos derivados (tabla 1)Generalmente al hablar de CgA se habla de la proproteína CgA de 439 aminoácidos y 48 KDa de peso molecular, derivada de la pre-CgA (una preproteína de 457 aminoácidos) y cuyo gen se localiza en el locus 14q32.12. Como se ha comentado previamente, la CgA actúa como prohormona y tras ser sometida a modificaciones postransduccionales como la glucosilación, fosforilación o sulfatación y/o el procesamiento proteolítico tisular específico da lugar a péptidos biológicamente activos que controlan múltiples funciones fisiológicas. La mayoría de las funciones son de regulación inhibitoria directa o indirecta vía autocrina, paracrina o endocrina (tabla 1).
Acciones de la cromogranina A y sus péptidos derivados
| Intracelulares |
| Actividad granulogénica |
| Almacenamiento |
| Unión y regulación del flujo del calcio |
| Prohormona |
| Extracelulares |
| Inhibición de la secrecion de |
| Catecolaminas |
| Amilasa pancreática |
| Proopiomelanocortina |
| Parathormona |
| Secreción ácida por las células gástricas |
| Inhibición de la vasoconstricción arterial |
| Efecto inotrópico negativo |
| Regulación gastrointestinal: inhibición de la peristalsis colónica |
| Regulación del metabolismo de glúcidos, lípidos y proteínas |
| Actividad antimicrobiana |
| Actividad antiinflamatoria |
| Reparación tisular: regulación de la adhesión celular |
| Regulación de la nocicepción |
| Activación de la microglía en el sistema nervioso central |
| Degeneración apoptótica de las neuronas corticales |
Aunque la función de la CgA no se conoce por completo, cada vez se sabe más sobre la función de sus péptidos derivados23–30 y parece que muchas de las funciones atribuidas inicialmente a la CgA, sobre todo las extracelulares, son en realidad mediadas por estos péptidos (tabla 2).
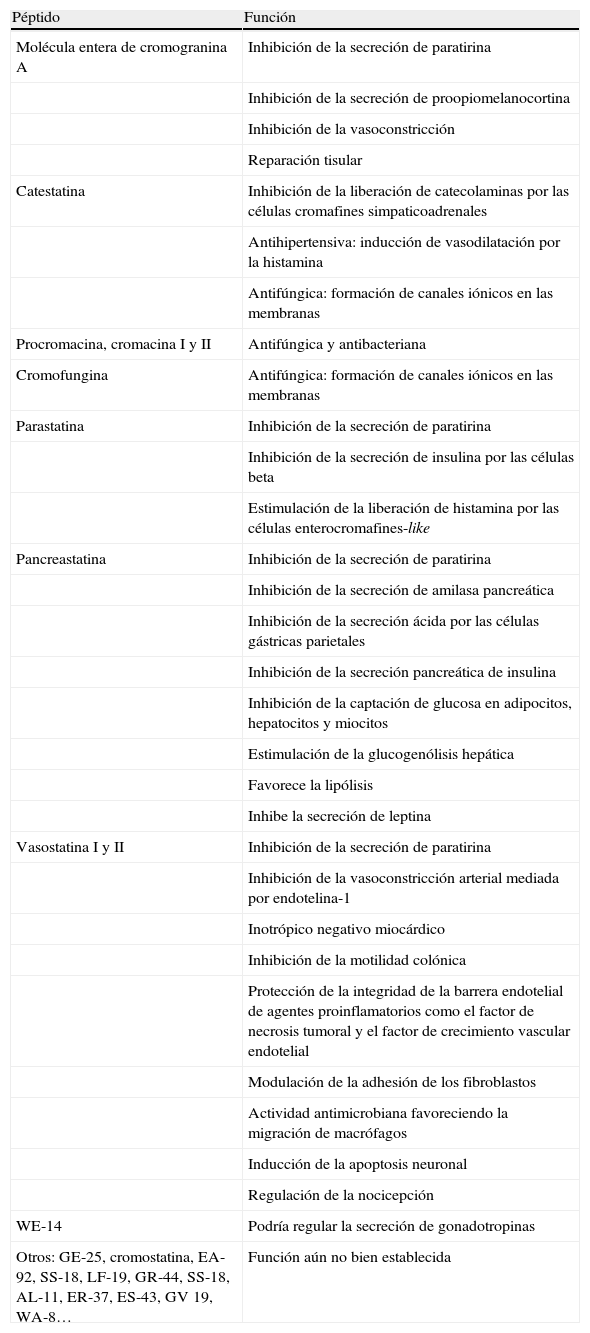
Funciones de los péptidos derivados de la cromogranina A
| Péptido | Función |
| Molécula entera de cromogranina A | Inhibición de la secreción de paratirina |
| Inhibición de la secreción de proopiomelanocortina | |
| Inhibición de la vasoconstricción | |
| Reparación tisular | |
| Catestatina | Inhibición de la liberación de catecolaminas por las células cromafines simpaticoadrenales |
| Antihipertensiva: inducción de vasodilatación por la histamina | |
| Antifúngica: formación de canales iónicos en las membranas | |
| Procromacina, cromacina I y II | Antifúngica y antibacteriana |
| Cromofungina | Antifúngica: formación de canales iónicos en las membranas |
| Parastatina | Inhibición de la secreción de paratirina |
| Inhibición de la secreción de insulina por las células beta | |
| Estimulación de la liberación de histamina por las células enterocromafines-like | |
| Pancreastatina | Inhibición de la secreción de paratirina |
| Inhibición de la secreción de amilasa pancreática | |
| Inhibición de la secreción ácida por las células gástricas parietales | |
| Inhibición de la secreción pancreática de insulina | |
| Inhibición de la captación de glucosa en adipocitos, hepatocitos y miocitos | |
| Estimulación de la glucogenólisis hepática | |
| Favorece la lipólisis | |
| Inhibe la secreción de leptina | |
| Vasostatina I y II | Inhibición de la secreción de paratirina |
| Inhibición de la vasoconstricción arterial mediada por endotelina-1 | |
| Inotrópico negativo miocárdico | |
| Inhibición de la motilidad colónica | |
| Protección de la integridad de la barrera endotelial de agentes proinflamatorios como el factor de necrosis tumoral y el factor de crecimiento vascular endotelial | |
| Modulación de la adhesión de los fibroblastos | |
| Actividad antimicrobiana favoreciendo la migración de macrófagos | |
| Inducción de la apoptosis neuronal | |
| Regulación de la nocicepción | |
| WE-14 | Podría regular la secreción de gonadotropinas |
| Otros: GE-25, cromostatina, EA-92, SS-18, LF-19, GR-44, SS-18, AL-11, ER-37, ES-43, GV 19, WA-8… | Función aún no bien establecida |
- a)
Actividad granulogénica: participación en la síntesis y maduración de los gránulos secretores, en especial en la agregación de los productos secretores en la red trans-Golgi y evitando su ruptura controlando su presión osmótica31,32. La CgA es el único miembro de la familia de las graninas que interviene en esta función, por lo que se habla de ella como el interruptor on/off de la granulogénesis33.
- b)
Almacenamiento: la presencia ubicua de la CgA en el tejido neuroendocrino y su cosecreción con las moléculas contenidas en el gránulo parecen indicar un papel en su almacenamiento.
- c)
Unión y regulación del flujo de calcio.
- d)
Prohormona: actividad como precursora de péptidos mediante su procesamiento proteolítico intra y extracelular.
- a)
Inhibición de la secreción de: catecolaminas por la médula adrenal (catestatina), amilasa pancreática mediada por la colecistoquinina (pancreastatina), proopiomelanocortina (molécula entera CgA), paratirina (molécula entera CgA, parastatina, pancreastatina, vasostatina), insulina por las células beta (parastatina, pancreastatina) y secreción ácida por las células parietales del estómago (pancreastatina)34.
- b)
Estimulación de la liberción de histamina por las células enterocromafines-like (parastatina).
- c)
Regulación cardiovascular mediante la inhibición de la contracción muscular arterial y miocárdica (molécula entera CgA, catestatina, vasostatina).
- d)
Regulación gastrointestinal mediante la inhibición de la peristalsis colónica (vasostatina)35.
- e)
Regulación del metabolismo de glúcidos, lípidos y proteínas (pancreastatina).
- f)
Actividad antimicrobiana: Primera línea de defensa del huésped contra los microorganismos invasores (catestatina, procromacina, cromacina, cromofungina, vasostatina)36–38.
- g)
Actividad antiinflamatoria (vasostatina).
- h)
Regulación de la barrera endotelial y modulación de la adhesión de fibroblastos y células endoteliales en la reparación y remodelamiento tisular que interviene en procesos como la angiogénesis, la inflamación y los procesos neoplásicos (molécula entera CgA, vasostatina)39,40.
- i)
Regulación de la nocicepción (vasostatina).
- j)
Activación de la microglía en el sistema nervioso central41.
- k)
Degeneración apoptótica de las neuronas corticales (vasostatina).
Existen diferentes ensayos analíticos para medir la CgA. Los más conocidos son el CgA-RIA (CIS bio international), DAKO CgA ELISA y CgA por IRMA (método sándwich con doble anticuerpo contra las fracciones de 145-197 y 198-245 aminoácidos). Stridsberg et al., en un estudio en el que comparan 3 métodos comerciales (RIA, IRMA y ELISA) encuentran diferencias en cuanto a la especificidad, sensibilidad y valor predictivo positivo y valor predictivo negativo. El RIA con anticuerpo monoclonal resultó ser el método más sensible, mientras que el IRMA compuesto por 2 anticuerpos monoclonales fue el más específico42.
Un estudio español compara los distintos métodos de medida de CgA en 52 pacientes sanos, 98 pacientes con procesos benignos, 94 pacientes con patología tumoral (no neuroendocrina), 20 pacientes con cáncer de pulmón de célula pequeña y 79 pacientes con tumores neuroendocrinos (TNE). Utilizando los distintos puntos de corte de normalidad (6 nmol/l, 60ng/ml y 90ng/ml para RIA, ELISA e IRMA) se encontraron valores anormales en una proporción elevada de pacientes con insuficiencia renal (76,7; 86,7 y 93,3% con ELISA, IRMA y RIA), otras enfermedades benignas (gastritis crónica, enfermedad inflamatoria intestinal, hepatopatía e insuficiencia cardíaca) y en otras enfermedades tumorales (59,8% ELISA; 55,4% IRMA y 37% RIA). Las curvas ROC que comparan el área bajo la curva entre sujetos sanos y con TNE, o entre sujetos sin TNE (excluyendo los que presentaban insuficiencia renal y cáncer de pulmón de célula pequeña) y con TNE mostraron mejores resultados con ELISA (0,96 y 0,77) y con IRMA (0,95 y 0,78) que con RIA (0,80 y 0,69)43.
Existen varios factores que pueden ser responsables de las diferencias en los estudios:
- –
En cada kit el anticuerpo se obtiene a partir de moléculas de CgA de distinto origen y tamaño (CgA de Escherichia coli, CgA de orina de pacientes con tumores carcinoides).
- –
Las concentraciones de CgA se expresan en diferentes medidas (nmol/l, ng/ml, U/l) y la definición de la concentración que se considera límite alto de la normalidad también es diferente.
- –
Las diferencias entre los anticuerpos utilizados. Cuantos más epítopos de la molécula de CgA pueda detectar un anticuerpo más capacidad tendrá de detectar péptidos derivados del procesamiento proteolítico de la CgA y más sensible será el método.
- –
Las diferencias en la muestra de pacientes del estudio en cuanto a tipo de TNE pueden sesgar los resultados, ya que en cada tejido el procesamiento de la molécula entera de CgA es diferente.
Las concentraciones de CgA pueden ser medidas en plasma o en suero. Existe un asociación lineal positiva entre ambos métodos (r=0,9858; p<0,001)44. Existen estudios de CgA en saliva para cuantificar el nivel de estrés, pero no se ha utilizado este método en el estudio de los TNE45.
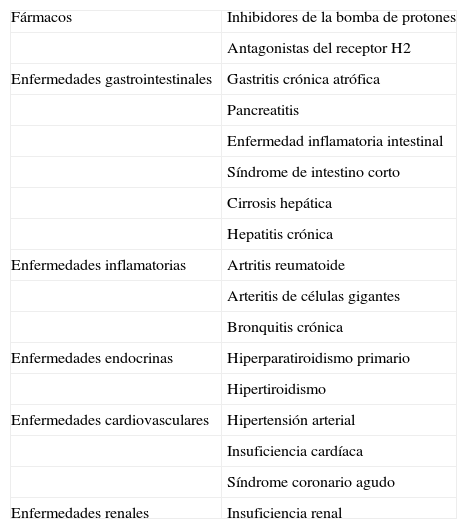
Existen múltiples causas de elevación de la CgA, que producen falsos positivos en la determinación de la misma: fármacos (inhibidores de la bomba de protones, antagonistas del receptor H2), insuficiencia renal, hipertensión arterial, insuficiencia cardíaca, síndrome coronario agudo, hipertirodismo e hiperparatiroidismo, gastritis crónica atrófica (GCA), pancreatitis, enfermedad inflamatoria intestinal, colon irritable, hepatitis crónica y cirrosis hepática, artritis reumatoide, bronquitis crónica y el estrés inducido por el ejercicio (tabla 3). Además se han reportado elevaciones de CgA en la arteritis de células gigantes, la artritis reumatoide y el lupus eritematoso sistémico46. Una de las causas más frecuentes de falsos positivos es la toma de inhibidores de la bomba de protones. La hipergastrinema que producen por la inhibición de la secreción ácida constituye un estímulo para las células enterocromafines gástricas. La elevación es mayor en pacientes que llevan más de un año de tratamiento47. Consideramos que, dado que no está demostrado el tiempo óptimo de retirada, dichos fármacos deben retirarse al menos entre 14 y 10 días antes de la determinación de CgA. Se podrán sustituir por ranitidina (que se suspenderá 3 días antes) u otros antiácidos.
Falsos positivos en la determinación de la cromogranina A
| Fármacos | Inhibidores de la bomba de protones |
| Antagonistas del receptor H2 | |
| Enfermedades gastrointestinales | Gastritis crónica atrófica |
| Pancreatitis | |
| Enfermedad inflamatoria intestinal | |
| Síndrome de intestino corto | |
| Cirrosis hepática | |
| Hepatitis crónica | |
| Enfermedades inflamatorias | Artritis reumatoide |
| Arteritis de células gigantes | |
| Bronquitis crónica | |
| Enfermedades endocrinas | Hiperparatiroidismo primario |
| Hipertiroidismo | |
| Enfermedades cardiovasculares | Hipertensión arterial |
| Insuficiencia cardíaca | |
| Síndrome coronario agudo | |
| Enfermedades renales | Insuficiencia renal |
A diferencia de la CgA, la CgB no se afecta por la presencia de insuficiencia renal o el uso de inhibidores de la bomba de protones. Este hecho podría hacer de ella un marcador tumoral complementario, pero hay que tener en cuenta que presenta un patrón de expresión tisular distinto y que en su determinación también hay limitaciones y diferencias en cuanto a la técnica utilizada y la definición del límite alto de la normalidad. En un estudio con 44 pacientes con tumores carcinoide, 17 con tumor endocrinopancreático (TEP) esporádico y 11 con TEP asociados a neoplasia endocrina múltiple tipo 1 (MEN 1), la sensibilidad de la CgB fue del 87% frente al 99% que presentaba la CgA18,48–50
Cromogranina A en tumores neuroendocrinos en generalSe han encontrado concentraciones de CgA elevadas en una variedad de TNE como feocromocitomas, paragangliomas, neuroblastomas, carcinoma cutáneo de células de Merckel, TNE gastrointestinales, tumores de las células de los islotes pancreáticos, carcinoma medular de tiroides, adenomas de paratiroides y adenohipófisis, y también en una proporción de pacientes con TNE broncopulmonares (incluyendo cáncer de pulmón de células pequeñas).
Como marcador tumoral, la CgA sérica se caracteriza por ser moderadamente sensible e inespecífica. Y entre los marcadores tumorales generales (e inespecíficos como la enolasa neuronal específica, el antígeno carcinoembrionario (CEA) o la gonadotropina coriónica humana, la CgA es el que tiene la mayor sensibilidad y especificidad para la detección de TNE51–53.
Es de gran utilidad en los TNE en los que no está disponible ningún marcador o la sintomatología se presenta de forma tardía en el curso de la enfermedad, en los TNE no funcionantes, que por lo general conservan la capacidad de secretar CgA y en los TNE en los que la determinación del marcador presenta inconvenientes por tener limitaciones (como la fluctuación sérica de los niveles de catecolaminas en los feocromocitomas) o inconvenientes (como la recogida de orina de 24h tras restricciones dietéticas) representando en estos casos un marcador más estable54.
En una muestra de 211 pacientes con TNE, gastroenteropancreáticos (TNE-GEP) y no gastroenteropancreáticos, en los que se midió la concentración sérica de CgA mediante RIA policlonal (utilizando CgA humana obtenida de feocromocitomas como trazador) y considerando como límite alto de la normalidad 175 mcg/l para hombres y mujeres premenopáusicas y 220 mcg/l para mujeres postmenopáusicas, la proporción de pacientes que presentaron concentraciones elevadas de CgA por cada tipo de TNE fue de mayor a menor: gastrinomas (100%, n=9), feocromocitomas (89%, n=9), tumores carcinoides (80%, n=62), TEP no funcionantes (69%, n=13), carcinomas medulares de tiroides (50%, n=26), carcinomas de pulmón de células pequeñas (39%, n=23), neuroblastomas (33%, n=3), tumores de células de Merckel (25%, n=4), adenomas hipofisarios no funcionantes (20%, n=10), insulinomas (10%, n=21) y paragangliomas (8%, n=25). En esta muestra las concentraciones de CgA, expresadas como mediana (límites) en mcg/l se encontraron más elevadas en tumores carcinoides 688 (33–52.340) mcg/l, seguido en orden descendente por gastrinomas 772 (289–1.933) mcg/l, TEP no funcionantes 306 (85–14.750) mcg/l, feocromocitomas 275 (110–4.674) mcg/l, carcinomas medulares de tiroides 184 (80–13.900) mcg/l, carcinomas pulmonares de células pequeñas 149 (45–2.948) mcg/l, neuroblastomas 133 (117–238) mcg/l, tumores de células de Merckel 109 (84–1.056) mcg/l, paragangliomas 106 (50–11.590) mcg/l, insulinomas 105 (63–236) mcg/l, adenomas hipofisarios no funcionantes 131 (85–240) mcg/l, y en último lugar adenomas hipofisarios secretores de GH 71 (53–115) mcg/l53,55.
Las diferencias entre tumores se pueden explicar por el hecho de que la expresión de la CgA circulante depende de un conjunto de factores como el tipo de célula de origen, el grado de diferenciación, la densidad de los gránulos secretores, el tamaño y extensión tumoral y la capacidad de secreción tisular. Respecto al último factor, se debe señalar que parece que las concentraciones elevadas de CgA se asocian significativamente de forma independiente con la presencia de otras secreciones56.
Cromogranina A en los tumores neuroendocrinos gastroenteropancreáticosLa CgA es la granina más abundante en los TNE-GEP y representa el mejor marcador general a nivel tisular (junto a la sinaptofisina para la confirmación inmunohistoquímica) y sanguíneo.
La variabilidad en los límites de sensibilidad (60-100%) y especificidad (70-100%) para la CgA circulante publicados para los diferentes tipos de TNE-GEP en la literatura viene determinada por varios factores:
- -
La presentación clínica del TNE, que a su vez depende del lugar de origen, las características histológicas del tumor, el tamaño del tumor primario, la vía de diseminación, la presencia o ausencia de metástasis, la funcionalidad o actividad secretora del tumor, el grado de diferenciación neuroendocrina y la asociación a un síndrome hereditario.
- -
La técnica utilizada para su determinación y si asta es capaz de detectar los péptidos resultantes del proceso de fragmentación.
- -
El umbral considerado como patológico, y cómo se maneja y estudia la variabilidad de CgA en el grupo control en los estudios.
- -
La ubicuidad en el tejido normal que determina que distintos eventos fisiológicos o patológicos no neoplásicos puedan también elevarla.
Junto al ácido 5-hidroxiindolacético (5-HIAA), la CgA es el mejor marcador tanto en el diagnóstico como en el seguimiento de los pacientes con tumores carcinoides derivados del intestino medio. Puede resultar especialmente útil también en aquellos subtipos, como los rectales o bronquiales, en los que es menos probable que las concentraciones de 5-HIAA se eleven o en los de intestino posterior, que habitualmente son no funcionantes y cada vez son diagnosticados en un estadio más precoz en el contexto del cribado por cáncer colorrectal, aunque en estos casos los valores de CgA presentan una concentración baja.
En pacientes con gastrinoma por síndrome de Zollinger-Ellison (SZE) las concentraciones de CgA son significativamente más altas que en aquellos pacientes con GCA. A medida que la enfermedad progresa localmente o a distancia las concentraciones aumentan progresivamente. Sin embargo, el nivel de aumento refleja más la hiperplasia de las células enterocromafines-like gástricas producida por la gastrina que el propio tamaño del gastrinoma57.
En los TNE pancreáticos, la CgA es el marcador sérico más útil para el diagnóstico, estadificación y seguimiento, independientemente de su funcionalidad, por su correlación con el tamaño y progresión tumoral, valor en el seguimiento evolutivo y para evaluar la respuesta al tratamiento. En los TNE pancreáticos funcionantes la CgA tiene una sensibilidad del 64-100%58. En los TEP no funcionantes la sensibilidad está en un 64-84%59.
En un estudio de Campana et al. en el que se estudiaba la determinación plasmática de CgA mediante el kit DAKO CgA ELISA en una muestra de 280 pacientes (238 con TNE, 42 con GCA con y sin hiperplasia de células enterocromafín-like y 48 sujetos sanos) encontraron que el mejor valor de corte para diferenciar sujetos con TNE de sujetos sanos era 18-19 U/l (sensibilidad 85,3% y especificidad de 95,8%), para diferenciar sujetos con TNE de sujetos sin TNE (sanos y los que presentaban GCA) 31-32 U/l (sensibilidad 75,3% y especificidad 84,2%). En el grupo de TNE el origen era gástrico en 5,9% (n=14), bronquial en 8,4% (n=20), intestinales en 35,7% (n=85), pancreático en 39,5% (n=94) y había un 10,5% (n=25) de los 238 que presentaban SZE. Las concentraciones de CgA expresadas como media (desviación estándar) más elevadas se encontraron en los pacientes con SZE 1490,5 (3819,3) U/l y las más bajas en los bronquiales 46,3 (94,6) U/l. Los derivados del estómago 78 (69,2) U/l, páncreas 322,2 (952,7) U/l e intestino 380,1 (1224,9) U/l tenían valores intermedios sin diferencias estadísticamente significativas entre ellos60.
Cromogranina A y carga tumoral y extensión tumoralLas concentraciones de CgA en tumores carcinoides de intestino medio y en los TEP presentan correlación positiva con el tamaño y la extensión tumoral53,56,60–63. Por esa razón las concentraciones circulantes de CgA solo están ligeramente elevadas en pacientes con insulinomas (al igual que sucede con los paragangliomas o adenomas hipofisarios), ya que estos tumores generalmente son detectados en una etapa temprana de su evolución por un síndrome clínico característico secundario a la secreción hormonal o por síntomas compresivos64.
En estudios con TNE, las concentraciones de CgA son más elevadas en los pacientes con metástasis. Además, son significativamente más elevadas en aquellos pacientes con metástasis difusas (ganglios linfáticos a distancia, metástasis en pulmón, hueso y bazo) frente a los que solo tienen metástasis locales. En otros estudios centrados en pacientes con TNE-GEP con metástasis, las concentraciones de CgA también se han relacionado particularmente con el grado de extensión hepático62,65. En la detección de metástasis de tumores carcinoides, la combinación de la gammagrafía de receptores de somatostatina con las concentraciones de CgA aumenta la sensibilidad del 80% hasta un 93%66.
Cromogranina A como factor pronóstico y predictor de supervivenciaLas concentraciones altas de CgA se han demostrado como predictores independientes de mal pronóstico y menor supervivencia en TNE-GEP con metástasis en general y específicamente para:
- –
Tumores carcinoides del intestino medio62,65,67,68. En un estudio con 310 pacientes con tumor carcinoide confirmado mediante histopatología (256 de intestino anterior, 39 de intestino medio y 6 de intestino posterior) en el que se consideraba como límite alto de la normalidad 350 mcg/l y en el que no se especifica la técnica de determinación, concentraciones de CgA en plasma superiores a 5.000 mcg/l en tumores de intestino medio actuaban como factor predictor independiente de mal pronóstico (supervivencia de 33 meses frente a 57 meses de supervivencia si presentaban concentraciones inferiores a 5.000 mcg/l)67.
- –
TNE pancreáticos69–72.
Es importante destacar que esta correlación con el tamaño, la extensión tumoral y como factor pronóstico no existe en 3 situaciones:
- a)
Gastrinomas: presentan concentraciones altas de CgA, incluso en ausencia de metástasis, en correlación con la hiperplasia de las células enterocromafines-like más que por el tamaño del tumor.
- b)
Tumores pobremente diferenciados: presentan concentraciones de CgA bajas o ausentes por la pérdida de la capacidad síntesis y secreción de CgA73.
- c)
Tumores en tratamiento con análogos de somatostatina: las concentraciones son bajas por el efecto antisecretor más que por el efecto antitumoral74.
En los tumores carcinoides se recomienda utilizar la determinación del 5-HIAA en combinación con la CgA, ya que esta tiene mayor sensibilidad para detectar la progresión tumoral52. En los tumores de intestino medio, la CgA ha demostrado una correlación del 83% con la progresión tumoral y del 100% con la progresión hepática. Además, la CgA ha demostrado ser el primer marcador de recidiva, por delante de la determinación del 5-HIAA y las técnicas de imagen52,75,76. En una muestra de 39 pacientes con tumores carcinoides de intestino medio con metástasis en tratamiento con análogos de somatostatina, la CgA presentaba una mayor correlación con la funcionalidad física, la calidad de vida y el valor pronóstico para la supervivencia en comparación con la determinación de 5-HIAA en orina de 24h, que no presentaba ninguna de estas asociaciones77. En los pacientes con cardiopatía carcinoide, tanto la elevación de la CgA como la de NT-proBNP («N-terminal pro-brain peptide», marcador de fallo ventricular izquierdo) son marcadores diagnósticos y de supervivencia78.
Evaluación de la respuesta al tratamientoLa monitorización de la CgA también es útil para evaluar la respuesta a las diferentes opciones terapéuticas: cirugía, tratamiento médico, con radionúclidos y trasplante hepático79,80. La CgA podría considerarse un biomarcador de respuesta en algunos estudios con pacientes tratados con everolimus en TNE pancreáticos80,81.
Cromogranina A y síndrome de neoplasias múltiples tipo 1La monitorización de las concentraciones de CgA es de utilidad en los pacientes con MEN 1 ya que permite un diagnóstico precoz de un TNE-GEP y por lo tanto su abordaje terapéutico precoz. La identificación de una elevación de la concentración CgA sugiere la presencia de un TEP (en general) y en menor proporción de un gastrinoma, ya que el hiperparatiroidismo primario y/o los adenomas hipofisarios raramente la elevan.
En el cribado de TNE de páncreas, aunque ha demostrado ser el marcador de TNE más sensible, no puede ser la única medida diagnóstica y la determinación de CgA debe combinarse con pruebas de imagen periódicas. En un estudio con 34 pacientes con MEN 1 en el que la determinación de CgA se realizaba mediante RIA y considerando el límite alto de la normalidad 130 mcg/l, concentraciones elevadas de CgA indicaban la presencia de un tumor de páncreas con una especificidad del 100%, pero la sensibilidad tan solo fue del 59%62,82.
Cromogranina A en tumores neuroendocrinos no gastroenteropancreáticos- –
Feocromocitomas. La CgA es útil en el diagnóstico y seguimiento del feocromocitoma, para monitorizar tanto el tratamiento como la recidiva y la progresión tumoral. La determinación de CgA circulante aislada presenta una sensibilidad y especificidad similar a la de la determinación de catecolaminas/metanefrinas en plasma u orina, y parece que la combinación aumentaría la rentabilidad. Además su determinación no presenta la limitación de la fluctuación sérica de las concentraciones que tienen las catecolaminas, tras la cirugía el descenso de sus concentraciones es rápido frente a las catecolaminas/metanefrinas urinarias que pueden tardar 2-3 semanas y su determinación no se ve alterada por los fármacos utilizados para su manejo. Su concentración sérica muestra correlación con el tamaño tumoral y la extensión, de manera que su utilidad en el cribado de pacientes con enfermedad hereditaria o tumores pequeños es limitada. Los resultados acerca de un papel en la discriminación entre feocromocitoma benigno y maligno está siendo controvertido. En tumores de la corteza suprarrenal podría ser útil en el diagnóstico diferencial con feocromocitomas pobremente diferenciados que no presentan elevación de catecolaminas/metanefrinas3,83–86.
- –
Otras neoplasias derivadas de las células cromafines. Como se ha mostrado previamente, en paragangliomas y neuroblastomas la sensibilidad es inferior (10 y 30%, respectivamente) frente a sensibilidades superiores al 85% en feocromocitomas en varios estudios53. Aunque en un estudio con 34 niños a los que se había diagnosticado de neuroblastoma (en diferentes estadios), la determinación de CgA mediante RIA, y considerando como límite alto de la normalidad una concentración superior a 52ng/ml, presentó valor diagnóstico con una sensibilidad del 91% y una especificidad del 100% con correlación con el tamaño tumoral y como un útil predictor de supervivencia87.
- –
Carcinoma medular de tiroides. La determinación de la CgA circulante en su diagnóstico no es superior a la calcitonina (CT) ni al CEA, excepto en el caso de tumores desdiferenciados que no expresan CT ni CEA88.
- –
Adenomas hipofisarios. La CgA presenta resultados controvertidos en el diagnóstico de gonadotropinomas, adenomas hipofisarios clínicamente no funcionantes y tumores hipofisarios no endocrinos53,89,90. Se ha apuntado su utilidad en el diagnóstico etiológico del síndrome de Cushing, sugiriendo que concentraciones elevadas pueden indicar origen ectópico91. Como sucede en el caso de los feocromocitomas, parece que la determinación de CgB y secretogranina II podría tener un valor diagnóstico en el caso de prolactinomas3.
- –
Neoplasia paratiroidea. No parece ser de utilidad.
La elevación de las concentraciones de CgA en otros tumores refleja la diferenciación neuroendocrina de los mismos en los casos de cáncer de páncreas, colorrectal, gástrico y de próstata. En el carcinoma de mama y hepatocarcinoma la causa de dicha elevación no está clara.
En pacientes con adenocarcinoma de páncreas, las concentraciones están más elevadas que en sujetos con pancreatitis crónica y sujetos sanos92.
Hasta en el 34% de los pacientes con carcinoma colorrectal puede estar elevada y se relaciona con peor pronóstico después de la cirugía93.
En el cáncer de próstata existe correlación entre la inmunohistoquímica y las concentraciones plasmáticas, y también se ha relacionado con el estadio de Gleason y pronóstico desfavorable94,95. Además su determinación puede ayudar a identificar a aquellos pacientes con cáncer de próstata avanzado que no presentan valores elevados de antígeno específico prostático, aquellos que podrían ser eligibles para terapia adyuvante o aquellos que presentan resistencia a la terapia de supresión hormonal96. Estos son algunos de los factores que han hecho que su determinación sea una práctica clínica habitual en el manejo de adenocarcinomas y tumores mixtos de próstata.
En los pacientes con hepatocarcinoma se objetivan concentraciones altas en más del 80% de los pacientes, con elevaciones mayores que en la hepatitis crónica y en la cirrosis hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.