El interés en el estudio de la actividad del eje hipotálamo-hipofisario-adrenal, en los pacientes con trastornos mentales, surgió a raíz de ver cómo pacientes con trastornos depresivos graves presentaban un hipercortisolismo basal, similar al encontrado en pacientes con síndrome de Cushing. El hipercortisolismo en estos pacientes se veía reflejado por una ausencia de supresión en el test de supresión con dexametasona en dosis única de 1mg. Del mismo modo, con posterioridad se ha visto que numerosas enfermedades psiquiátricas han mostrado algún grado de alteración en esta prueba, como la anorexia nerviosa, el trastorno obsesivo compulsivo, procesos neurodegenerativos, los cuadros maníacos y la esquizofrenia. También en los últimos años se ha estudiado la relación entre el hipercortisolismo basal y el estrés, generando nuevas líneas de estudio en los trastornos de la personalidad, y el trastorno de estrés postraumático. Concretamente en el trastorno límite de la personalidad se estudió la respuesta al estrés, por la importancia que los eventos estresantes y traumáticos tienen en la génesis de este trastorno. Investigaciones realizadas en esta línea demostraron que la utilización de dosis menores de dexametasona podrían ser de una gran utilidad en el estudio de aquellos trastornos que cursaran con una respuesta exagerada al estrés. El objetivo del presente articulo es realizar una revisión narrativa de los estudios neuroendocrinos realizados mediante test de supresión con dexametasona en los trastornos psiquiátricos, y de esta manera conocer su utilidad como prueba complementaria diagnóstica o como marcador pronóstico.
Activity of the hypothalamic-pituitary-adrenal axis had been studied for the past half century, when some researchers noted that some patients with Cushing's syndrome and severe mood disorders had high baseline cortisol levels, which resulted in an inhibited response in the 1mg dexamethasone suppression test. Altered dexamethasone suppression test results were subsequently found in many psychiatric diseases, including anorexia nervosa, obsessive-compulsive disorder, degenerative dementia, bipolar disorders, and schizophrenia. The relationship between high baseline cortisol levels and stress has also been studied. Some researches on the genesis of borderline personality disorder focused on traumatic childhood backgrounds. Other investigations aimed at elucidating the relationship between traumatic backgrounds and some psychiatric disorders noted that patients with post-traumatic stress disorder and borderline personality disorder showed an enhanced cortisol suppression with low cortisol doses (0.5mg). Recent studies showed that use of an ultra-low dose of cortisol during the dexamethasone suppression test may be helpful for deteting disorders with hyperactivity of the hypothalamic-pituitary-adrenal axis.
Recent advances in neuroimaging support the existence of hyperactivity of the hypothalamic-pituitary-adrenal axis in patients with borderline personality disorder, relating a decreased pituitary gland volume to major traumatic backgrounds and suicidal attempts. The purpose of this paper is to make a narrative review of research using dexamethasone suppression test in psychiatric disorders, in order to ascertain its value as a supplemental diagnostic test or as a prognostic marker.
Las concentraciones de adrenocorticotropina (ACTH) y cortisol aumentan rápidamente en situaciones de estrés físico o psíquico, hipoglucemia o fiebre. La regulación del eje depende principalmente de 3 mecanismos: en el primero de ellos interviene la liberación pulsátil de corticotropina (CRH) en función de los ritmos circadianos endógenos del sistema nervioso central; en el segundo mecanismo regulador, la ACTH estimula la corteza suprarrenal, a través de la zona fascicular, donde se secretan los glucocorticoides (cortisol y corticosterona), y la zona reticular, produciendo andrógenos como la dehidroepiandrosterona (DHEA) y la androstenediona.; y por último el tercer mecanismo regulador, es el circuito de retroalimentación realizado por los glucocorticoides circulantes, por el torrente general sobre la hipófisis, el hipotálamo y otras áreas exteriores al eje hipotalamo-hipofisario-adrenal (HHA) como el hipocampo1.
La secreción diaria de cortisol presenta un ritmo circadiano muy pronunciado de forma similar al de la ACTH (niveles máximos por la mañana y bajos por la tarde). La ACTH regula la liberación de cortisol a partir de la corteza suprarrenal. La CRH hipotalámica es el regulador principal de la ACTH. El cortisol actúa mediante un sistema de regulación negativa que afecta a la liberación de ACTH y CRH1.
Medición de las concentraciones de cortisolComo las concentraciones de cortisol varían a lo largo del día, las concentraciones de cortisol en sangre deben relacionarse con la hora de obtención de la muestra, y dado que algunos laboratorios no disponen de valores de referencia propios para el cortisol, según la hora de obtención de la muestra, una alternativa consiste en medir el cortisol alrededor de la medianoche, que es cuando alcanza su concentración mínima. La muestra de elección es la sangre, aunque la medida también puede realizarse en saliva. Si en estas pruebas la concentración de cortisol resulta elevada, probablemente existe una alteración en la producción de cortisol. Posteriormente, se solicitan otras pruebas para conocer la causa por la que se producen estos aumentos.
Cortisol en orina de 24hTambién conocido como cortisol libre en orina, y a menudo utilizado para evaluar la producción total de cortisol.
Prueba de estimulación con corticotropinaEn esta prueba se inyecta CRH y se miden las concentraciones de ACTH y de cortisol a distintos tiempos: justo antes de administrarse la CRH (nivel basal) y de manera seriada en el tiempo, por ejemplo a los 30 y 60min de haberla administrado. La respuesta normal supone un máximo de las concentraciones de ACTH seguido de un máximo de las de cortisol. La mayoría de los pacientes con síndrome de Cushing, ya sea por tumores adrenales ya sea por tumores que generan una secreción ectópica de ACTH, no responde a la administración de CRH. La ACTH puede medirse en muestras de sangre obtenidas mediante un catéter colocado en los senos petrosos inferiores, que son unas formaciones venosas que transportan la sangre procedente de la hipófisis.
Test de supresión con dexametasonaLa dexametasona es un esteroide sintético que mimetiza la acción del cortisol, inhibiendo por retroalimentación la producción de CRH y de ACTH. Existen diferentes modalidades de esta prueba de supresión que se usan para confirmar el diagnóstico del síndrome de Cushing. Una respuesta normal a la dexametasona consiste en la supresión de la secreción del cortisol. Los pacientes con síndrome de Cushing no presentan una supresión adecuada de la secreción de cortisol después de una dosis baja y única de dexametasona, administrada en el momento de acostarse, hablando de test de supresión de dexametasona (TSD) positivo2. Puede también administrarse dosis más elevadas de dexametasona durante un período de 48h para distinguir entre un tumor hipofisario productor de ACTH y otras posibles causas de síndrome de Cushing.
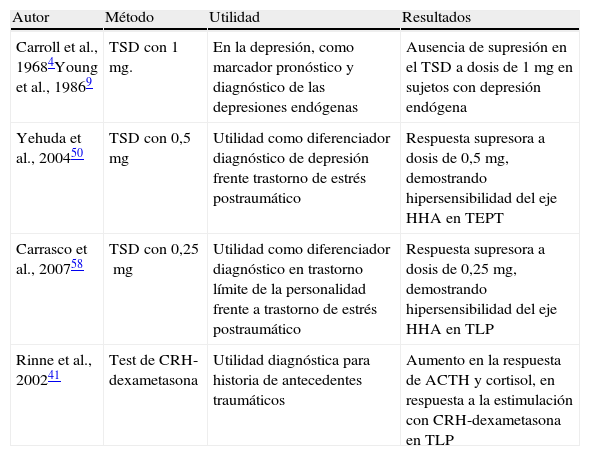
Estudios en los trastornos del estado de ánimoCuando hablamos de depresión deben estar presentes en la clínica, al menos 2 síntomas: por un lado, el bajo estado de ánimo y, por otro, la anhedonia o pérdida de interés por actividades placenteras3. Las clasificaciones psiquiátricas actuales dividen la depresión en 2 grandes grupos: la depresión mayor, que agrupa aquellas depresiones de intensidad elevada, de al menos 2 semanas de duración, con mayor sustrato biológico, y que conllevaban un deterioro en el funcionamiento global del sujeto; y la distimia, que agrupa aquellas depresiones de intensidad leve, de al menos 2 años de duración, de mayor sustrato neurótico, y que no merman tanto el funcionamiento global del sujeto. Los estudios de depresión y actividad del eje HHA comenzaron a finales de los años 60, cuando un grupo de investigadores encabezados por Carroll et al.4–6, describieron un incremento en la secreción de cortisol, resistente a la supresión con dexametasona (TSD), observado mediante el TSD de 1mg, en pacientes depresivos graves, algo que hasta entonces se había observado en pacientes con síndrome de Cushing (tabla 1). De estos estudios, se pudo llegar a la conclusión de que el TSD con dosis de un 1mg presentaba una sensibilidad del 67%, y una especificidad del 96%, para identificar a los pacientes con síntomas depresivos de tipo melancólico4–8. La depresión melancólica se considera un subtipo de depresión mayor, de gran heredabilidad, con un sustrato biológico importante, y por ello, el nombre de depresión endógena o melancólica. Sin embargo, la sensibilidad del TSD en pacientes con depresión mayor, se estimaba en solo un 44%, si bien se observó que dicha sensibilidad aumentaba, con la presencia de síntomas psicóticos (67-78%) y síntomas de manía mixta; en otras palabras, que aumentaba cuando existían más variables de sustrato endógeno o biológico4–8. Este hallazgo estaba presente tanto en niños como en adultos independientemente del sexo. Una de las aplicaciones prácticas del TSD en los trastornos afectivos, como la depresión, sería la de predictor de respuesta al tratamiento farmacológico. Se observó que los pacientes con un test de supresión positivo (aquellos que presentaban una ausencia de supresión en el TSD de 1mg) se beneficiaban menos de un tratamiento con placebo, y más de tratamiento farmacológico, que aquellos en los que el test era negativo. El TSD de 1mg no puede asegurar su utilidad diagnostica, al existir únicamente una sensibilidad del 44%, para los pacientes con criterios de depresión mayor, y siendo la depresión mayor una entidad heterogénea, donde se incluyen distintos tipos de depresión como la depresión psicótica, depresión endógena, depresión posparto y depresión anancástica entre otras. Sin embargo, sí puede tener una utilidad como marcador pronóstico, dado que los pacientes con TSD 1mg positivo presentarían una mejor respuesta al tratamiento farmacológico que los sujetos son TSD negativo. En la década de los 90, y en congruencia con los datos obtenidos, Young et al.9–11, demostrarían una hiperactividad de la hormona liberadora de CRH hipotalámica con aplanamiento de la respuesta de ACTH en pacientes depresivos (tabla 1).
Principales investigaciones realizadas con test de supresión de dexametasona en enfermedades mentales
| Autor | Método | Utilidad | Resultados |
| Carroll et al., 19684Young et al., 19869 | TSD con 1mg. | En la depresión, como marcador pronóstico y diagnóstico de las depresiones endógenas | Ausencia de supresión en el TSD a dosis de 1mg en sujetos con depresión endógena |
| Yehuda et al., 200450 | TSD con 0,5mg | Utilidad como diferenciador diagnóstico de depresión frente trastorno de estrés postraumático | Respuesta supresora a dosis de 0,5mg, demostrando hipersensibilidad del eje HHA en TEPT |
| Carrasco et al., 200758 | TSD con 0,25mg | Utilidad como diferenciador diagnóstico en trastorno límite de la personalidad frente a trastorno de estrés postraumático | Respuesta supresora a dosis de 0,25mg, demostrando hipersensibilidad del eje HHA en TLP |
| Rinne et al., 200241 | Test de CRH-dexametasona | Utilidad diagnóstica para historia de antecedentes traumáticos | Aumento en la respuesta de ACTH y cortisol, en respuesta a la estimulación con CRH-dexametasona en TLP |
CRH: corticotropina; HHA: eje hipotamalo-hipofisario-adrenal; TEPT: trastorno de estrés postraumático; TLP: trastorno límite de la personalidad; TSD: test de supresión de dexametasona.
En la depresión atípica, en contraste con el hipercortisolismo basal observado en las depresiones melancólicas, los pacientes presentan un menor nivel basal y una mayor proporción de concentraciones normales. En 2002, Levitan et al.12 observaron que las depresiones atípicas presentaban una concentración de cortisol tras la administración de dexametasona más baja que otras depresiones (melancólicas y psicóticas), y también se observó un incremento en las concentraciones de cortisol, tras administración de 75mg de desimipramina (inhibidor selectivo de la recaptación de noradrenalina) en comparación con otras depresiones que orientan hacia una menor disfunción del sistema noradrenérgico, en los estudios llevados a cabo por Asnis et al. en 199513,14.
En la distimia, los resultados hallados muestran un porcentaje de no supresores similar al de sujetos normales, mientras que es significativamente más bajo que los grupos de depresión mayor con los que se compara15,16, aunque en un estudio llevado a cabo por Brambilla et al. en 198917 no se encontraron diferencias entre distimia y depresión mayor.
Estudios en trastornos neuróticosLa neurosis clásicamente se definía como el conjunto de enfermedades mentales, sin evidencia de lesión orgánica, con un juicio de la realidad conservado, y donde existía un elevado nivel de angustia. Según el DSM IV TR, dentro de las neurosis, se incluyen los trastornos del estado de ánimo, los trastornos de ansiedad, los trastornos somatomorfos, los trastornos disociativos, los trastornos facticios y los trastornos de la personalidad entre otros3. Con respecto a los estudios del TSD en el trastorno obsesivo compulsivo (TOC), existen discordancias, ya que el número de no supresores varía enormemente de unos trabajos a otros (0-41%). Mientras que los estudios llevados a cabo a finales de los 80 por Insel et al., Cottraux et al. y Schlesser et al. constataban una frecuencia de no supresores similar a la que se refería en melancolías (superior al 25%)18–21, otros estudios llevados a cabo en la misma década, por Lieberman et al., Monteiro et al., Vallejo et al., y Curtis et al., recogían cifras sensiblemente inferiores21–25. Curtis et al. en 198225 analizaron estas discrepancias sobre una muestra de 29 enfermos obsesivos, y concluyeron que las anomalías del TSD en pacientes obsesivos dependían del trastorno afectivo sobreañadido, ya que 3 de los 5 pacientes no supresores (17%) cumplían criterios del DSM-III-R de trastorno depresivo mayor, y todos ellos tenían puntuaciones en el test de Hamilton de depresión superiores a 17. Además se constató una elevada correlación entre estas puntuaciones y las concentraciones de cortisol tras dexametasona todo lo cual indica una mediatización de la depresión en los resultados del TSD.
Los estudios realizados en la década de los 80, en el trastorno de pánico o de angustia, por Curtis et al., Sheehan et al., Lieberman et al. y Goldstein et al. entre otros, encontraron un porcentaje bajo (en torno al 15%) de no supresores en el TSD25–34. En un estudio llevado a cabo por Sheehan et al. en 198326, en sujetos con trastorno de pánico, se hallaron tan solo 3 TSD anormales entre 20 pacientes diagnosticados de ataques de pánico o agorafobia, que además parecía atribuible a distintas causas de la propia condición de angustia-agorafobia. Otro estudio llevado a cabo por Lieberman et al. en 198327, constata un 7,8% de no supresión ente 51 pacientes con ataques de pánico. Por otra parte, Goldstein et al. en 198733 constataron TSD anormales en 3 pacientes ansiosos (2 agorafóbicos con crisis de angustia y otro con crisis de angustia sin agorafobia) de un total de 35.
Sin embargo, algunos trabajos llevados a cabo por Grunhaus et al. y Ceulemans et al. en 1987 y 1985 respectivamente, detectaron cifras similares a las de las depresiones35,36. De todas formas hay que tener en cuenta el resultado del estrés sobre el TSD según apuntaron Ceulemans et al. En la década de los 90, Coryell et al29. encontraron una no supresión del 47,5% en 40 sujetos prequirúrgicos sin historia psiquiátrica. Probablemente las cifras elevadas de no supresión en estos pacientes reflejaban un estrés inespecífico. Tal vez por ello encontraron una relación entre la no supresión y la presencia de más síntomas de ansiedad, más incapacidad social y laboral, y una mayor frecuencia de depresión comórbida.
Estudios en esquizofreniaLos estudios realizados en la década de los 90 en pacientes con esquizofrenia resultan contradictorios. Se ha observado de una manera extensa una ausencia de supresión del cortisol en el TSD, pero su etiología no está clara, y podría estar relacionada con la depresión o con síntomas negativos tal y como apuntan Ismail et al.37. Sin embargo, Pivac et al. encontraron unas tasas similares de no supresión en pacientes esquizofrénicos con síntomas positivos (56%) y negativos (53%)38. Tampoco se halló una relación entre el comportamiento suicida y la ausencia de supresión tal y como apuntaron Lewis et al.39.
Estudios en síndrome de fatiga crónicaLos estudios llevados a cabo por Gaab et al. en 2002 en pacientes con síndrome de fatiga crónica describieron concentraciones normales de cortisol, mostrando una supresión a la dexametasona aumentada y prolongada40. Este aumento de la retroalimentación negativa de eje HHA podría ser una explicación de las alteraciones del funcionamiento del eje HHA previamente descritas en estos pacientes.
Estudios con test de supresión de dexametasona a dosis de 0,5 mg y 0,25 mgEl punto de inflexión que permitió la reciente recuperación del interés neuropsiquiátrico por la dexametasona fue a raíz de los estudios diferenciales realizados entre el trastorno de estrés postraumático (TEPT) y pacientes con depresión mayor, que demostraron la hipersensibilidad del eje HHA en los pacientes con trastorno de estrés postraumático. Los estudios realizados inicialmente observaron que el cortisol libre urinario se encontraba aumentado en la depresión y disminuido en el estrés postraumático; que la cortisolemia tras dexametasona de 1mg estaba aumentada en la depresión y disminuida en el estrés postraumático; que, tal y como apuntaron Rinne et al.41 en 2002, la respuesta de ACTH tras CRH se encontraba disminuida en ambos y sobre todo en el número de receptores glucocorticoideos en los linfocitos, disminuidos en la depresión y aumentados en el estrés postraumático (tabla 1). Es aquí cuando se pone de manifiesto la existencia de una hipersensibilidad del eje HHA a dosis bajas de dexametasona en los sujetos con TEPT. El aumento en la densidad de receptores glucocorticoideos en los linfocitos de los pacientes con TEPT observada mediante análisis de radioligandos citosólicos indicaría una sensibilidad aumentada para los sistemas de retroinhibición del eje a nivel de los receptores glucocorticoideos hipofisarios.
A partir de entonces se comenzó a hipotetizar con que los sujetos con TEPT podrían suprimir con dosis menores a 1mg de dexametasona en el TSD, y se comenzó a utilizar 0,5mg de dexametasona (la mitad de la dosis habitual), encontrándose que los pacientes con TEPT seguían suprimiendo pese a que inicialmente no se esperaba esta respuesta, y que los depresivos sin traumas previos no presentaban respuesta supresora. Esta nueva versión de la prueba clásica se consideró como un elemento diferencial entre la depresión y el TEPT. Sin embargo, podría deberse a la historia vital previa; así, tras un evento traumático aquellos sujetos que presentaban estrés postraumático y los que tenían depresión mayor pero contaban con traumas previos importantes desarrollan una mayor supresión. Los depresivos que no presentan traumas previos no tienen respuesta supresora. Sin embargo, Lindley et al. en 2004, utilizando medición de cortisol libre en saliva, en veteranos de guerra no consiguieron demostrar los hallazgos previos de cortisolemia basal disminuida y de hipersupresión en el estrés postraumático42.
A partir de los estudios que demostraron la importancia de los antecedentes traumáticos en la génesis de los trastornos de la personalidad y al tener en cuenta la importante comorbilidad existente entre el TEPT y el trastorno limite de la personalidad (TLP), es cuando se empieza a estudiar la respuesta al cortisol en estos pacientes. En esta línea algunos investigadores43 realizaron estudios con TSD en pacientes con diagnóstico de TLP y diagnóstico comórbido de TEPT. Los estudios realizados con TSD de 0,5mg arrojaron una mayor tasa de supresión en el TSD en pacientes con TLP y diagnóstico comórbido de TEPT, pero no en pacientes con TLP sin diagnostico de TEPT. Estos estudios ponen de manifiesto la existencia de una respuesta supresora de cortisol a dosis bajas de dexametasona, si bien un importante número de sujetos control presentaba también tasas elevadas de supresión (un 70-80% a dosis de 0.5mg).
Continuando la línea de trabajo de los traumas infantiles, se describió que los pacientes con TLP tenían aumentada la respuesta de ACTH y cortisol, en respuesta a la estimulación con CRH-dexametasona, mientras que si desarrollaban estrés postraumático la respuesta de ACTH quedaba atenuada41 (tabla 1). Esta respuesta se veía influida en mayor medida por la historia de abusos infantiles que por el propio diagnóstico de TLP. Posteriormente, en otro estudio se comunicó la disminución de esta hiperrespuesta del eje HHA en mujeres con TLP con abuso infantil mantenido mediante la utilización de un tratamiento farmacológico con fluvoxamina44.
En esta misma línea, un grupo de investigadores trataron de aumentar la especificidad del TSD, reduciendo la dosis de dexametasona a 0,25mg45. Suponían que la población normal no suprimiría el cortisol plasmático, es decir sus concentraciones plasmáticas superarían los 5 mcg/dl. De esta forma se conseguiría excluir a los sujetos sin patología, para la detección de una hiperrespuesta supresora en los sujetos con TLP.
Dicho estudio obtuvo una tasa de supresión significativamente mayor en pacientes con diagnostico de TLP y presencia de antecedentes de trauma infantil en comparación con el grupo de pacientes con TLP sin antecedentes traumáticos y el grupo control. En este estudio se utilizó una dosis de 0,25mg de dexametasona en lugar de los 0,5mg de los estudios anteriores. Por tanto, este estudio sugiere la existencia de una hipersensibilización de los sistemas de retroinhibición del eje a nivel de los receptores glucocorticoideos hipofisarios. Estos estudios han tenido por objetivo confirmar la hipersensibilización inhibitoria de los mecanismos de respuesta al estrés en los pacientes con TLP estudiando la respuesta supresora de cortisol utilizando un estímulo mínimo de dexametasona con 0,25mg45.
Algunos estudios han encontrado una alta prevalencia de abuso infantil en la historia de los pacientes con trastorno de la conducta alimentaria y lo han correlacionado con una mayor gravedad del trastorno y con la existencia de más síntomas bulímicos, sugiriendo que las alteraciones en los mecanismos de respuesta al estrés y en el funcionamiento del eje HHA pudieran tener un papel importante en la fisiopatología de estos trastornos. Hallazgos preliminares plantean que algunos subtipos dentro de los trastornos de la conducta alimentaria presentan, al igual que ocurre en el TEPT y en el TLP, un estado de hipersensibilidad del eje HHA con un aumento de la sensibilidad a dexametasona46–48. En esta línea, un estudio realizado en 25 pacientes diagnosticadas de trastorno de la conducta alimentaria observa que un 12% de estas pacientes presentaba antecedentes traumáticos sin encontrarse relación con el subtipo de trastorno de la conducta alimentaria48. Las pacientes más impulsivas y con más rasgos límite presentaban de forma significativa mayor número de antecedentes traumáticos; del mismo modo encontraron una relación significativa entre la suspensión del cortisol y la presencia de antecedentes traumáticos, de modo que las pacientes más impulsivas y con más rasgos límite presentaban niveles significativamente menores de cortisol tras 0,25mg de dexametasona.
Existen no obstante voces discordantes con esta hipersensibilidad del HHA en los TLP. Estos estudios sugieren que el peso de los antecedentes traumáticos en las disfunciones del eje HHA depende del TEPT comórbido, sin embargo no hay evidencias de que estas alteraciones aparezcan en los pacientes con TLP.
La hipersensibilidad del eje HHA también se ha demostrado mediante la utilización de un test combinado de dexametasona y CRH. Se observó una mayor tasa de supresión en los pacientes con diagnóstico de TLP que presentaban una historia de traumas infantiles de abuso que en aquellos que carecían de dicha historia de antecedentes traumáticos43,45,49,50.
En los estudios de neuroimagen la hipersensibilidad del eje HHA se ha relacionado con el volumen de la glándula pituitaria45. En estudios con resonancia magnética aquellos pacientes con TLP y mayor numero de antecedentes de tentativas suicidas presentan un volumen disminuido51,52. También se ha observado un menor volumen de la pituitaria en aquellos pacientes con TLP e importante historia de antecedentes traumáticos52.
Relación con rasgos dimensionalesEstudios en población sana, llevados a cabo por McCleery et al. en 2001, y Zobel et al. en 2004, encontraron que los individuos con bajo neuroticismo mostraban una respuesta significativamente mayor de cortisol al test de CRH-dexametasona (alta reactividad) que los individuos con alto neuroticismo53,54.
Otros autores como Rosenblitt et al. en 200155, desarrollaron estudios similares en estudiantes universitarios, utilizando la escala de búsqueda de sensaciones de Zuckerman, y midendo la testosterona y el cortisol. Como cabría esperar, la puntuación en la escala es mayor en hombres que en mujeres. Los resultados apoyan la existencia de una relación inversa significativa entre el cortisol y la búsqueda de sensaciones en hombres, pero no en mujeres. Esta diferencia se mantiene incluso después del ajuste según los niveles de testosterona y la edad.
Otro estudio de Schweitzer et al., en 200156, estudió mediante el TSD y la versión revisada del inventario clínico multiaxial de Millon (MCMI-II) a los pacientes diagnosticados de trastorno depresivo mayor con un trastorno de personalidad clínicamente relevante, observando de forma significativa que los supresores tenían puntuaciones más altas que los no supresores en 6 de las 13 escalas del Millon: límite, pasivo-agresivo, esquizoide, esquizotípico, evitativo y autodestructiva.
ConclusiónEl estudio de la respuesta de cortisol puede ser de utilidad para identificar o predecir el pronóstico de algunos trastornos psiquiátricos.
Tradicionalmente la depresión ha sido la patología más estudiada en este campo, asociándose a un hipercortisolismo basal similar al observado en algunos trastornos endocrinológicos, como el sindrome de Cushing2. Los pacientes con depresión mayor han mostrado una ausencia a la supresión de cortisol tras la administración de dosis baja de dexametasona de 1mg, mediante la utilización del TSD. La sensibilidad de esta prueba para el diagnóstico de depresión mayor se veía aumentada cuanto mayor era el número de síntomas melancólicos, endógenos y psicóticos asociados a su clínica. Los estudios realizados en esta línea también concluyeron que el TSD podría tener valor pronóstico, puesto que los sujetos con un TSD positivo presentaban una respuesta más favorable al tratamiento farmacológico que a la psicoterapia y al placebo5–7. Sin embargo, numerosas enfermedades psiquiátricas han mostrado algún grado de alteración en esta prueba, como la anorexia nerviosa, TOC, demencia degenerativa, cuadros maníacos y esquizofrenia, aportando datos discordantes acerca de la implicación del cortisol en los mecanismos fisiopatológicos de las mismas. La relación entre el hipercortisolismo basal y el estrés se reavivó después de ver las diferencias existentes entre la depresión mayor y el trastorno de estrés postraumatico. En estos estudios se observó que el cortisol libre urinario se encontraba aumentado en la depresión y disminuido en el estrés postraumático, y que la cortisolemia tras TSD de 1mg estaba aumentada en la depresión y disminuida en el estrés postraumático; La respuesta de ACTH tras CRH se encontraba disminuida en ambos y sobre todo en el número de receptores glucocorticoideos en los linfocitos, disminuidos en la depresión y aumentados en el estrés postraumático a pesar de existir un hipercortisolismo basal.
Los estudios más recientes parecen señalar a los receptores glucocorticoideos como responsables de la sensibilización de los sistemas de retroinhibición del eje HHA.
En aquellos trastornos en los que existe una relación con los antecedentes traumáticos, se ha observado una respuesta exagerada de cortisol ante estímulos mínimos de dexametasona, manifestada por una mayor supresión en respuesta al TSD de 0,25mg. En los pacientes con trastorno límite de la personalidad, en los que el peso de los antecedentes traumáticos según diversos autores es responsable de este trastorno, se observan cifras de cortisol plasmático significativamente más bajas que en los sujetos sanos o en otros pacientes. Tal y como ocurre en la depresión, donde el TSD de 1mg tiene un valor pronóstico, en este caso por ausencia de supresión de cortisol, en el TLP parece que la respuesta supresora a dosis bajas de 0,25mg en el TSD también puede tener valor pronóstico, dado que la hipersupresión se correlacionaría con una mayor inestabilidad afectiva, mayor impulsividad y una mayor gravedad clínica. Esto reflejaría un peor funcionamiento social, familiar y laboral, y clínicamente se manifestaría por un aumento en el número de intentos de suicidio57,58.
Por ultimo, los estudios de TSD con relación a los rasgos de la personalidad observaron que las dimensiones de la personalidad relacionadas con la impulsividad y el descontrol emocional parecían relacionarse con una respuesta hipersensible del cortisol a la supresión, aunque la relación con el neuroticismo no ha quedó del todo clara53,54. Esta dimensión del neuroticismo, tendría 2 componentes distintos y posiblemente opuestos en cuanto a su relación con el eje HHA: un componente de angustia-inhibición (probablemente relacionado con hipercortisolismo) y un componente de labilidad emocional (probablemente relacionado con hipocortisolismmo y supresión excesiva en el TSD)55.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.