La fibrosis quística es la enfermedad genética letal con herencia autosómica recesiva más frecuente en la raza caucásica, afectando aproximadamente a uno por cada 2.000 nacidos vivos. La supervivencia de los pacientes con fibrosis quística ha mejorado gracias a los avances en los cuidados respiratorios y nutricionales, alcanzando un promedio de esperanza de vida comprendido entre los 30 y 40 años. La aparición de diabetes en la fibrosis quística es una comorbilidad que aumenta con la edad, con una prevalencia de hasta el 50% en los adultos. Su desarrollo se asocia a un empeoramiento de la función pulmonar y el estado nutricional, por lo que su diagnóstico precoz es esencial para mejorar la calidad de vida y clase funcional. El tratamiento con insulina de la diabetes y otras alteraciones precoces del metabolismo hidrocarbonado podría conllevar a una mejora de la función pulmonar y del estado nutricional de los pacientes con fibrosis quística.
Cystic fibrosis is the most common fatal inherited autosomal recessive disease in Caucasians, affecting approximately one out of every 2,000 births. Survival of patients with cystic fibrosis has significantly improved due to advances in respiratory and nutritional care, and their current average life expectancy is 30-40 years. Development of cystic fibrosis-related diabetes is a comorbidity that increases with age and may reach a prevalence up to 50% in adults. Its development is associated to impaired lung function and nutritional status, and early diagnosis and treatment are therefore essential to improve quality of life and performance status. Insulin therapy for diabetes and other early carbohydrate metabolism disorders may improve lung function and nutritional status of patients with cystic fibrosis.
En España, la incidencia de fibrosis quística (FQ) oscila entre uno por cada 2.810 a 5.532 nacidos vivos, dependiendo del estudio. Probablemente esta variación está causada por diferentes prevalencias de la principal mutación, F508Δ, que consiste en la desaparición de una fenilalanina en la posición 508 de la proteína CFTR (cystic fibrosis transmembrane regulator). En nuestro país, la frecuencia de esta mutación como causante de la enfermedad, oscila desde el 50% en poblaciones mediterráneas, hasta 80% en Asturias1–3. Debido a la mayor supervivencia de los pacientes con FQ, actualmente la diabetes relacionada con la fibrosis quística (DRFQ) es una de las comorbilidades más frecuentes en los sujetos que alcanzan la edad adulta. Los primeros casos descritos de DRFQ e intolerancia a la glucosa (ITG) en FQ datan de 19554.
Típicamente la DRFQ se diagnostica en la adolescencia tardía, con una edad media al diagnóstico comprendida entre los 18 y 25 años. La prevalencia es difícil de establecer y a menudo resulta infraestimada, dependiendo de los criterios diagnósticos y de monitorización que se utilicen. En Europa y Estados Unidos se estima una prevalencia global del 12,4 y 16,9%, respectivamente5,6. La DRFQ puede aparecer a cualquier edad, pero lo más habitual es que la prevalencia aumente con ella, siendo de un 9% a los 5-9 años, un 26% a los 10-20 años y aproximadamente hasta un 50% a los 30 años4,7. Entre los 15 y 30 años el porcentaje de pacientes con tolerancia normal a la glucosa desciende casi linealmente, teniendo en cuenta que esta estimación es difícil de precisar, porque el estado metabólico puede variar de año en año en los pacientes con FQ8–11.
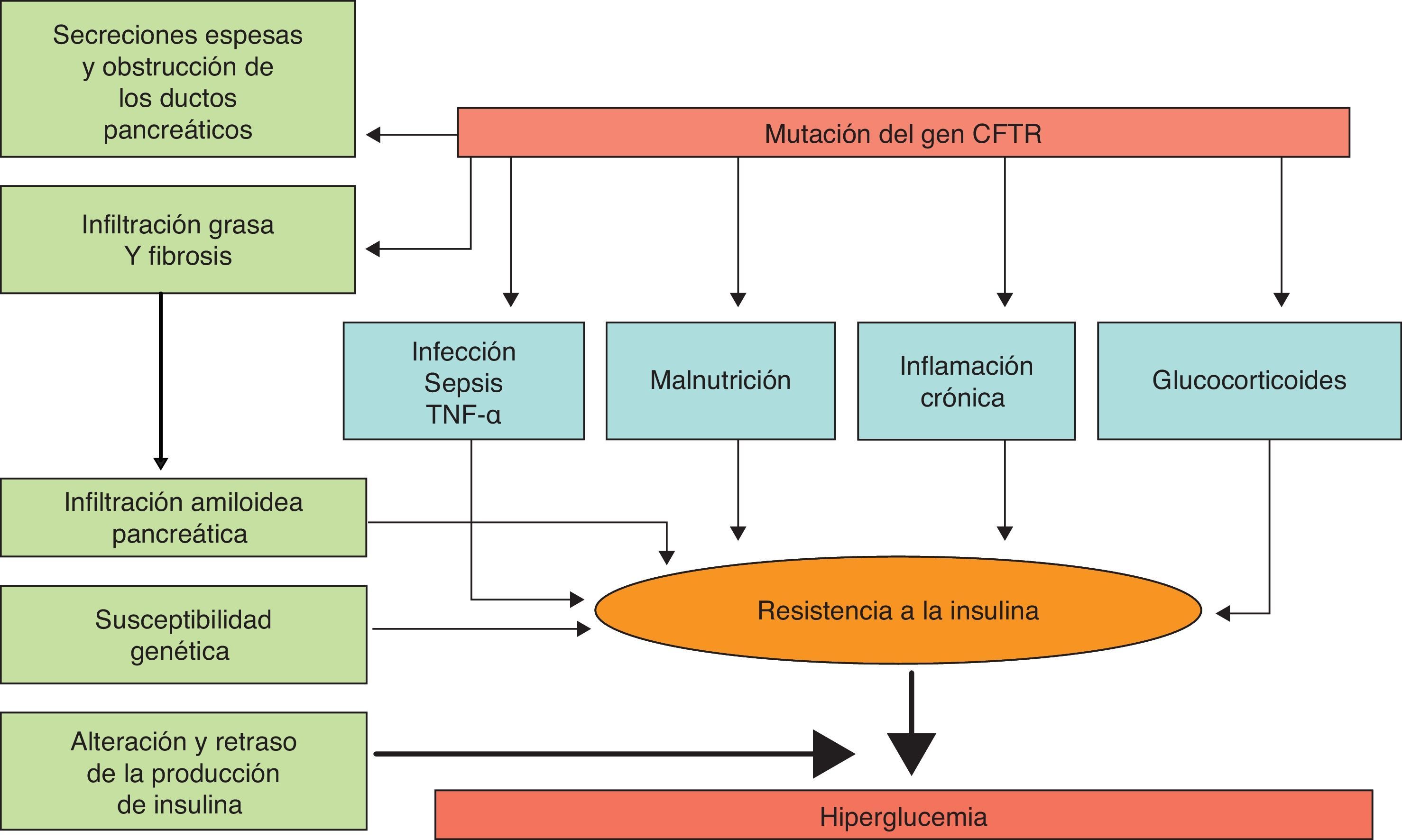
FisiopatologíaPoco se conoce sobre los factores predictivos de desarrollo de diabetes en la FQ y no está claro qué características diferencian a los individuos con FQ que desarrollarán o no diabetes. Entre los factores predisponentes se han identificado (fig. 1): el género femenino, la edad, la clase de mutación genética (mayor riesgo en homocigotos para la mutación del F508Δ), la presencia de insuficiencia pancreática exocrina, el grado de deterioro de la función pulmonar, el uso de corticoides y la presencia de otras complicaciones de la FQ simultáneas, como son la enfermedad hepática y el trasplante pulmonar8,12.
Mecanismos fisiopatogénicos de la alteración del metabolismo hidrocarbonado en la CF.
Adaptado de: O’Riordan et al.4
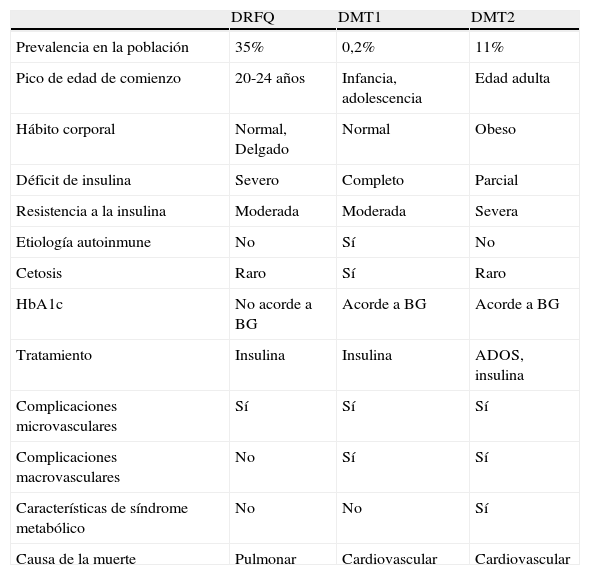
El mecanismo exacto por el cual se desarrolla la diabetes en la FQ permanece sin esclarecer. Se sabe que el principal factor fisiopatogénico es el déficit de insulina asociado a la disfunción de la célula β, aunque también influyen otros factores como la resistencia a la insulina, la alteración del funcionamiento de otras hormonas pancreáticas, la alteración del eje enteroinsular y del aclaramiento de la insulina10,13. Aunque la DRFQ presenta similitudes con la diabetes mellitus tipo 1 y tipo 2 (tabla 1), se debe considerar una entidad distinta, con objetivos a largo plazo específicos11.
Principales características de la diabetes relacionada con la fibrosis quística comparada con DM tipo 1 y tipo 2
| DRFQ | DMT1 | DMT2 | |
| Prevalencia en la población | 35% | 0,2% | 11% |
| Pico de edad de comienzo | 20-24 años | Infancia, adolescencia | Edad adulta |
| Hábito corporal | Normal, Delgado | Normal | Obeso |
| Déficit de insulina | Severo | Completo | Parcial |
| Resistencia a la insulina | Moderada | Moderada | Severa |
| Etiología autoinmune | No | Sí | No |
| Cetosis | Raro | Sí | Raro |
| HbA1c | No acorde a BG | Acorde a BG | Acorde a BG |
| Tratamiento | Insulina | Insulina | ADOS, insulina |
| Complicaciones microvasculares | Sí | Sí | Sí |
| Complicaciones macrovasculares | No | Sí | Sí |
| Características de síndrome metabólico | No | No | Sí |
| Causa de la muerte | Pulmonar | Cardiovascular | Cardiovascular |
BG: blood glucose (glucosa plasmática); DMT1: diabetes mellitus tipo 1; DMT2: diabetes mellitus tipo 2; DRFQ: diabetes relacionada con la fibrosis quística.
Fuente: Laguna et al.11
La primera fase de la secreción de insulina en respuesta a una sobrecarga de glucosa oral e intravenosa –y a otros estímulos secretores de insulina– está alterada en adultos con FQ9,10,14,15. El pico máximo de insulina está significativamente retrasado hasta los 90-120 minutos en pacientes con DRFQ, respecto a los 30-60 minutos en sujetos sanos10. Esta pérdida de la primera fase de la secreción de insulina aparece incluso en sujetos con FQ y una tolerancia normal a la glucosa9,14,15. La cantidad absoluta de insulina secretada a lo largo del tiempo también está disminuida en los casos con DRFQ6,9. Este descenso global de la secreción de insulina se ha asociado con la presencia de insuficiencia pancreática exocrina. Los pacientes con insuficiencia pancreática exocrina presentan una reducción del 41% en el pico de insulina plasmático en respuesta a la ingesta de glucosa. La secreción de glucagón y polipéptido pancreático son también menores, mientras que los niveles de somatostatina pueden estar más elevados. La respuesta del glucagón a la hipoglucemia está disminuida de forma global en pacientes con FQ, tanto los que tienen DRFQ como los que presentan un metabolismo hidrocarbonado normal. Se ha sugerido que esta insulinopenia asociada a la alteración del glucagón y otras hormonas pancreáticas, retrasa el desarrollo de DRFQ y hace que sean infrecuentes los episodios de cetoacidosis en este tipo de diabetes10. En resumen, en la DRFQ existe una disminución del pico de secreción de insulina, de su primera fase de secreción y de la cantidad total de insulina secretada en respuesta a una sobrecarga de glucosa.
Otro factor que puede estar implicado en la aparición de DRFQ es la resistencia a la insulina (RI). Su papel patogénico es controvertido, aunque parece ampliamente aceptado que los pacientes con DRFQ presentan diferentes grados de RI, y que determinadas condiciones clínicas como las infecciones, el estado nutricional, el uso de corticoides y el estado clínico de la enfermedad pulmonar, pueden condicionar una exacerbación importante de la hiperglucemia. En cuanto a los mecanismos de la RI en la DRFQ, se han descrito alteraciones en el transportador GLUT-415,16. Los pacientes con FQ tienen un estado de inflamación crónica de bajo grado, por lo que también se ha postulado la elevación del TNFα como un mecanismo favorecedor de la RI. Hay estudios que demuestran que los niveles de TNFα están elevados en plasma y en muestras de lavado broncoalveolar de pacientes con FQ, y que se correlacionan con los sistemas de puntuación del estado clínico, con tendencia a niveles más elevados en los sujetos con DRFQ e ITG16. Más recientemente se ha observado que los niveles de gamma-glutamil transpeptidasa, otro marcador de la RI, parecen estar relacionados con un aumento del riesgo de DRFQ, de forma independiente de la edad, el sexo y la proporción de grasa corporal12. En el mismo sentido, algunos estudios en pacientes con FQ han objetivado niveles elevados de ácidos grasos libres, estrechamente relacionados con la RI, y que se relacionan con el desarrollo de DRFQ10.
DiagnósticoHoy en día, el diagnóstico de diabetes en la FQ se establece según los criterios de la North American Cystic Fibrosis Foundation y la American Diabetes Association (ADA) mediante la hemoglobina glicada (HbA1c), la glucemia plasmática en ayunas, o la prueba de tolerancia oral a la glucosa de 2 horas (OGTT)15–19.
La HbA1c (%) no se debería utilizar como prueba de cribado de DRFQ, porque puede ser normal en los estadios iniciales y en los casos de hiperglucemia intermitente. Además, debido al estado de inflamación crónica, la vida media del hematíe en la FQ está disminuida, y por tanto los valores de la HbA1c pueden ser inferiores a lo esperado9,14,15,17. Holl et al.18 realizaron un estudio en el que se observó que el valor medio de la glucemia a los 120 minutos no era distinto en los casos de FQ con HbA1c elevada respecto a aquellos con valores normales, concluyendo que la HbA1c no debería sustituir a la OGTT como prueba de cribado debido a su baja sensibilidad.
En la actualidad, la OGTT es la prueba de cribado más sensible para detectar DRFQ, y la recomendada por la International Society for Pediatric and Adolescent Diabetes y la American Diabetes Association (ADA), puesto que los niveles de glucosa plasmática estudiados únicamente en ayunas podrían dejar sin diagnosticar a más de 2/3 de los pacientes con DRFQ.
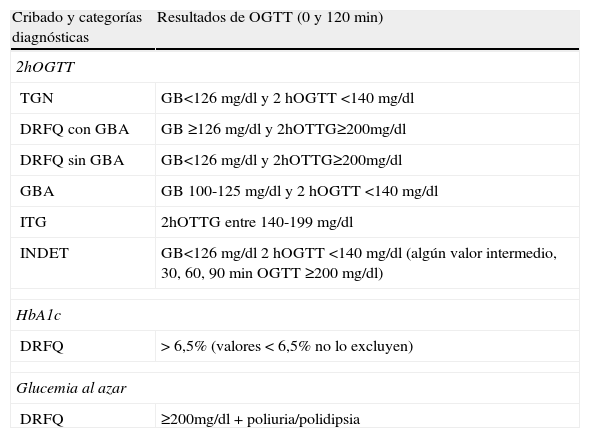
Según los resultados de la OGTT, los pacientes pueden ser clasificados en varias categorías (tabla 2), en función de la glucemia en diferentes tiempos durante la prueba: tolerancia normal a la glucosa, DRFQ con glucemia basal alterada (GBA), DRFQ sin GBA, alteración de la glucemia en ayunas (GBA), ITG y tolerancia a la glucosa indeterminada (INDET)4,9,17,19.
Categorías diagnósticas de las alteraciones del metabolismo hidrocarbonado según los resultados de la sobrecarga oral de glucosa (OGTT). North American CF Consensus Conference 201017,19
| Cribado y categorías diagnósticas | Resultados de OGTT (0 y 120 min) |
| 2hOGTT | |
| TGN | GB<126 mg/dl y 2hOGTT <140 mg/dl |
| DRFQ con GBA | GB ≥126 mg/dl y 2hOTTG≥200mg/dl |
| DRFQ sin GBA | GB<126 mg/dl y 2hOTTG≥200mg/dl |
| GBA | GB 100-125 mg/dl y 2hOGTT <140 mg/dl |
| ITG | 2hOTTG entre 140-199 mg/dl |
| INDET | GB<126 mg/dl 2hOGTT <140 mg/dl (algún valor intermedio, 30, 60, 90min OGTT ≥200 mg/dl) |
| HbA1c | |
| DRFQ | > 6,5% (valores < 6,5% no lo excluyen) |
| Glucemia al azar | |
| DRFQ | ≥200mg/dl + poliuria/polidipsia |
TGN: tolerancia normal a la glucosa; DRFQ con GBA: diabetes relacionada con la fibrosis quística con glucemia basal alterada; DRFQ sin GBA: diabetes relacionada con la fibrosis quística sin glucemia basal alterada; GBA: glucemia basal alterada; HbA1c: hemoglobina glicada; INDET: tolerancia a la glucosa indeterminada; ITG: intolerancia a la glucosa; 2hOGTT: test de sobrecarga oral de glucosa, con glucemia a los 0 y 120 minutos.
La historia natural de la diabetes en la FQ sigue una evolución en el tiempo caracterizada, en primer lugar, por la aparición de hiperglucemia postprandial intermitente, seguida de ITG, DRFQ sin GBA y, por último, DRFQ con GBA. Por lo tanto, aproximadamente el 15% de los adultos con DRFQ tienen GBA, y el 25% cursan sin GBA14,15. Es importante destacar que la proporción de GBA es menor en estos pacientes en comparación con otros tipos de diabetes; incluso se han descrito casos de hipoglucemia en ayunas20,21. Es decir, existe una menor prevalencia global de GBA22,23.
En general, se recomienda realizar una OGTT anual, en fase de estabilidad clínica, a los pacientes mayores de 10 años19, aunque recientemente se está planteando realizar el cribado antes de los 10 años. Odet et al.24, estudiaron a 94 niños con FQ con una edad comprendida entre 6 y 9 años y detectaron una alteración del metabolismo hidrocarbonado en el 41%; de ellos, hasta un 42% desarrolló diabetes. En base a estos resultados, niños menores de 10 años con FQ ya tendrían un riesgo incrementado de desarrollar diabetes. También se debería hacer la OGTT en las embarazadas, en el pretrasplante y en los casos de deterioro de la función pulmonar, retraso del crecimiento o del desarrollo puberal, pérdida de peso inexplicada y síntomas clásicos de diabetes o hipoglucemia. Se recomienda monitorizar los niveles de glucemia capilar en ayunas y postprandiales en caso de hospitalización por enfermedad severa, nutrición artificial, uso de corticoides, y antes y después de una cirugía mayor. Los pacientes con DRFQ sin GBA, o con ITG, que están en riesgo de progresar a DRFQ con GBA, se deberían estudiar anualmente14,15,19. Los síntomas de diabetes no son un indicador sensible, puesto que su aparición es insidiosa y muy tardía.
Respecto a la OGTT, el pico de hiperglucemia máximo a los 120 minutos en la mayoría de los pacientes con FQ puede estar ausente, por lo que se cree necesario extraer muestras cada 30 minutos. Se ha observado que los sujetos con FQ sin DRFQ presentan una hiperglucemia a los 30, 60 y 90 minutos, aunque los niveles de glucemia a los 0 y 120 minutos sean similares a controles sanos. Por tanto, la glucemia a los 60 y 90 minutos puede ser más sensible para detectar intolerancia a la glucosa en estos pacientes21,22. Los niveles de glucemia al azar normales no excluyen el diagnóstico, puesto que dependen de la hora del día, la última comida, el vaciado gástrico, etc. En cambio, niveles persistentemente elevados (≥ 200mg/dl) permiten establecer el diagnóstico, por lo que la ADA ha incorporado la glucemia al azar como herramienta diagnóstica25. En este sentido, una opción sería realizar un perfil glucémico mediante glucemias capilares múltiples durante un periodo prolongado y variando los tiempos en los cuales se extraen las muestras. Estudios recientes26 han objetivado que existe una asociación entre una peor función pulmonar y la presencia de hiperglucemia en puntos intermedios de la OGTT, concretamente con un valor de glucemia a los 60 minutos por encima de 140mg/dl. En cambio, en este mismo estudio, no se encontró esa correlación negativa entre el volumen espiratorio forzado en un segundo (FEV1%) y los niveles de glucemia a los 120 minutos, sugiriéndose que el diagnóstico del estado de tolerancia hidrocarbonada no debería ser dependiente de los niveles de glucemia en los tiempos clásicos de 0 y 120 minutos. Lee et al.27, analizaron la utilidad diagnóstica de una prueba más simple, con una sobrecarga oral de glucosa de 50g, y determinación de glucosa plasmática antes y una hora después (1h-CGT) de la ingesta de glucosa; consideraron positivo un valor de la glucosa en plasma a la hora de la sobrecarga superior a 140mg/dl. Se realizó el 1h-CGT a 31 pacientes con FQ sin historia previa de DRFQ, y una semana más tarde se les practicó la OGTT. Se detectó hiperglucemia en ambos estudios en el 30% de los sujetos (todos los pacientes con hiperglucemia en la OGTT también se detectaron en el 1h-CGT), mientras que hasta en un 35% solo se identificó mediante el 1h-CGT. Estos resultados llevan a los autores a sugerir que la OGTT (considerada como el gold standard) puede subestimar la presencia de eventos hiperglucémicos breves (glucemia > 140mg/dl) en una proporción importante de casos, aunque son necesarios más estudios en esta población para valorar la utilidad diagnóstica del 1h-CGT. Recientemente, Schmid et al.28 analizaron la prevalencia de un pico máximo de glucosa por encima de 200mg/dl en algún punto intermedio de la curva; encontraron que, considerando la serie globalmente, la INDET así definida afectaba al 10% de los pacientes; respecto a los inicialmente clasificados como TGN, este porcentaje ascendía al 22,2%. Por lo tanto, estos autores refuerzan el concepto de la importancia de considerar alteraciones intermedias en la OGTT en el estudio de los pacientes con FQ17,29. Actualmente existen nuevas aproximaciones para una mejor caracterización de las alteraciones del metabolismo hidrocarbonado en pacientes con TGN en base a los incrementos de la insulina y el péptido C en plasma durante la OGTT. Los pacientes con unos niveles basales menores y un menor incremento de dichos parámetros durante la OGTT tienen un peor estado nutricional y una función pulmonar más disminuida29.
Mortalidad y función pulmonarAunque la DRFQ comparte algunos aspectos de la DM tipo 1 y 2, también posee importantes diferencias que hacen que su diagnóstico, manejo y tratamiento sean específicos. En los pacientes con FQ es importante el diagnóstico temprano de las alteraciones del metabolismo hidrocarbonado, puesto que el desarrollo de diabetes se asocia con un aumento del riesgo de muerte del 31-55%, independientemente de otras complicaciones de la FQ30. El déficit de insulina promueve un balance negativo de proteínas, contribuyendo a la morbimortalidad de estos sujetos con un aumento del catabolismo y de pérdida de peso9. La pérdida ponderal puede aparecer incluso con alteraciones precoces del metabolismo hidrocarbonado23.
Otros factores asociados con un aumento de mortalidad son la edad, el sexo femenino, el deterioro de la función pulmonar, la desnutrición, la infección pulmonar por el complejo Burkholderia cepacia, el diagnóstico de aspergilosis broncopulmonar alérgica, la enfermedad hepática y el transplante de órgano previo30.
La enfermedad respiratoria es la responsable de la mayor parte de la morbimortalidad y es, junto con la malabsorción, la forma más frecuente de presentación de la enfermedad. En los pacientes con DRFQ existe un declive de la función pulmonar mayor que en los pacientes normoglucémicos, en relación directa con el grado de déficit de insulina y con la severidad de la alteración del metabolismo hidrocarbonado. Expresado de otro modo, el grado de intolerancia a la glucosa se correlaciona directamente con un menor FEV1% y una menor capacidad vital forzada (CVF%)15. La DRFQ incluso se asocia con una peor puntuación en las escalas utilizadas30 para definir el estadio clínico y radiológico de la enfermedad pulmonar, como son las escalas de Shwachman y Kulczycki31 y de Brasfield32–34.
El deterioro en los parámetros de función pulmonar se observa con frecuencia antes del diagnóstico de la DRFQ. En niños este deterioro se ha objetivado hasta un año antes; otros autores señalan que este declive de la función pulmonar puede preceder hasta tres o cuatro años a la aparición de CFRD35. Este intervalo de tiempo podría explicarse debido a las alteraciones en el catabolismo proteico que el déficit de insulina conlleva y por la consecuente disminución en la masa muscular, reduciéndose así la función inspiratoria del diafragma15,17. Estudios histológicos de pulmón de pacientes diabéticos sin FQ han objetivado la presencia de fibrosis y engrosamiento de la lámina basal. Otros factores que se han mencionado en la literatura como responsables de la enfermedad pulmonar en los pacientes diabéticos sin FQ son la glucosilación anómala no enzimática de las proteínas del árbol bronquial, la presencia de una microangiopatía pulmonar subyacente y el aumento de la reactividad bronquial consecuencia de la neuropatía autonómica y frénica36,37.
La enfermedad pulmonar severa (definida como un FEV1 < 40%) puede asociarse a un mal control glucémico en los sujetos con DRFQ. Por otra parte, también la presencia de diabetes conlleva una mayor frecuencia de exacerbaciones de la enfermedad pulmonar y un aumento de la prevalencia de patógenos en el esputo8,15. La colonización por Pseudomonas aeruginosas también está asociada con un peor resultado clínico, una peor función pulmonar, mayor número de hospitalizaciones y menor peso, siendo un predictor importante de deterioro clínico y morbimortalidad38–40. Como consecuencia, los pacientes con DRFQ tienen una menor supervivencia y una peor calidad de vida.
Complicaciones microvasculares y macrovasculares en la diabetes relacionada con la fibrosis quísticaLas complicaciones microvasculares han sido descritas en estudios de pequeñas series de casos de pacientes con DRFQ. En ninguno de ellos los pacientes con DRFQ sin GBA desarrollaron complicaciones microvasculares durante un seguimiento de 14 años. Aunque se ha sugerido que los pacientes con DRFQ sin GBA no requieren tratamiento porque están asintomáticos y no parecen tener riesgo de complicaciones microvasculares, las consecuencias nutricionales del déficit de insulina pueden deteriorar su calidad de vida23. En el caso de los pacientes afectos de DRFQ con GBA, después de un seguimiento de más de 10 años, se observó microalbuminuria en un 14%, retinopatía en un 16%, neuropatía en un 55% y gastropatía en un 50%. La ADA recomienda realizar una monitorización de las complicaciones microvasculares anualmente, desde los 5 años del diagnóstico de DRFQ19. Según el estudio de Schwarzenberg et al., la complicación más común es la neuropatía, con una prevalencia similar que en la DM tipo 1 y 2; el hallazgo más frecuente es la disminución de la amplitud del potencial de acción del nervio sural, junto con una alteración de los reflejos cardiorrespiratorios5. En otro estudio, que comparó la frecuencia de complicaciones microvasculares en un grupo de pacientes con DRFQ frente a un grupo con DM tipo 1, se obtuvo una mayor prevalencia de microalbuminuria en el grupo de DRFQ –con una función renal normal– y de retinopatía en los pacientes DM tipo 1. No se encontraron diferencias en relación a otras complicaciones microvasculares, tales como la neuropatía periférica.41,42.
No existen apenas comunicaciones o series de casos de FQ con complicaciones macrovasculares, probablemente debido a la baja esperanza de vida global de esta población y el bajo índice de dislipemias, hipertensión y obesidad.
TratamientoEl objetivo del tratamiento es doble: por un lado, mejorar el estado nutricional de los pacientes con el efecto anabólico de la insulina –lo que conlleva una mejora de la función pulmonar– y, por otro lado, disminuir la incidencia de complicaciones tardías de la diabetes, sobre todo microvasculares.
Actualmente se recomienda tratar con insulina la DRFQ con GBA19. El uso de antidiabéticos orales no está recomendado14,19. Hay poca evidencia de la superioridad de pautas de insulina específicas en la DRFQ. También estaría indicado el inicio de tratamiento insulínico si hubiese síntomas cardinales de diabetes (polidipsia, poliuria, pérdida de peso), una pérdida inexplicada de peso a pesar de un adecuado manejo nutricional, retraso del crecimiento y la pubertad o un declive en la función pulmonar inexplicable14. Sin embargo, recientemente se han publicado los resultados de un ensayo clínico en el que el tratamiento con insulina rápida preprandrial en pacientes con DRFQ sin GBA revertía la tendencia a perder peso progresivamente, con incremento de grasa y masa magra corporal43. Los resultados de este estudio apuntarían al beneficio de tratar con insulina a los pacientes con DRFQ (con y sin hiperglucemia de ayuno). Los beneficios del tratamiento con insulina incluyen un aumento del peso, una mejoría en la función pulmonar (FEV1%) y una disminución de las exacerbaciones pulmonares. El tratamiento debe ser individualizado y ajustarse a la ingesta de carbohidratos, que no deben restringirse con el fin de mejorar el control glucémico. Por otro lado, no está claro cuál debe ser la actitud ante los pacientes con FQ e ITG o INDET, ni si el tratamiento precoz de las alteraciones hidrocarbonadas con insulina sería capaz de reducir el empeoramiento progresivo de la función pulmonar y del estado nutricional. Recientemente se han publicado algunos estudios, con un escaso número de pacientes incluidos, que muestran que el tratamiento precoz con insulina en estas situaciones también sería beneficioso44-46. Bizzarri et al.47 estudiaron los resultados de una dosis diaria de insulina glargina en pacientes con FQ e ITG. Los autores demuestran que este tratamiento produjo un incremento significativo del índice de masa corporal y del FEV1% durante el tiempo de seguimiento del estudio (1-1,8 años), sin producirse ningún episodio de hipoglucemia. Postulan que el tratamiento precoz con insulina tiene buena tolerancia y podría disminuir el declive de la función pulmonar y el estado nutricional47. Otros autores, como Dobson et al., estudiaron el efecto del tratamiento con insulina en pacientes con FQ de larga evolución, con deterioro de la función pulmonar y del peso sin una clara causa, y con una OGTT y HbA1c normal, pero con picos postprandiales de hiperglucemia mayores de 180mg/dl, detectados en controles domiciliarios de glucemia capilar. El tratamiento con insulina aumentó el peso en todos los pacientes y mejoró la función pulmonar, sin síntomas o valores de glucemia sugestivos de hipoglucemia46. Mozillo et al.22 publicaron recientemente los efectos del tratamiento con insulina glargina durante un año en un grupo de pacientes FQ con distintas alteraciones en el metabolismo hidrocarbonado. Después del tratamiento con insulina durante un año se objetivó, de forma global, una mejoría significativa en el FEV1% y una disminución del número de exacerbaciones pulmonares22.
Por tanto, estos estudios comentados proponen la hipótesis de que el tratamiento con insulina de diversas alteraciones precoces del metabolismo hidrocarbonado debería considerarse una opción terapéutica para la mejoría de la función pulmonar y la calidad de vida de este grupo de pacientes. Sin embargo, y a pesar de estos primeros datos positivos del tratamiento con insulina en las alteraciones precoces del metabolismo de la glucosa en pacientes con FQ, son necesarios más estudios controlados, randomizados, y con un mayor periodo de observación, para valorar los efectos de la insulina a nivel pulmonar y nutricional en los pacientes con alteraciones precoces del metabolismo hidrocarbonado como la ITG y la INDET.
ConclusionesDebido a la mejora de las técnicas diagnósticas y los tratamientos disponibles, la esperanza de vida de los pacientes con FQ alcanza la cuarta o quinta década de la vida, por lo que actualmente la DRFQ es una problemática cada vez más prevalente.
La aparición de diabetes se asocia con un aumento de la morbimortalidad, un deterioro de la función pulmonar, del estado nutricional y del estadio clínico funcional. La DRFQ debe considerarse como una entidad específica y distinta de la DM tipo 1 o 2, cuyo diagnóstico precoz es fundamental para instaurar medidas de control de sus efectos deletéreos específicos en la enfermedad de base.
Hoy en día, los criterios diagnósticos de las alteraciones hidrocarbonadas de la FQ se basan en los tiempos 0 y 120 minutos de la OGTT, aunque recientemente está adquiriendo cada vez más importancia clínica la hiperglucemia en los puntos intermedios de la prueba –a los 30, 60 y 90 minutos–, que diversos trabajos relacionan con el pronóstico funcional de FQ y, por tanto, deben ser tenidos en cuenta en la evaluación global del paciente con alteraciones hidrocarbonadas.
El tratamiento precoz con insulina de la DRFQ, y probablemente de otras alteraciones precoces del metabolismo glucémico, conllevaría una mejora de la situación pulmonar y nutricional y la calidad de vida de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.