Determinar las concentraciones del factor inhibidor de la migración de macrófagos (MIF) en mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos (SOPQ).
MétodoSe seleccionaron mujeres con diagnóstico de SOPQ y controles sanas, de edades similares, con menstruaciones regulares y ovarios normales por ecografía, que fueron divididas en 4 grupos (grupo A: SOPQ obesas; grupo B: SOPQ no obesas; grupo C: controles obesas, y grupo D: controles no obesas) de acuerdo con el índice de masa corporal (obesas>30kg/m2 y no obesas<25kg/m2). Se analizaron las concentraciones de lutoprina, folitropina, androstendiona, testosterona, globulina fijadora de hormonas sexuales, glucosa sérica, insulina y MIF.
ResultadosLas mujeres con SOPQ obesas y no obesas presentaron concentraciones más elevadas de lutoprina, folitropina, testosterona, androstendiona e insulina comparadas con las mujeres del grupo control de obesas y no obesas, respectivamente (p<0,0001). Se observó que las mujeres con SOPQ presentaron concentraciones significativamente más altas de MIF (grupo A: 48,6±9,9mg/ml, y grupo B: 35,2 ± 6,0ng/ml) comparadas con las controles (grupo C: 13,5±6,0ng/ml, y grupo D: 12,0±4,3ng/dl; p<0,0001). Se observó que las concentraciones del MIF presentaban una correlación débil, positiva y significativa con los valores de glucemia e insulina en ayunas en las mujeres con SOPQ (p<0,05).
ConclusiónExisten diferencias significativas en las concentraciones plasmáticas del MIF entre las mujeres con SOPQ obesas y no obesas respecto a las controles normales.
To measure macrophage migration inhibitory factor (MIF) concentrations in obese and non-obese women diagnosed with polycystic ovary syndrome (PCOS).
MethodWomen diagnosed with PCOS and age-matched healthy controls with regular mensese and normal ovaries on ultrasound examination were selected and divided into 4 groups (group A, PCOS and obese; group B, PCOS and non-obese; group C, obese controls; and group D, non-obese controls) based on body mass index (obese>30kg/m2 y non-obese<25kg/m2). Luteinizing hormone, follicle-stimulating hormone, androstenedione, testosterone, sex hormone-binding globulin, serum glucose, insulin and MIF levels were measured.
ResultsObese and non-obese women with PCOS had higher luteinizing hormone, follicle-stimulating hormone, androstenedione, testosterone, and insulin levels as compared to the obese and non-obese control groups, respectively (P<.0001). Women with PCOS had significantly higher MIF levels (group A, 48.6±9.9mg/ml; group B, 35.2±6.0ng/ml) as compared to controls (group C, 13.5±6.0ng/ml; group D, 12.0±4.3ng/dl; P<.0001). A weak, positive and significant correlation was seen between fasting blood glucose and insulin levels in women with PCOS (P<.05).
ConclusionSignificant differences exist in plasma MIF levels between obese and non-obese women with and without PCOS.
El síndrome de ovarios poliquísticos (SOPQ), el cual está caracterizado por hiperandrogenismo, anovulación crónica e infertilidad, es uno de los desórdenes endocrinos más frecuentes en las mujeres. Además de las anomalías reproductivas, una proporción significativa de las mujeres con SOPQ sufren de obesidad, resistencia a la insulina y características del síndrome metabólico1,2. La mejoría de estas anomalías metabólicas, especialmente aquellas relacionadas con la resistencia a la insulina, por cambios en el estilo de vida o intervenciones farmacológicas, han demostrado mejorar el hiperandrogenismo y la infertilidad3.
Diferentes investigaciones han expuesto la posibilidad que el SOPQ pueda estar asociado con un aumento en los marcadores bioquímicos y fisiológicos de riesgo cardiovascular, incluyendo la disfunción endotelial. Las mujeres con SOPQ tienen factores específicos de riesgo cardiovascular como obesidad, anomalías del perfil lipídico, alteración de la tolerancia glucosada e hipertensión, lo que las lleva a tener un alto riesgo de enfermedad cardiaca coronaria4. También se ha observado que estas mujeres tienen un alto riesgo de presentar diabetes mellitus del tipo no insulinodependiente5. Aún no está claro si el incremento del riesgo está relacionado con las anomalías endocrinas asociadas al SOPQ per se, como el hiperandrogenismo, o si es consecuencia de las anomalías antropométricas o metabólicas.
El factor inhibidor de la migración de macrófagos (MIF) es una citocina proinflamatoria cuyas concentraciones plasmáticas se incrementan luego de la inyección de endotoxina en animales experimentales y que, además, participa en la cascada inflamatoria que sigue a la administración de la endotoxina6,7. La concentración de endotoxina necesaria para estimular el MIF es de 10 a 100 veces menor que la necesaria para activar la secreción de factor de necrosis tumoral alfa (TNF-alfa)8. Es producido por una variedad de tipos celulares que, además de las células inmunes, incluye monocitos/macrófagos, células B y T, y células endoteliales, endocrinas y epiteliales9. Es la única citocina que se almacena en las células secretoras y es liberada rápidamente después de la aparición del estímulo. Adicionalmente, también es secretada por las células después de la síntesis de novo en respuesta6,7.
El MIF puede tener un papel en la aterogénesis a través de la estimulación de los macrófagos/células espumosas en la placa aterosclerótica8. La evidencia demuestra que también controla los procesos metabólicos e inflamatorios subyacentes al desarrollo de los desórdenes metabólicos, como la homeostasis de la glucosa durante periodos de estrés y la infiltración de macrófagos en el tejido adiposo. Se expresa y segrega por el tejido adiposo, por lo que se esperaría que estuviera elevado en la obesidad de una forma similar al TNF-alfa y la interleucina-610. En vista de la relación entre obesidad, inflamación y arterosclerosis, por un lado, y el papel del MIF en la inflamación por el otro, se ha propuesto que este pueda elevar sus concentraciones en pacientes con SOPQ, independientemente de la obesidad.
El objetivo de la investigación fue determinar las concentraciones plasmáticas de MIF entre mujeres obesas y no obesas con diagnóstico de SOPQ.
MétodosEntre septiembre de 2009 y julio de 2012 se incluyeron en el estudio mujeres que asistieron a las consultas de Medicina Interna, Endocrinología y Ginecología del Hospital Central Dr. Urquinaona con diagnóstico de SOPQ. El Comité de Ética del hospital aprobó el estudio, y se obtuvo el consentimiento por escrito de todas las mujeres.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligoanovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (concentraciones de testosterona plasmática por encima del límite superior normal y relación lutoprina [LH]/folitropina [FSH] anormal>2), y ovarios normales o aumentados de tamaño (>10ml) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2-9mm de diámetro en la evaluación ecográfica abdominal11.
Se seleccionaron mujeres con SOPQ y obesidad (índice de masa corporal [IMC]>30kg/m2; grupo A, n=34) y no obesas IMC<25kg/m2; grupo B, n=13). Las pruebas hormonales y la ecografía abdominal se realizaron durante la fase folicular temprana, entre el tercer y quinto día del ciclo menstrual espontáneo. El grupo control (n=47) consistió en mujeres de edades similares, con menstruaciones regulares, que asistieron a la consulta para sus controles ginecológicos rutinarios (entre 21 y 35 días), sin evidencias de hiperandrogenismo (testosterona total<60ng/ml, testosterona libre<2ng/ml, sulfato de dehidroepiandrosterona<27picog/ml) y ovarios normales por ecografía, que asistieron a la consulta por afecciones diferentes a SOPQ y fueron divididas de acuerdo al IMC en obesas (IMC>30kg/m2; grupo C, n=33) y no obesas (IMC<25kg/m2; grupo D, n=13). Todas las controles se estudiaron del día 3 al 5 de su ciclo menstrual.
Se excluyeron las mujeres con enfermedad tiroidea (TSH menor de 0,39 o mayor de 4,0picoUI/ml), disfunción hipotalámica-hipofisaria e insuficiencia ovárica (FSH menor de 1,4 o mayor de 20mUI/ml y estradiol menor 20pg/ml), tumores adrenales u ováricos secretores de andrógenos (testosterona total>200ng/ml y sulfato de dehidroepiandrosterona>800picog/dl), hiperplasia adrenal congénita no clásica (17 hidroxiprogesterona>3ng/ml), presencia de hiperprolactinemia (prolactina>26ng/ml), hipertensión secundaria, infecciones activas, síndrome de Cushing (determinado por la prueba de supresión con 1mg de dexametasona), déficit de vitamina B12 o folato, antecedentes de enfermedad hepática, insuficiencia renal con aclaramiento de creatinina<30ml/min por 1,73m2 de superficie corporal, excreción de proteína urinaria>1g/día, ángor pectoris, infarto del miocardio o enfermedad cerebrovascular reciente, y aquellas mujeres que no aceptaron participar en el estudio. Las formas secundarias de hipertensión arterial fueron excluidas sobre la base de estudios clínicos y de laboratorio. Las mujeres que tomaban fármacos antihipertensivos fueron excluidas del estudio, y a las que tomaban fármacos hipolipidemiantes se les solicitó que los suspendieran por 4 semanas antes del estudio. Ninguna paciente tomaba fármacos que afectaran las concentraciones de los marcadores de inflamación (por ejemplo, anticonceptivos orales o fármacos sensibilizantes a la insulina).
La evaluación ecográfica se realizó con un ecógrafo Logiq® Pro 3, de General Electric, usando un transductor abdominal convexo de 3,5MHz, y un transductor vaginal de 5MHz. El IMC se calculó dividiendo el peso por la talla al cuadrado (kg/m2), mientras que la relación cintura-cadera se calculó dividiendo la circunferencia de la cintura entre la circunferencia de la cadera. Se midió la circunferencia de la cintura tomando el punto medio entre el borde inferior costal y la cresta ilíaca, y la cadera, tomando la parte más ancha de la región glútea. La medida se obtuvo con una cinta métrica graduada en centímetros, estando el sujeto en bipedestación y con los brazos en posición anatómica.
Todas las muestras de sangre venosa se tomaron en ayunas, en la primera semana posterior a la menstruación espontánea o inducida. Todas se manejaron de forma similar y se almacenaron a −8°C por 1-3 días. Las concentraciones de FSH, LH, estradiol, androstendiona y testosterona se midieron por radioinmunoanálisis y quimioluminiscencia usando kits comerciales (Immulite® 2000, Diagnostic Product Corp., Los Angeles, EE. UU.). Los coeficientes de variación intra e interensayo fueron de 4 y 7% para FSH, 6 y 7% para LH, 7 y 9% para estradiol, 6 y 10% para androstendiona y 4 y 7% para testosterona, respectivamente. La globulina fijadora de hormonas sexuales se cuantificó por inmunoanálisis (AutoDELFIA® Immunoassay analyzer, PerkinElmer, Massachusetts, EE.UU.); el coeficiente de variación interensayo fue del 3%, y el intraensayo, del 4%.
La glucosa sérica se cuantificó por el método de la glucosa-oxidasa (Pointe Scientific Inc., Massachusetts, EE. UU.). Los coeficientes de variación intra e interensayo fueron de un 1,4 y 1,9%, respectivamente. La insulina se determinó por radioinmunoanálisis (Coat-A-Count®, Diagnostic Products Corp., Los Angeles, EE. UU.). Los coeficientes de variación intra e interensayo fueron de un 1,6 y 5,5%, respectivamente. Las concentraciones plasmáticas de MIF fueron establecidas usando una prueba de ELISA (R&D Systems, Minneapolis, EE. UU.), con coeficientes de variación intra e interensayo de 3,5 y 12%, respectivamente.
Los datos se presentan como media±desviación estándar. Para comparar las características clínicas y de laboratorio en las mujeres con SOPQ y las mujeres del grupo control se utilizó la prueba de la t de Student para muestras no relacionadas. También se utilizó esta prueba para comparar estas características en las mujeres del grupo A y del grupo B con las mujeres del grupo C y D, respectivamente. Los coeficientes de correlación entre las concentraciones de MIF en las mujeres con SOPQ con los parámetros de laboratorio se evaluaron usando la prueba de Pearson. Se realizó un análisis de regresión lineal entre los diferentes parámetros de laboratorio y las concentraciones de los 3 marcadores en estudio. Se consideró un valor p<0,05 como estadísticamente significativo.
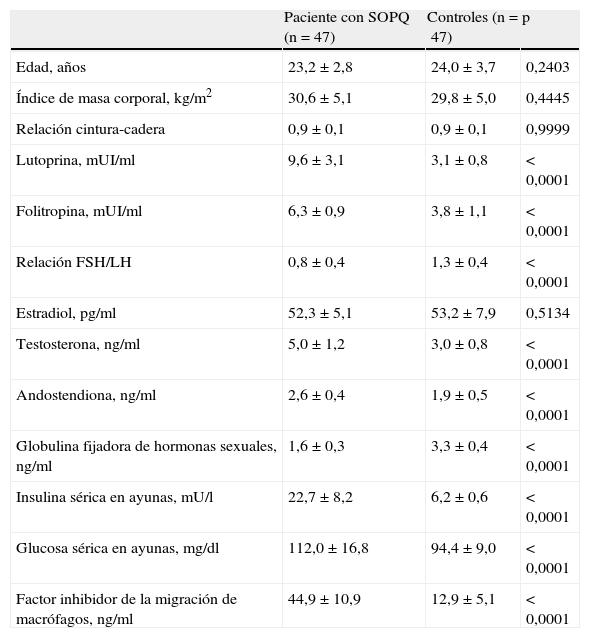
ResultadosLas características clínicas y endocrinas de las mujeres con SOPQ y las controles se muestran en la tabla 1. Los grupos eran similares en edad (p=0,2403) e IMC (p=0,4445). Los hallazgos confirmaron las diferencias entre las mujeres con SOPQ y los sujetos controles. Las concentraciones de LH, FSH y la relación FSH/LH estaban significativamente más elevadas en las mujeres con SOPQ comparadas con las mujeres del grupo control (p<0,0001). No se encontraron diferencias estadísticamente significativas en las concentraciones de estradiol (p=0,5134). Los valores de testosterona y androstendiona fueron significativamente más altos en las mujeres con diagnóstico de SOPQ (p<0,0001). Los valores de globulina fijadora de hormonas sexuales fueron significativamente menores en las mujeres con SOPQ, comparados con los de las controles. También se encontraron concentraciones más altas de insulina y glucemia en ayunas en las pacientes con SOPQ comparadas con las de las controles (p<0,0001).
Características de las pacientes con síndrome de ovarios poliquísticos y controles
| Paciente con SOPQ (n=47) | Controles (n=47) | p | |
| Edad, años | 23,2±2,8 | 24,0±3,7 | 0,2403 |
| Índice de masa corporal, kg/m2 | 30,6±5,1 | 29,8±5,0 | 0,4445 |
| Relación cintura-cadera | 0,9±0,1 | 0,9±0,1 | 0,9999 |
| Lutoprina, mUI/ml | 9,6±3,1 | 3,1±0,8 | <0,0001 |
| Folitropina, mUI/ml | 6,3±0,9 | 3,8±1,1 | <0,0001 |
| Relación FSH/LH | 0,8±0,4 | 1,3±0,4 | <0,0001 |
| Estradiol, pg/ml | 52,3±5,1 | 53,2±7,9 | 0,5134 |
| Testosterona, ng/ml | 5,0±1,2 | 3,0±0,8 | <0,0001 |
| Andostendiona, ng/ml | 2,6±0,4 | 1,9±0,5 | <0,0001 |
| Globulina fijadora de hormonas sexuales, ng/ml | 1,6±0,3 | 3,3±0,4 | <0,0001 |
| Insulina sérica en ayunas, mU/l | 22,7±8,2 | 6,2±0,6 | <0,0001 |
| Glucosa sérica en ayunas, mg/dl | 112,0±16,8 | 94,4±9,0 | <0,0001 |
| Factor inhibidor de la migración de macrófagos, ng/ml | 44,9±10,9 | 12,9±5,1 | <0,0001 |
Los valores de MIF se muestran en la tabla 1. Se observó que las mujeres con SOPQ mostraron concentraciones significativamente más altas (44,9±10,9ng/dl) comparadas con los valores promedio en las mujeres del grupo control (12,9±5,1ng/dl; p<0,0001).
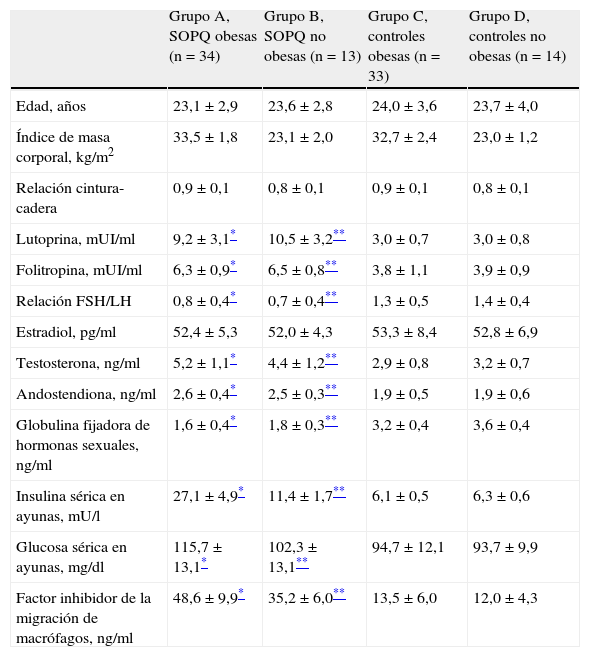
En la tabla 2 se observan las características de las mujeres con SOPQ obesas (grupo A; n=34), las mujeres con SOPQ no obesas (grupo B; n=13), las controles obesas (grupo C; n=33) y las controles no obesas (grupo D; n=14). Las mujeres de los 4 grupos no mostraron diferencias estadísticamente significativas con relación a la edad (p=ns). Las mujeres de ambos grupos de SOPQ (tabla 2) presentaron valores más elevados de LH, FSH, relación FSH/LH, testosterona y androstendiona comparadas con las mujeres de los grupos C y D (p<0,0001). No se encontraron diferencias significativas en las concentraciones de estradiol entre las mujeres de los grupos A y B y las de los grupos C y D (p=0,5360 y p=0,5016, respectivamente). Por otro lado, las concentraciones de globulina fijadora de hormonas sexuales fueron más bajas en ambos grupos de mujeres con diagnóstico de SOPQ frente a las controles (p<0,0001). Con respecto a las concentraciones de insulina, las mujeres de los grupos A y B presentaron concentraciones significativamente más altas que las mujeres de los grupos C y D. Las mujeres con SOPQ obesas y no obesas presentaron concentraciones de glucosa sérica significativamente más altas que las controles obesas y no obesas, respectivamente (p<0,0001).
Características de las pacientes con síndrome de ovarios poliquísticos y controles, obesas y no obesas
| Grupo A, SOPQ obesas (n=34) | Grupo B, SOPQ no obesas (n=13) | Grupo C, controles obesas (n=33) | Grupo D, controles no obesas (n=14) | |
| Edad, años | 23,1±2,9 | 23,6±2,8 | 24,0±3,6 | 23,7±4,0 |
| Índice de masa corporal, kg/m2 | 33,5±1,8 | 23,1±2,0 | 32,7±2,4 | 23,0±1,2 |
| Relación cintura-cadera | 0,9±0,1 | 0,8±0,1 | 0,9±0,1 | 0,8±0,1 |
| Lutoprina, mUI/ml | 9,2±3,1* | 10,5±3,2** | 3,0±0,7 | 3,0±0,8 |
| Folitropina, mUI/ml | 6,3±0,9* | 6,5±0,8** | 3,8±1,1 | 3,9±0,9 |
| Relación FSH/LH | 0,8±0,4* | 0,7±0,4** | 1,3±0,5 | 1,4±0,4 |
| Estradiol, pg/ml | 52,4±5,3 | 52,0±4,3 | 53,3±8,4 | 52,8±6,9 |
| Testosterona, ng/ml | 5,2±1,1* | 4,4±1,2** | 2,9±0,8 | 3,2±0,7 |
| Andostendiona, ng/ml | 2,6±0,4* | 2,5±0,3** | 1,9±0,5 | 1,9±0,6 |
| Globulina fijadora de hormonas sexuales, ng/ml | 1,6±0,4* | 1,8±0,3** | 3,2±0,4 | 3,6±0,4 |
| Insulina sérica en ayunas, mU/l | 27,1±4,9* | 11,4±1,7** | 6,1±0,5 | 6,3±0,6 |
| Glucosa sérica en ayunas, mg/dl | 115,7±13,1* | 102,3±13,1** | 94,7±12,1 | 93,7±9,9 |
| Factor inhibidor de la migración de macrófagos, ng/ml | 48,6±9,9* | 35,2±6,0** | 13,5±6,0 | 12,0±4,3 |
Se encontró que las mujeres con SOPQ y obesas tenían concentraciones de MIF significativamente más altas que las controles obesas (48,6±9,9 frente a 13,5±6,0ng/dl; p<0,05). De igual forma, en las pacientes con SOPQ no obesas se observaron concentraciones significativamente más altas de MIF al compararlas con las mujeres controles no obesas (35,2±6,7 frente a 12,0±4,3ng/dl; p<0,0001).
Al analizar el grupo de mujeres con SOPQ obesas y no obesas, se observó que las concentraciones del MIF presentaban una correlación significativa con los valores de glucemia en ayunas (r=0,285; p<0,0001) e insulina en ayunas (r=0,272; p<0,0001). El análisis de regresión lineal mostró que los factores que afectaban la concentración plasmática del MIF fueron las concentraciones de insulina (beta=0,344; p<0,003) y glucosa sérica (beta=0,665; p<0,001).
DiscusiónLos resultados de la investigación demuestran que las mujeres obesas y no obesas con SOPQ presentan concentraciones más elevadas de MIF comparadas con las mujeres controles. González et al.12 fueron los primeros en demostrar que las concentraciones del MIF eran más altas en las mujeres con SOPQ, independientemente de la obesidad.
La disminución de la sensibilidad a la insulina es el defecto subyacente en la mayoría de las pacientes con SOPQ, y esta es considerada como un mecanismo patológico importante para el desarrollo de enfermedades cardiovasculares13. Estudios experimentales y clínicos han establecido la relación no solo de forma correlativa, sino también causal, entre la resistencia a la insulina y la inflamación crónica, especialmente en el tejido adiposo14,15. Cuando los monocitos/macrófagos infiltran el tejido adiposo, liberan citocinas proinflamatorias, y estos mediadores contribuyen, por diferentes mecanismos, al desarrollo de la insensibilidad celular y a la vasculopatía característica de la aterosclerosis15.
Los hallazgos de la presente investigación son similares a los reportados en investigaciones previas que señalan que la obesidad es un estado proinflamatorio asociado con un aumento de las concentraciones de TNF-alfa, interleucina-6 y proteína C reactiva, y un incremento del nivel de peroxidación lipídica y del daño oxidativo de las proteínas plasmáticas16,17. El incremento en las concentraciones plasmáticas del MIF puede contribuir a la aceleración del proceso aterosclerótico en los sujetos obesos8. Sin embargo, la elevación de las concentraciones de MIF en mujeres con SOPQ no obesas evidencia una aterogénesis acelerada que puede ocurrir en el síndrome, independientemente de la obesidad.
El aumento de las concentraciones plasmáticas del MIF también demuestra de forma indirecta el incremento de la actividad inflamatoria de las células mononucleares, ya que es bien conocido que en la pared arterial los monocitos se convierten en macrófagos y las células espumosas forman las placas ateroscleróticas. El mecanismo inflamatorio puede contribuir a la patogénesis de la insulinorresistencia a través del bloqueo de las señales de esta18.
Es interesante hacer notar que en la presente investigación las mujeres con SOPQ, tanto obesas como no obesas, presentan una elevación de las concentraciones plasmáticas del MIF, un mediador clave en los mecanismos de inmunidad innatos y adaptativos, especialmente aquellos mediados por los monocitos/macrófagos. Los macrófagos cargados de lipoproteínas de baja densidad oxidadas forman las células espumosas, y estas, de manera colectiva, forman las estrías grasas de las arterias. Las lesiones con abundantes células espumosas y una delgada capa fibrosa son las que probablemente se rompan y activen la trombosis relacionada con los efectos proinflamatorios19. El MIF es un producto segregado por los macrófagos y es su estimulador después de su secreción. Esto demuestra una relación autocrina y paracrina y, por lo tanto, responsable de mantener la actividad de las células espumosas en la placa aterosclerótica. También puede intensificar y prolongar la inflamación al inhibir la apoptosis de las células espumosas18.
La sobreexpresión del TNF-alfa en el tejido adiposo puede inducir la resistencia a la insulina. Debido a que el MIF aumenta la expresión de esta citocina, y viceversa20, el incremento en las concentraciones puede causar resistencia a la insulina en el tejido adiposo a través de la acción misma del MIF y/o la inducción del TNF-alfa.
Otro potencial papel del MIF es el de estimular la secreción de las células beta de los islotes pancreáticos21. En la presente investigación las concentraciones de insulina y glucemia en ayunas fueron más altas en las mujeres con SOPQ, tanto obesas como no obesas. Las abundantes cantidades de MIF en el páncreas evidencian algún papel en el metabolismo de la glucosa. La línea celular diferenciada INS-1 tiene el potencial de expresar el MIF, y este proceso puede ser potenciado por la concentración de glucosa en el medio de cultivo. Más aún, en estudios de perfusión realizados en islotes aislados de rata, la inmunoneutralización del MIF reduce la primera y segunda fase de la secreción de insulina inducida por la glucosa en un 39 y 31%, respectivamente21. Se ha especulado que el MIF estimula la secreción de insulina y la secreción es regulada por la glucosa. También funciona como una enzima que reduce los puentes sulfidrilos y los rompe8. Esta acción puede potencialmente reducir la actividad biológica de la insulina y la eficiencia de los receptores de esta, los cuales también tienen puentes sulfidrilos. Esto podría contribuir a la resistencia a la insulina y aumentar la necesidad de secreción de esta18. Parece razonable pensar que el MIF modula tanto el metabolismo de los hidratos de carbono como las respuestas inflamatorias e inmunológicas, contrarregulando la alteración de la homeostasis por la acción de la supresión de los glucocorticoides22.
Herder et al.23 reportaron una fuerte asociación entre las concentraciones plasmáticas del MIF y la alteración de la tolerancia glucosada en un estudio con 1.653 pacientes con diabetes no insulinodependiente, alteración de la tolerancia glucosada y sujetos controles normoglucémicos. También describieron una asociación entre la alta expresión de los alelos del MIF y el aumento en el riesgo de diabetes no insulinodependiente. Church et al.24 examinaron las concentraciones plasmáticas en 71 individuos obesos que participaron en un programa de reducción de peso con dieta. Las altas concentraciones del MIF se correlacionaron con la disfunción de las células beta, y se observó una disminución del MIF después de la pérdida de más de 14kg en 8 meses. Otro estudio en animales suministró datos que apoyan el papel del MIF en el desarrollo de la resistencia a la insulina y la aterosclerosis al promover la inflamación del tejido adiposo25.
A diferencia de lo reportado previamente12,26, en la presente investigación no se logró comprobar la correlación entre las concentraciones de MIF y las concentraciones plasmáticas de testosterona y/o androstendiona. Una posible explicación para este hallazgo es que en la presente investigación el número de mujeres seleccionadas fue superior al del estudio antes mencionado. Investigaciones previas han descrito una asociación positiva entre las concentraciones circulantes de andrógenos y los mediadores de inflamación en las mujeres con SOPQ26,27. El hiperandrogenismo inducido de forma experimental favorece el desarrollo de aterosclerosis y parece suprimir tanto la respuesta inmune mediada por células T como la mediada por células B28. Adicionalmente, se sabe que diversas citocinas, como TNF-alfa, interleucina-1 beta e interleucina-6, además del MIF, poseen múltiples efectos sobre las neuronas del hipocampo e hipofisarias29. Estas estructuras cerebrales producen, a su vez, neuropéptidos como el péptido intestinal vasoactivo, la somatostatina y la sustancia P, todos ellos con importantes repercusiones en la regulación de la inflamación sistémica30.
En conclusión, estas observaciones aportan evidencia de la elevación de las concentraciones plasmáticas del MIF en las mujeres con SOPQ obesas y no obesas, comparadas con las mujeres controles sanas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.