El 80% de los pacientes con diabetes mellitus tipo 2 (DM2) tienen sobrepeso u obesidad, lo que se asocia a su vez con otros factores de riesgo cardiovascular y con un riesgo aumentado de cáncer. Los grandes estudios de intervención centrados en el control intensivo de la glucemia no han logrado demostrar una reducción de eventos cardiovasculares en pacientes diabéticos tipo 2. Los dos principales problemas observados en estos estudios son la ganancia de peso y la aparición de hipoglucemias graves en las ramas de intervención intensiva, lo que podría haber mitigado el potencial efecto favorable del control glucémico. Por el contrario, la pérdida de peso en pacientes diabéticos mediante cambios en el estilo de vida, fármacos y/o cirugía mejora simultáneamente todos los factores de riesgo cardiovascular, incluida la hiperglucemia. La cirugía bariátrica ha mostrado una rápida resolución de la DM2 en un gran porcentaje de pacientes y reduce la mortalidad específica para diabetes. A pesar de ello, todos los consensos y recomendaciones para el tratamiento de la DM2 centran la toma de decisiones en el nivel de hemoglobina glucosilada. Este artículo pretende abrir un debate sobre la necesidad de sustituir la estrategia terapéutica glucocéntrica por una estrategia adipocéntrica.
Eighty percent of patients with type 2 diabetes mellitus (T2DM) are overweight or obese, which in turn is associated with other cardiovascular risk factors and an increased risk of cancer. Large intervention studies focused on intensive glycemic control have failed to show a reduction of cardiovascular events in T2DM patients. The two major concerns in these studies were weight gain and severe hypoglycemia in the arms of intensive intervention, which could have mitigated the potential beneficial effect of glycemic control. On the contrary, weight loss in diabetic patients through changes in lifestyle, drugs and/or surgery simultaneously improves all cardiovascular risk factors including hyperglycemia. Bariatric surgery has shown an early resolution of T2DM in a large percentage of patients and a decrease of diabetes-specific mortality. Despite this, all consensus and recommendations for the treatment of T2DM focus their decisions on the glycated hemoglobin value. This article aims to open a debate on the need to replace the glucose-centered therapeutic strategy for a weight-centered strategy.
La diabetes mellitus tipo 2 (DM2) constituye una de las comorbilidades más importantes asociadas a la obesidad central o visceral, y el incremento actual en la prevalencia de DM2 en el mundo es paralelo al observado con la pandemia de obesidad1. El Nurses’ Health Study mostró que el riesgo relativo de diabetes aumentaba 40 veces en mujeres con índice de masa corporal (IMC) mayor de 35kg/m2 en comparación con aquéllas cuyo IMC era menor de 232. En el período comprendido entre los años 1987 y 2007, la prevalencia de sobrepeso en España tuvo un incremento en valores absolutos de 14,1 puntos porcentuales en varones y 10,3 en mujeres, mientras que la obesidad aumentó 8,7 y 7,3 puntos en varones y mujeres, respectivamente. El resultado final es que en el año 2007 un 61,6% de varones y un 46,0% de mujeres en nuestro país tenían un IMC mayor de 25; las cifras correspondientes para obesidad fueron 15,9 y 15,6%, respectivamente3. Según los últimos datos publicados por la Federación Internacional de Diabetes, la prevalencia de DM en población adulta española en 2010 se estima en un 8,7% y las proyecciones para 2030 elevan esta cifra al 11,1%1. Sin embargo, un estudio epidemiológico realizado recientemente en España (Estudio di@bet.es) que incluye 5.419 personas mayores de 18 años en 100 centros de salud, muestra una prevalencia total de DM ajustada por edad y sexo del 14,5%4. En este mismo estudio, la prevalencia de obesidad se eleva al 28%5.
Datos del estudio NHANES en Estados Unidos muestran que el 80,3% de pacientes con DM2 tienen un IMC mayor de 25kg/m2 y el 49,1% un IMC mayor de 306, lo que se asocia a su vez con otros factores de riesgo cardiovascular (FRCV) como la hipertensión arterial (HTA), la dislipemia aterogénica, la microalbuminuria y el incremento en los niveles de factores proinflamatorios y protrombóticos. La obesidad central, medida como un cociente aumentado cintura/cadera, mostró una fuerte asociación con el infarto de miocardio después del ajuste por IMC en el estudio caso-control INTERHEART7. Es probable que las medidas antropométricas como el IMC o la circunferencia de la cintura (CC) infraestimen la prevalencia real de obesidad central, definida como un incremento en la grasa abdominal, en la población con DM2.
La DM2 se asocia, además, con un riesgo aumentado de ciertos cánceres, como el de hígado, páncreas, endometrio, colon, recto, mama y vejiga8. Esta asociación puede deberse en parte a factores de riesgo compartidos entre ambas enfermedades, tales como la obesidad, el envejecimiento, la dieta y la inactividad física.
La pérdida de peso mediante cambios en el estilo de vida mejora simultáneamente todos los FRCV, incluida la DM9. En dos grandes estudios de cohortes realizados en sujetos obesos mórbidos sometidos a cirugía bariátrica se observó una reducción de la mortalidad total (sobre todo por enfermedad cardiovascular y cáncer), y una reducción de la mortalidad específica para DM respecto a los pacientes que recibieron un tratamiento convencional para la obesidad10,11. Por lo tanto, el tratamiento integral de la DM2 debería ir dirigido al control de todas las comorbilidades asociadas e incluir como eje fundamental la pérdida de peso, especialmente de grasa visceral. Los grandes estudios de intervención centrados en el control intensivo de la glucemia no han logrado demostrar una reducción de eventos cardiovasculares en pacientes diabéticos12–14. Los dos principales problemas observados en estos estudios son la ganancia de peso y la aparición de hipoglucemias graves en las ramas de intervención intensiva, lo que podría haber mitigado el potencial efecto favorable del control glucémico. Además, un reciente metaanálisis de ensayos clínicos aleatorizados no mostró una reducción del riesgo de cáncer con un control glucémico intensivo15.
En septiembre de 2010, se publicó un documento de consenso promovido por la Sociedad Española de Diabetes, en colaboración con otras sociedades científicas, para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 216. El documento tiene como principales aspectos positivos la individualización de los objetivos de control según las características del paciente y la estratificación de las opciones terapéuticas en función del nivel de hemoglobina glucosilada (HbA1c). Sin embargo, adolece del mismo problema que encontramos en todos los consensos y guías clínicas publicadas por diversas sociedades científicas: el algoritmo de decisión se basa en la HbA1c17–19. En muchos casos, las estrategias de intensificación terapéutica recomendadas de forma preferente por estos documentos conducen a una ganancia ponderal no deseada que repercute negativamente sobre otras comorbilidades del paciente obeso19.
En definitiva, la gran pregunta que nos planteamos actualmente los médicos que tratamos a los pacientes diabéticos tipo 2 es si la vieja estrategia terapéutica glucocéntrica debería ser sustituida por una estrategia adipocéntrica más acorde con la fisiopatología de la enfermedad, acompañada de un control paralelo estricto de otros factores de riesgo cardiovascular. Este artículo pretende fomentar un debate que determine en un futuro próximo la filosofía del tratamiento del paciente con aumento de grasa abdominal que además es diabético.
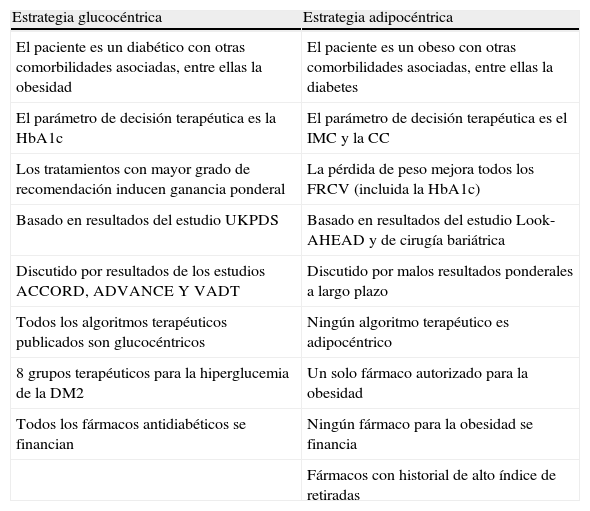
¿Glucocentrismo o adipocentrismo?En la tabla 1 se establecen las principales diferencias entre ambas aproximaciones terapéuticas. Los defensores de la estrategia glucocéntrica basan su posición en los resultados del conocido estudio de intervención UKPDS20,21. Este estudio, realizado en pacientes con DM2 de reciente diagnóstico, mostró que la mejoría del control glucémico con tratamiento farmacológico se asociaba a un menor riesgo de complicaciones microvasculares (retinopatía, neuropatía y nefropatía). Se observó, además, una reducción del 16% en las complicaciones cardiovasculares en la rama de control intensivo, pero esta diferencia no fue estadísticamente significativa. Un seguimiento a 10 años de la cohorte UKPDS tras la finalización del ensayo mostró que los pacientes inicialmente aleatorizados a un control intensivo tenían reducciones a largo plazo en infarto de miocardio (15% con sulfonilureas o insulina como tratamiento inicial, y 33% con metformina como tratamiento inicial), ambas estadísticamente significativas, y en la mortalidad por todas las causas (13 y 27%, respectivamente)22. Este fenómeno se ha atribuido al efecto de la denominada memoria hiperglucémica en los primeros años de tratamiento.
Características de las estrategias glucocéntrica y adipocéntrica en el tratamiento del paciente con diabetes tipo 2 (DM2)
| Estrategia glucocéntrica | Estrategia adipocéntrica |
| El paciente es un diabético con otras comorbilidades asociadas, entre ellas la obesidad | El paciente es un obeso con otras comorbilidades asociadas, entre ellas la diabetes |
| El parámetro de decisión terapéutica es la HbA1c | El parámetro de decisión terapéutica es el IMC y la CC |
| Los tratamientos con mayor grado de recomendación inducen ganancia ponderal | La pérdida de peso mejora todos los FRCV (incluida la HbA1c) |
| Basado en resultados del estudio UKPDS | Basado en resultados del estudio Look-AHEAD y de cirugía bariátrica |
| Discutido por resultados de los estudios ACCORD, ADVANCE Y VADT | Discutido por malos resultados ponderales a largo plazo |
| Todos los algoritmos terapéuticos publicados son glucocéntricos | Ningún algoritmo terapéutico es adipocéntrico |
| 8 grupos terapéuticos para la hiperglucemia de la DM2 | Un solo fármaco autorizado para la obesidad |
| Todos los fármacos antidiabéticos se financian | Ningún fármaco para la obesidad se financia |
| Fármacos con historial de alto índice de retiradas |
CC: circunferencia de cintura; FRCV: factores de riesgo cardiovascular; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal.
En realidad, el estudio UKPDS no puede considerarse un estudio de intervención intensiva en la acepción actual del término, puesto que el grupo aleatorizado a terapia convencional fue tratado inicialmente solo con medidas dietéticas, y la rama de tratamiento intensivo hoy se denominaría tratamiento convencional; pero sí demuestra que un buen control glucémico desde el diagnóstico de la DM2 proporciona beneficios cardiovasculares a largo plazo. Sin embargo, los resultados de tres grandes ensayos (ACCORD, ADVANCE y VADT)12–14, no mostraron una reducción significativa en el pronóstico cardiovascular con un control glucémico intensivo realizado en pacientes con DM2 más avanzada que la de los participantes en el UKPDS. De hecho, el estudio ACCORD fue finalizado de forma prematura debido a un incremento de un 22% en la mortalidad total en el grupo de control intensivo12. El análisis de subgrupos en estos ensayos sugieren un beneficio del control glucémico intensivo sobre la enfermedad cardiovascular en aquellos pacientes con menor duración de la DM2, menor HbA1c inicial y/o ausencia de enfermedad cardiovascular conocida.
Aunque no se ha podido demostrar que la ganancia ponderal inducida por un control glucémico intensivo reduzca el potencial efecto beneficioso del mismo sobre la morbimortalidad cardiovascular, el aumento de peso podría influir en los resultados a través de variables intermedias de difícil cuantificación, debido a las conocidas interrelaciones de la obesidad con otros FRCV. Lo cierto es que encontramos incrementos medios de 4kg en la rama de insulina del UKPDS20, 3,5kg en la rama intensiva del ACCORD12 y 7,8kg en la rama intensiva del VADT14. El único estudio que no mostró un incremento ponderal con el control glucémico intensivo fue el ADVANCE13, probablemente por el menor porcentaje de insulinización.
Para el médico «glucocéntrico» el paciente es diabético con otras comorbilidades asociadas, entre ellas la obesidad. Tiene a su disposición 8 grupos farmacológicos distintos para tratar la hiperglucemia del paciente, todos ellos financiados por el Sistema Nacional de Salud y, además, se guía por unos algoritmos terapéuticos que llevan con frecuencia a un incremento ponderal relevante del paciente en pocos años, debido al uso preferente de sulfonilureas, glinidas, glitazonas o insulina. El paciente está expuesto a la aparición de hipoglucemias, algunas de ellas graves. Afortunadamente las guías recomiendan como tratamiento farmacológico inicial la metformina, cuyos efectos beneficiosos sobre el control glucémico y la reducción de complicaciones micro y macrovasculares21 se acompañan de un efecto ponderal neutro y es posible que además presente otras propiedades terapéuticas beneficiosas, como la reducción del riesgo de neoplasias, que están en fase de investigación8. Además, se está incrementando la utilización de inhibidores de dipeptidilpeptidasa 4 (IDPP4) en segundo escalón terapéutico, que también tienen un efecto ponderal neutro. Otro aspecto positivo de las guías «glucocéntricas» es la recomendación de un control estricto, frecuentemente farmacológico, de otros FRCV como la HTA, la dislipemia y el tabaquismo23.
Por el contrario, la estrategia adipocéntrica considera al paciente diabético tipo 2 como un paciente con sobrepeso/obesidad que, además, tiene otras comorbilidades asociadas, entre ellas la diabetes. La pérdida ponderal controla simultáneamente todos los FRCV y reduce a priori la necesidad de tratamiento farmacológico. Esta filosofía terapéutica encuentra en su camino un cúmulo de dificultades. El parámetro fundamental de decisión terapéutica es el IMC y la CC, pero sin embargo, ningún algoritmo publicado utiliza estos parámetros como criterio primario, si bien es cierto que las guías incorporan la obesidad como criterio secundario para la selección del tratamiento tras metformina. Las posibilidades terapéuticas incluyen la modificación de estilo de vida (MEV), el tratamiento farmacológico y la cirugía bariátrica; esta última opción no se recoge en ningún algoritmo terapéutico. De los 8 grupos terapéuticos para el tratamiento de la hiperglucemia en la DM2 solo uno, los agonistas del receptor del péptido similar al glucagón de tipo 1 (abreviado GLP-1, del inglés glucagon-like peptide type 1) induce una pérdida de peso significativa, y el único fármaco autorizado para la obesidad en nuestro país en el momento actual es orlistat, que siguiendo el destino de todos estos fármacos no está financiado y muy raramente aparece incluido en las guías terapéuticas para la DM2. Finalmente, los fármacos para la obesidad son un grupo considerado «sospechoso» por las agencias reguladoras, las autoridades sanitarias y los propios médicos, que siguen viendo en la obesidad una cuestión cosmética que no justifica el potencial riesgo de un nuevo fármaco. El problema se agrava por el elevado número de retiradas de fármacos para perder peso que se han producido en los últimos años (dexfenfluramina, rimonabant y sibutramina), y el uso indiscriminado por la población general de estos medicamentos con fines puramente estéticos.
Modificación de estilo de vida en la DM2La MEV es un componente fundamental del tratamiento de la hiperglucemia y del resto de FRCV en pacientes con DM2. Sin embargo, el mantenimiento a largo plazo de los cambios de estilo de vida en el paciente diabético es muy complicado en la práctica clínica. Los pacientes obesos con DM2 presentan una especial dificultad para perder peso con MEV y/o tratamiento farmacológico para la obesidad24. Además, como se ha señalado previamente, la mayoría de fármacos utilizados en la DM2 para el tratamiento de la hiperglucemia induce un incremento de peso o en el mejor de los casos tiene un efecto neutro. Una revisión sistemática de 22 ensayos clínicos aleatorizados en DM2 que estudiaron el efecto de la MEV o la terapia conductual frente al tratamiento habitual, con un seguimiento de 1 a 5 años, mostró una diferencia ponderal de tan solo 1,7kg (intervalo de confianza [IC] del 95%: 0,3-3,2kg)25.
El estudio Look AHEAD (Action for Health in Diabetes) es un gran ensayo clínico diseñado para determinar si la pérdida de peso a largo plazo con MEV mejora el control glucémico y previene la enfermedad cardiovascular en pacientes con DM29. Los datos de seguimiento a un año de este estudio (planificado para una duración total de 11,5 años), confirmaron que una intervención intensiva sobre el estilo de vida en diabéticos tipo 2 que incluye una restricción calórica a expensas fundamentalmente de la grasa y una actividad física moderada-intensa, consigue una pérdida ponderal media al año del seguimiento del 8,6% en el grupo de intervención, frente al 0,7% en el grupo control. Y lo que es más importante, también logra un descenso de HbA1c desde el 7,3 al 6,6%, una mejoría de la presión arterial, del colesterol HDL (asociado a las lipoproteínas de alta densidad), del nivel de triglicéridos y de la microalbuminuria, y una reducción en el número y/o dosis de fármacos para la diabetes, la hipertensión o la dislipemia. Recientemente, se han publicado los resultados del estudio a 4 años, en los que se mantienen diferencias significativas, aunque atenuadas, en el peso, la HbA1c y otros factores de riesgo excepto el colesterol LDL (asociado a las lipoproteínas de baja densidad), debido al mayor uso de estatinas en el grupo control26. La cuestión crítica es si las diferencias observadas entre ambos grupos se traducirán en una reducción en la enfermedad cardiovascular, pero estos resultados no estarán disponibles en varios años. Sin embargo, la magnitud de los efectos observados en los factores de riesgo en el estudio Look AHEAD se ha asociado en otros ensayos clínicos y estudios observacionales previos con una reducción de la morbimortalidad cardiovascular.
El protocolo del estudio Look AHEAD es muy difícil de instaurar en nuestra realidad asistencial9. Durante los 6 primeros meses, los participantes fueron vistos semanalmente, con tres reuniones grupales y una individual por mes; en los 6 meses siguientes acudieron a reuniones grupales quincenales y a una sesión individual mensual. Posteriormente, los pacientes fueron vistos de forma individual al menos una vez al mes. En el equipo terapéutico estaban integrados dietistas, psicólogos y especialistas en ejercicio físico.
Sin embargo, disponemos en nuestro país de una potente arma terapéutica con una tradición secular que es la dieta mediterránea, la cual ha mostrado la misma eficacia en la pérdida de peso de pacientes obesos que las dietas bajas en carbohidratos o bajas en grasa y, además, reduce la incidencia de diabetes en un 52% en comparación con una dieta baja en grasa27,28. En pacientes con DM2 de reciente diagnóstico, la dieta mediterránea mejora el control glucémico y otros FRCV en comparación con una dieta baja en grasa, y además reduce la necesidad de fármacos antidiabéticos29. Un estudio de cohortes australiano ha mostrado una reducción de la mortalidad total y asociada a la DM en pacientes con mayor adherencia a un patrón de dieta mediterránea30.
En los últimos años, ha surgido una corriente integradora que propugna el abordaje multifactorial del paciente diabético. Esta estrategia se basa en los resultados del estudio Steno231. La intensificación del tratamiento en pacientes con DM2 y microalbuminuria mediante MEV, abandono del tabaco, terapia hipoglucemiante para reducir la HbA1c a menos de 6,5%, terapia hipolipemiante para mantener colesterol total menor de 175mg/dl, terapia antihipertensiva (con utilización sistemática de inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de la angiotensina 2) para alcanzar una presión arterial menor de 130/80mmHg, aspirina y suplementos vitamínicos, redujo el riesgo de enfermedad cardiovascular y complicaciones microvasculares en un 50% respecto al grupo de terapia convencional, aunque pocos pacientes llegaron a alcanzar una HbA1c<6,5% e incluso hubo una ligera ganancia de peso en ambos grupos. El seguimiento observacional tras finalizar el ensayo mostró una reducción de la mortalidad total y cardiovascular en la rama de tratamiento intensivo32. Los autores concluyen, utilizando calculadoras de riesgo cardiovascular, que el uso de estatinas y antihipertensivos causó el mayor efecto en la reducción de riesgo. Este estudio confirma lo observado en la experiencia clínica diaria: conseguir los objetivos de control ponderal y glucémico es mucho más difícil que alcanzar los objetivos de tensión arterial y lípidos en la DM2. Una visión pragmática del estudio abogaría por centrarnos en el control tensional y lipídico, y en menor medida en el control glucémico, abandonando una intervención intensiva sobre el peso. Desde mi punto de vista el mensaje debe ser otro: los fármacos antihipertensivos e hipolipemiantes son un tratamiento sinérgico con la pérdida ponderal a la hora de reducir el riesgo cardiovascular, pero probablemente podamos evitar la polifarmacia si el paciente consigue los objetivos de peso.
Tratamiento farmacológico óptimo en el paciente con DM2Tras los resultados del estudio UKPDS, la metformina constituye el tratamiento antidiabético de primera elección en todas las guías, incluso de inicio simultáneo a la MEV, dada la reducción observada en la mortalidad total y específica para DM, la reducción de complicaciones microvasculares y de infarto de miocardio21. La metformina no produce hipoglucemias y fue el fármaco que menor ganancia de peso indujo en el UKPDS. Algunas guías recomiendan incluso el empleo de metformina para la prevención de la DM2 en pacientes con riesgo elevado de progresión a DM, como aquéllos con glucemia basal alterada y/o intolerancia a la glucosa, HbA1c superior al 6% y no respuesta a modificación de estilo de vida23. Sin embargo, existe una falta absoluta de consenso sobre el siguiente escalón terapéutico tras metformina en la DM2. Muchos algoritmos recomiendan las sulfonilureas básicamente porque son más baratas; existe mucha experiencia en su uso y, en monoterapia, han conseguido una reducción de complicaciones microvasculares20. Pero no hay que olvidar, que en el estudio UKPDS la asociación metformina-sulfonilurea mostró un inesperado incremento de la mortalidad relacionada con la DM21, y este hallazgo aún no ha sido suficientemente clarificado. También se preconiza un uso precoz de la insulina, por ser el fármaco hipoglucemiante más eficaz y por su efecto protector sobre las complicaciones microvasculares20, pero la insulina, al igual que las sulfonilureas, induce una ganancia de peso y aumenta el riesgo de hipoglucemias. Los nuevos análogos basales, glargina y detemir, presentan un menor riesgo de hipoglucemias que la insulina NPH, y detemir parece inducir una menor ganancia ponderal que NPH33. Un reciente documento de consenso publicado conjuntamente por la American Diabetes Association y la American Cancer Society8 concluye que hay datos preliminares y limitados que sugieren que metformina estaría asociada a un menor riesgo de cáncer y que la insulina exógena presentaría una asociación positiva con el riesgo de neoplasias, aunque advierte que se precisan estudios que clarifiquen si esta asociación es causal y si los controvertidos datos epidemiológicos que apuntan a un mayor riesgo con glargina se confirman en estudios bien diseñados.
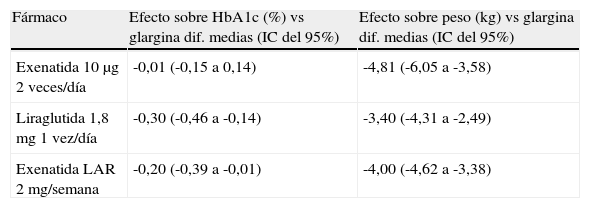
La propuesta adipocéntrica alternativa recomienda la utilización de agonistas del receptor de GLP-1 como exenatida, liraglutida o en un futuro próximo preparados de administración semanal como exenatida LAR, albiglutida, taspoglutida o semaglutida34. Estos fármacos inducen una pérdida ponderal mediada por un efecto anorexígeno central y un retardo en el vaciamiento gástrico, una mejoría prolongada del control glucémico inducida por el efecto incretínico y la pérdida de peso, y una reducción de otros FRCV como la presión arterial o los lípidos. Su eficacia es similar o mayor que las insulinas basales y otros antidiabéticos orales (tabla 2), con la ventaja añadida de no inducir hipoglucemias35. Se especula sobre un potencial efecto protector sobre la célula beta por inhibición de la apoptosis que lograría modificar la historia natural de la enfermedad; pero habrá que esperar varios años antes de poder verificar este dato. Actualmente, se desconoce si los cambios beneficiosos sobre múltiples factores se traducirán en una reducción del riesgo cardiovascular a largo plazo. Las principales limitaciones de este grupo terapéutico son la vía de administración, el coste, los efectos adversos gastrointestinales, la dificultad para predecir el perfil de paciente que obtendrá una buena respuesta glucémica y ponderal, y la falta de experiencia sobre su seguridad a largo plazo.
Efecto de los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) sobre la hemoglobina glucosilada (HbA1c) y el peso corporal en comparación con insulinoterapia basal en pacientes diabéticos tipo 2
| Fármaco | Efecto sobre HbA1c (%) vs glargina dif. medias (IC del 95%) | Efecto sobre peso (kg) vs glargina dif. medias (IC del 95%) |
| Exenatida 10μg 2 veces/día | -0,01 (-0,15 a 0,14) | -4,81 (-6,05 a -3,58) |
| Liraglutida 1,8mg 1 vez/día | -0,30 (-0,46 a -0,14) | -3,40 (-4,31 a -2,49) |
| Exenatida LAR 2 mg/semana | -0,20 (-0,39 a -0,01) | -4,00 (-4,62 a -3,38) |
Fuente: datos obtenidos de la revisión sistemática y el metaanálisis de Shyangdan DS., et al.35.
IC del 95%: intervalo de confianza del 95%.
Un fármaco que podría ser utilizado con mayor frecuencia en el tratamiento del paciente diabético con sobrepeso es el orlistat, un inhibidor de la lipasa pancreática frecuentemente olvidado por su falta de financiación y por la sensación de que no tiene un efecto relevante sobre el control glucémico o el peso en la DM2. Sin embargo, un metaanálisis de ensayos clínicos controlados en pacientes diabéticos de más de un año de seguimiento mostró una diferencia media ponderada respecto a placebo de -2,61% del peso corporal (IC del 95%: 3,06-2,17)24. En otra revisión de datos agrupados de 7 ensayos clínicos se observó que orlistat produjo un descenso significativo de HbA1c de 0,74% frente a 0,31% el placebo36. Esta mejoría del control glucémico es superior a la esperada para la pérdida de peso observada. Se postulan varios mecanismos alternativos para explicar este efecto, como una mejoría en la sensibilidad a la insulina, una digestión más lenta e incompleta de la grasa alimentaria, la reducción de la lipemia postprandial, una reducción del tejido adiposo visceral y la estimulación de la secreción intestinal de GLP-1.
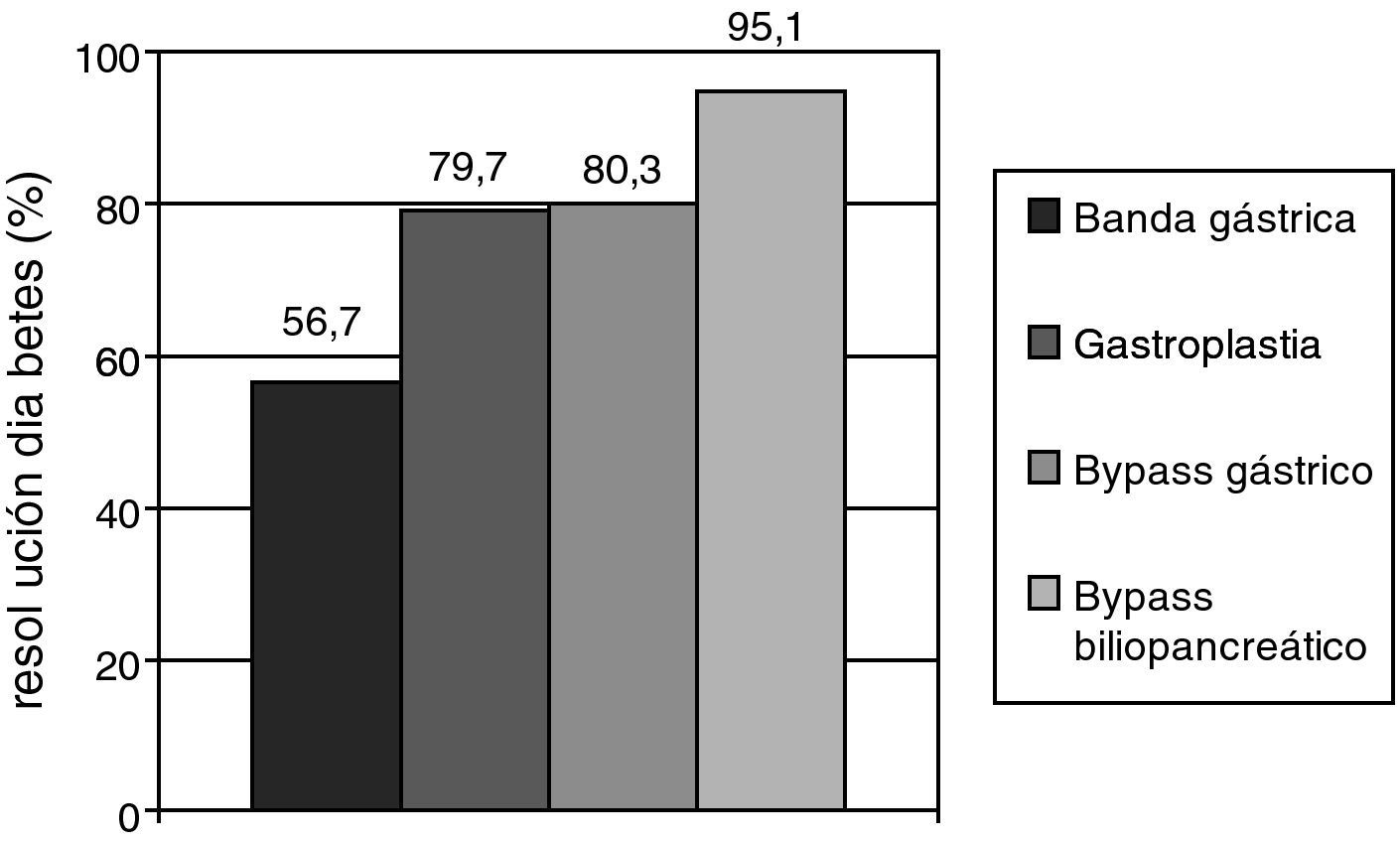
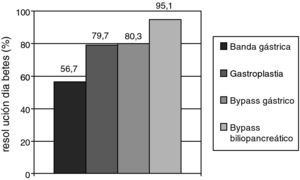
Cirugía metabólica en el paciente con DM2Los resultados más espectaculares en el tratamiento de la DM2 centrado en la pérdida de peso se han obtenido en pacientes sometidos a cirugía bariátrica, sobre todo con técnicas malabsortivas. Las guías de práctica clínica recomiendan este procedimiento a pacientes con IMC mayor de 40, que no pierden peso con medidas dietéticas y farmacológicas, extendiendo la indicación a pacientes con IMC superior a 35 y comorbilidades mayores como la DM2, la HTA, la dislipemia, la enfermedad cardiovascular, la osteoartrosis severa o la apnea del sueño37. Un reciente metaanálisis mostró que el bypass gástrico y el bypass biliopancreático consiguen una resolución de la diabetes a largo plazo en el 80,3 y 95,1% de los pacientes, respectivamente (fig. 1)38. La principal objeción a estos resultados es la baja calidad metodológica de los estudios incluidos. La mejoría del control glucémico se obtiene a los pocos días de la intervención, cuando todavía no se ha producido una pérdida ponderal relevante. Por ello, se piensa que la modificación anatómica del intestino induce un cambio en la secreción de péptidos gastrointestinales (incretinas y anti-incretinas) que son parcialmente responsables de la resolución de la DM2 en muchos de estos pacientes39.
Porcentaje de pacientes sometidos a distintas técnicas de cirugía bariátrica que consiguieron una resolución de la diabetes mellitus en un seguimiento superior a dos años. La resolución de la diabetes tipo 2 (DM2) se definió como la retirada de todos los fármacos para la DM2 con glucemia basal inferior a 100mg/dl y/o hemoglobina glucosilada menor del 6%. Fuente: adaptado de Buchwald H., et al.38.
En el momento actual se desconoce el peso relativo de la pérdida ponderal y el efecto incretínico en la resolución o mejoría de la DM2 tras cirugía bariátrica. Un ensayo clínico comparó la banda gástrica ajustable laparoscópica (un procedimiento restrictivo que no induce cambios relevantes en las incretinas) con el tratamiento médico convencional en pacientes con DM2 e IMC entre 30 y 4040. Los pacientes del grupo quirúrgico perdieron un 20,7% del peso inicial y un 73% de los mismos presentaron remisión de la DM2 a los dos años de la intervención; los pacientes del grupo control perdieron un 1,7% del peso inicial y un 13% cumplían criterios de remisión al final del estudio. Es probable, por tanto, que la restricción calórica y la pérdida ponderal desempeñen un papel central en la mejoría del metabolismo hidrocarbonado de los pacientes sometidos a cirugía bariátrica.
Además de conseguir la resolución o la franca mejoría de la DM2, la cirugía bariátrica mejora múltiples FRCV y como se ha comentado previamente reduce la mortalidad total10,11. Por ello, no es sorprendente que se intente extender la indicación de cirugía gastrointestinal no solo para tratar la diabetes asociada a la obesidad, sino para tratar la DM2 per se, emergiendo el concepto de cirugía metabólica (tabla 3)41. Esta práctica, todavía no validada por ensayos clínicos ni incluida en las guías terapéuticas, implica no solo el uso de procedimientos bariátricos convencionales sino intervenciones gastrointestinales experimentales que buscan aumentar la secreción de incretinas (interposición ileal) o evitar la secreción de hipotéticos factores anti-incretínicos (bypass duodenoyeyunal)42.
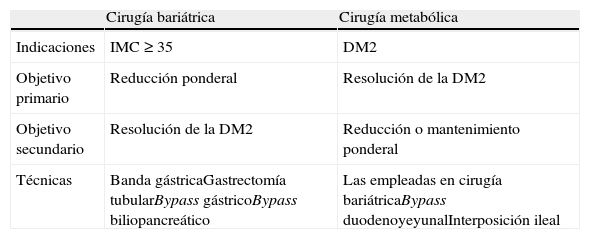
Diferencias entre la cirugía bariátrica y la cirugía metabólica
| Cirugía bariátrica | Cirugía metabólica | |
| Indicaciones | IMC≥35 | DM2 |
| Objetivo primario | Reducción ponderal | Resolución de la DM2 |
| Objetivo secundario | Resolución de la DM2 | Reducción o mantenimiento ponderal |
| Técnicas | Banda gástricaGastrectomía tubularBypass gástricoBypass biliopancreático | Las empleadas en cirugía bariátricaBypass duodenoyeyunalInterposición ileal |
DM2: diabetes mellitus tipo 2; IMC: índice de masa corporal.
La cirugía metabólica para la DM2 cuenta con muchos detractores, que la consideran un método draconiano para tratar una enfermedad médica. Una revisión integrada de estudios preliminares publicados sobre cirugía metabólica en diabéticos con IMC inferior a 35 y con un seguimiento muy heterogéneo (media de 23 meses, rango: 6-216 meses) concluye que un 89,1% de pacientes con IMC previo entre 30 y 35 y un 81,8% de pacientes con IMC previo entre 25 y 29,9% suspendieron tras la cirugía todos los fármacos para la DM, manteniendo una glucemia media próxima a la normalidad. La mortalidad fue muy baja (0,29%) y el descenso del IMC fue moderado, de -6,8 puntos de IMC en el grupo de obesidad y -3,4 en el grupo de sobrepeso, con IMC medios finales de 25,2 y 23,1, respectivamente43. Si estos datos se confirman en los ensayos clínicos actualmente en marcha, el IMC no sería un factor de decisión para seleccionar a los pacientes candidatos a cirugía metabólica42. Varios estudios han mostrado que la cirugía metabólica puede ser un procedimiento coste-efectivo para el tratamiento de la DM244.
En una conferencia internacional sobre cirugía gastrointestinal en la DM2, con la participación de múltiples sociedades científicas, se concluyó que la cirugía gastrointestinal, mediante bypass gástrico, banda gástrica ajustable o bypass biliopancreático, podría considerarse como tratamiento de la DM2 en candidatos quirúrgicos aceptables con IMC mayor de 35 mal controlados con MEV y tratamiento médico45. El tratamiento quirúrgico también puede ser apropiado como alternativa en pacientes diabéticos mal controlados con IMC entre 30 y 35. En este último grupo el procedimiento de elección es el bypass gástrico. Aunque las nuevas técnicas quirúrgicas como el bypass duodeno-yeyunal, la interposición ileal, la gastrectomía tubular o el manguito intraluminal han mostrado resultados prometedores en estudios preliminares, deberían utilizarse solo en el contexto de ensayos clínicos.
En cualquier caso, se necesitan estudios bien diseñados a largo plazo que demuestren la eficacia y seguridad de la cirugía metabólica en pacientes con IMC menor de 35 antes de que ésta pueda consolidarse como alternativa al tratamiento médico. Por consiguiente, no se deberían realizar estos procedimientos fuera de ensayos clínicos o, excepcionalmente, en casos muy seleccionados como tratamiento compasivo.
Conclusión: ¿Es necesario un cambio de modelo terapéutico en la DM2?Los defensores del modelo glucocéntrico dominante argumentarán que no se precisa un cambio de modelo terapéutico, porque los algoritmos actuales consiguen mejorar el control glucémico y reducir las complicaciones microvasculares. En un subgrupo de pacientes, el control glucémico intensivo puede reducir además las complicaciones macrovasculares. Además, no está demostrado que el aumento de peso que experimenta el paciente con el tiempo sea un factor pronóstico negativo.
Frente a esta posición ortodoxa, los partidarios de un modelo adipocéntrico pensamos que la estrategia glucocéntrica no consigue controlar la glucemia a largo plazo en un porcentaje relevante de pacientes, incluso con terapias insulínicas complejas: entre el 32,6 y el 50,6% de sujetos con insulinoterapia intensiva en el estudio 4T no consiguieron a los tres años una HbA1c inferior al 7%46. Fármacos recomendados en segunda línea como las sulfonilureas, las glinidas o la insulina inducen hipoglucemias y tanto estos grupos como las glitazonas favorecen el aumento de peso. La ganancia ponderal deteriora en muchos casos otros FRCV y diversas comorbilidades del paciente obeso, como la apnea del sueño, la hipoventilación, la osteoartrosis o la insuficiencia cardiaca. Existen cada vez más datos preocupantes sobre la asociación obesidad, diabetes y cáncer, y el incremento ponderal puede cerrar el círculo vicioso. Finalmente, el modelo clásico acaba por agotar la reserva pancreática, y tarde o temprano el paciente precisa insulinoterapia.
En contraposición, la estrategia adipocéntrica consigue actuar sobre el núcleo fisiopatológico de la enfermedad, reduciendo la necesidad de fármacos para la hiperglucemia y otros FRCV mediante MEV. Las grandes pérdidas de peso conseguidas con cirugía bariátrica reducen la mortalidad total y se modifica precozmente la historia natural de la enfermedad. Es posible que los fármacos con efecto incretina también tengan un efecto modificador de la evolución de la DM2.
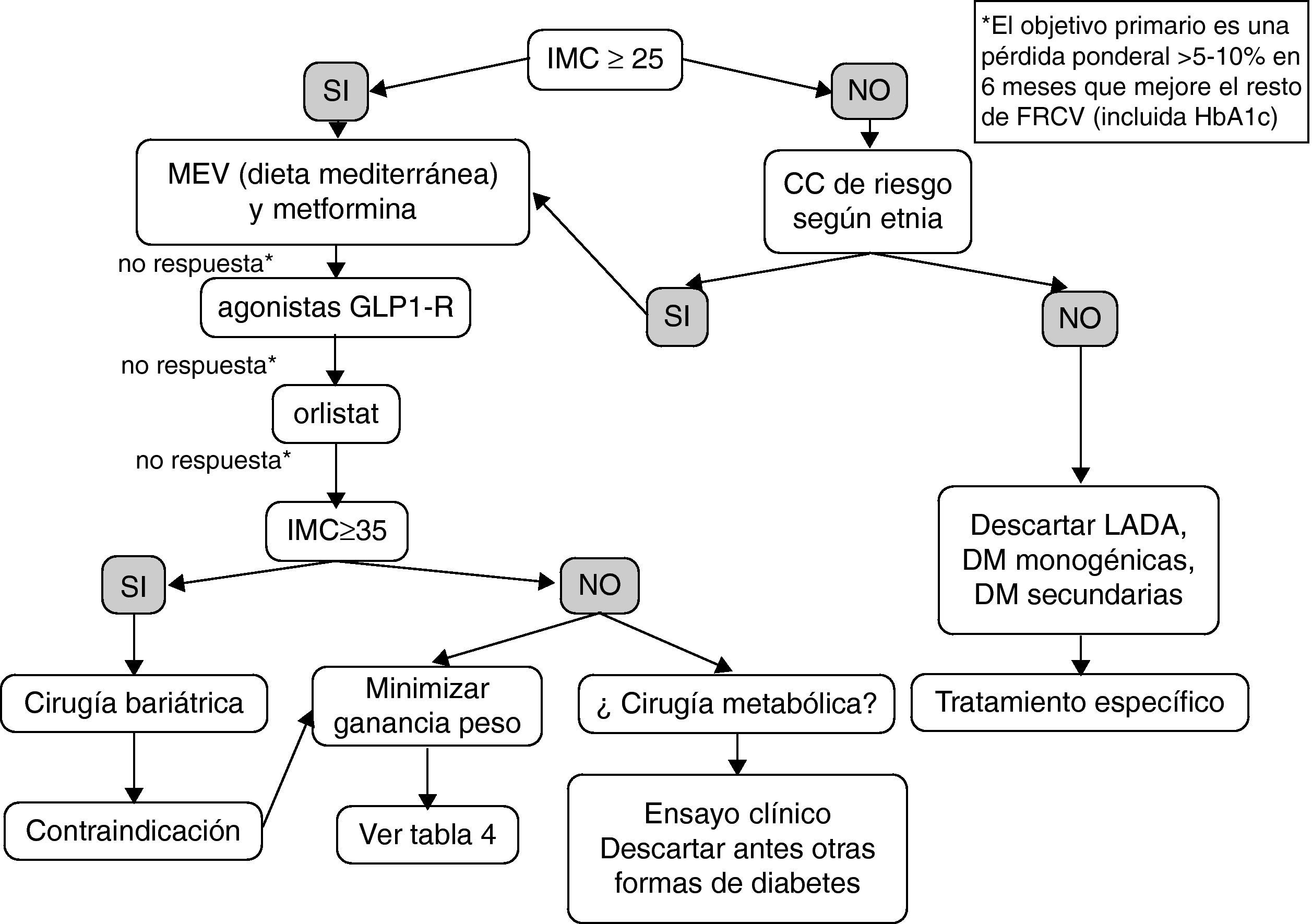
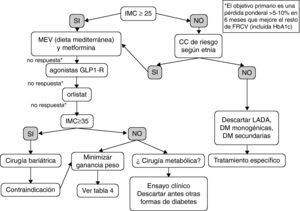
La figura 2 constituye una propuesta preliminar y empírica de estrategia adipocéntrica en el tratamiento de la DM2. Es necesario aclarar, que no es un algoritmo sustentado por ensayos clínicos (se apoya en los estudios comentados en el artículo y en la opinión del autor) y, por tanto, se trata de un esquema para una discusión en profundidad, que considero imprescindible antes de elevarlo a la categoría de recomendación. Los pacientes con un diagnóstico previo de DM2 pero IMC y CC en rango normal probablemente tengan otras formas de DM como LADA (latent autoimmune diabetes of the adult), DM monogénica o secundaria, que precisan un tratamiento específico, por lo que el modelo terapéutico propuesto no sería aplicable a este grupo. El eje motor de decisión es la pérdida de peso y, secundariamente, la mejoría del resto de FRCV. La combinación progresiva de MEV, metformina, agonista del receptor GLP-1 y orlistat es sinérgica en sus objetivos ponderales y glucémicos, y deberíamos ofrecerla a más pacientes. Además, todo paciente diabético tipo 2 con IMC mayor de 35 tiene derecho a conocer la opción quirúrgica, tanto por su efectividad, su relación coste-efectividad y el beneficio sobre la morbimortalidad. Finalmente, en los próximos años es posible que la indicación de cirugía metabólica deje de estar condicionada por el IMC; por el momento algunos pacientes con IMC entre 30 y 35 y mal control metabólico a pesar de politerapia podrían incluirse en ensayos clínicos controlados en centros de referencia.
Propuesta empírica de algoritmo adipocéntrico para el tratamiento del paciente con diabetes tipo 2 (DM2).
CC: circunferencia de cintura; FRCV: factores de riesgo cardiovascular; GLP1-R: receptor del péptido similar al glucagón tipo 1; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; LADA: diabetes autoinmune latente del adulto; MEV: modificación del estilo de vida.
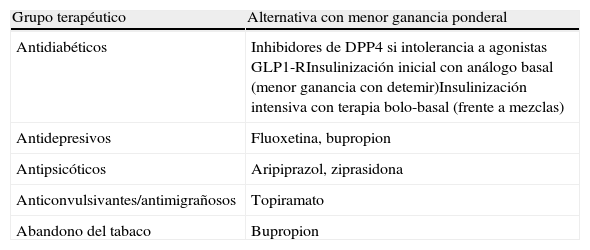
Un porcentaje variable de pacientes no logrará controlar los FRCV con este algoritmo. En ese caso utilizaremos fármacos antidiabéticos con el efecto menos desfavorable sobre el peso del paciente y añadiremos hipolipemiantes y antihipertensivos. Es también importante orientar a otros especialistas sobre ciertos fármacos que pueden ayudar al paciente a perder peso (tabla 4).
Recomendaciones para minimizar la ganancia de peso en un paciente diabético tipo 2 que no consigue los objetivos de control glucémico o precisa de otros tratamientos farmacológicos
| Grupo terapéutico | Alternativa con menor ganancia ponderal |
| Antidiabéticos | Inhibidores de DPP4 si intolerancia a agonistas GLP1-RInsulinización inicial con análogo basal (menor ganancia con detemir)Insulinización intensiva con terapia bolo-basal (frente a mezclas) |
| Antidepresivos | Fluoxetina, bupropion |
| Antipsicóticos | Aripiprazol, ziprasidona |
| Anticonvulsivantes/antimigrañosos | Topiramato |
| Abandono del tabaco | Bupropion |
DPP4: dipeptidil-peptidasa 4; GLP1-R: receptor del péptido similar al glucagón tipo 1.
Los pacientes que atendemos pueden tener una diabetes tipo 2 con otras comorbilidades asociadas, entre ellas la obesidad, o bien ser obesos con otras comorbilidades asociadas, entre ellas la diabetes. Parece algo banal, pero si uno se acostumbra a utilizar la segunda fórmula en sus diagnósticos, habrá iniciado un gran cambio en el manejo de sus pacientes diabéticos tipo 2.
Conflicto de interesesJ.J. Gorgojo Martínez declara que ha recibido honorarios por conferencias, actividades formativas y trabajos de investigación de las siguientes empresas farmacéuticas: Novo Nordisk, Lilly, Sanofi-Aventis, Roche, GlaxoSmithKline, Pfizer, Almirall, Novartis, Abbott, MSD y Bristol-Myers Squibb.