La hipomagnesemia es una alteración bioquímica poco frecuente en pacientes ambulatorios, pero que puede detectarse hasta en un 12% de los pacientes hospitalizados, en los que factores como la nutrición parenteral total y enteral, diuréticos, diarrea, hipoalbuminemia y fármacos nefrotóxicos (antibióticos, quimioterápicos, etc.) desempeñan un papel importante en su aparición. Los síntomas de hipomagnesemia generalmente aparecen con valores séricos inferiores a 1,2mg/dl. Con mucha frecuencia se asocia a la presencia de hipocalcemia, hipopotasemia y alcalosis metabólica. Recientemente diferentes autores han descrito varios casos de hipomagnesemia sintomática asociada al uso prolongado de inhibidores de la bomba de protones (IBP).
Un varón caucásico de 39 años de edad acudió al servicio de urgencias por calambres en las manos, pies y entumecimiento de la cara de 24horas de evolución. Desde hacía 4 años tenía episodios similares, que relacionaba con deposiciones diarreicas abundantes. El paciente tenía hipertensión arterial, dislipemia y una hernia de hiato. Además, había sufrido hace 5 años un infarto cerebral hemisférico derecho de origen cardioembólico del que se recuperó sin secuelas. Desde entonces, seguía el siguiente tratamiento: acenocumarol 3mg al día, ácido acetilsalicílico 100mg al día, atenolol 25mg cada 12h, amlodipino 5mg al día, losartán potásico 50mg al día, hidroclorotiazida 25mg al día, simvastatina 20mg al día y omeprazol 40mg al día. No había consumido alcohol ni ingerido productos de herbolario, laxantes o fármacos nefrotóxicos.
En el momento de su llegada al servicio de urgencias tenía una presión arterial de 118/62mmHg, una frecuencia cardiaca de 103ppm, estaba eupneico con una saturación basal de oxígeno del 97% y sin fiebre. Presentaba fasciculaciones musculares en los cuádriceps y espasmo carpopedal en manos y pies. Los signos de Chvostek y Trosseau fueron negativos. Las exploraciones pulmonar, cardiaca y abdominal fueron normales. En los análisis de laboratorio destacaba una creatinina de 1,01mg/dl, urea 26mg/dl, Na+ 142mM/l, Cl− 102mM/l, K+ 2,2 mM/l (3,5-5,5 meq/l), Ca++ 6,87mg/dl (8,7-10,3mg/dl), Mg++ 0,7mg/dl (1,40-2,40mg/dl), P+ 1,8mg/dl (2,7-4,5mg/dl). La gasometría venosa presentaba los siguientes valores: pH 7,45, pCO2 43mmHg y HCO3− 29,9 mEq/l. El electrocardiograma mostraba un ritmo sinusal sin alteraciones del ST y/o QTc. Las radiografías de tórax y abdomen fueron normales. El paciente ingresó en planta de hospitalización de endocrinología y se inició tratamiento urgente sustitutivo intravenoso de Mg++, K+ y Ca++ siguiendo las recomendaciones establecidas (4 ampollas de 12 mEq de Mg++ en 1.000ml de suero glucosado al 5% en 24h, solución de KCl de 20 mEq/l a velocidad máxima de 10 mEq/h, y carga de 200mg de Ca++ elemental seguido de una perfusión a 2mg/kg/h). Se realizaron controles analíticos cada 3horas para ajuste iónico. Tras unas horas de tratamiento, se alcanzó la normalización iónica y la remisión de los síntomas, continuándose con suplementos orales de Ca++, Mg++ y K+.
En analíticas de 2 años previas al ingreso no había registrados niveles de Mg++ ni de P+ y únicamente destacaba la presencia de hipocalcemia (7,4; 8,4; 8,5) e hipopotasemia (3,5; 2,2; 3,3).
Los estudios de tubulopatía renal, función tiroidea, metabolismo óseo (PTH 35,8 pg/ml, vitamina D 25-OH 38,10 ng/ml) e hiperaldosteronismo fueron normales. El paciente fue dado de alta asintomático tras 10 días de ingreso. La tiazida fue retirada y se continuó el tratamiento con suplementos orales de Mg++ (4,25 mmol/día) y Ca++ (1.000mg/día). Tres meses después el paciente acudió a una revisión programada en las consultas externas de endocrinología con los mismos síntomas. La analítica mostraba en esta ocasión un K+ 3,5mM/l, Ca++ total 8,2mg/dl, P+ 2,8g/dl y Mg++ 1,10mg/dl. Se completó el estudio gastrointestinal con pruebas funcionales, una tomografía computarizada tóracoabdominal, una colonoscopia, una panendoscopia oral y un tránsito gastrointestinal, para descartar síndromes malabsortivos o paraneoplásicos. De todas estas pruebas, la única alteración fue una prueba de intolerancia a la lactosa positiva. A pesar de los suplementos orales de Ca++ y Mg++, la hipomagnesemia e hipocalcemia persistieron hasta la suspensión del omeprazol e inicio de ranitidina 150mg cada 12h. Al alta se mantuvieron las sales de magnesio orales y una dieta sin lactosa. Después de 3 semanas, los análisis mostraron una normalización de los parámetros iónicos. Los suplementos orales fueron suspendidos, sin que posteriormente hubiera nuevos descensos en los valores séricos de Mg++ y Ca++.
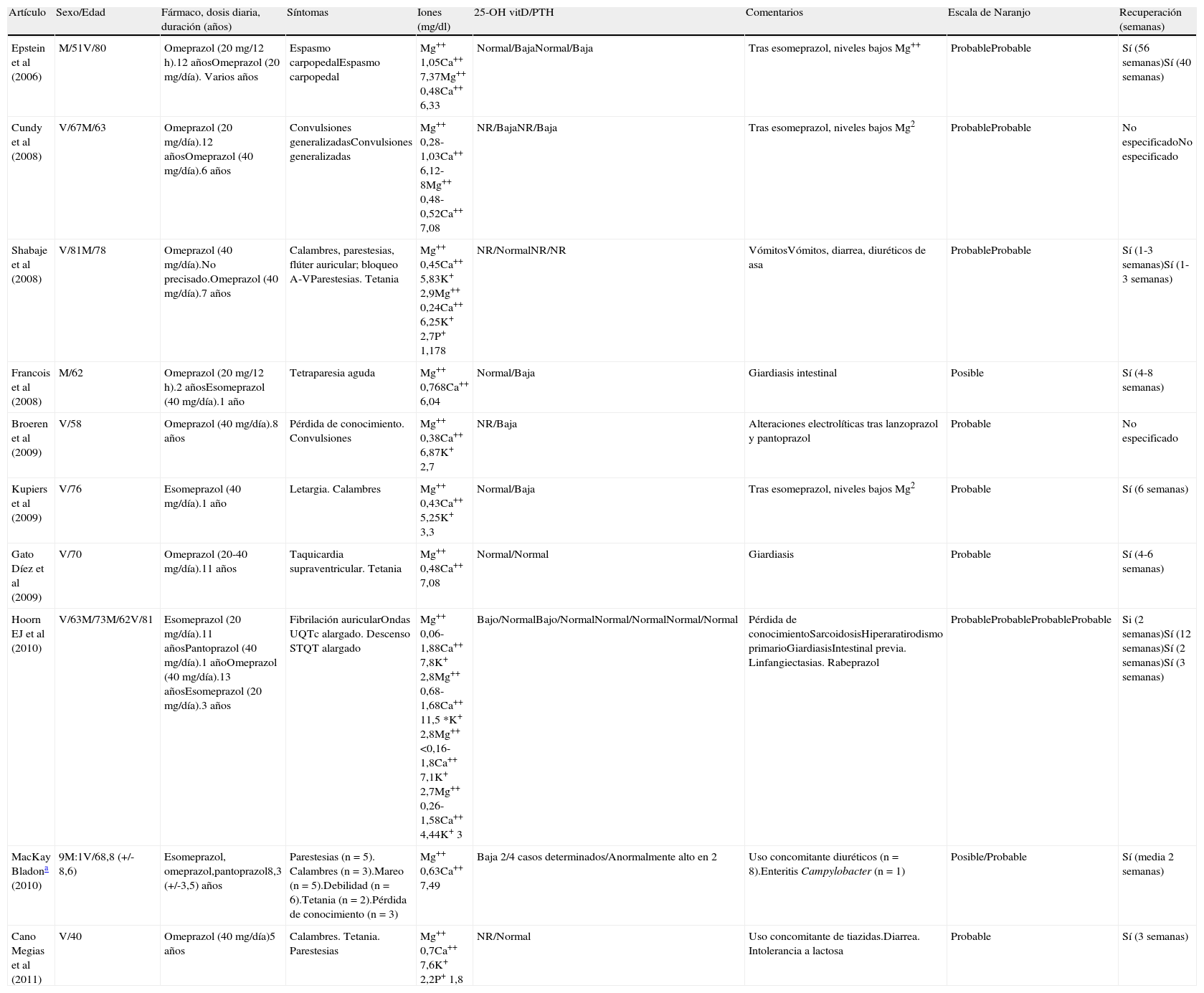
Hoy en día se desconoce la incidencia exacta de este efecto secundario de los IBP. En la búsqueda en Pub Med/MEDLINE de artículos recientemente publicados (2002-enero 2011) utilizando los términos hypomagnesaemia, proton pump-inhibitor y/o omeprazole, pantoprazole, lanzoprazole, hemos encontrado hasta 25 casos publicados (incluyendo el aquí descrito). El análisis del tipo de IBP, dosis y duración del tratamiento, características clínicas, factores precipitantes, manejo terapéutico y pronóstico se incluyen en la tabla 1. Todos los pacientes estaban en tratamiento con IBP al menos durante un año (media 7,7 años; rango 1-13). Existe un predominio del sexo femenino en las series descritas (15 mujeres, 10 varones), que puede ser atribuido a un mejor cumplimiento terapéutico1. La edad media de presentación era de 67,9 años (rango 40-81 años). La hipomagnesemia no sólo se asocia al omeprazol1 (n=15), sino que parece ser un efecto secundario de clase (esomeprazol1–4, pantoprazol1, lanzoprazol1,5, y rabeprazol4). Además el riesgo de hipomagnesemia no es dependiente de la dosis. Puede suceder tanto con dosis bajas o medias (20-40mg/día) como en 1 o 2 tomas al día2,6,7. La mayoría de los pacientes (n=21, 84%) tenían manifestaciones neuromusculares, como debilidad, mareo, parestesias1, calambres musculares8, espasmo carpopedal2, convulsiones generalizadas2,5 incluso pérdida de conocimiento o tetraparesia aguda3. Además, 3 de estos pacientes tenían alteraciones electrocardiográficas: taquicardia supraventricular7, flúter auricular8 y fibrilación auricular4. Hoom et al4 describen únicamente trastornos en el ritmo cardiaco sin síntomas neuromusculares asociados. Aproximadamente una cuarta parte de todos los pacientes (n=6, 24% del total) tuvieron algún tipo de alteración electrocardiográfica. Se describen con frecuencia factores desencadenantes que contribuyen a la hipomagnesemia (tabla 1). En nuestro caso eran el uso crónico de diuréticos tiazídicos y diarrea por intolerancia a la lactosa, que son causas conocidas de hipomagnesemia por pérdidas renales y gastrointestinales.
Resumen de casos publicados: sintomatología clínica, alteraciones iónicas, tratamiento y puntuación en la escala de Naranjo
| Artículo | Sexo/Edad | Fármaco, dosis diaria, duración (años) | Síntomas | Iones (mg/dl) | 25-OH vitD/PTH | Comentarios | Escala de Naranjo | Recuperación (semanas) |
| Epstein et al (2006) | M/51V/80 | Omeprazol (20 mg/12 h).12 añosOmeprazol (20 mg/día). Varios años | Espasmo carpopedalEspasmo carpopedal | Mg++ 1,05Ca++ 7,37Mg++ 0,48Ca++ 6,33 | Normal/BajaNormal/Baja | Tras esomeprazol, niveles bajos Mg++ | ProbableProbable | Sí (56 semanas)Sí (40 semanas) |
| Cundy et al (2008) | V/67M/63 | Omeprazol (20 mg/día).12 añosOmeprazol (40 mg/día).6 años | Convulsiones generalizadasConvulsiones generalizadas | Mg++ 0,28-1,03Ca++ 6,12-8Mg++ 0,48-0,52Ca++ 7,08 | NR/BajaNR/Baja | Tras esomeprazol, niveles bajos Mg2 | ProbableProbable | No especificadoNo especificado |
| Shabaje et al (2008) | V/81M/78 | Omeprazol (40 mg/día).No precisado.Omeprazol (40 mg/día).7 años | Calambres, parestesias, flúter auricular; bloqueo A-VParestesias. Tetania | Mg++ 0,45Ca++ 5,83K+ 2,9Mg++ 0,24Ca++ 6,25K+ 2,7P+ 1,178 | NR/NormalNR/NR | VómitosVómitos, diarrea, diuréticos de asa | ProbableProbable | Sí (1-3 semanas)Sí (1-3 semanas) |
| Francois et al (2008) | M/62 | Omeprazol (20 mg/12 h).2 añosEsomeprazol (40 mg/día).1 año | Tetraparesia aguda | Mg++ 0,768Ca++ 6,04 | Normal/Baja | Giardiasis intestinal | Posible | Sí (4-8 semanas) |
| Broeren et al (2009) | V/58 | Omeprazol (40 mg/día).8 años | Pérdida de conocimiento. Convulsiones | Mg++ 0,38Ca++ 6,87K+ 2,7 | NR/Baja | Alteraciones electrolíticas tras lanzoprazol y pantoprazol | Probable | No especificado |
| Kupiers et al (2009) | V/76 | Esomeprazol (40 mg/día).1 año | Letargia. Calambres | Mg++ 0,43Ca++ 5,25K+ 3,3 | Normal/Baja | Tras esomeprazol, niveles bajos Mg2 | Probable | Sí (6 semanas) |
| Gato Díez et al (2009) | V/70 | Omeprazol (20-40 mg/día).11 años | Taquicardia supraventricular. Tetania | Mg++ 0,48Ca++ 7,08 | Normal/Normal | Giardiasis | Probable | Sí (4-6 semanas) |
| Hoorn EJ et al (2010) | V/63M/73M/62V/81 | Esomeprazol (20 mg/día).11 añosPantoprazol (40 mg/día).1 añoOmeprazol (40 mg/día).13 añosEsomeprazol (20 mg/día).3 años | Fibrilación auricularOndas UQTc alargado. Descenso STQT alargado | Mg++ 0,06-1,88Ca++ 7,8K+ 2,8Mg++ 0,68-1,68Ca++ 11,5 *K+ 2,8Mg++ <0,16-1,8Ca++ 7,1K+ 2,7Mg++ 0,26-1,58Ca++ 4,44K+ 3 | Bajo/NormalBajo/NormalNormal/NormalNormal/Normal | Pérdida de conocimientoSarcoidosisHiperaratirodismo primarioGiardiasisIntestinal previa. Linfangiectasias. Rabeprazol | ProbableProbableProbableProbable | Si (2 semanas)Sí (12 semanas)Sí (2 semanas)Sí (3 semanas) |
| MacKay Bladona (2010) | 9M:1V/68,8 (+/- 8,6) | Esomeprazol, omeprazol,pantoprazol8,3 (+/-3,5) años | Parestesias (n=5). Calambres (n=3).Mareo (n=5).Debilidad (n=6).Tetania (n=2).Pérdida de conocimiento (n=3) | Mg++ 0,63Ca++ 7,49 | Baja 2/4 casos determinados/Anormalmente alto en 2 | Uso concomitante diuréticos (n=8).Enteritis Campylobacter (n=1) | Posible/Probable | Sí (media 2 semanas) |
| Cano Megias et al (2011) | V/40 | Omeprazol (40 mg/día)5 años | Calambres. Tetania. Parestesias | Mg++ 0,7Ca++ 7,6K+ 2,2P+ 1,8 | NR/Normal | Uso concomitante de tiazidas.Diarrea. Intolerancia a lactosa | Probable | Sí (3 semanas) |
M: mujer; NR: no realizado; V: varón.
Valores medios de serie de 10 casos. La escala de Naranjo sólo ha podido ser aplicada al único caso descrito, siendo la puntuación de probable. La escala de Naranjo es uno de los algoritmos más utilizados para evaluar la relación causal de una reacción adversa medicamentosa (RAM). (Naranjo CA, Busto U, Sellers E M, Sandor P, Ruiz I, Roberts EA et al A method for estimating of adverse drug reactions. Clin Pharmacol Ther. 1981;30:239-245. Las categorías correspondientes a la puntuación total son las siguientes: La RAM es: segura: > 9; probable: 5-8; posible: 1-4; improbable < 1.
Los casos publicados en la literatura médica describen la presencia concomitante de otros trastornos electrolíticos como hipopotasemia (n=9, cifra media 2,7 mM/l) e hipofosfatemia (n=2)5,8. Todos los trabajos han comunicado la presencia de hipocalcemia secundaria (valores medios de Ca2+ 7,16mg/dl).
El mecanismo de la hipomagnesemia inducida por IBP todavía no está aclarado. Schilingman et al9 proponen que el tratamiento con IBP induce cambios en el pH intestinal y produce una disminución en la expresión de la familia de receptores de potencial transitorio de canales de melastatina (TRPM) en individuos heterocigóticos. Recientemente se han identificado dos de estos receptores, TRPM6 y TRPM79,10, que son claves en el transporte intestinal transepitelial y tubular renal de Mg++. Varios factores regulan su expresión: valores séricos de Mg++, angiotensina II, aldosterona, bradicinina, estrógenos, fármacos inductores de hiperglucemia, diabetes mellitus, diuréticos, acidosis o alcalosis o inmunosupresores como tacrolimus.
En general, la recuperación completa de los trastornos hidroelectrolíticos sucedió en una media de 6 semanas (1-56 semanas). Se cambió a un anti-H2 en casi dos tercios de los pacientes (n=18), siendo retirado el IBP como única actitud terapéutica en el resto. En conclusión, la hipomagnesemia inducida por el tratamiento prolongado con IBP es un efecto adverso de clase. Puede ser desencadenada por múltiples factores, que deben de ser considerados en cada caso individual. MacKay y Bladon1 recomiendan realizar un control anual de iones, incluyendo K+, Ca++ y Mg++ en todos los pacientes que se encuentren en tratamiento con IBP. Es una alteración iónica totalmente reversible tras la retirada del IBP. Sin embargo, la mayoría de los pacientes precisan de un tiempo (varias semanas) de tratamiento con suplementos orales de Mg++ y Ca++ para la completa resolución de las anomalías electrolíticas. Los clínicos deben estar atentos a las alteraciones iónicas de pacientes que se presentan con tetania, arritmias o convulsiones de causa no aclarada y que estén en tratamiento de larga duración con IBP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Pablo Guisado Vasco por su atención y consejos en la elaboración del presente trabajo.