La conducta a seguir con el nódulo tiroideo y el cáncer de tiroides en la paciente embarazada requiere especiales consideraciones. El abordaje diagnóstico y terapéutico del nódulo tiroideo se rige por los criterios habituales en las pacientes no embarazadas. Por su parte, el manejo del cáncer diferenciado de tiroides durante la gestación implica una serie de retos para la madre y el feto. Los datos disponibles muestran que el embarazo no supone un aumento de riesgo de aparición o recurrencia de cáncer de tiroides, pero no está completamente descartado que la gestación pueda representar un estímulo en pacientes con enfermedad activa. Es importante tener en cuenta que en caso de ser necesario el tratamiento quirúrgico se recomienda llevarlo a cabo durante el segundo trimestre o, preferentemente, tras el parto. La mayoría de las gestantes con enfermedad de bajo riesgo solo requieren el ajuste del tratamiento con levotiroxina. Sin embargo, en mujeres que tienen valores elevados de tiroglobulina antes de la gestación o con datos morfológicos de persistencia de enfermedad deberá realizarse un seguimiento periódico mediante la determinación de tiroglobulina y realización de ecografías cervicales. La gestación supone una contraindicación absoluta para la administración de 131I.
Special considerations are warranted in management of thyroid nodule and thyroid cancer during pregnancy. The diagnostic and therapeutic approach of thyroid nodules follows the standard practice in non-pregnant women. On the other hand, differentiated thyroid cancer management during pregnancy poses a number of challenges for the mother and fetus. The available data show that pregnancy is not a risk factor for thyroid cancer development or recurrence, although flare-ups cannot be completely ruled out in women with active disease. If surgery is needed, it should be performed during the second term or, preferably, after delivery. A majority of pregnant patients with low-risk disease only need adjustment in levothyroxine therapy. However, women with increased serum thyroglobulin levels before pregnancy or structural disease require regular thyroglobulin measurements and neck ultrasound throughout pregnancy. Pregnancy is an absolute contraindication for radioactive iodine administration.
Recientemente la American Thyroid Association (ATA) y la Endocrine Society (ENDO) han publicado sendas guías clínicas que recopilan los principales avances de los últimos años en el manejo de la patología tiroidea de la mujer gestante1,2. Los documentos, especialmente la guía de la ATA, son exhaustivos y las recomendaciones en gran medida están solapadas.
Pensamos que la profusión de guías no es necesaria, ya que puede conducir a crear desconcierto entre los profesionales3. Por ello nuestra intención no es desarrollar una guía más, sino adaptar y sintetizar esquemáticamente para los profesionales del entorno hispano la información que contienen los 2 documentos americanos y, en su caso, indicar si existen peculiaridades específicas en nuestro ámbito. En el caso de que se quiera profundizar en algún concepto, o se desee conocer la fuerza o evidencia de las recomendaciones, se propone consultar los documentos citados.
Años atrás se publicó en Endocrinología y Nutrición la Guía clínica para el manejo de la disfunción tiroidea subclínica durante la gestación4. En continuidad con ese documento, se publica ahora la Guía clínica para el manejo de la patología nodular tiroidea en el embarazo. Con objeto de facilitar la consulta rápida se ha optado por presentar unas recomendaciones basadas en cuestiones y respuestas mediante un formato visual, claro, práctico y manejable.
Interpretación de la función tiroidea y del bocio durante la gestaciónLos cambios que se producen en el tiroides durante la gestación se han estudiado con profundidad a lo largo de los últimos años y pueden ser tanto morfológicos como funcionales5. Durante el embarazo, la concentración circulante tanto de tirotropina como de las hormonas tiroideas tiene valores de referencia propios que deben tenerse en cuenta y deben ser señalados por cada laboratorio con objeto de evitar interpretaciones erróneas1,6,7. Esto es de capital importancia en el seguimiento de la paciente con antecedente de cáncer diferenciado de tiroides, como veremos más adelante.
La sospecha de cáncer de tiroides debe estar presente en cualquier paciente que consulta por bocio. Por ello se debe tener en cuenta que, dependiendo del consumo de yodo, el volumen tiroideo puede aumentar entre un 10% (en zonas con ingesta normal-alta) y un 40% (en zonas con bajo consumo) durante el embarazo. En nuestro medio existe un estudio realizado en 35mujeres embarazadas del Valle de Arán, una zona tradicionalmente endémica de déficit de yodo. Los autores midieron el volumen tiroideo durante el 1.er y el 3.er trimestre del embarazo. La mediana del volumen tiroideo en estas mujeres aumentó desde 7,5 hasta 9,5ml a lo largo de la gestación (p<0,001). También se observó que esta diferencia era mayor entre las mujeres que habían tenido múltiples gestaciones. En sintonía con estudios en otras zonas geográficas, el trabajo español concluía que tanto el déficit de yodo como la multiparidad son factores bociógenos durante la gestación8.
Embarazo y nódulos tiroideosEl manejo del nódulo tiroideo durante la gestación se rige, en general, por los criterios habituales de diagnóstico y tratamiento de esta alteración. Las peculiaridades propias de la gestación están en relación con cambios en la prevalencia de los nódulos, su tamaño y crecimiento, así como las indicaciones de tratamiento, especialmente el quirúrgico.
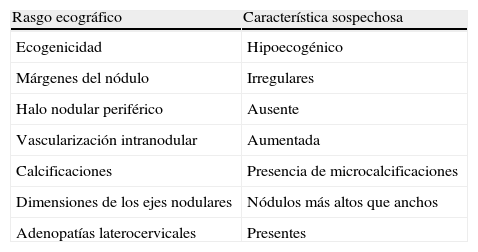
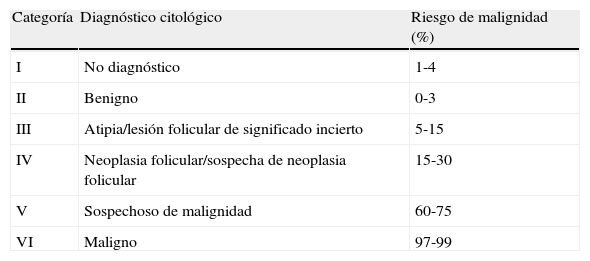
Del mismo modo que en la mujer no gestante, el estudio ecográfico es esencial en todo nódulo tiroideo. La ecografía proporciona información valiosa y orienta acerca de la naturaleza benigna o maligna de los nódulos9 (tabla 1). Igualmente, siguiendo los criterios generales, el estudio insoslayable en los nódulos tiroideos es la evaluación citológica mediante punción-aspiración con aguja fina (PAAF). Obviamente, la gestación no condiciona ninguna variación en los diagnósticos citológicos de los nódulos tiroideos. Actualmente, la clasificación más extendida es la recomendada por el sistema de Bethesda10, que se resume en la tabla 2.
Rasgos ecográficos de los nódulos tiroideos que sugieren malignidad
| Rasgo ecográfico | Característica sospechosa |
| Ecogenicidad | Hipoecogénico |
| Márgenes del nódulo | Irregulares |
| Halo nodular periférico | Ausente |
| Vascularización intranodular | Aumentada |
| Calcificaciones | Presencia de microcalcificaciones |
| Dimensiones de los ejes nodulares | Nódulos más altos que anchos |
| Adenopatías laterocervicales | Presentes |
Criterios de diagnóstico citológico. «Clasificación de Bethesda»
| Categoría | Diagnóstico citológico | Riesgo de malignidad (%) |
| I | No diagnóstico | 1-4 |
| II | Benigno | 0-3 |
| III | Atipia/lesión folicular de significado incierto | 5-15 |
| IV | Neoplasia folicular/sospecha de neoplasia folicular | 15-30 |
| V | Sospechoso de malignidad | 60-75 |
| VI | Maligno | 97-99 |
Está descrito que durante el embarazo aumenta tanto la aparición de nuevos nódulos tiroideos así como el volumen de los ya existentes1. No obstante, generalmente los nódulos vuelven al tamaño basal tras el parto11. Sin embargo, en un trabajo español, Jaén Díaz et al.12 encontraron que la prevalencia de nódulos tiroideos durante el primer trimestre del embarazo era del 33,2%, cifra ligeramente inferior a la prevalencia que hallan en los controles (38,5%), aunque esta diferencia no fue estadísticamente significativa. Este dato, que sugiere que el embarazo no favorece la aparición de nódulos tiroideos, contrasta con las observaciones de otros estudios no españoles11,13,14. No obstante, también llama la atención la alta prevalencia de nódulos tiroideos del estudio de Jaén Díaz et al.12, ya que hallan una prevalencia de nódulos en embarazadas notablemente mayor que la descrita en la mayoría de los trabajos similares, que oscila entre el 3 y el 21%.
1. El embarazo ¿causa algún trastorno morfológico sobre la glándula tiroidea?
La mayoría de las investigaciones sugieren que el embarazo incrementa tanto el riesgo de desarrollar nuevos nódulos tiroideos, como propicia un aumento del tamaño de los ya existentes1. Los nódulos pre-gestacionales pueden aumentar hasta un 50% su tamaño, y la aparición de un nódulo de novo durante el embarazo ocurre hasta en el 20% de las pacientes. Este riesgo también se ve favorecido tanto por la edad como por el incremento del número de gestaciones (la multiparidad supone un aumento del 10-15%).
2. ¿Qué precauciones se pueden tomar para evitar la aparición de nódulos tiroideos durante la gestación?
Los datos epidemiológicos sugieren que el bajo consumo de yodo predispone para el desarrollo de nódulos en el tiroides. Por ello es muy aconsejable tomar suplementos de yoduro potásico durante toda la gestación. Adicionalmente, con esta medida se protege contra la aparición de hipotiroidismo en la madre y en el feto, además de proporcionar al feto el yodo necesario para que sintetice sus hormonas tiroideas.
Manejo clínico del nódulo tiroideo durante la gestación3. ¿Cuál es el manejo del nódulo tiroideo en la mujer gestante?
El descubrimiento de un nódulo tiroideo durante el embarazo aconseja llevar a cabo una detallada historia clínica y examen físico. La historia debe incluir: a)los antecedentes familiares de enfermedades tiroideas (autoinmunes y nodulares) y de carcinomas (medular de tiroides, neoplasia endocrina múltiple 2A y cáncer de colon); b)los antecedentes personales, especialmente el consumo de yodo, radiación cervical previa e historia obstétrica; c)además se indagará sobre los signos o síntomas de disfunción tiroidea, y especialmente la evolución del nódulo tiroideo, y d)la exploración cuidadosa del cuello completa el estudio clínico (tabla 3).
Protocolo de actuación en la primera visita a la paciente embarazada con nódulos tiroideos
| Historia clínica | |
| Características del nódulo | Evaluar crecimiento y presencia de síntomas localesSintomatología de disfunción tiroidea |
| Antecedentes personales | Radioterapia cervicalConsumo habitual de yodo |
| Antecedentes familiares | Carcinoma de tiroides: papilar o medular, y neoplasia endocrina múltiple tipo 2Carcinoma de colon: poliposis familiar |
| Exploración física | |
| Palpación cervical | Características del nódulo, presencia de adenopatías localesSignos sistémicos de disfunción tiroidea |
| Laboratorio | |
| Perfil tiroideo | Objetivo: TSH < 2,5 mU/l |
| Ecografía tiroidea | |
| Estudio citológico | Todo nódulo sólido > 1cm |
| Punción-aspiración con aguja fina | Todo nódulo con rasgos ecográficos sospechosos |
| Tratamiento | |
| Suplementos de yodo | 200μg/día |
La recomendación general de determinar la función tiroidea en todo paciente con nódulos en el tiroides también rige para la embarazada15. Por ello, ante una mujer gestante con un nódulo tiroideo se debe realizar un estudio funcional mediante la determinación de TSH y T4 libre.
En el caso de confirmar las alteraciones morfológicas en la exploración, se deberá llevar a cabo una ecografía tiroidea y, si fuese preciso, se completará el estudio con una PAAF. El embarazo no supone una contraindicación para la PAAF, de modo que esta puede llevarse a cabo en cualquier momento de la gestación. Los rasgos ecográficos que determinan si es preciso hacer el análisis citológico se resumen en los siguientes criterios: a)todo nódulo mayor de 1cm; b)los nódulos que tengan rasgos ecográficos sugestivos de malignidad; c)crecimiento rápido o sospecha clínica de malignidad; d)descubrimiento mediante ecografía de adenopatías cervicales potencialmente metastásicas, y e)presencia de factores de riesgo, como historia familiar de cáncer tiroideo o antecedente de radioterapia cervical. No obstante, si los rasgos ecográficos son de benignidad, la PAAF de los nódulos puede demorarse hasta después del parto.
La gammagrafía está contraindicada durante el embarazo. Sin embargo, la información disponible señala que la realización involuntaria de una gammagrafía antes de la semana 12 de gestación no parece que lesione el tiroides del feto1.
En general, la presencia de cáncer de tiroides no condiciona una alteración en la función de la glándula. La medición de los valores circulantes de tiroglobulina carece de interés diagnóstico y pronóstico en este contexto. No hay suficiente información sobre la conveniencia de determinar la calcitonina durante el embarazo, excepto en el caso de que existan antecedentes familiares de carcinoma medular de tiroides. El estímulo con pentagastrina está contraindicado en la gestación.
4. ¿Se debe hacer cribado de alteraciones tiroideas durante la gestación?
Cada vez existe un mayor número de evidencias que apoyan la conveniencia de llevar a cabo un cribado de función tiroidea y un examen físico cervical tan pronto como la mujer conozca la noticia de su embarazo16. El beneficio que supone corregir disfunciones tiroideas detectadas durante el primer trimestre de gestación supera ampliamente el coste de su cribado17.
Por la escasez de estudios acerca de la relación entre nódulos tiroideos y autoinmunidad durante el embarazo, no existen recomendaciones sobre la conveniencia de la medición de los anticuerpos antitiroideos durante este tiempo. Además, por la situación de privilegio inmunitario que ocurre durante el embarazo, la concentración circulante de los anticuerpos antitiroideos desciende a lo largo de la gestación, lo que podría complicar la interpretación de los resultados18.
5. ¿Cuáles son los valores de referencia de las hormonas tiroideas que se deben tener en cuenta durante la gestación?
Por las razones aducidas anteriormente, el valor circulante de TSH debe estar entre 0,1-2,5mU/l durante el 1.er trimestre de la gestación. El objetivo durante el 2.° y el 3.er trimestre es 0,2-3,0 y 0,3-3,0mU/l, respectivamente1.
6. ¿Cómo se debe realizar el seguimiento de los nódulos benignos a lo largo de la gestación?
Los nódulos tiroideos que han recibido el diagnóstico de sospecha de benignidad por sus rasgos ecográficos o que han sido así catalogados citológicamente y que no producen sintomatología compresiva no precisan especial seguimiento durante el embarazo.
Se deberá repetir la ecografía ante nódulos que crezcan rápidamente. En estos casos, así como en aquellos en los que aparezcan cambios ecográficos sospechosos de malignidad, se deberá repetir la PAAF.
Tratamiento del nódulo tiroideo durante la gestaciónUna vez establecido el diagnóstico (clínico, ecográfico o citológico), los nódulos tiroideos benignos no precisan tratamiento.
7. ¿Es útil el tratamiento supresor con levotiroxina durante el embarazo?
No está recomendado tratar el bocio nodular con dosis suprafisiológicas de levotiroxina, ya que la supresión de la secreción de TSH podría generar efectos adversos no buscados tanto en la madre como en el feto19.
8. ¿Cuándo hay indicación quirúrgica de un nódulo tiroideo?
En casos de que se produzcan cambios ecográficos o citológicos en nódulos previamente benignos, o si la evolución del nódulo despertase dudas acerca de su naturaleza, se recomienda llevar a cabo tratamiento quirúrgico. También es indicación quirúrgica la aparición de síntomas compresivos.
Los nódulos con PAAF indeterminada (categorías3, 4 y 5 de Bethesda) o maligna (categoría6) deben ser intervenidos (tabla 2). Las indicaciones precisas de la cirugía se abordan en la pregunta 12.
9. ¿Cómo se deben tratar los nódulos tiroideos hiperfuncionantes?
El tratamiento del hipertiroidismo en la mujer gestante es complejo. Las recomendaciones para su manejo exceden el objetivo de esta guía y han sido reseñadas en otro documento4. En cualquier caso conviene subrayar que el tratamiento con radioyodo está contraindicado a lo largo de todo el embarazo.
Manejo del cáncer diferenciado de tiroides diagnosticado durante el embarazoEl cáncer diferenciado de tiroides es el segundo tumor maligno más frecuente diagnosticado durante el embarazo por detrás del cáncer de mama, con una prevalencia de 14 cada 100.000nacimientos20. Además, el 10% de todos los cánceres de tiroides que ocurren durante la edad fértil se diagnostican durante el embarazo o durante el primer año posparto, y el tipo histológico más frecuente es el carcinoma papilar21. El manejo de cáncer diferenciado de tiroides durante la gestación implica una serie de retos diagnósticos y terapéuticos para la madre y el feto.
10. En mujeres embarazadas con nódulos tiroideos ¿aumenta la frecuencia de cáncer de tiroides?
Existen 3 estudios retrospectivos en los que encuentran un mayor riesgo de malignidad en mujeres embarazadas con nódulos tiroideos. No obstante, estos estudios tienen un defecto en la selección de las pacientes, ya que fueron realizados en hospitales de referencia terciarios donde las mujeres con cáncer pueden estar sobrerrepresentadas22-24.
Sin embargo, cabe esperar que el embarazo suponga una circunstancia favorecedora de la aparición y crecimiento de nódulos malignos dado el déficit de yodo relativo que experimenta la madre, el incremento de factores de crecimiento, la aparición de hormonas con actividad estimuladora similar a la de la TSH y los niveles altos de estrógenos. Es por ello que el manejo de estas pacientes requiere una especial consideración.
11. ¿Afecta el embarazo al pronóstico del cáncer de tiroides?
La mayoría de los estudios indican que el embarazo no empeora el pronóstico de las mujeres diagnosticadas de cáncer diferenciado de tiroides25–31. Solo en uno de los 7 estudios publicados que han abordado esta cuestión se encontró mayor riesgo de persistencia/recurrencia de enfermedad en las mujeres diagnosticadas durante el embarazo o durante el año tras el parto30. Este hallazgo se relacionó con la presencia de altos niveles de expresión del receptor de estrógenos en las células tumorales tiroideas. No obstante, el número de pacientes del estudio fue pequeño y poco representativo.
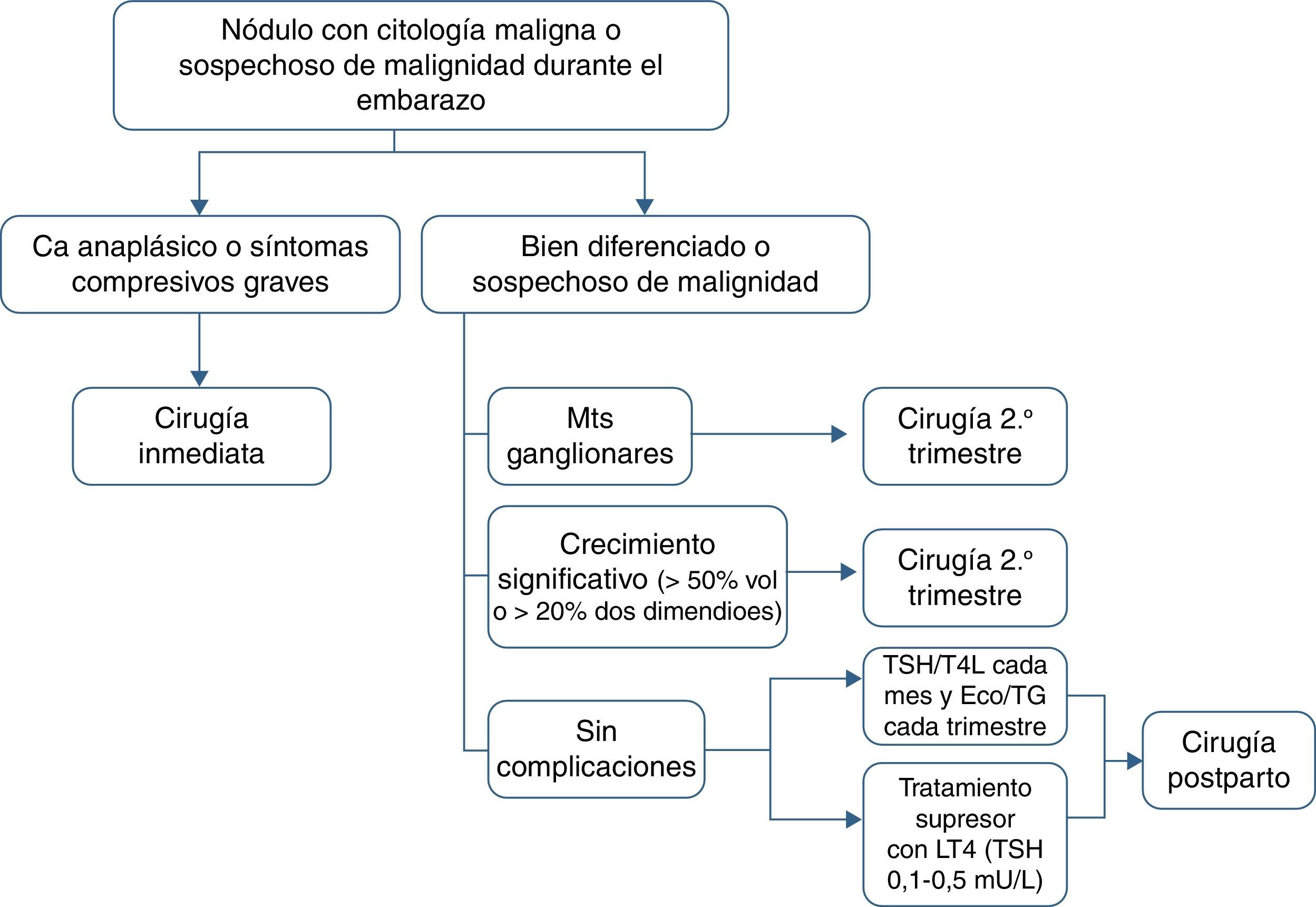
En conclusión, hasta la fecha no hay evidencia suficiente que permita concluir que el embarazo empeora el pronóstico del cáncer de tiroides. Por tanto, la tiroidectomía durante el embarazo se puede posponer en la mayoría de las pacientes embarazadas hasta el posparto sin que afecte al riesgo de recurrencia o mortalidad1.
El impacto del embarazo en las mujeres con carcinoma anaplásico o medular no ha sido estudiado.
12. ¿Cuál debe ser el manejo del cáncer de tiroides diagnosticado durante el embarazo?
Se debe tener en cuenta que casi siempre existe un conflicto entre el tratamiento óptimo de la madre y el bienestar fetal. Por tanto, existe un dilema ético. La decisión de cuál es la mejor opción terapéutica conviene tomarla en el seno de un equipo multidisciplinar que incluya endocrinólogo, cirujano, obstetra, especialista en medicina nuclear y neonatólogo.
Existen dos particularidades a tener en cuenta en el manejo de la mujer con cáncer diferenciado de tiroides que se diagnostica durante el embarazo: la contraindicación absoluta de la administración del yodo radiactivo y la elección del momento de la tiroidectomía. Como ya se ha comentado, en general se recomienda retrasar la cirugía hasta el posparto, puesto que no hay evidencia suficiente de que el embarazo empeore el pronóstico del cáncer1.
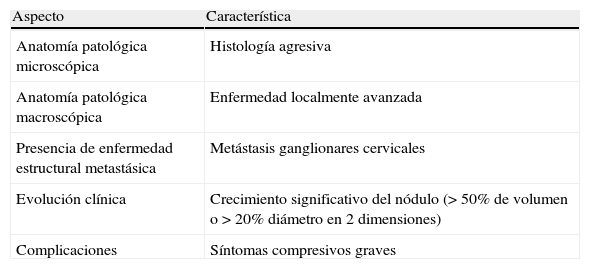
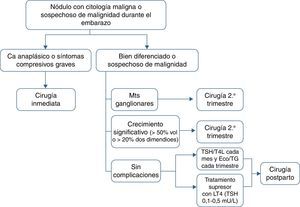
Se recomienda la tiroidectomía en el segundo trimestre en los siguientes casos: a)histología agresiva o localmente avanzada (p.ej., carcinoma anaplásico o pobremente diferenciado), b)aparición de ganglios cervicales metastásicos (diagnosticados por citología), c)síntomas compresivos graves (p.ej., obstrucción traqueal), y d)crecimiento significativo del nódulo maligno (>50% de volumen o >20% de diámetro en 2 dimensiones) antes de la semana 24 de gestación (tabla 4).
Indicaciones de cirugía de un nódulo tiroideo maligno en el segundo trimestre del embarazo
| Aspecto | Característica |
| Anatomía patológica microscópica | Histología agresiva |
| Anatomía patológica macroscópica | Enfermedad localmente avanzada |
| Presencia de enfermedad estructural metastásica | Metástasis ganglionares cervicales |
| Evolución clínica | Crecimiento significativo del nódulo (> 50% de volumen o > 20% diámetro en 2 dimensiones) |
| Complicaciones | Síntomas compresivos graves |
Si el nódulo maligno no reúne las características mencionadas o es diagnosticado hacia el final de la segunda mitad del embarazo, la cirugía se puede retrasar hasta el posparto. En estos casos se recomienda iniciar tratamiento supresor con levotiroxina buscando unas concentraciones de TSH en el límite inferior de la normalidad (0,1-1,5mU/l).
En el seguimiento se deben determinar las concentraciones circulantes de TSH y T4 libre cada mes y realizar una ecografía y análisis de tiroglobulina trimestralmente (fig. 1).
13. ¿Cuáles son los riesgos perioperatorios de la tiroidectomía durante el embarazo para el feto y la madre?
La cirugía en el primer trimestre implica un riesgo inasumible de aborto espontáneo y alteración de la organogénesis. Por otro lado, la intervención realizada durante el tercer trimestre supone un mayor riesgo de nacimiento pretérmino. Por ello, la tiroidectomía durante el segundo trimestre es la que comporta un menor riesgo para la madre y para el feto32. No obstante, si se interviene durante el embarazo, debe tenerse en cuenta el riesgo de hipotiroidismo (y posible hipoparatiroidismo) materno posquirúrgico.
Manejo de mujeres embarazadas con antecedente de cáncer diferenciado de tiroidesEl manejo de las mujeres con antecedente de cáncer diferenciado de tiroides que buscan una nueva gestación tiene peculiaridades específicas que se deben tener en cuenta. Estas indicaciones se resumen en la tabla 5.
Consideraciones sobre el embarazo y la lactancia en mujeres con antecedente de cáncer diferenciado de tiroides
| Antes de la gestación |
| - Se debe evitar la gestación en los 6-12 meses posteriores a la administración de dosis terapéuticas de radioyodo- El antecedente de tratamiento con radioyodo no condiciona mayor riesgo de infertilidad, aborto, mortalidad neonatal, malformaciones congénitas, parto prematuro, bajo peso al nacer, muerte durante el primer año de vida ni desarrollo de cáncer- El embarazo no supone un riesgo de recurrencia en mujeres sin evidencia de enfermedad bioquímica o estructural previa a la gestación. Sin embargo, puede representar un estímulo en pacientes con enfermedad activa |
| Seguimiento durante la gestación |
| - En cualquier mujer con hipotiroidismo resulta crucial mantener una concentración de hormonas tiroideas adecuadas al momento de la gestación en el que se encuentre- Pacientes de bajo riesgo: solo requieren la monitorización de TSH y el ajuste de tratamiento cuando sea necesario junto con una exploración cada 3 meses- Pacientes de alto riesgo: si antes de la gestación el riesgo de la enfermedad aconsejaba necesario mantener suprimida la TSH, se deberá mantener la misma recomendación durante el embarazo, ajustando la dosis de levotiroxina. En mujeres que presentan niveles elevados de tiroglobulina antes de la gestación o con datos morfológicos de persistencia de enfermedad deberá realizarse ecografía cervical en cada trimestre |
| Seguimiento durante la lactancia |
| - La lactancia puede llevarse a cabo de forma segura en mujeres con antecedente de cáncer diferenciado de tiroides- Es necesario tener en cuenta que no debe administrarse radioyodo durante la lactancia y tampoco hasta pasadas al menos 4 semanas del cese de la misma |
14. ¿Qué información debemos proporcionar a la mujer con antecedente de cáncer diferenciado de tiroides y deseo gestacional?
Debe informarse a la mujer que debería evitar la gestación en los 6-12meses posteriores a la administración de la dosis terapéutica de radioyodo, con objeto de conseguir la estabilización de la dosis de levotiroxina y verificar la remisión de la enfermedad2,33–35.
15. ¿Qué riesgos puede tener por haber recibido tratamiento con radioyodo con anterioridad?
Los estudios realizados en mujeres a las que se había administrado radioyodo con anterioridad para el tratamiento del cáncer diferenciado de tiroides no han observado mayor riesgo de complicaciones, tales como infertilidad, aborto, mortalidad neonatal, malformaciones congénitas, parto prematuro, bajo peso al nacer, muerte durante el primer año de vida o desarrollo de cáncer36,37.
16. Un nuevo embarazo ¿puede aumentar el riesgo de recurrencia en mujeres con antecedente de cáncer de tiroides?
En muchas ocasiones el principal interés de la mujer reside en conocer si existe o no la posibilidad de recurrencia del cáncer como consecuencia de una nueva gestación.
Desde el punto de vista fisiopatológico hay que tener en cuenta que durante el embarazo tanto la hCG como los estrógenos producen cambios en la concentración sérica de TSH, T4L y tiroglobulina7,38. Existen datos que apoyan que los estrógenos pueden estimular la expresión del gen de la tiroglobulina, especialmente durante el tercer trimestre, lo que aumentaría la potencial producción de tiroglobulina en el cáncer diferenciado de tiroides. Esto tiene lugar sin estimular el protooncogén c-Myc y sin promover una rápida proliferación celular39,40. Además, algunos estudios clínicos sugieren que la concentración circulante de tiroglobulina puede elevarse sin que exista un tumor concomitante, lo que puede constituir un elemento de confusión40,41.
Varios estudios han evaluado la repercusión del embarazo en mujeres con antecedente de cáncer diferenciado de tiroides, 3 de ellos publicados en los últimos 5 años40,42–44. Leboeuf et al.40 estudiaron 36mujeres que se habían quedado embarazadas a los 4,3años de media tras el tratamiento inicial del cáncer diferenciado de tiroides. Tras el parto, 8 de ellas tenían valores de tiroglobulina un 20% mayor que los que presentaban antes de la gestación. De estas mujeres, 3 tenían enfermedad activa y 5 no tenían evidencia de enfermedad. Sin embargo, no se detectó recurrencia en el posparto inicial en las mujeres con ecografía cervical negativa cuyos valores de tiroglobulina sérica eran menores de 3,2ng/ml.
Por los datos de estos estudios se puede deducir que el embarazo no supone un riesgo de recurrencia en mujeres sin evidencia de enfermedad bioquímica o estructural previa a la gestación. Sin embargo, como se ha indicado anteriormente (pregunta 11), no está completamente descartado que el embarazo pueda representar un estímulo en pacientes con enfermedad activa1.
Seguimiento durante el embarazo de la mujer con antecedente de cáncer diferenciado de tiroidesEn cualquier mujer con hipotiroidismo resulta crucial mantener unos niveles de hormonas tiroideas ajustados a los valores de referencia específicos a lo largo de la gestación. Diversos estudios han demostrado que incluso un hipotiroidismo leve se asocia con efectos adversos para la madre y el feto45. Habitualmente las necesidades de sustitución de hormonas tiroideas aumentan de un 20% a un 40%, siendo imprescindible el ajuste en las primeras semanas46,47. Además, otros suplementos que se utilizan habitualmente, tales como hierro y calcio, pueden alterar la absorción de la levotiroxina.
17. ¿Cómo se debe ajustar la dosis de levotiroxina?
Siempre deben evaluarse los valores de hormonas tiroideas en el momento que se confirme la gestación. En principio, deberían repetirse los análisis de función tiroidea cada 4semanas hasta las semanas 16-20 y posteriormente una vez entre la semana 26 y la 32. En caso de que se precise ajustar la dosis de levotiroxina, deben reevaluarse las hormonas tiroideas 4semanas después1.
Como información orientativa, la media de aumento de la dosis de levotiroxina sobre la dosis pregestacional a lo largo de los 3 trimestres de la gestación es del 9, del 21 y del 26%, respectivamente.
18. ¿Es necesario mantener la supresión de TSH durante la gestación?
El objetivo con respecto a los valores de TSH durante el embarazo no cambia con respecto a la situación preconcepcional. En las pacientes de bajo riesgo (T1-T2, N0, M0, sin histología agresiva) el objetivo es alcanzar concentraciones de TSH entre 0,3-1,5mU/l. En las pacientes sin enfermedad bioquímica o estructural evidente, pero que tuvieron factores de riesgo en el diagnóstico (T3-4, N1, M1 o con histología agresiva), el objetivo es mantener cifras circulantes de TSH entre 0,1-0,5mU/l. Sin embargo, es importante tener en cuenta que si el riesgo de la enfermedad antes de la gestación aconsejaba mantener los valores de TSH circulante suprimidos, se deberá mantener la misma precaución durante el embarazo, ajustando la dosis de levotiroxina convenientemente1. Sobre los posibles efectos adversos de esta medida, resultó muy ilustrativo un estudio realizado en 25.765mujeres, de las cuales 433 tenían hipertiroidismo subclínico. En ninguna de ellas los valores bajos de TSH se correlacionaron con efectos adversos48.
19. ¿Deben utilizarse suplementos de yodo?
A pesar del antecedente de tiroidectomía, las pacientes con antecedente de cáncer de tiroides, como el resto de las mujeres embarazadas, deben mantener una ingesta mínima de 250μg/día de yodo durante el embarazo y la lactancia49. En estos casos los suplementos de yodo se administran a la madre pensando en las necesidades del tiroides del feto1.
20. ¿Cómo debe realizarse el seguimiento?
La mayoría de las gestantes con cáncer diferenciado de tiroides de bajo riesgo solo requieren la monitorización de la concentración circulante de TSH y el ajuste de tratamiento, cuando sea necesario, junto con una exploración cada 3meses45. En estos casos no se requiere ni determinación de tiroglobulina ni realización de ecografía1.
Sin embargo, en mujeres que presentan valores elevados de tiroglobulina antes de la gestación o con datos morfológicos de persistencia de enfermedad deberá realizarse un seguimiento con determinación de tiroglobulina y realización de una ecografía cervical en cada trimestre del embarazo1.
Manejo durante la lactancia de la mujer con antecedente de cáncer diferenciado de tiroides21. ¿Qué consideraciones hay que tener en cuenta durante la lactancia?
La lactancia puede llevarse a cabo de forma segura en mujeres con antecedente de cáncer diferenciado de tiroides15. Sin embargo, es necesario tener en cuenta que no debe administrarse radioyodo durante la lactancia y tampoco hasta pasadas al menos 4 semanas del cese de la misma2, ya que la mama lactante concentra una cantidad considerable de yodo15. No obstante, es deseable retrasar 3meses la administración del radiofármaco tras cesar la lactancia, para asegurar que el incremento que produce la lactancia en la mama de la actividad del symporter sodio-yodo haya vuelto a la normalidad50. Si el tratamiento fuera urgente podría realizarse una gammagrafía con 123I para valorar la captación residual de la mama, de tal forma que una concentración de radiactividad por encima de lo normal debería retrasarlo.
La involución de la mama lactante es variable y existen datos de que la bromocriptina consigue acelerarla51. Este fármaco puede prescribirse en casos concretos como «uso fuera de indicación»15. Por supuesto, tampoco puede reanudarse la lactancia después de la administración del radioyodo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los otros miembros del Grupo de Trabajo de Cáncer de Tiroides de la Sociedad Española de Endocrinología y Nutrición son: Elías Álvarez García, Emma Anda Apiñaniz, Amparo Calleja, Sergio Donnay, José Manuel Gómez-Sáez, Edelmiro Menéndez Torre, Pablo Moreno Llorente, María Angustias Muros, Elena Navarro González, Vicente Pereg, Begoña Pérez Corral, Javier Santamaría Sandi, Pilar Santisteban y Carles Zafón Llopis.