Estudiar la frecuencia de hígado graso no alcohólico (HGNA), su relación con variables clínicas y bioquímicas, y el efecto de la intervención durante 12 meses en el estilo de vida en niños y adolescentes obesos.
MétodosSe seleccionaron 36 pacientes obesos entre 7 y 18 años, 42% femeninos y 58% masculinos, 72,2% prepuberales y 27,8% puberales. Antes y 12 meses después de intervención sobre dieta y actividad física, se tomaron medidas antropométricas y se cuantificaron glucosa e insulina (basal y poscarga de glucosa), perfil lipídico, proteína C reactiva y aminotransferasas. Se realizó ecografía hepática para determinar presencia de HGNA.
ResultadosEl 66,7% (n=24) presentó HGNA, 30,6% de grado leve, 27,8% moderado y 8,3% grave. Aquellos con HGNA tenían índice de masa corporal (IMC; p=0,007), circunferencia abdominal (p=0,005), área grasa (p=0,002), insulina basal (p=0,01) y HOMA-IR (p=0,008) más altos, y QUICKI (p=0,02) más bajo, que aquellos sin HGNA. Con la intervención, la actividad física aumentó (p=0,0001) y la ingesta calórica se mantuvo igual; el HGNA desapareció en 9 pacientes (37,5%; p=0,02) y en 3 mejoró el grado de alteración (12,5%). Además, el Z-Score del IMC (p=0,005), el área grasa (p=0,0001), la insulina basal (p<0,05), la resistencia a la insulina (p<0,005), el perfil lipídico (p<0,03) y las transaminasas disminuyeron. La disminución de peso fue la principal variable explicativa de la mejoría del HGNA.
ConclusiónEn este grupo de niños y adolescentes obesos se observó una alta frecuencia de HGNA. La intervención en estilo de vida con reducción de peso es efectiva en el tratamiento del HGNA.
To study the frequency of non-alcoholic fatty liver disease (NAFLD), its relationship to clinical and biochemical variables, and the effect 12-month's lifestyle intervention in obese children and adolescents.
MethodsThirty-six obese patients aged 7 to 18 years, 42% female and 58% male, 72.2% prepubertal and 27.8% pubertal, were selected. Anthropometric measurements and glucose, insulin (baseline and after a glucose load), lipid profile, C-reactive protein, and aminotransferase tests were performed before and 12 months after dietary and physical activity intervention. Liver ultrasound was performed to determine the presence of NAFLD.
ResultsNAFLD was found in 66.7% (n=24), and was mild in 30.6%, moderate in 27.8%, and severe in 8.3%. Subjects with NAFLD had higher body mass index (BMI, p=0.007), waist (p=0.005), fat area (p=0.002), basal insulin (p=0.01), and HOMA-IR (p=0.008) values and lower QUICKI (p=0.02) values than those with no NAFLD. After intervention, physical activity increased (p=0.0001) and calorie intake remained unchanged. NAFLD disappeared in 9 patients (37.5%, p=0.02) and disease severity decreased in 3 patients (12.5%). In addition, BMI Z-score (p=0.005), fat area (p=0.0001), basal insulin (p<0.05), insulin resistance (p<0.005), lipid profile (p<0.03), and transaminases decreased. Weight loss was the main variable accounting for NAFLD improvement.
ConclusionThis group of obese children and adolescents showed a high frequency of NAFLD. The lifestyle intervention with weight reduction is effective for the treatment of NAFLD.
El hígado graso no alcohólico (HGNA) es la acumulación anormal de grasa en los hepatocitos, principalmente en forma de triglicéridos1,2. La historia natural del HGNA va desde la esteatosis simple, que es un trastorno lentamente progresivo, a la esteatohepatitis no alcohólica (EHNA), la fibrosis e incluso la cirrosis3,4. La mayoría de los estudios indica que el HGNA puede desarrollarse muy temprano en la vida, y hay una relación directa con el grado de obesidad5. De hecho, mientras que la frecuencia general de HGNA en niños y adolescentes es de 2,6 a 9,6%, en aquellos con obesidad puede presentarse en el 20 a 80% de los casos6,7. Un estudio previo realizado en Mérida, Venezuela, reportó una frecuencia de 45% de HGNA en niños obesos, sin diferencia en relación al sexo2.
El patrón de oro para el diagnóstico del HGNA es la histología hepática (biopsia)3,8, sin embargo, por la ausencia de invasividad, bajo costo, inocuidad, y alta disponibilidad, la ecografía es el método por imágenes más usado9; además, la ecografía ha demostrado una sensibilidad del 70% y especificidad del 100% con respecto a la biopsia hepática10, y en niños, mostró una excelente correlación con el grado histológico de esteatosis hepática11. La presencia, grado y patrón de elevación de las aminotrasferasas (AST: aspartato aminotransferasa y ALT: alanina amitransferasa) no es específica y hasta el 70% de los pacientes con HGNA no muestran anomalías de las mismas, y su aumento puede hacer sospechar de EHNA12.
El tratamiento del HGNA pediátrico puede revertir el proceso y prevenir su evolución a fibrosis, hipertensión portal y cirrosis. La mayoría de los pacientes con HGNA son obesos, así como resistentes a la insulina, por lo que basados en la comprensión de su fisiopatología, el tratamiento de primera línea es la pérdida de peso mediante una dieta hipocalórica y la práctica de ejercicio aeróbico13. En niños obesos con HGNA, Nobili et al. 200614 y Reinehr et al. 200915 obtuvieron una mejoría del HGNA en el 50 a 60% de los casos, actuando sobre el cambio en el estilo de vida.
Debido al aumento en la frecuencia de obesidad en niños y adolescentes, así como de sus complicaciones16, se propone evaluar un grupo de niños y adolescentes obesos para determinar la presencia de HGNA, su asociación con variables clínicas y bioquímicas, y el efecto de los cambios en el estilo de vida durante un año de seguimiento.
Materiales y métodosSujetosSe realizó un estudio tipo ensayo clínico, no aleatorizado, en el cual el sujeto es su mismo control. De las consultas del Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) y de los Institutos Educativos de la ciudad de Mérida, evaluados en un trabajo anterior16, se seleccionaron 36 pacientes obesos entre 7 y 18 años con un IMC > al percentil (pc) 97 para su edad y sexo, según las tablas de Fundacredesa17. Se excluyeron aquellos con: patologías endocrinas de base, patologías hepáticas agudas o crónicas, síndromes genéticos asociados a obesidad, con tratamientos farmacológicos que interfieran con la función hepática e inmune y el metabolismo de carbohidratos y lípidos; con alguna enfermedad aguda o crónica y con algún impedimento físico que limite el ejercicio. El estudio siguió las recomendaciones éticas de la Declaración de Helsinki y los representantes firmaron el consentimiento informado.
ProtocoloSe obtuvo información sobre datos personales, antecedentes familiares de enfermedades cardiovasculares y metabólicas. Se cuantificaron las horas por semana de ejercicio físico y de actividades sedentarias como televisión y computación. Para explorar los hábitos de alimentación se aplicó la técnica de recordatorio de 24 h. Los participantes, en ropa interior, fueron pesados utilizando una balanza estándar; la talla se determinó con el promedio de 3 medidas realizadas con el estadiómetro de Harpenden. Se calculó el IMC (peso/talla2) y el Z-Score del IMC. Se midió el pliegue del tríceps con el calibrador específico, así como la circunferencia del brazo izquierdo, circunferencia abdominal (CA) y de la cadera, siguiendo las indicaciones del National Health and Nutrition Examination Survey-2000. Se calcularon el índice cintura/cadera (ICC), el área grasa y el área muscular17. Se consideró obesidad abdominal cuando tenía CA > pc 90 de la población multiétnica18. Se midió la tensión arterial y se clasificó de acuerdo a las curvas de Fundacredesa17, como hipertensión arterial (HTA) cuando fue > pc 97 y como TA normal-alta (pre-HTA) cuando se encontró entre el pc 90 y 97 para su edad y sexo.
En ayunas se obtuvo una muestra de sangre para la determinación de glucemia, insulina, lipidograma que incluyó triglicéridos (Tg), colesterol (Ct), C-HDL y C-LDL, proteína C reactiva (PCR), AST y ALT. Se administró una carga de glucosa de 1,75g/kg de peso (máximo de 75g) y se determinaron los valores de glucemia e insulina a las 2 h. La determinación de la glucemia, Ct, Tg y la fracción de C-HDL se realizó por métodos enzimáticos colorimétricos con reactivos de Biosystem en un analizador OLYMPUS AU-640. La fracción de C-LDL se calculó mediante la fórmula de Friedewald: C-LDL=Ct – (Tg/5 + C-HDL). Insulina y PCR ultrasensible se cuantificaron por quimioluminiscencia (Siemens Medical Solutions Diagnostics), con coeficientes de variación interensayo e intraensayo de 6,5 y 5,4% y de 7,5 y 4,1% respectivamente. Las aminotransferasas se determinaron por el método de Reitman S. y Frankel S. El límite superior normal de la AST fue de 40 U/mL y de la ALT de 38 U/mL. Los análisis se realizaron en el Laboratorio de Hormonas del IAHULA. El índice de resistencia insulínica HOMA-IR (Homeostasis Model Assessment-Insulin Resistance) se calculó según la fórmula insulinemia (μU/mL) x glucemia (mmol/L)/ 22,5 y el índice de sensibilidad a la insulina QUICKI (quantitative insulin-sensitivity check index) según 1 / [log (insulina 0min) + log(Glucemia 0min)]. Se diagnosticó hiperglucemia en ayunas o diabetes mellitus (DM) según los criterios de la ADA19; se consideró resistencia a la insulina un HOMA-IR > 2,5 y dislipidemia según los criterios del National Institute of Health 199120. Para el diagnóstico de síndrome metabólico (SM) se utilizaron los criterios de Cook et al. 200321, excepto por el nivel de glucemia en ayunas, donde se usó el punto de corte de 100mg/dl en vez de 110mg/dL. La presencia de 3 o más criterios estableció el diagnóstico.
La ecografía hepática fue realizada por un especialista en gastroenterología pediátrica, se utilizó un equipo marca Esaote Medical con transductor de 5MHz. y software de 4.7. En la evaluación posterior a la intervención, este especialista no disponía de los resultados previos. Se distinguieron 3 grados de HGNA8,22:
HGNA Tipo I. Leve. Caracterizado por un mínimo aumento de la ecogenicidad hepática con preservación de la visualización del diafragma y de los bordes de los vasos intrahepáticos.
HGNA Tipo II. Moderado. Con aumento moderado de la ecogenicidad hepática y pequeña dificultad para la valoración de diafragma y vasos intrahepáticos.
HGNA Tipo III. Grave. Con marcado aumento de la ecogenicidad, escasa o nula visualización de las paredes de los vasos intrahepáticos, del diafragma y de la porción posterior del lóbulo derecho hepático, debido a la pobre penetración del ultrasonido.
Intervención sobre alimentación y ejercicio físicoSe entregó a los participantes y representantes un formato general de recomendaciones nutricionales y de actividad física, con tablas para el registro semanal de peso y horas de actividad física. Se indicó el consumo de porciones menores de alimentos y la disminución en la ingesta de azucares refinados, bebidas carbonatadas, carbohidratos y grasas en general, así como el aumento del consumo de fibra a través de las frutas y vegetales. Se indicó ejercicio físico moderado como caminatas o trotes, o cualquier actividad física de su preferencia, con una duración de 30 minutos diarios o al menos 3 veces a la semana, acompañado de una disminución del tiempo utilizado para ver televisión o video-juegos. Se informó sobre los cambios esperados y se estimuló la participación activa y responsable de los padres y representantes. En 18 sujetos se realizó contaje de número de pasos por día con el uso de un podómetro (Omron model HJ-112INT). La duración de esta intervención en estilo de vida fue de 12 meses, con seguimiento mensual, al cabo de los cuales se repitió la evaluación completa realizada antes de la intervención. Se consideró efecto beneficioso si hubo mejoría parcial o total del HGNA luego de la intervención.
Análisis estadísticoLas variables continuas se presentan en promedio y desviación estándar y las categóricas en número y porcentaje. Para las asociaciones entre las variables categóricas se aplicó el chi cuadrado. Para las diferencias entre las variables categóricas antes y después de la intervención, se aplicó el test de McNemar. La comparación entre las variables continuas se realizó con el test de T de Student para muestras dependientes o independientes según el caso. Se aplicó una regresión logística para determinar cuál de las variables tuvo mayor influencia sobre la mejoría del HGNA. Se consideró significativo una p<0,05.
ResultadosLa edad promedio de los 36 escolares y adolescentes fue 10,59±2,96 años, de los cuales 15 (42%) eran del sexo femenino y 21 (58%) del masculino, 26 (72,2%) prepuberales (estadíos i y ii de Tanner) y 10 (27,8%) puberales (estadíos iii, iv y v de Tanner). Todos eran obesos.
Antes de la intervención, 14 de los participantes (38,9%) presentaron hipercolesterolemia, 8 (22,2%) C-LDL alto, 19 (52,8%) Tg elevados, 27 (75%) C-HDL bajo, 10 (27,8%) tensión arterial elevada, de los cuales 6 presentaron preHTA (pc 90-97) y 4 HTA (> pc 97); 5 (13,9%) resistencia insulínica, 24 (66,7%) obesidad abdominal y 14 (38,9%) SM. En 24 pacientes, el 66,7% se diagnosticó HGNA y en los 12 restantes (33,3%), no se observaron signos ecográficos sugestivos de HGNA. No hubo casos de DM, de hiperglucemia en ayunas o de intolerancia a la glucosa.
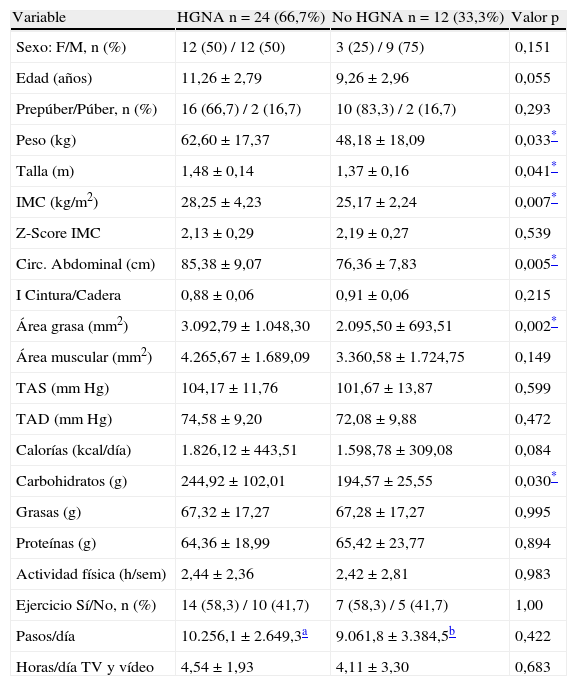
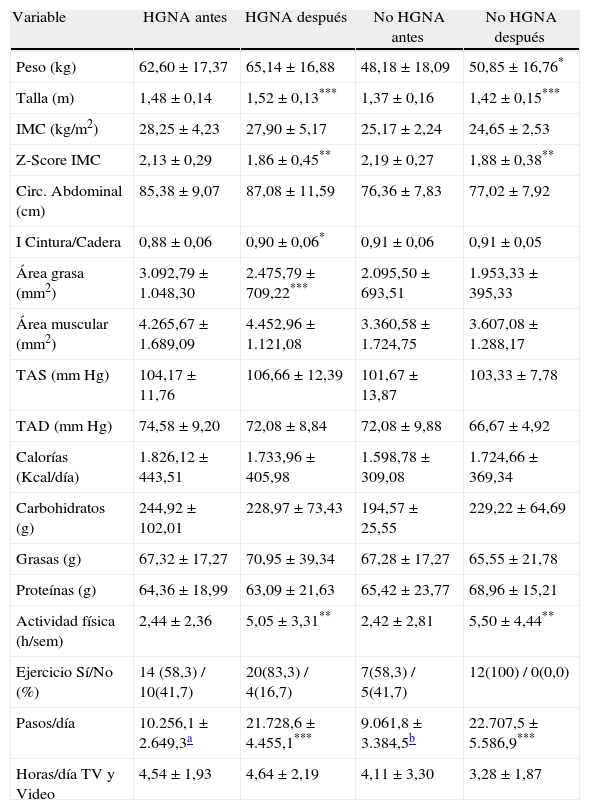
Según la presencia o no de HGNA, antes de la intervención, no se observaron diferencias en edad, sexo, estadío puberal, presión arterial, ingesta calórica total y actividad física. Los valores promedio de peso (p=0,03), talla (p=0,04), IMC (p=0,007), circunferencia abdominal (p=0,005) y área grasa (p=0,002) fueron mayores en aquellos con HGNA. Fue mayor el consumo de carbohidratos en el grupo con HGNA (p=0,03) (tabla 1).
Características clínicas, nutricionales y actividad física de los escolares y adolescentes obesos según la presencia de HGNA, antes de la intervención
| Variable | HGNA n=24 (66,7%) | No HGNA n=12 (33,3%) | Valor p |
| Sexo: F/M, n (%) | 12 (50) / 12 (50) | 3 (25) / 9 (75) | 0,151 |
| Edad (años) | 11,26±2,79 | 9,26±2,96 | 0,055 |
| Prepúber/Púber, n (%) | 16 (66,7) / 2 (16,7) | 10 (83,3) / 2 (16,7) | 0,293 |
| Peso (kg) | 62,60±17,37 | 48,18±18,09 | 0,033* |
| Talla (m) | 1,48±0,14 | 1,37±0,16 | 0,041* |
| IMC (kg/m2) | 28,25±4,23 | 25,17±2,24 | 0,007* |
| Z-Score IMC | 2,13±0,29 | 2,19±0,27 | 0,539 |
| Circ. Abdominal (cm) | 85,38±9,07 | 76,36±7,83 | 0,005* |
| I Cintura/Cadera | 0,88±0,06 | 0,91±0,06 | 0,215 |
| Área grasa (mm2) | 3.092,79±1.048,30 | 2.095,50±693,51 | 0,002* |
| Área muscular (mm2) | 4.265,67±1.689,09 | 3.360,58±1.724,75 | 0,149 |
| TAS (mm Hg) | 104,17±11,76 | 101,67±13,87 | 0,599 |
| TAD (mm Hg) | 74,58±9,20 | 72,08±9,88 | 0,472 |
| Calorías (kcal/día) | 1.826,12±443,51 | 1.598,78±309,08 | 0,084 |
| Carbohidratos (g) | 244,92±102,01 | 194,57±25,55 | 0,030* |
| Grasas (g) | 67,32±17,27 | 67,28±17,27 | 0,995 |
| Proteínas (g) | 64,36±18,99 | 65,42±23,77 | 0,894 |
| Actividad física (h/sem) | 2,44±2,36 | 2,42±2,81 | 0,983 |
| Ejercicio Sí/No, n (%) | 14 (58,3) / 10 (41,7) | 7 (58,3) / 5 (41,7) | 1,00 |
| Pasos/día | 10.256,1±2.649,3a | 9.061,8±3.384,5b | 0,422 |
| Horas/día TV y vídeo | 4,54±1,93 | 4,11±3,30 | 0,683 |
Datos presentados en X±DE y n (%). IMC: índice de masa corporal; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
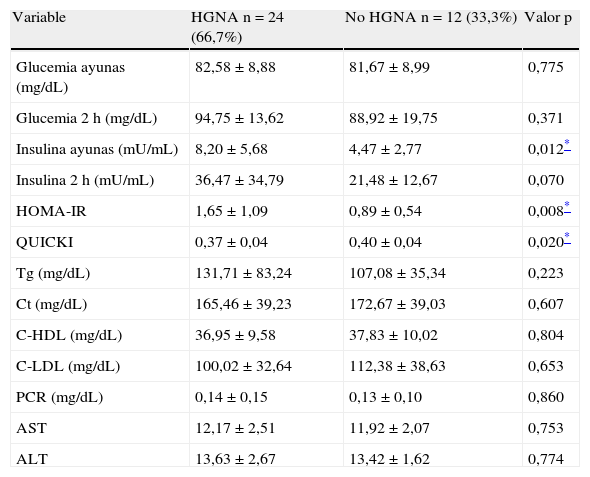
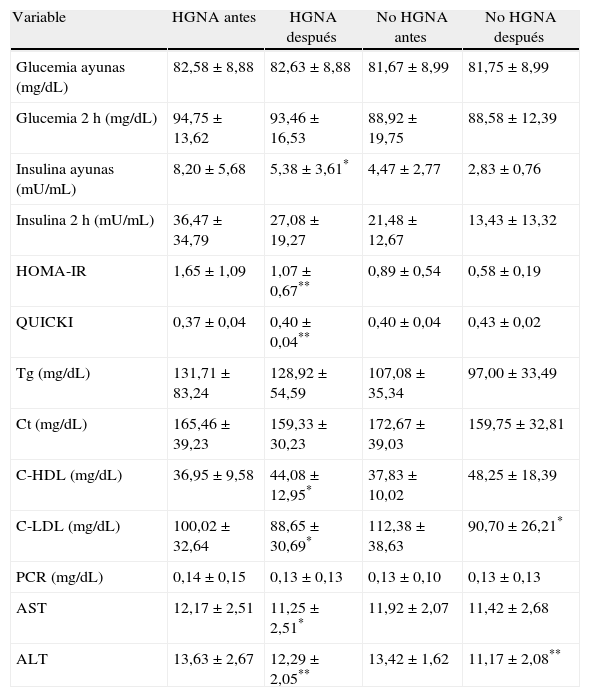
Antes de la intervención, la insulina en ayunas (p=0,01) y el HOMA-IR (p=0,008) fueron mayores y el QUICKI (p=0,02) menor en el grupo con HGNA. La insulina 2 h y los Tg tendieron a ser más altos en el grupo con HGNA, sin alcanzar significancia estadística, mientras que los valores de glucemia, Ct, C-LDL, C-HDL, PCR y transaminasas no fueron diferentes entre los grupos. Ninguno de los pacientes tuvo cifras de transaminasas superiores a los valores de referencia (tabla 2).
Niveles de las variables metabólicas, proteína C reactiva y aminotransferasas en los escolares y adolescentes obesos según la presencia de HGNA, antes de la intervención
| Variable | HGNA n=24 (66,7%) | No HGNA n=12 (33,3%) | Valor p |
| Glucemia ayunas (mg/dL) | 82,58±8,88 | 81,67±8,99 | 0,775 |
| Glucemia 2 h (mg/dL) | 94,75±13,62 | 88,92±19,75 | 0,371 |
| Insulina ayunas (mU/mL) | 8,20±5,68 | 4,47±2,77 | 0,012* |
| Insulina 2 h (mU/mL) | 36,47±34,79 | 21,48±12,67 | 0,070 |
| HOMA-IR | 1,65±1,09 | 0,89±0,54 | 0,008* |
| QUICKI | 0,37±0,04 | 0,40±0,04 | 0,020* |
| Tg (mg/dL) | 131,71±83,24 | 107,08±35,34 | 0,223 |
| Ct (mg/dL) | 165,46±39,23 | 172,67±39,03 | 0,607 |
| C-HDL (mg/dL) | 36,95±9,58 | 37,83±10,02 | 0,804 |
| C-LDL (mg/dL) | 100,02±32,64 | 112,38±38,63 | 0,653 |
| PCR (mg/dL) | 0,14±0,15 | 0,13±0,10 | 0,860 |
| AST | 12,17±2,51 | 11,92±2,07 | 0,753 |
| ALT | 13,63±2,67 | 13,42±1,62 | 0,774 |
Datos presentados en X±DE. AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; PCR: proteína C reactiva.
En la tabla 3 se presentan y comparan las características clínicas, nutricionales y actividad física de los escolares y adolescentes obesos al inicio del estudio y a los 12 meses de la intervención, clasificados de acuerdo a la presencia de HGNA. En ambos grupos hubo una disminución del Z-Score del IMC (p<0,005 para ambos), sin cambios en la ingesta calórica. Hubo un aumento de la actividad física (p<0,005 en h/sem y p<0,0001 en pasos/día), sin cambio en las horas de sedentarismo. En los pacientes con HGNA el área grasa disminuyó (p<0,0001), cambio que no fue observado en los pacientes sin HGNA. No se observaron cambios significativos en las demás variables estudiadas.
Características clínicas, nutricionales y actividad física de los escolares y adolescentes obesos según la presencia de HGNA, antes y después de la intervención
| Variable | HGNA antes | HGNA después | No HGNA antes | No HGNA después |
| Peso (kg) | 62,60±17,37 | 65,14±16,88 | 48,18±18,09 | 50,85±16,76* |
| Talla (m) | 1,48±0,14 | 1,52±0,13*** | 1,37±0,16 | 1,42±0,15*** |
| IMC (kg/m2) | 28,25±4,23 | 27,90±5,17 | 25,17±2,24 | 24,65±2,53 |
| Z-Score IMC | 2,13±0,29 | 1,86±0,45** | 2,19±0,27 | 1,88±0,38** |
| Circ. Abdominal (cm) | 85,38±9,07 | 87,08±11,59 | 76,36±7,83 | 77,02±7,92 |
| I Cintura/Cadera | 0,88±0,06 | 0,90±0,06* | 0,91±0,06 | 0,91±0,05 |
| Área grasa (mm2) | 3.092,79±1.048,30 | 2.475,79±709,22*** | 2.095,50±693,51 | 1.953,33±395,33 |
| Área muscular (mm2) | 4.265,67±1.689,09 | 4.452,96±1.121,08 | 3.360,58±1.724,75 | 3.607,08±1.288,17 |
| TAS (mm Hg) | 104,17±11,76 | 106,66±12,39 | 101,67±13,87 | 103,33±7,78 |
| TAD (mm Hg) | 74,58±9,20 | 72,08±8,84 | 72,08±9,88 | 66,67±4,92 |
| Calorías (Kcal/día) | 1.826,12±443,51 | 1.733,96±405,98 | 1.598,78±309,08 | 1.724,66±369,34 |
| Carbohidratos (g) | 244,92±102,01 | 228,97±73,43 | 194,57±25,55 | 229,22±64,69 |
| Grasas (g) | 67,32±17,27 | 70,95±39,34 | 67,28±17,27 | 65,55±21,78 |
| Proteínas (g) | 64,36±18,99 | 63,09±21,63 | 65,42±23,77 | 68,96±15,21 |
| Actividad física (h/sem) | 2,44±2,36 | 5,05±3,31** | 2,42±2,81 | 5,50±4,44** |
| Ejercicio Sí/No (%) | 14 (58,3) / 10(41,7) | 20(83,3) / 4(16,7) | 7(58,3) / 5(41,7) | 12(100) / 0(0,0) |
| Pasos/día | 10.256,1±2.649,3a | 21.728,6±4.455,1*** | 9.061,8±3.384,5b | 22.707,5±5.586,9*** |
| Horas/día TV y Video | 4,54±1,93 | 4,64±2,19 | 4,11±3,30 | 3,28±1,87 |
Datos presentados en X±DE. IMC: índice de masa corporal; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
En el grupo con HGNA, las variables metabólicas que mejoraron con la intervención fueron la insulina en ayunas (p<0,05), el HOMA-IR (p<0,005), el QUICKI (p<0,005), el C-HDL (p<0,005), el C-LDL (p<0,005), la AST (p<0,05) y la ALT (p<0,005). En aquellos sin HGNA también se observó una mejoría en las variables metabólicas, sin embargo, la diferencia solo fue significativa para el C-LDL (p<0,05) y la ALT (p<0,005) (tabla 4).
Niveles de las variables metabólicas, proteína C reactiva y aminotransferasas en los escolares y adolescentes obesos según la presencia de HGNA, antes y después de la intervención
| Variable | HGNA antes | HGNA después | No HGNA antes | No HGNA después |
| Glucemia ayunas (mg/dL) | 82,58±8,88 | 82,63±8,88 | 81,67±8,99 | 81,75±8,99 |
| Glucemia 2 h (mg/dL) | 94,75±13,62 | 93,46±16,53 | 88,92±19,75 | 88,58±12,39 |
| Insulina ayunas (mU/mL) | 8,20±5,68 | 5,38±3,61* | 4,47±2,77 | 2,83±0,76 |
| Insulina 2 h (mU/mL) | 36,47±34,79 | 27,08±19,27 | 21,48±12,67 | 13,43±13,32 |
| HOMA-IR | 1,65±1,09 | 1,07±0,67** | 0,89±0,54 | 0,58±0,19 |
| QUICKI | 0,37±0,04 | 0,40±0,04** | 0,40±0,04 | 0,43±0,02 |
| Tg (mg/dL) | 131,71±83,24 | 128,92±54,59 | 107,08±35,34 | 97,00±33,49 |
| Ct (mg/dL) | 165,46±39,23 | 159,33±30,23 | 172,67±39,03 | 159,75±32,81 |
| C-HDL (mg/dL) | 36,95±9,58 | 44,08±12,95* | 37,83±10,02 | 48,25±18,39 |
| C-LDL (mg/dL) | 100,02±32,64 | 88,65±30,69* | 112,38±38,63 | 90,70±26,21* |
| PCR (mg/dL) | 0,14±0,15 | 0,13±0,13 | 0,13±0,10 | 0,13±0,13 |
| AST | 12,17±2,51 | 11,25±2,51* | 11,92±2,07 | 11,42±2,68 |
| ALT | 13,63±2,67 | 12,29±2,05** | 13,42±1,62 | 11,17±2,08** |
Datos presentados en X±DE.
*p<0,05; **p<0,005 versus antes de la intervención.
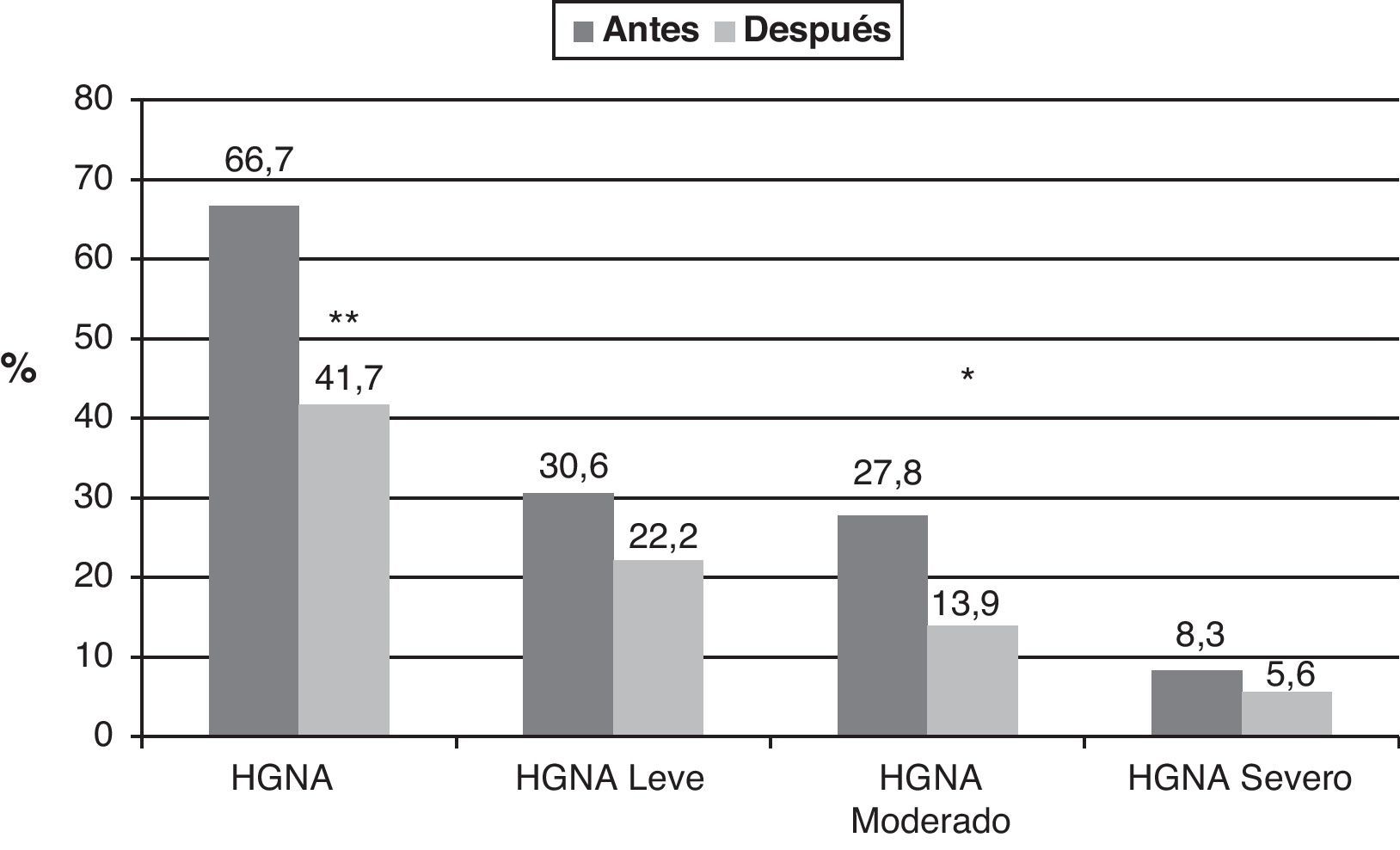
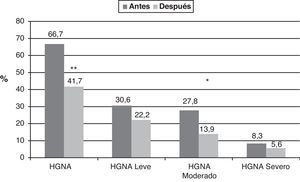
De los 36 niños y adolescentes obesos, 24 (66,7%) presentaban HGNA antes de la intervención; después de la intervención este persistió en 15 (41,7%) y desapareció en 9 de ellos (37,5%) (p=0,004) (fig. 1). Con respecto al grado de alteración, en los 24 pacientes con HGNA, antes de la intervención, el 30,6% (n=11) tenía HGNA de grado leve, el 27,8% (n=10) moderado y el 8,3% (n=3) grave; después de la intervención se obtuvo una mejoría significativa (p=0,03), donde, el 22,2% (n=8) presentó HGNA leve, el 13,9% (n=5) moderado y el 5,6% (n=2) grave. Hubo 3 pacientes en los que no desapareció el HGNA, pero mejoraron su grado de alteración. La mejoría del HGNA fue independiente del sexo y el estadio puberal.
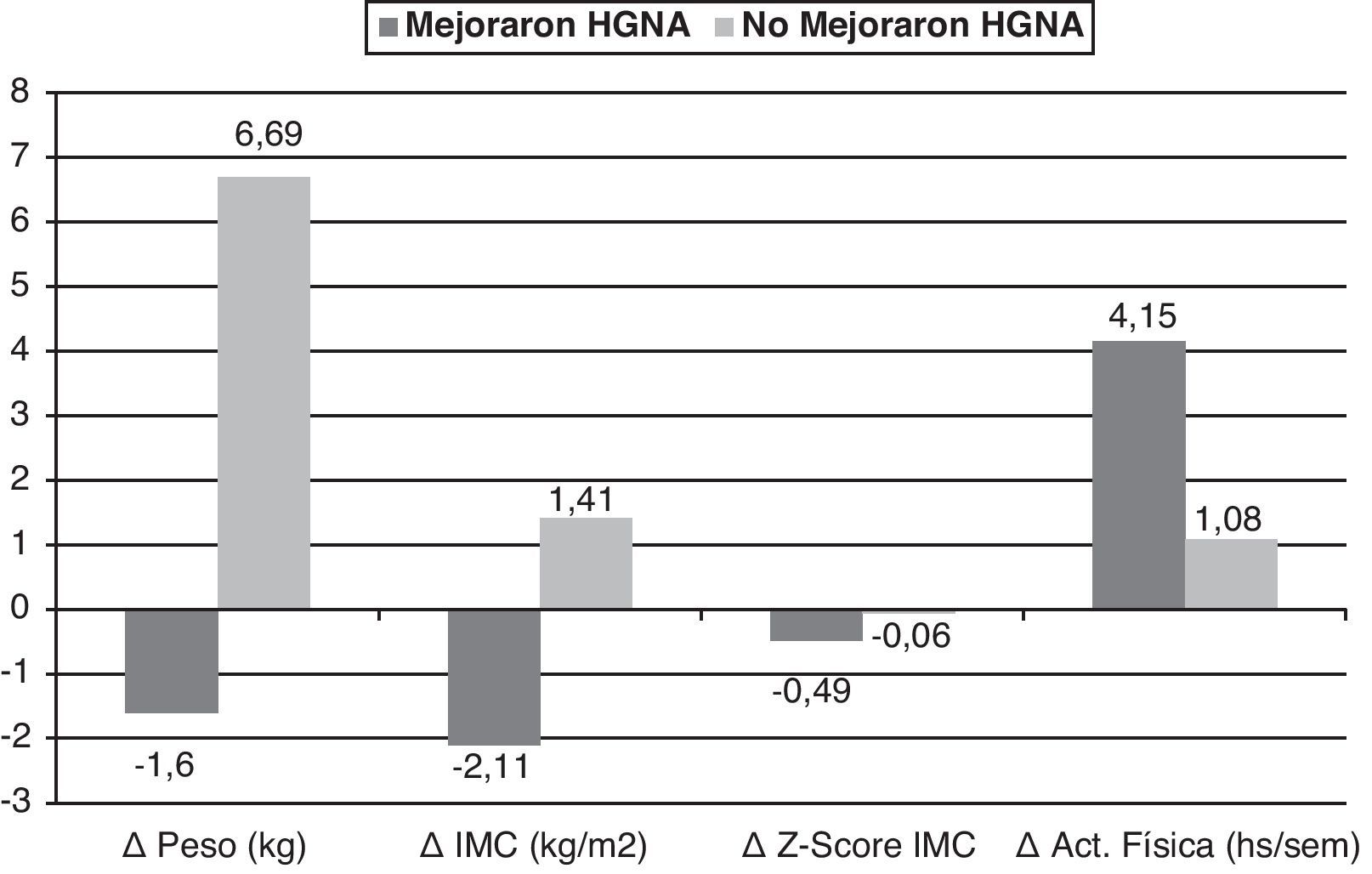
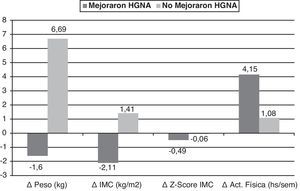
En la figura 2 se muestran los cambios significativos obtenidos en el delta de las variables en los participantes clasificados de acuerdo a la mejoría (n=12) o no (n=12) del HGNA con la intervención. Los cambios fueron el Δpeso y el ΔIMC, los cuales disminuyeron en el grupo que mejoró del HGNA y aumentaron en el que no mejoró (p=0,0001 para ambas variables) y el ΔZ-Score IMC cuya disminución fue mayor en el grupo que mejoró del HGNA (p=0,002). La actividad física aumentó más en el grupo que mejoró del HGNA (p=0,056). En el análisis de regresión logística, con la mejoría y no mejoría del HGNA como variable dependiente, se observó que la mejor variable explicativa fue el cambio del peso (Δ Peso), con un R cuadrado de 0,634, esto es, una explicación del 63% del cambio y una probabilidad de mejoría del HGNA 1,68 veces mayor en el grupo que logró disminuir de peso (Odds ratio: 1,682, IC: 1,072-2,639; p=0,024).
DiscusiónEl HGNA se ha convertido en la causa más común de enfermedad hepática en niños, especialmente aquellos obesos5,15,23. La prevalencia de HGNA es variable dependiendo del método diagnóstico, histología o ecografía hepática. En general, los estudios indican un aumento de la prevalencia de 2,6% hace una década24 a 5% en niños con normopeso, 38% en niños obesos8, y 48% en los niños con diabetes tipo 225. Pacheco et al. 20067 en Cuba, comunicaron una frecuencia de 48% de HGNA en niños y adolescentes obesos. En nuestro estudio, la realización del ultrasonido hepático permitió identificar una alta prevalencia de HGNA, en un 66,7% de los niños y adolescentes obesos. Estos resultados, al igual que otros en la literatura26, indican una asociación muy alta entre HGNA y obesidad.
Estudios iniciales reportaron una mayor frecuencia de HGNA en mujeres, luego se encontró una mayor frecuencia en hombres; sin embargo, estudios más recientes no obtuvieron diferencias en relación al sexo2,7,27. En concordancia con estos últimos, en nuestro estudio no se encontró relación entre HGNA y el sexo o el desarrollo puberal.
En nuestro estudio, todos los niños eran obesos. Sin embargo, aquellos con HGNA mostraron mayor peso, IMC, CA, área grasa, mayor consumo de carbohidratos, y mostraron niveles más altos de insulina basal y de resistencia a la insulina, sin diferencias en la concentración de las aminotransferasas ni de la PCR, en comparación con aquellos sin HGNA, lo que demuestra una relación de HGNA con mayor adiposidad, resistencia a la insulina y peores hábitos de alimentación. Cabe destacar que el 20% (5/24) de nuestros pacientes con HGNA tenían niveles de HOMA-IR superior a 2,5, mientras que entre los pacientes obesos sin HGNA, ninguno presentaba resistencia a la insulina. Estos resultados están en acuerdo con los de Burgert et al. 200628, quienes reportaron que un aumento en la fracción grasa del hígado en adolescentes obesos, estaba asociada con disminución de la sensibilidad a la insulina, y difieren de los obtenidos por Reinehr et al.15, quienes no encontraron relación entre la presencia de HGNA y la resistencia a la insulina. Cabe destacar que, aunque los niveles de HOMA-IR son mayores en los pacientes con HGNA, en general, en nuestros niños obesos, como se ha mencionado en trabajos previos en nuestra ciudad28,29, las cifras de HOMA-IR, PCR y transaminasas son mucho más bajas a las reportadas por otros autores en otras partes del mundo30. De hecho, a diferencia de Burgert et al. 200630, ninguno de nuestros pacientes mostró niveles elevados de transaminasas, lo cual ha sido también comunicado por otros12.
Los mecanismos por los cuales la adiposidad excesiva contribuye al HGNA son aún controvertidos. Se ha demostrado que la obesidad, principalmente visceral, y la resistencia a la insulina, asociada a la misma, debido al desbalance en la producción de citoquinas (aumento del factor de necrosis tumoral alfa y disminución de adiponectina, entre otros), conllevan a lipólisis, la cual incrementa los ácidos grasos circulantes que son llevados al hígado a través de la vena portal, produciendo sobrecarga de la betaoxidación y acumulación de los ácidos grasos en el hepatocito31. Por estos hechos, en la actualidad se reconoce al HGNA como una consecuencia de la resistencia a la insulina.
La mayoría de los estudios de intervención combinan cambios en la dieta con el ejercicio aeróbico en diferentes intervalos y niveles variables de supervisión, y apoyan el hecho de que incluso pequeños grados de pérdida de peso de alrededor de un 5-10%, muestran un claro beneficio14,29,32. Los resultados de nuestra investigación asemejan a lo reportado en población adulta en la literatura internacional, pues después de un año de intervención a través de dieta y ejercicio físico, se observó un descenso del Z-Score del IMC, una disminución significativa del área grasa y un aumento significativo de la actividad física, lo cual, trajo como consecuencia una mejoría de las variables metabólicas como colesterol total, C-HDL, C-LDL, insulina, enzimas hepáticas y en la sensibilidad a la insulina, tal como lo indica, una disminución significativa del HOMA-IR y un aumento del estimado aritmético relacionado con la sensibilidad a la insulina, QUICKI. Estos cambios fueron mayores en el grupo que presentaba HGNA, los cuales a su vez, eran los que basalmente mostraban mayores alteraciones.
La ecogenicidad hepática postintervención reveló una resolución completa del HGNA en 9 pacientes y mejoría en 3 de ellos, es decir un efecto beneficioso en el 50% de los casos de HGNA, similar a lo reportado por Ueno et al.33 y Reinher et al.15. Se pudo evidenciar que la disminución del peso y del IMC fueron las variables que marcaron la diferencia entre los niños y adolescentes que mejoraron del HGNA, en comparación con los que no mejoraron, y específicamente la disminución del peso, que apenas fue del 1,7% en estos niños, fue la mejor variable explicativa de esta mejoría, de acuerdo al análisis de regresión logística. Este hallazgo está de acuerdo con lo reportado por Huang et al.34 en pacientes con esteatohepatitis no alcohólica por histología hepática y por Reihner et al.15 en pacientes con HGNA diagnosticado por ecografía.
En adultos, un bajo nivel de ejercicio está positivamente relacionado con una mayor mortalidad y morbilidad cardiovascular, hecho demostrado también en niños y adolescentes35. Además, un estilo de vida sedentario con escasa actividad física, independientemente de la dieta, representa otro factor determinante para el HGNA. En particular, la intervención moderada del estilo de vida con estrategias destinadas a la reducción de peso por restricción de la ingesta de grasa total y saturada, junto con un incremento del ejercicio físico, se considera actualmente, la terapia de primera línea12,32,36. En nuestro estudio, fue evidente el aumento de la actividad física, medida tanto por las horas por semana como por los pasos por día, más que el cambio en la ingesta calórica, la cual no disminuyó significativamente pero se mantuvo, lo que relativamente se traduce en mejoría de la alimentación, considerando que son niños y adolescentes en crecimiento, lo cual trajo finalmente el beneficio sobre la reducción del peso e IMC.
Nuestro estudio muestra una alta frecuencia de HGNA en este grupo de niños y adolescentes obesos, y demuestra que un programa de asesoramiento sencillo en estilo de vida, que consiste en dieta y ejercicio físico, mejora de forma importante la sensibilidad a la insulina en el músculo, reduce la grasa visceral y disminuye la ecogenicidad hepática en la ecografía, lo que pone de relieve los posibles beneficios del asesoramiento del estilo de vida como una modalidad de tratamiento útil. Estos hallazgos nos permiten afirmar que la reducción del peso que produjo el tratamiento dietético, aunado a un incremento de la actividad física, tuvo efecto favorable en la mejoría del HGNA.
FinanciaciónEste estudio recibió financiación del Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad de Los Andes, Códigos: M-1013-11-07-AA y ADG- M-10.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.