La coexistencia de hipertiroidismo con la gestación no es un fenómeno excepcional. Cuando esto curre la repercusión es tanto materna como fetal e incluso, tras el parto, puede afectar al neonato y a la puérpera. El manejo clínico de esta situación es radicalmente distinto al del hipertiroidismo de la no gestante y plantea importantes retos tanto desde el punto de vista diagnóstico como terapéutico.
En esta revisión se examinan los aspectos relacionados con las peculiaridades de la valoración bioquímica de la función tiroidea en el embarazo, las diferentes posibilidades etiológicas ante la aparición de un hipertiroidismo en la gestación y el enfoque clínico terapéutico en cada caso. Se dedica especial atención a la gestación complicada con una enfermedad de Graves diferenciando su repercusión a distintos niveles: materno, fetal, neonatal y puerperal.
Association of hyperthyroidism and pregnancy is not an unusual event, and has an impact on both the mother and fetus. After delivery, it may also affect the newborn and the nursing mother. Clinical management of this situation is quite different from that required by non-pregnant hyperthyroid women and poses significant diagnostic and therapeutic challenges.
This review addresses aspects related to the unique characteristics of biochemical assessment of thyroid function in pregnancy, the potential causes of hyperthyroidism in pregnancy, and the clinical and therapeutic approach in each case. Special attention is paid to pregnancy complicated with Graves’ disease and its different the maternal, fetal, neonatal, and postnatal consequences.
La prevalencia de alteraciones en la función tiroidea en la mujer es muy elevada (un 5/1.000 de hipotiroidismo y un 3/1.000 de hipertiroidismo1), y puesto que muchos de estos cuadros se presentan en edad fértil no es extraño que la gestación se pueda asociar a estas enfermedades. Además, a medida que se va extendiendo la práctica clínica de realizar determinaciones de hormonas tiroideas (HT) en las gestantes, se van detectando cada vez más anomalías en la funcionalidad tiroidea de la embarazada que, en otras circunstancias, hubieran pasado desapercibidas.
Por otro lado, la función tiroidea materna experimenta modificaciones importantes durante el embarazo que se traducen en variaciones en los diferentes parámetros analíticos. Esta circunstancia obliga a emplear un enfoque diferente al de las no gestantes a la hora de interpretar los distintos parámetros de función tiroidea, para evitar diagnósticos y valoraciones erróneas con consecuencias potencialmente graves.
Como consecuencia de todo lo anterior, durante los últimos años se ha despertado el interés por la fisiología y las posibles alteraciones tiroideas en la gestación2. Dentro de estas, hemos revisado los aspectos relacionados con el hipertiroidismo en la gestación, los retos que plantea y sus posibles consecuencias tanto durante el embarazo (en la madre y/o el feto), como tras el parto (en la puérpera y/o en el neonato).
Valoración funcional del tiroides en la gestaciónDurante la gestación se producen importantes modificaciones fisiológicas3,4 que tienen una enorme repercusión en los diferentes parámetros maternos de función tiroidea, como se expone a continuación:
- -
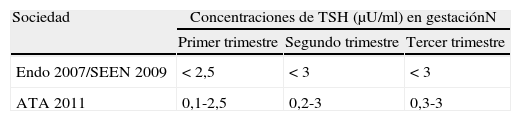
TSH. Tradicionalmente se ha podido observar que las concentraciones de TSH están disminuidas en cualquier periodo de la gestación en comparación con las concentraciones de la no gestante5, con un mínimo en el primer trimestre para posteriormente ir aumentando en el segundo y tercer trimestre. Esta evolución en las concentraciones de TSH refleja de forma especular las modificaciones en las concentraciones de la hormona gonadotrofina coriónica (HCG) que alcanza un máximo en el primer trimestre para luego ir disminuyendo. Es por esto por lo que las diferentes sociedades han establecido unos valores normales de referencia6–8 (tabla 1).
Hay que tener en cuenta que, en las gestaciones múltiples, la disminución de las concentraciones de TSH es aun mayor y que las gestantes fumadoras presentan concentraciones de TSH inferiores durante el primer y tercer trimestre9.
- -
TBG-T4T. El incremento estrogénico que acompaña a la gestación aumenta las concentraciones de TBG y consecuentemente los valores de T4T. Sin embargo, la variación de las concentraciones de T4T es muy constante (aumenta un 150%) e independiente del trimestre y del método empleado, por lo que aplicando un factor de 1,5 a los límites de referencia de la no gestante podríamos valorar la producción de T4 por parte de la embarazada si dispusiéramos de T4T.
- -
T4L. La mayoría de las determinaciones de T4 libre (T4L) empleadas en la práctica clínica no son realizadas mediante el gold standard del equilibrio de diálisis o ultrafiltración. Habitualmente se emplea un sistema de inmunoensayo en el que la T4L es un valor no directamente cuantificado, sino más bien estimado a través de un método que es proteínsensible (influido por TBG y albúmina) y por tanto se ve profundamente modificado por la gestación, variando además según el trimestre. Además, cada método de ensayo tiene variaciones específicas. Esto significa que, para una interpretación adecuada de T4L en la gestación, sería preciso disponer de valores de referencia según edad gestacional y método empleado, como advierte la American Thyroid Association (ATA)6.
Como podemos ver en la tabla 2, el hipertiroidismo durante la gestación puede tener consecuencias graves tanto para la madre como para el feto y, tras el parto, para el neonato10–12. Hay que añadir que recientemente se ha descrito un incremento del riesgo de trombosis en el hipertiroidismo endógeno13 al parecer reversible con el control del hipertiroidismo. Si tenemos en cuenta que la gestación por si misma presenta un incremento tanto en la trombosis venosa profunda como en el tromboembolismo pulmonar14, deberemos mantener un alto índice de sospecha para detectar precozmente esta complicación y posiblemente sería prudente plantearse medidas de profilaxis.
Repercusiones maternofetales del hipertiroidismo
| Maternas |
| Aborto |
| Preeclampsia (multiplica el riesgo × 5)7 |
| Parto pretérmino (multiplica el riesgo × 10)12 |
| Abruptio placentaria |
| Insuficiencia cardíaca (multiplica el riesgo × 20)12 |
| Tormenta tiroidea (multiplica el riesgo × 10)12 |
| Trombosis venosa13 |
| Fetales |
| Bajo peso nacimiento |
| Crecimiento intrauterino retrasado |
| Prematuridad |
| Pequeño para edad gestacional |
| Muerte fetal |
| Disfunción tiroidea (hiper o hipotiroidismo) |
| Bocio fetal |
| Neonatales |
| Hipertiroidismo transitorio |
| Hipotiroidismo transitorio o permanente |
En la tabla 3 se exponen las diferentes posibilidades diagnósticas ante la aparición de un hipertiroidismo durante la gestación. Por un lado, existen una serie de cuadros originados directamente por la propia gestación y que se pueden englobar bajo el epígrafe tirotoxicosis gestacional transitoria (TGT). Por otro, existe la posibilidad de que cualquier cuadro que origina una hiperfunción tiroidea fuera de la gestación esté también presente durante el embarazo. Finalmente, podemos encontrar un aumento de las concentraciones de HT debido a un aporte exógeno de las mismas.
Clasificación etiológica del hipertiroismo en la gestación
| Tirotoxicosis gestacional transitoria |
| Hiperemesis gravídica |
| Gestación múltiple |
| Hipertiroidismo trofoblástico (mola, coricocarcinoma) |
| Hyperreactio luteinalis |
| Tirotoxicosis familiar gestacional |
| Hiperplacentosis |
| Patología tiroidea |
| Enfermedad de Graves |
| Tiroiditis |
| Bocio multinodular |
| Adenoma tiroideo tóxico |
| Yatrogénica |
| Sobretratamiento |
| Toma inadvertida de hormonas tiroideas (contaminación alimentaria, pastillas adelgazantes, etc.) |
| Facticio |
Esta es la causa más frecuente de hipertiroidismo en la gestación, pudiéndose encontrar en el 1 al 3% de todas las gestaciones15,16. Se ha definido como un hipertiroidismo transitorio limitado a la primera mitad del embarazo y caracterizado por aumento de T4L o T4T (ajustada) con TSH suprimida o indetectable, en ausencia de autoanticuerpos antitiroideos16 o rasgos físico sugerentes de EG17. Habitualmente es el resultado del aumento de las concentraciones de HCG o de su mayor afinidad por los receptores de TSH.
Dentro de este grupo (tabla 3) el cuadro más característico es la HG, pero existen otras situaciones que también cursan con aumento de HCG como son el embarazo múltiple o la enfermedad trofoblástica (mola hidatiforme o coriocarcinoma), con una prevalencia de TGT de hasta el 50%17. Además hay otras causas más infrecuentes como la hiperreactio luteinalis18, caracterizada por la formación de quistes teca luteínicos en el contexto de la gestación, o la hiperplacentosis19, en la que se observa un incremento del peso de la placenta y de la producción de HCG. Existe también un cuadro familiar (la tirotoxicosis familiar gestacional20), en el que debido a una mutación autosómica dominante se produce una hipersensibilidad del receptor de TSH a las concentraciones fisiológicas de HCG; clínicamente se caracteriza por desarrollar TGT en todos las gestaciones y en todas las mujeres de la familia con concentraciones normales de HCG.
Hiperemesis gravídicaDe todas las causas de TGT la más frecuente y habitual es la HG. Se presenta en el 0,5-10/1.000 de las gestaciones21, y el 30-60% de estas cursan con aumento de HT libres y supresión de TSH22. Hay que recordar que el concepto de HG debe restringirse a aquellos cuadros que cursen, en el primer trimestre de gestación, con: vómitos, deshidratación, pérdida de al menos el 5% del peso corporal y cetonuria23.
En estos casos, el hipertiroidismo se caracteriza por supresión de las concentraciones de TSH y mínimo aumento de T4L, con T3L frecuentemente normal. Habitualmente el cuadro de hiperfunción tiroidea, junto con los vómitos acompañantes, ceden espontáneamente antes de la semana 20, siendo suficiente el tratamiento sintomático, con hidratación intravenosa y complejo vitamínico B para prevenir el riesgo excepcional de encefalopatía de Wernicke24. No existe evidencia de que el tratamiento con ATT aporte ningún beneficio25 y se desaconseja su empleo6.
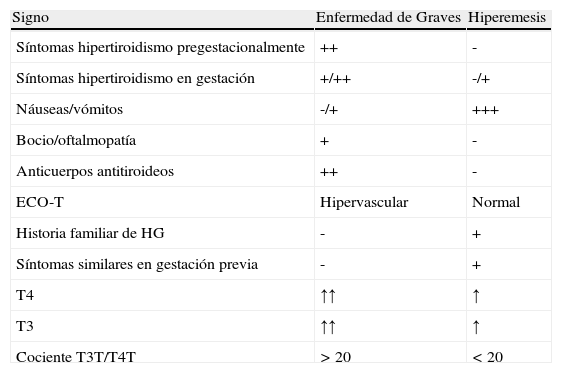
Excepcionalmente una HG con un componente de hiperfunción tiroidea muy llamativo o una EG con intolerancia digestiva (náuseas y vómitos) asociada pueden plantear la duda del diagnóstico diferencial entre ellas. En la tabla 4 se exponen las diferencias fundamentales. De cualquier forma, un cuadro de hipertiroidismo que se prolongase más allá del primer trimestre nos debe hacer sospechar otro origen diferente al de la TGT.
Diferencias entre enfermedad de Graves e hiperemesis
| Signo | Enfermedad de Graves | Hiperemesis |
| Síntomas hipertiroidismo pregestacionalmente | ++ | - |
| Síntomas hipertiroidismo en gestación | +/++ | -/+ |
| Náuseas/vómitos | -/+ | +++ |
| Bocio/oftalmopatía | + | - |
| Anticuerpos antitiroideos | ++ | - |
| ECO-T | Hipervascular | Normal |
| Historia familiar de HG | - | + |
| Síntomas similares en gestación previa | - | + |
| T4 | ↑↑ | ↑ |
| T3 | ↑↑ | ↑ |
| Cociente T3T/T4T | >20 | <20 |
ECO-T: ecografía tiroidea; HG: hiperemesis gravídica.
Dentro de las enfermedades tiroideas, la EG es la que más habitualmente origina hipertiroidismo en el embarazo, ocurriendo en el 0,1 al 1% de todas la gestaciones (0,4% clínico y 0,6% subclínico)10.
La historia natural de la EG durante la gestación es la de exacerbación de los síntomas durante el primer trimestre, debido al efecto aditivo de la estimulación de HCG sobre el receptor de TSH, mejora durante la segunda mitad del embarazo por el efecto inmunomudalor de la gestación y recidiva tras el parto.
Enfermedad de Graves en la gestanteLos síntomas de una EG activa en la gestación no varían de los típicos de la EG. Ocasionalmente algunos de los síntomas pueden confundirse con los propios de la gestación; la posible presencia de signos oculares y bocio ayuda a clarificar el cuadro y las determinaciones hormonales permiten establecer el diagnóstico
Tratamiento de la enfermedad de Graves en la gestaciónComo es bien sabido la EG en las no gestantes es susceptible de 3 posibilidades terapéuticas: I131, cirugía o tratamiento médico con ATT. De estas 3 opciones, la administración de I131 está contraindicada en la gestación por el riesgo de malformaciones7, por lo que las opciones quedan limitadas a la tiroidectomía o al empleo de ATT. En cuanto a la cirugía, como más adelante se expone, debe limitarse a circunstancias extremas.
Tratamiento médico. AntitiroideosEn el tratamiento médico de la EG en la gestación, el PTU se ha considerado clásicamente el tratamiento de elección frente a MM/CM hasta hace pocos años26. Este concepto se basaba en ciertos trabajos que sugerían una mínima transferencia placentaria del PTU en comparación con el MM/CM27 y a los efectos teratogénicos del MM/CM. Hoy en día sabemos que ambos ATT atraviesan la placenta y por tanto tienen la misma posibilidad de afectar el feto y producir hipotiroidismo fetal26.
Además, el papel del MM/CM en la aparición en el feto de aplasia cutis, atresia coanal y esofágica junto a algunas otras malformaciones que globalmente se han conocido como «embriopatía por metimazol»28 ha sido muy debatido29–31, atribuyéndose en algunos casos estas malformaciones al efecto deletéreo del hipertiroidismo en si mismo. Trabajos recientes32,33, sin embargo, sí que evidencian un efecto teratogénico del MM/CM del que carece el PTU.
Por otro lado, durante los últimos años se han ido sucediendo descripciones de casos de hepatitis tóxica fulminante en paciente en tratamiento con PTU34,35, con una prevalencia del 0,1 al 0,5% y una mortalidad elevada (25-50%)10,36. Incluso se han descrito caso de hepatitis neonatal en recién nacidos cuyas madres habían sido tratadas con PTU37,38.
Nos encontramos, por tanto, ante un dilema: por un lado, el MM/CM parece claramente reconocido hoy en día que representa un riesgo de malformaciones y, por otro, el PTU puede originar complicaciones letales.
Ante esta disyuntiva, algunos autores han recomendado que las mujeres con EG realizasen un tratamiento ablativo antes del embarazo39. Sin embargo, esta solución apenas resuelve el problema; en la mayoría de los casos las mujeres con EG no planifican su gestación. Por otro lado, esta medida no impide un eventual hipertiroidismo fetal (hiperF) por persistencia de concentraciones elevadas de anticuerpos estimulantes del tiroides (TSI) que requeriría un tratamiento médico, planteando nuevamente el problema.
Por este motivo la ATA estableció unos criterios del empleo del PTU, en la población general y en las gestantes40. En el caso del embarazo desaconseja el empleo de MM/CM en el primer trimestre de gestación (periodo de organogénesis) y recomienda utilizar PTU; pasada la semana 12 de embarazo se debe retirar PTU por riesgo de hepatopatía y continuar el control de la EG con MM/CM. Fuera de la gestación solo recomienda el empleo de PTU en 2 situaciones: primera, si se presentase una tormenta tiroidea, y segunda, cuando haya efectos adversos inducidos por MM/CM.
Para evitar retrasar el inicio de tratamiento con PTU, sería recomendable que aquellas mujeres con EG que potencialmente se puedan quedar embarazadas y no utilizan ningún método anticonceptivo dispusieran de PTU en su domicilio y estuvieran instruidas en el cambio de medicación (de MM/CM a PTU) en cuanto tuvieran la certeza de su gestación.
Tratamiento médico. Manejo clínicoEn función de lo comentado, el tratamiento de la EG en la gestación se realizará en el primer trimestre con PTU y, posteriormente, con MM/CM. La dosis inicial puede oscilar entre 50–300mg/día de PTU divido en 3 dosis, 5–15mg/día de metimazol o 10-15mg/día de carbimazole en dosis única6. Siempre buscando emplear la mínima dosis posible
De forma transitoria se pueden emplear betabloqueantes, ya que su empleo prolongado se ha asociado a crecimiento intrauterino retrasado, bradicardia e hipoglucemia neonatal41. Además algunos autores han descrito un aumento de aborto espontáneo con el tratamiento combinado de propanolol y ATT42.
Para ajustar la dosis de ATT hay que tratar de mantener la función tiroidea de la madre casi en el límite de la hiperfunción subclínica, ya que el tiroides fetal es mucho más sensible al efecto bloqueante de los ATT. De hecho, la presencia de TSH detectable es una indicación para disminuir la dosis de ATT10,43.
La EG durante la gestación evoluciona de forma muy dinámica, de manera que hasta el 20-30% de las pacientes alcanzan un grado de control que permite suspender los ATT en el último trimestre de gestación44. La utilización de la pauta combinada de (ATT y HT) para el tratamiento de la EG está absolutamente contraindicada en la gestación, ya que ocasiona hipotiroidismo fetal (hipoF)6,43.
Tratamiento quirúrgicoCon relación al empleo de la cirugía para controlar la EG de la gestante, los diferentes consensos y guías clínicas6,7,43 coinciden en recomendarla solo en los siguientes supuestos:
- 1
Reacciones adversas a los ATT que impidan su empleo.
- 2
Necesidad de dosis altas de ATT.
- 3
Falta de adherencia de la paciente al tratamiento médico.
Además, la guía italiana43 la recomienda también en casos de bocio materno de gran tamaño con compresión de la vía respiratoria.
En caso de realizarse, el momento óptimo sería a partir del segundo trimestre. Esta circunstancia justificaría, como preparación quirúrgica, el empleo en una gestante con EG de betabloqueantes y yoduro sódico (50-100mg/día)45 durante un breve periodo de tiempo (10-14 días). Como ya se ha comentado previamente, hay que evitar el tratamiento prolongado con betabloqueantes. También se debe ser cauto con la administración de yoduro potásico para evitar el desarrollo de bocio y/o hipoF.
La cirugía supone un profundo cambio de situación. Por un lado, se resuelve el hipertiroidismo de la gestante, pero a cambio se origina un hipotiroidismo en la madre que habrá que suplir rápidamente y realizar controles periódicos de TSH. Además, se debe realizar un control de las cifras de TSI y, si es preciso, vigilar el desarrollo de hipertiroidismo fetal.
Variación de la autoinmunidad tiroidea durante la gestaciónAlgunos autores han demostrado, al menos en algunos casos, que existe un cambio en la actividad funcional de los anticuerpos dirigidos contra el receptor de TSH de estimuladora a inhibitoria o bloqueante46,47. Es decir, que la gestación modularía no solo las concentraciones de autoanticuerpos sino, en este caso, el perfil funcional de los mismos. Este concepto implica que la EG en la gestante no solo puede evolucionar hacia la normofunción sino que, incluso, puede llegar a la hipofunción debido a ese cambio de actividad estimuladora-bloqueante, como se ha descrito en algún caso48. Es decir, la EG de la gestante es un proceso cambiante que exige una vigilancia periódica permanente, que no debe abandonarse aunque se haya llegado a una situación de aparente remisión que no precise ATT.
Determinaciones de anticuerpos estimulantes del tiroides en la gestaciónAl objeto de prevenir el impacto de posibles autoanticuerpos tipo TSI en el tiroides fetal, la ATA publicó en 199849 unos criterios que establecían las indicaciones de determinaciones de TSI en la gestante según las características de la EG de la madre (tabla 5).
Indicaciones para la determinación de TSI según la European Thyroid Association
| I) Mujer eutiroidea con EG curada con tatamiento médico antes de la gestación |
| - No determinación |
| II) Mujer eutiroidea con EG curada tras I131o cirugía |
| - Determinar TSI precozmente: si fuese positivo, vigilar hipertiroidismo fetal |
| - Determinar TSI en tercer trimestre (si positivo en primer trimestre): si positivo, vigilar hipertirodismo neonatal |
| III) Mujer en tratamiento por EG en la gestación |
| - Determinar TSI en tercer trimestre. Si positivo, vigilar hipertirodismo neonatal |
EG: enfermedad de Graves.
Fuente: Laurberg et al.49
En aquellos casos con EG curada pregestacionalmente con terapia médica se entiende que se ha resuelto el cuadro inmunológico, y no procede la determinación de TSI.
Cuando la EG se resolvió mediante tratamiento ablativo (quirúrgico o radioterápico), el proceso inmunológico puede persistir. Después de la cirugía, las concentraciones de TSI se suelen negativizar al cabo de 12 a 18 meses. Tras el I131 aumentan inicialmente tras lo primeros meses de administrar el I131 para ir disminuyendo posteriormente, si bien pueden mantenerse elevados hasta 5 años50. Esto significa que si queremos evitar un posible hiperF tras el I131 habría que mantener una anticoncepción prolongada, por lo que en mujeres con deseo de gestación y títulos elevados de TSI sería preferible la cirugía frente al I131. En todos estos casos se debe cuantificar TSI precozmente para valorar el posible riesgo de HF, y volver a determinarlo en el tercer trimestre para constatar si mantiene positividad y existe por tanto riesgo de hipertiroidismo neonatal.
En las EG activas durante el embarazo, el posible riesgo de hiperF estaría controlado por el tratamiento con ATT de la madre. Se recomienda, sin embargo, estudiar los TSI al finalizar la gestación para alertar del riesgo de hipertiroidismo neonatal.
La ATA6 aconseja la determinación en torno a la semana 20-24 y establece unas recomendaciones mucho más genéricas:
- -
Madre con hipertiroidismo activo.
- -
Antecedentes de tratamiento con I131.
- -
Tiroidectomía previa.
- -
Neonato previo con hipertiroidismo.
En el caso del feto hay que recordar que a partir de la semana 20 su tiroides alcanza ya la madurez y, consecuentemente, la capacidad de responder al mismo tipo de influencias (ATT y TSI) que el tiroides del adulto. Como resultado de esta circunstancia podemos encontrarnos, en el contexto de la EG de la gestante, tanto hipoF como hiperF.
Hipotiroidismo fetalHabitualmente el hipoF surge como consecuencia de unao sobredosificación relativa de ATT que, si bien puede mantener una situación de normofunción en la madre, origina una clara hipofunción en el feto.
Clínica sugerenteClínicamente se puede sospechar por la observación de bocio fetal en una ecografía obstétrica y el desarrollo de polihidramnios en una gestante en tratamiento con ATT.
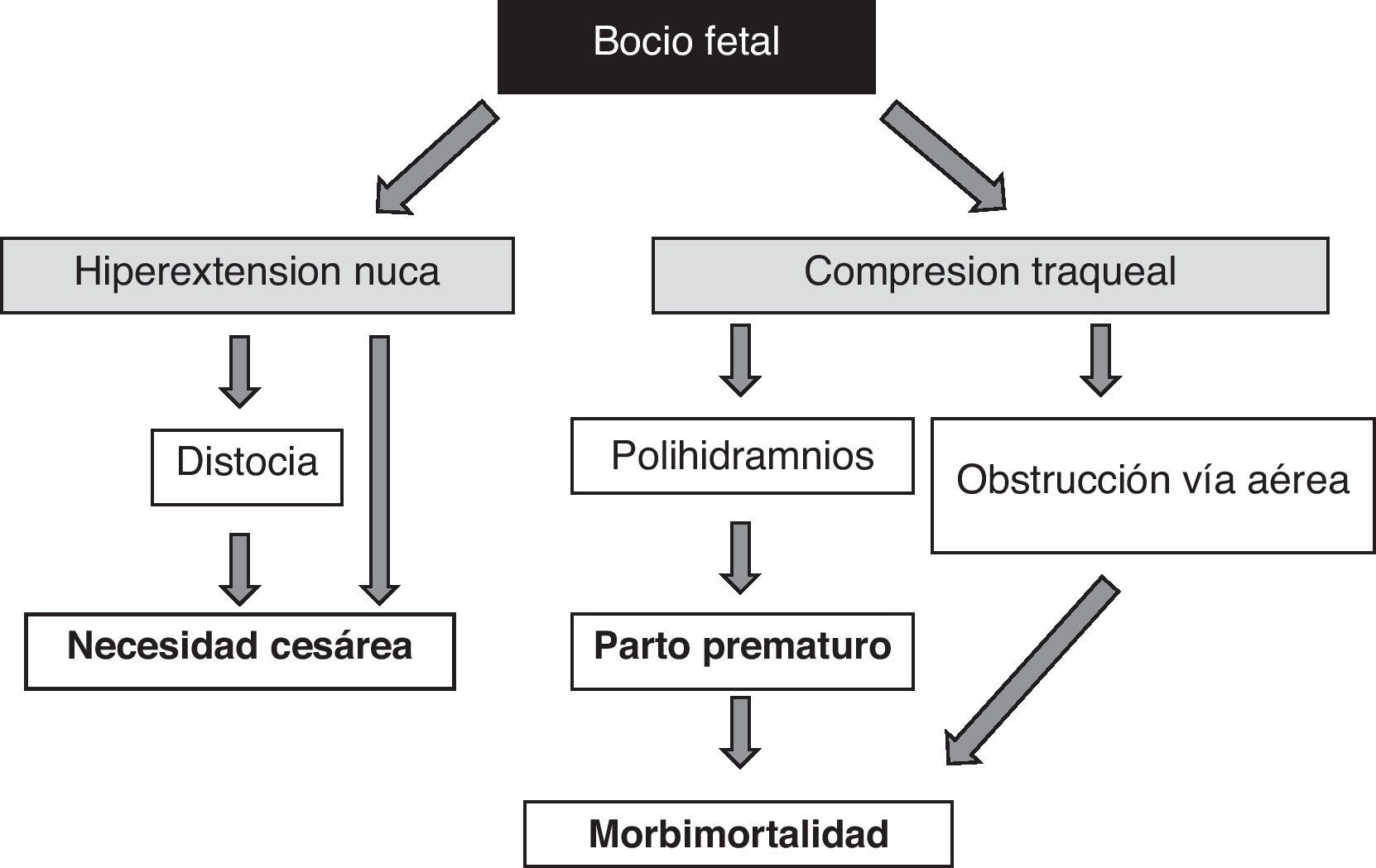
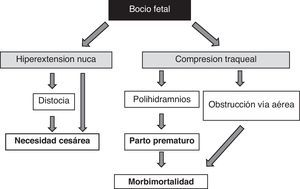
La presencia de bocio fetal, independientemente de aspectos funcionales, supone un dato de alarma por su efecto masa51 (fig. 1). Hay que tener en cuenta que el aumento de volumen tiroideo condicionará una hiperextensión de nuca del feto que dificultará su movilidad intrauterina y, como consecuencia, originará una situación de presentación anómala en el momento del parto (distocia hombros, de nalgas, etc.). Aunque no impidiese la adecuada colocación cefálica del feto, esta hiperextensión impediría la adecuada flexión del cuello fetal para el parto originando una presentación de cara. Todas estas situaciones obligarían a la práctica de una cesárea. Sin embargo, no sería esta la principal complicación, la compresión del bocio sobre los inmaduros cartílagos traqueales del feto puede causar una compresión traqueoesofágica. Como resultado se produciría una obstrucción de la vía aérea con el consiguiente riesgo de asfixia; además, la compresión esofágica dificultaría la deglución del líquido amniótico propiciando su acumulación y el desarrollo de polihidramnios, que favorecería el parto prematuro, principal causa de morbimortalidad neonatal.
DiagnósticoPara confirmar el hipoF tras los datos de sospecha, la única forma absolutamente fiable es la determinación de HT fetales mediante la realización de una cordocentesis. Se trata de una técnica no exenta de complicaciones (presenta un 2% de riesgo de muerte fetal52) y más compleja que la simple amniocentesis. Sin embargo, la determinación de HT fetales en el líquido amniótico no es fiable y no se correlaciona con la determinación en sangre fetal53; hay que recordar que en el líquido amniótico podemos encontrar HT de origen materno54. Las diferentes guías6,43 reservan la cordocentesis para cuando se detecte bocio en un feto cuya madre esté tomando ATT y no se pueda establecer con seguridad si se trata de un hiperF o un hipoF, y siempre realizada en un centro experimentado.
Frente a este abordaje, recientemente se está postulando la determinación del compuesto W. Este compuesto es el resultado del metabolismo de las HT fetales. En el feto, a diferencia del adulto, el metabolismo de las HT sigue la vía de la sulfoconjugación formándose diiodotironina sulfato; este compuesto es a su vez metilado en la placenta o en la pared uterina antes de pasar a la circulación materna y formar el compuesto W. El mencionado compuesto está presente en todas las gestantes a partir del desarrollo de la función tiroidea fetal y aumenta progresivamente a lo largo del embarazo para desaparecer tras el parto, por lo que se le ha propuesto como un marcador de función tiroidea fetal55. En este contexto, una inadecuada progresión de las concentraciones del compuesto W en una gestante tratada con ATT puede ser un indicador de desarrollo de hipoF56. No obstante, de momento se trata de un método casi experimental.
TratamientoLa primera medida a adoptar será la supresión de los ATT. Sin embargo, debido a la latencia de los efectos de los ATT una vez suspendidos, se precisa también de la suplencia de HT hasta que el tiroides fetal se recupere totalmente. Puesto que las HT tienen un paso limitado a través de la placenta, se deben administrar por vía intraamniótica. Esta vía, aunque cruenta, es mucho más inocua que la cordocentesis, con un riesgo mínimo de aborto tras la mitad de la gestación57.
En cuanto al tratamiento intraamniótico del feto con T4, no existe una pauta terapéutica establecida y los datos de la literatura ofrecen bastante disparidad53,58,59; una reciente revisión51 de los casos descritos hasta ahora concluye que la dosis media está alrededor de 279μg de levotiroxina administrados una vez a la semana (durante una a 6 semanas). De esta forma parece que el bocio fetal revierte a las 0,5-2,5 semanas tras la primera dosis. En algunos casos se realizó nueva determinación de HT, mientras que en otros simplemente fueron vigilando la desaparición ecográfica del bocio.
Hipertiroidismo fetalEl hiperF es una complicación rara, puede presentarse hasta en el 1-2% de los hijos de madres con EG actual o pasada, si bien posiblemente sea un cuadro infradiagnosticado60,61.
El desarrollo de hiperF, exceptuando los rarísimos casos de mutaciones del receptor de TSH62, puede ser la consecuencia de 2 circunstancias: la existencia de una gestante con EG mal controlada o, más frecuentemente, surgir en el contexto de una gestante con EG curada pregestacionalmente con tratamiento ablativo que mantenga concentraciones elevadas de TSI. Ya se han referido previamente las indicaciones de determinar TSI para conocer el riesgo de hiperF. Un valor de TSI superior en 3 o 5 veces el valor normal6,63 supone un riesgo elevado de hiperF.
Clínica sugerenteEl desarrollo de bocio fetal es uno de los rasgos más precoces. Además se puede observar taquicardia fetal, edad ósea avanzada, retraso global de crecimiento y craneosinostosis64. De forma más grave, puede producirse una insuficiencia cardíaca con hidrops fetal o alteraciones madurativas del desarrollo del sistema nervioso central con retraso mental. Eventualmente se puede producir un parto prematuro65.
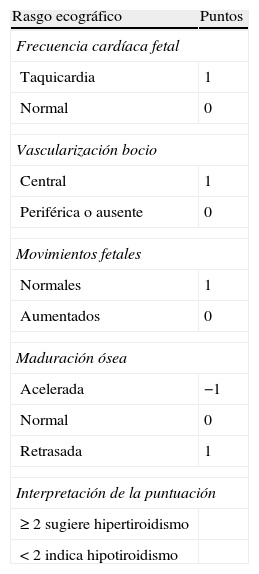
DiagnósticoLos signos previamente expuestos no son definitivos; la taquicardia no siempre está presente y la presencia de bocio en la ecografía es un dato común con el hipoF. Si se plantease la duda de si estamos ante un hipoF por efecto de los ATT o ante un hiperF por mal control materno, algunos autores han propuesto un sistema de puntuación basado en datos ecográficos66 (tabla 6). Si persistiese la duda, deberemos recurrir a la determinación de HT fetales mediante cordocentesis, tal y como se expuso en el apartado de hipoF. Quizá en un futuro el compuesto W (ya comentado previamente) nos pueda servir en este propósito.
Puntuación ecográfica para distinguir hipertiroidismo de hipotiroidismo en bocio fetal
| Rasgo ecográfico | Puntos |
| Frecuencia cardíaca fetal | |
| Taquicardia | 1 |
| Normal | 0 |
| Vascularización bocio | |
| Central | 1 |
| Periférica o ausente | 0 |
| Movimientos fetales | |
| Normales | 1 |
| Aumentados | 0 |
| Maduración ósea | |
| Acelerada | −1 |
| Normal | 0 |
| Retrasada | 1 |
| Interpretación de la puntuación | |
| ≥2 sugiere hipertiroidismo | |
| <2 indica hipotiroidismo | |
Adaptada de Huel et al.66
El tratamiento debe basarse en ATT. En este caso, a diferencia del hipoF, el tratamiento no hay que administrarlo de forma intraamniótica ya que los ATT atraviesan la placenta libremente. Si se trata de un hiperF en el contexto de una gestante mal controlada de su EG, simplemente habrá que ajustar el tratamiento de la madre. Si, por el contrario, la madre está normofuncional por tratamiento ablativo previo, y solo el feto presenta la situación de hiperfunción, se administrará a la madre MM/CM comenzando con dosis de 10-20mg/día. Se debe monitorizar el tratamiento cada 4-5 días según la FC fetal y la evolución del bocio al objeto de no sobredosificar al feto y ocasionar un hipoF10.
Si la madre, al administrarle los ATT, desarrollase un hipotiroidismo, le administraremos levotiroxina que, al no atravesar apenas la placenta, compensará ese hipotiroidismo sin afectar al feto. Esta sería la única circunstancia en la que se podría emplear la pauta combinada.
Enfermedad de Graves en el neonatoEn el neonato, la EG durante la gestación puede producir tanto hiper como hipotiroidismo.
Hipertiroidismo neonatalLo podemos encontrar en el 1 al 5% de los hijos de gestantes con EG10. Se presenta cuando la madre padece una EG activa con títulos de TSI elevados en el último trimestre. Durante la gestación el feto se mantiene normofuncional por el efecto de los ATT que recibe la madre. Los ATT tienen una vida media de 24–72h, por lo que transcurrido ese tiempo dejan de actuar sobre el tiroides fetal que queda expuesto a los TSI maternos que pueden persistir hasta 12 semanas tras el parto.
Se manifiesta como un cuadro de hiperfunción tiroidea e incluso insuficiencia cardíaca, que aparece un par de días tras el parto en un recién nacido inicialmente asintomático.
También puede presentarse en recién nacidos de madres que hayan recibido tratamiento ablativo antes de la gestación y mantengan TSI elevados, en las que se desarrolló un hiperF no diagnosticado. En estos casos el hipertiroidismo neonatal es una continuación del hiperF; los recién nacidos están afectos gravemente al nacimiento, con bajo peso y aceleración de la maduración ósea.
El tratamiento consistirá en administrar MM/CM a dosis de 0,5- 1mg/kg peso/día y propanolol 2mg/kg peso/día36, según la evolución clínica y sabiendo que se trata de una situación transitoria. Hay que tener en cuenta que, eventualmente, los TSI pueden cambiar su perfil funcional y pasar a ser bloqueantes del receptor y desarrollar un hipotiroidismo.
Hipotiroidismo neonatal secundarioEn hijos de madres con EG mal controlada podemos encontrar que las concentraciones elevadas de HT a las que han sido expuestos durante la gestación han ocasionado una supresión de la secreción de TSH que origine un hipotiroidismo secundario al nacimiento67. Esta situación puede ser transitoria o definitiva por una alteración hipofisaria permanente en la secreción de TSH.
Se deberá suplir al neonato con levotiroxina e ir valorando periódicamente si la TSH recupera su secreción.
También se puede observar hipotiroidismo neonatal transitorio por persistencia de autoanticuerpos maternos bloqueantes del receptor de TSH68.
Enfermedad de Graves en la puérperaTras el parto puede reaparecer la EG previamente controlada, ya sea pregestacionalmente o durante la gestación. Se estima que hasta un 84% pueden recidivar en el puerperio, en comparación con el 56% de las recidivas de las mujeres que no han tenido un embarazo69. Se recomienda, por tanto, determinar las HT maternas a las 6 semanas posparto y continuar hasta un año tras el parto10.
Si recidiva la EG será preciso el tratamiento médico con MM/CM. Si bien los ATT están presentes en la leche materna, su administración no presenta riesgo durante la lactación, pudiéndose tomar hasta 20-30mg de MM/CM sin que repercutan en el tiroides del recién nacido70. Sí que se recomienda tomar los ATT en dosis fraccionadas y siempre tras finalizar la toma de leche.
Se ha sugerido que los TSI presentes en la leche materna, a través de un epitelio gastrointestinal inmaduro del lactante, podrían alcanzar la circulación general del neonato y producir o prolongar un hipertiroidismo neonatal. Sin embargo, no se ha obtenido un grado de evidencia concluyente de que este fenómeno pueda ocurrir en la práctica71.
AddendumCon posterioridad al envío de este manuscrito se ha publicado una nueva guía de práctica clínica de la Sociedad de Endocrinología Norteamérica sobre el Manejo de la disfunción tiroidea durante el embarazo y posparto (J Clin Endocrinol Metab. 2012; 97: 2543–2565). Las recomendaciones que establecen en el apartado del hipertiroidismo en la gestación no difieren sustancialmente de las expuestas en esta revisión.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.