Paciente de 56años, sin antecedentes de interés, ingresada en agosto de 2009 por cuadro de síndrome constitucional con pérdida ponderal de 8kg en el último año, saciedad precoz y epigastralgia, tratada ambulatoriamente con omeprazol y domperidona. En la exploración física destacaba hepatomegalia de 3cm bajo el reborde costal derecho y la palpación de la punta del bazo a nivel del hipocondrio izquierdo. En la analítica realizada presentaba: Hb: 11,3g/dl (<12g/dl), VSG: 73mm/h (>20mm/h), HbA1c: 6,7% (>5,7%), glucemia basal: 117mg/dl (60-100mg/dl), LDH: 708 (>380U/l).
Se realizó una fibrogastroscopia que mostraba una lesión de 3×4cm que comprimía de manera extrínseca el antro. La TAC abdominal mostraba múltiples lesiones focales hepáticas con características de metástasis hipervasculares que abarcaban el 70% del hígado, y una lesión focal en la cola pancreática que producía trombosis de la vena esplénica. Se realizó PAAF hepática guiada por ecografía con resultado de metástasis hepáticas de carcinoma neuroendocrino bien diferenciado, sinaptofisina positivo. No fue posible el estudio de Ki67 ni cromograninaA en la muestra. El octreoscan mostraba actividad positiva de receptores de somatostatina en el hígado. No se pudo obtener tejido del tumor primario, por lo que no fue posible su caracterización histológica.
Tras el diagnóstico de tumor neuroendocrino (TNE) metastásico bien diferenciado, se inició tratamiento quimioterápico con estreptotozina y adriamicina. Dos meses después, la paciente ingresó por infección urinaria y hepatalgia; requirió dexametasona, con descompensación hiperglucémica tratada con insulina subcutánea en pauta bolo-basal, que se mantuvo al alta. La TAC de control de abril de 2010 mostraba importante reducción del número y tamaño de las metástasis hepáticas, así como discreta disminución del tamaño de la masa en la cola pancreática. En ese momento se inició tratamiento con octreótido LAR 30mg i.m. cada 4semanas.
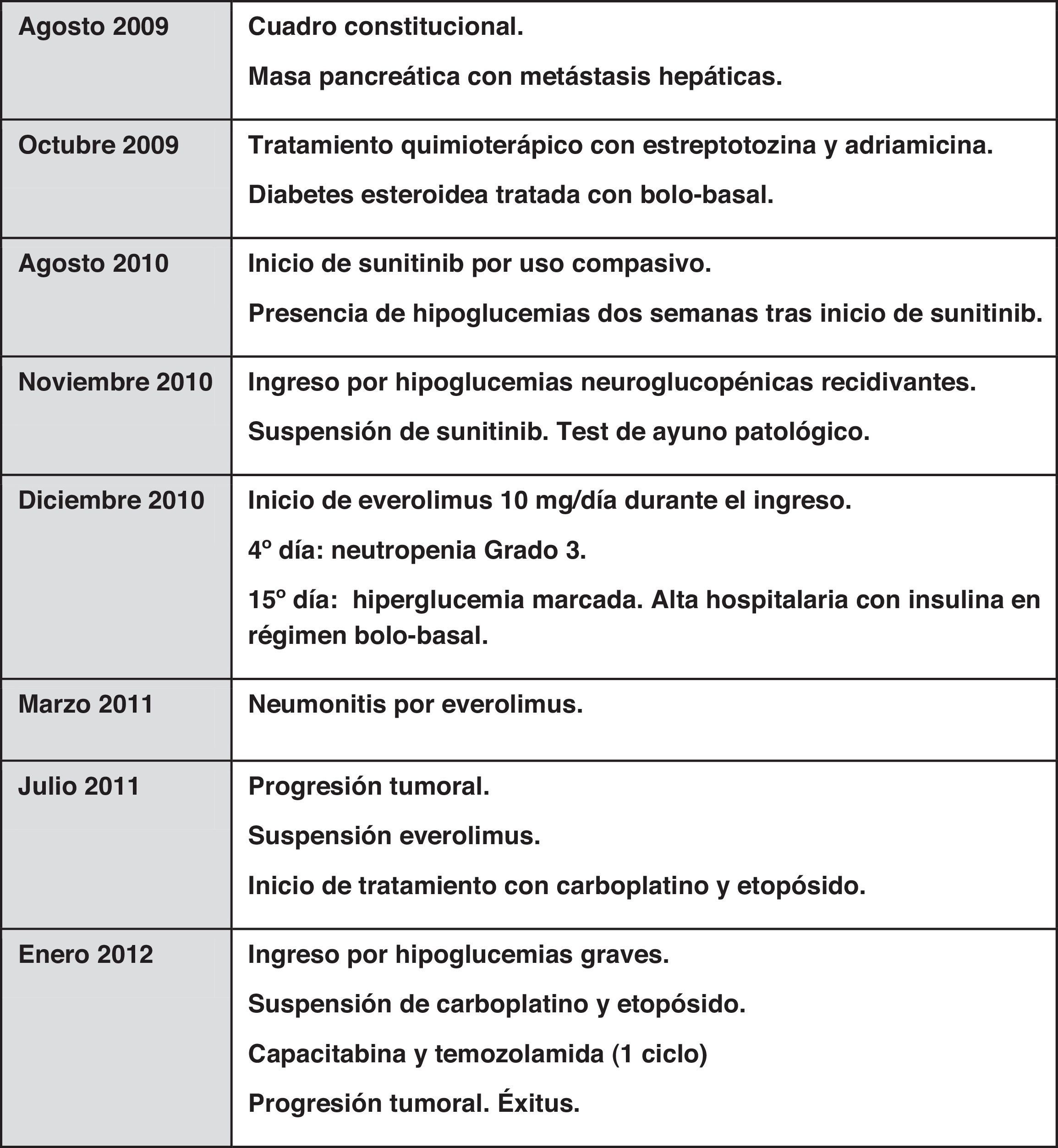
En agosto de 2010 se realizó TAC abdominal de control que mostraba crecimiento de la lesión pancreática y del número y tamaño de las lesiones hepáticas. Se inició tratamiento con sunitinib como uso compasivo, a dosis de 37,5mg/día vía oral, con disgeusia y estreñimiento como efectos tóxicos. Dos semanas tras el inicio del fármaco presentó hipoglucemias objetivadas de manera ambulatoria. Ingresó en noviembre de 2010 en endocrinología por un cuadro de hipoglucemias recidivantes de difícil control, a pesar de tratamiento ambulatorio escalonado con dieta fraccionada, diazóxido a dosis progresivas hasta 300mg/día, y prednisona 30mg/día. Durante el ingreso precisó aporte continuo de suero glucosado al 10%. Se suspendió el sunitinib por la coincidencia temporal con el desarrollo de hipoglucemias. Se realizó test de ayuno, con hipoglucemia severa y patrón bioquímico de glucemia, insulina y péptidoC compatible con hiperinsulinismo endógeno (tabla 1). Se descartó mediante estudio de tóxicos urinarios la presencia de metformina, repaglinida, glipizida, gliclazida, glibornurida, nateglinida, glimepirida, glibenclamida y gliquidona. Se sospechó la presencia de un insulinoma maligno como primera posibilidad. Durante el mismo ingreso se asoció everolimus 10mg al día como tratamiento del tumor primario y para el manejo de hipoglucemias refractarias severas con clínica neuroglucopénica. Al cuarto día de iniciar everolimus la paciente presentó neutropenia de 600neutrófilos/μl, por lo que se disminuyó la dosis a 5mg/día; tras normalización del hemograma al 10.° día de tratamiento, se aumentó la dosis a 10mg/día. Se planificó embolización selectiva de las metástasis hepáticas para control sintomático y de la enfermedad tumoral; sin embargo, 15días después de iniciar everolimus la paciente presentó hiperglucemia franca que mantuvo durante el resto del ingreso.
Permaneció 4meses sin hipoglucemia; en cambio, desarrolló hiperglucemia marcada como toxicidad asociada a everolimus y octreótido, que precisó de insulina en régimen basal-bolo. En marzo se realizó nuevo TAC toracoabdominal, que mostraba infiltrados pulmonares de nueva aparición en relación con neumonitis por everolimus, y estabilidad de la enfermedad tumoral. Tres meses después, ante la progresión radiológica de los infiltrados pulmonares por everolimus, se disminuyó la dosis a 5mg/24h.
En julio de 2011, 8meses tras iniciar everolimus, reingresó por hipoglucemias graves asociadas a progresión de la enfermedad tumoral a nivel pancreático y hepático. Se suspendió este tratamiento y se inició carboplatino y etopósido. En la TAC de control no se observaron los infiltrados neumónicos previos. Requirió nuevo ingreso en enero de 2012 por hipoglucemias graves con pérdida de conocimiento de difícil manejo ambulatorio. Valorada por endocrinología, se instauró tratamiento con diazóxido 300mg/24h en 3dosis, dexametasona 2mg/8h, dextrosa al 50% en perfusión continua, dextrinomaltosa 500g en 1.000ml a 40ml/h por sonda nasogástrica y octreótido 30mg LAR cada 4semanas, a pesar de lo cual presentó hipoglucemias menores de 30mg/dl con clínica neuroglucopénica grave. Inició capecitabina más temozolamida, y completó el primer ciclo. Poco después falleció por sepsis urinaria e hipoglucemias refractarias (fig. 1).
Se presenta un caso de TNE pancreático con un posible cambio de fenotipo tumoral a lo largo del curso clínico, ya que desarrolló hipoglucemias con sintomatología grave un año después del diagnóstico de neoplasia pancreática aparentemente no funcionante desde el punto de vista hormonal. A pesar de haber presentado previamente hiperglucemia esteroidea, posteriormente desarrolló hipoglucemias de repetición; se descartó la toma de fármacos hipoglucemiantes, y se objetivó hiperinsulinismo endógeno (péptidoC detectable con glucemias muy bajas) en el test de ayuno. Previamente la paciente había sido tratada con sunitinib; se han descrito hipoglucemias como efecto adverso de este inhibidor de tirosina cinasas cuya fisiopatología concreta se desconoce, si bien podría estar en relación con la inhibición de c-kit (tirosina cinasa c-kit o CD117) y PDGFRβ (receptor-beta del factor de crecimiento derivado de plaquetas). Sin embargo, tras la suspensión de sunitinib persistieron las hipoglucemias, y aumentaron su frecuencia y gravedad.
El manejo terapéutico del insulinoma maligno progresivo con hipoglucemias recidivantes severas es un verdadero desafío médico. El control de la sintomatología es fundamental para mejorar la calidad de vida de los pacientes; se han utilizado múltiples terapias con respuesta variable. Asimismo el tratamiento de la enfermedad tumoral en progresión puede ser complicado; existen escasos estudios comparativos, y una elevada toxicidad asociada a diversos fármacos. Menos del 10% de los pacientes con insulinoma presentan metástasis a distancia (hígado, hueso, ganglios linfáticos); en estos, la mediana de supervivencia es inferior a 2años1.
Dentro de las líneas de tratamiento utilizadas se encuentran la cirugía citorreductora (debulking), terapias sobre la enfermedad hepática (embolización, quimioembolización, ablación con radiofrecuencia, termoterapia intersticial inducida por láser, radioterapia interna selectiva utilizando microesferas), interferón alfa, quimioterapia citotóxica o radionúclidos. Asimismo, la resección del tumor primario pancreático cuando sea posible, incluso en presencia de metástasis hepáticas, puede ayudar a controlar la sintomatología y aumentar la supervivencia2.
Clásicamente, la asociación de doxorubicina con estreptozotocina asociado o no a 5-fluorouracilo se ha utilizado como primera línea de tratamiento, con respuestas de hasta un 70%3-5 (toxicidad: miocarditis, insuficiencia renal o hepática, mucositis, astenia, diarrea y/o mielosupresión). Recientemente se han obtenido resultados con temozolamida más capecitabina como primera línea terapéutica para TNE pancreáticos, incluyendo insulinomas malignos metastásicos, alcanzando una supervivencia mediana libre de progresión de 18meses, con respuesta tumoral en el 70% de los pacientes6.
Las vías moleculares implicadas en insulinomas malignos esporádicos son mayoritariamente desconocidas. La disminución de TSC2 (proteína2 de esclerosis tuberosa) y PTEN (enzima fosfatidilinositol-3,4,5-trisfosfato 3-fosfatasa) conlleva la activación de la vía mTOR (mammalian target of rapamycin), que se ha implicado en la respuesta celular de numerosos tumores. Todo ello implica crecimiento, proliferación, disminución de apoptosis y aumento de angiogénesis7,8. Everolimus (RAD001, Affinitor®) es un inhibidor de la vía mTOR que en un ensayo doble ciego, controlado con placebo en fase iii con 410pacientes con TNE de bajo-intermedio grado a dosis de 10mg, ha demostrado incrementar la mediana de supervivencia de 4,6 a 11meses (estudio RADIANT3)9. Sin embargo, el número de pacientes incluidos con insulinoma maligno progresivo es desconocido, ya que no fue publicado en dicha serie. Los efectos secundarios asociados a everolimus son frecuentes e incluyen estomatitis, aftosis, rash, diarrea, neutropenia, anemia, astenia, neumonitis no infecciosa, infecciones e hiperglucemia, entre otros.
Everolimus puede inducir hiperglucemia inhibiendo la liberación de insulina por la célula beta a través de la vía AMPK (proteína cinasa activada por 5′-AMP)/c-Jun y quizá también por la producción de insulinorresistencia periférica10. La mejoría del control glucémico parece independiente, al menos en parte, de los cambios sobre la masa tumoral, apoyando el efecto directo sobre la liberación/función de la insulina.