La diabetes mellitus tipo 2 es una patología con una enorme prevalencia y morbilidad, que van en aumento. La fractura osteoporótica se encuentra entre las denominadas complicaciones «no clásicas» de la diabetes y ha sido durante tiempo ignorada, tal vez por su complejo abordaje tanto diagnóstico como terapéutico. Las herramientas habituales para la prevención de la fractura por fragilidad, como el FRAX y la densitometría ósea, no han demostrado la suficiente eficacia en estos pacientes, ya que infraestiman el riesgo. Nuevas técnicas de evaluación ósea, como el trabecular bone score o los marcadores de remodelado óseo, podrían ser de utilidad, aunque requieren una mayor evidencia científica para recomendar su uso en la práctica clínica habitual. Las características especiales de su fisiopatología condicionan la aparición de fracturas sin existir alteraciones densitométricas, en lo que podemos calificar de «paradoja diabética».
Type 2 diabetes mellitus prevalence and morbidity are increasing. Osteoporotic fractures are among the ‘non-classical’ complications of diabetes and been overlooked for a long time, maybe because of their complex diagnostic and therapeutic approach. The usual tools for preventing fragility fractures (such as the fracture risk assessment tool and bone densitometry) underestimate risk of fractures in type2 diabetic patients. New techniques, such as trabecular bone score or bone turnover markers, could be useful, but greater scientific evidence is required to recommend their use in clinical practice. The special characteristics of their pathophysiology result in decreased bone remodeling with normal or even increased bone mineral density, but with low quality. These changes lead to the occurrence of osteoporotic fractures without evidence of densitometric changes, which could be called ‘the diabetic paradox’.
Son numerosos los estudios epidemiológicos centrados en el abordaje de las complicaciones clásicas de la diabetes. La enorme —y cada vez mayor— prevalencia de esta patología hace que sea un problema de salud pública de primer orden. Sin embargo, la osteoporosis en la diabetes mellitus tipo2 (DM2) constituye una «epidemia silente», ya que es de difícil estimación por ser asintomática hasta que aparece la fractura.
Afrontar el estudio y la prevención de la osteoporosis en estos pacientes es una tarea compleja, ya que las técnicas diagnósticas habituales no son útiles1. El mecanismo fisiopatológico que subyace a esta patología da lugar a un hueso con una densidad normal o aumentada, pero de baja resistencia por alteración en su microarquitectura, grado de recambio y acumulación de lesiones. Son varios los estudios que ponen de manifiesto esta «paradoja diabética», demostrando el incremento de fracturas por fragilidad en estos pacientes pese a tener una densidad ósea normal2-4. Un metaanálisis realizado por Janghorbani et al.5 concluyó en un riesgo relativo de fractura de cadera en pacientes con DM2 de 1,7 tras el análisis de 12 estudios al respecto.
Por otro lado, hay que considerar la importante morbilidad, el coste económico y el impacto sobre la calidad de vida del paciente que tiene la fractura por fragilidad, debido a la disminución de la capacidad física y al mayor grado de dependencia6,7. Todo ello genera una demanda al especialista para un mejor abordaje y solución de esta complicación de la diabetes.
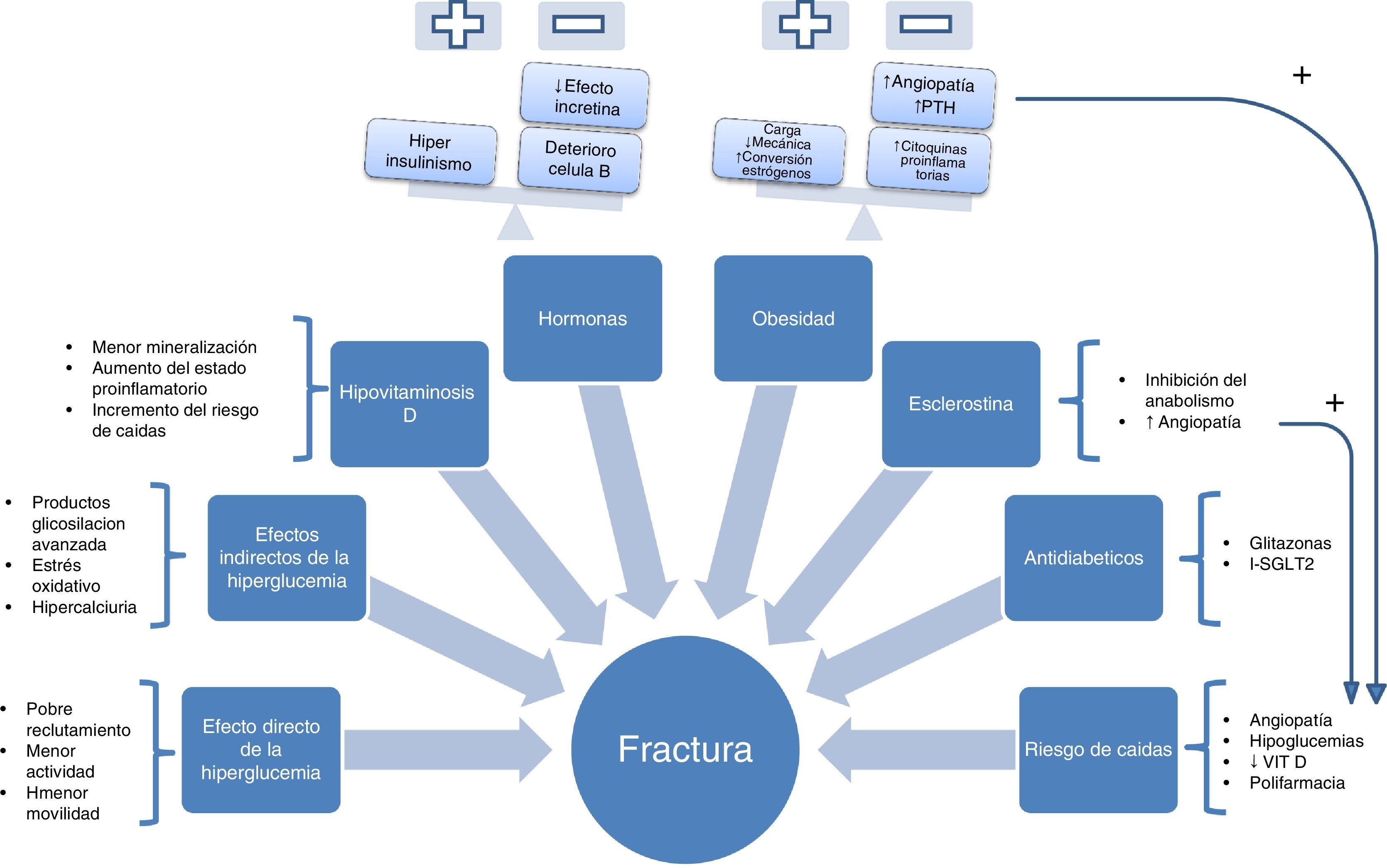
Fisiopatología. «El octeto ominoso de la fractura en el paciente con DM2»Las características fisiopatológicas de la fractura en la DM2 son especiales y tremendamente heterogéneas. Esta diversidad de factores implicados parece ocasionar una disminución en el recambio óseo. Son varios los estudios que muestran una disminución de los marcadores de remodelado óseo en los pacientes con DM28. Lamentablemente, son escasos los datos histomorfométricos al respecto, seguramente por tratarse de un procedimiento invasivo. En un estudio realizado en 26 pacientes con DM2 (13 hombres y 13 mujeres con función renal normal) se objetivó una disminución del volumen de osteoide y osteoblastos9. Estos resultados son consistentes con otro estudio realizado en 8 sujetos con diabetes (6DM2 y 2DM1) a los que se les realizó biopsia de cresta iliaca para estudio histomorfométrico10. En una persona sana (sin diabetes) el hueso es un tejido dinámico que se encuentra en un continuo proceso de remodelado con el fin de mantener la competencia biomecánica del esqueleto, prevenir la aparición de lesiones y contribuir a la homeostasis mineral. Cada año se renueva aproximadamente el 25% del hueso trabecular y el 3% del hueso cortical, en un proceso regulado por diversos factores mecánicos, hormonales y locales. Pero ¿qué pasa si este proceso de remodelado disminuye? Pues que se origina un hueso con densidad normal o alta pero con elevado riesgo de fractura.
Para llegar a entender este complicado conjunto de factores implicados en la patogenia se podría hacer un esquema en forma de «octeto ominoso» de la génesis de la fractura por fragilidad (fig. 1), en la que estarían presentes:
- 1.
Efectos directos de la hiperglucemia sobre las células óseas. La hiperglucemia se ha asociado a un descenso de la maduración, función y motilidad del osteoclasto. Así se muestra, por ejemplo, en un estudio realizado en modelos celulares, que mide el efecto que ejerce la exposición a un medio con alta concentración de glucosa sobre la osteoclastogénesis inducida por RANK-L. Para ello, miden la activación de la osteoclastogénesis mediante la determinación de fosfatasa ácida tartrato resistente, la expresión del receptor de calcitonina (propia del osteoclasto maduro), la catepsinaK y la actividad de la caspasa3. Se objetivó una disminución de todos estos marcadores de actividad osteoclástica en presencia de hiperglucemia. Asimismo, se estudió la capacidad de migración y la motilidad de los osteoclastos, que se encontró disminuida en los expuestos a mayor concentración de glucosa. Por todo ello, se concluye que la exposición a hiperglucemia origina en el osteoclasto una alteración a distintos niveles: menor formación, reducción de su actividad y disminución de la motilidad, con dificultad para llegar a las microfracturas para poder repararlas11.
- 2.
Efectos indirectos de la hiperglucemia. Otro mecanismo indirecto por el que actúa la hiperglucemia es la producción de productos de glucación avanzados, que se encuentra muy aumentada en el paciente con diabetes. La gluclación modifica la estructura de las proteínas nativas, sus propiedades fisicoquímicas y sus funciones biológicas. El caso de la pentosidina es uno de los más estudiados en el paciente con diabetes. Estudios como el publicado por el grupo de Yamamoto et al.12 mostraron que los niveles de pentosidina se asociaban a fracturas vertebrales, independientemente de las complicaciones de la diabetes, de la duración de la misma, del tratamiento con insulina o glitazonas o de otros factores de riesgo conocidos, como alcohol, tabaco, etc.
Asimismo, la hiperglucemia está implicada de manera indirecta en un incremento del estrés oxidativo y de la hipercalciuria, que podría originar una alteración de la estructura y de la mineralización ósea13.
- 3.
Hipovitaminosis D. Además de la hiperglucemia, hay otros factores importantes implicados en la fragilidad ósea del paciente con DM2, como el déficit de vitaminaD. Varios estudios muestran una asociación inversa entre la vitaminaD y la DM2, tal y como recoge una revisión reciente14. Este déficit genera una menor mineralización, aumenta el estado proinflamatorio y, además, incrementa el riesgo de caídas por el papel que ha demostrado a nivel del músculo esquelético15. Es más, en un metaanálisis de ensayos aleatorizados se llegó a concluir que la suplementación con vitaminaD (dosis de 700-1.000UI/día) podría reducir el riesgo de caídas en un 19%16.
- 4.
Hormonas. El hiperinsulinismo, presente en etapas iniciales de la DM2, se ha postulado como uno de los factores cruciales para entender la paradoja diabética17. La insulina estaría implicada en el aumento de la densidad mineral ósea de estos pacientes, frente a la pérdida de densidad propia de la diabetes mellitus tipo1, la cual se inicia con insulinopenia en etapas precoces de la vida, lo que ocasionaría una falta de consecución del pico de masa ósea adecuado. En etapas más avanzadas de la enfermedad, en las cuales se produce el deterioro de la célula beta, se perdería este efecto anabólico.
Por otro lado, cada vez disponemos de más evidencia científica sobre el papel que desempeña el sistema incretina sobre el tejido óseo de estos pacientes. Estudios en modelos animales parecen demostrar un efecto anabólico, como el llevado a cabo en modelo de rata ovariectomizada por Ma et al.18, en el cual la administración de exendin-4 demostró promover la formación ósea (mediante el incremento del número de osteoblastos por superficie ósea y los marcadores de formación propéptido aminoterminal del procolágeno tipo1 y osteocalcina) e inhibir la resorción (disminuyendo el número de osteoclastos, los niveles de deoxipiridinolina y telopéptido carboxiterminal del colágeno tipo1, e incrementando el ratio osteoprotegerina/ligando del RANK). También otro estudio realizado en modelo animal de ratón deficiente en receptor de leptina ha demostrado un efecto positivo óseo de un nuevo triple análogo de los receptores del polipéptido inhibidor gástrico (GIP), del péptido similar al glucagón tipo1 (GLP1) y del glucagón19.
- 5.
Obesidad. Es, sin duda, uno de los factores más discutidos. Tradicionalmente se le otorgaba un efecto positivo sobre el tejido óseo, debido al incremento de la carga mecánica que estimula al osteocito o por la conversión de andrógenos a estrógenos. No obstante, en un estudio realizado en modelo animal de rata ovariectomizada, el incremento de peso y estrógenos, mediante una dieta con alto porcentaje de grasa, no produjo mejora en las propiedades del tejido óseo20. Por otro lado, la mayoría de estudios realizados sobre la asociación de peso y densidad ósea eran de tipo trasversal. En el Health, Aging, and Body Composition Study se realiza un estudio longitudinal en una muestra de 2.570 personas donde se objetiva, mediante densitometría, que los pacientes con obesidad perdían 0,003g/cm2 por año más que los adultos con normopeso (p<0,001)21. Actualmente se cuestiona este efecto beneficioso, entre otros motivos, por el estado proinflamatorio que genera con la liberación de múltiples citoquinas (IL-6, TNF-alfa, etc.). Estas favorecerían tanto la resorción ósea como la angiopatía22,23, con el consiguiente incremento del riesgo de caídas. Todo ello contribuiría al incremento del riesgo de fracturas en estos pacientes24.
- 6.
Incremento de la esclerostina. Es bien conocido el papel de la vía canónica Wnt en el tejido óseo, donde a través de una cascada de señales activa la transcripción de genes con efecto anabólico y controla al osteoblasto a diferentes niveles: diferenciación, proliferación y función final25. La esclerostina, que ha demostrado estar significativamente aumentada en el paciente con DM2, es un inhibidor de esta vía anabólica ósea. Asimismo, se ha demostrado recientemente, en varios estudios, la asociación entre niveles aumentados de esclerostina en mujeres con DM2 y la fractura vertebral26,27.
No menos importante es el papel que esta vía juega en otros procesos biológicos relacionados con la enfermedad cardiovascular. Un estudio publicado por Morales-Santana et al. pone de manifiesto la asociación entre los niveles endógenos del inhibidor de la vía WNT (esclerostina) y la lesión aterosclerótica en el paciente con DM228. Aún está por determinar si esta asociación entre esclerostina y arteriopatía contribuye a un mayor riesgo de caídas.
- 7.
Riesgo de caídas. El incremento de las caídas en el paciente con DM2 es un hecho que viene condicionado fundamentalmente por la angiopatía (retinopatía, polineuropatía, etc.) y que favorece, sin duda, la aparición de fracturas. La angiopatía guarda una muy estrecha relación con la fractura osteoporótica en una especie de «díada patogénica» que ha quedado constatada en diversos estudios, en los que se ha visto que ambos no solo comparten factores de riesgo comunes sino también vías patogénicas idénticas, como la ya mencionada WNT o la vía OPG/RANK-L28-31.
Además de la arteriopatía, existen otros factores favorecedores de la caída en estos pacientes, como puede ser el déficit de vitaminaD antes comentado, las hipoglucemias o la «polimedicación» de estos pacientes.
- 8.
Antidiabéticos orales. Una revisión de este año realizada por Meier et al.32 pone el acento en la importancia que tiene el empleo de determinados fármacos antidiabéticos sobre la seguridad a nivel óseo. Especial mención, por el potencial incremento de riesgo de fracturas, merecen las glitazonas33,34 y los inhibidores del cotransportador sodio-glucosa tipo2 (SGLT-2)35. Estos últimos han demostrado, en un modelo animal de ratón no diabético, disminuir el volumen de hueso trabecular36, y en el modelo de ratón diabético no demostraron ninguna mejoría a nivel óseo, pese al mejor control glucémico observado. También en el Canagliflozin Cardiovascular Assessment Study (CANVAS), con 4.327 participantes, se ha demostrado un incremento del riesgo de fractura, del 4% versus el 2,6%, en pacientes con DM2 tratados con canagliflozina frente a placebo37.
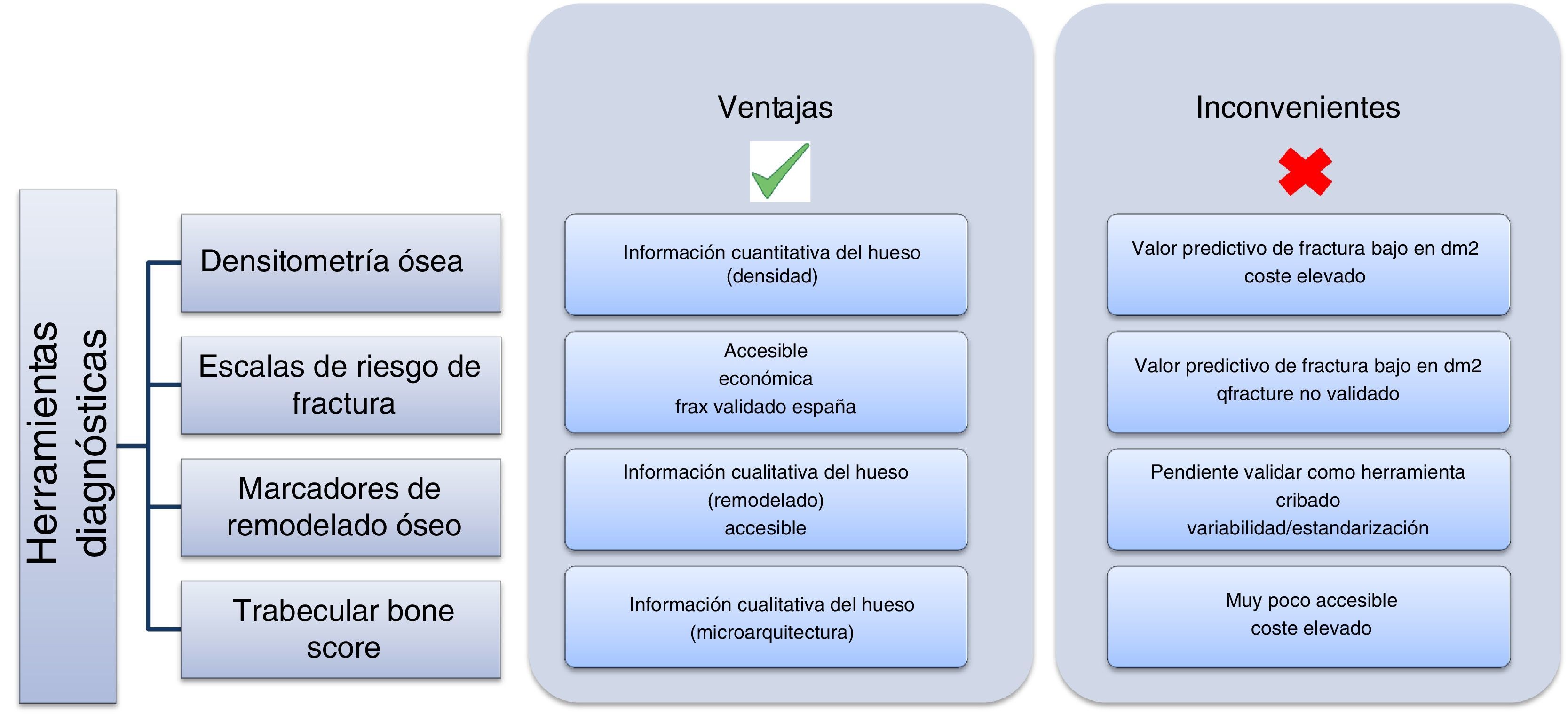
Una vez planteadas la prevalencia y la complejidad del problema, el siguiente paso es preguntarse cómo abordarlo y prevenirlo en nuestro paciente con DM2 (fig. 2). No se trata de una tarea sencilla, ya que tradicionalmente el método para diagnosticar la osteoporosis era el empleo del DEXA de acuerdo a los criterios establecidos por la Organización Mundial de la Salud (OMS) en 199438, basados en la medición de la densidad mineral ósea en columna lumbar, cuello femoral, cadera o tercio distal del radio. Estos criterios establecen como valores de normalidad una densidad mayor a −1 desviación estándar (DE) con relación a la media de adultos jóvenes (T-score); valores comprendidos entre −1 y −2,5DE se definen como baja masa ósea, y valores inferiores a −2,5DE son diagnósticos de osteoporosis. En el caso del paciente con DM2 se ha demostrado que esta técnica no es útil, ya que el incremento del riesgo de fractura es independiente de la densidad, y de facto tienen una mayor densidad mineral ósea (DMO) a nivel lumbar y femoral39.
Las escalas de riesgo de fractura son herramientas cada vez más empleadas, a la vez que accesibles y económicas. El máximo exponente es el FRAX, desarrollado por el centro colaborador de la OMS de la Universidad de Sheffield como herramienta para identificar población de riesgo y así llevar a cabo prevención primaria (intervención: si >3% de riesgo en cadera o >20% en otra localización). Esta herramienta tiene como principal inconveniente no valorar como ítem la propia DM2. Son varios los estudios realizados para valorar su utilidad en pacientes con diabetes, de los que se concluye que no es una herramienta válida ya que infraestima el riesgo de fractura en esta población40,41. Una alternativa posible podría ser el empleo del QFractureScore, desarrollado en una extensa cohorte británica42 que incorpora como factor de riesgo la DM2, pero que presenta como inconveniente que se encuentra solo validada para el Reino Unido.
En tercer lugar, podemos plantearnos el papel de los marcadores de remodelado óseo (MRO). Son varios los estudios que reflejan que el paciente con DM2 tiene niveles disminuidos de MRO como consecuencia de una reducción del anabolismo óseo. Así se refleja en un metaanálisis de 22 estudios que objetivó niveles significativamente menores del marcador de formación osteocalcina en pacientes con DM28. Los mismos autores han publicado este año una revisión sistemática donde se concluye el potencial uso de los MRO en la valoración ósea del paciente con DM243. Estos marcadores han demostrado una asociación de manera significativa con la fractura vertebral en la DM226. En 2014, el grupo de trabajo de la International Osteoporosis Foundation (IOF) y la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) publicó un metaanálisis que otorga un potencial papel predictor de fractura osteoporótica en población general44. No obstante, y pese a lo prometedor de estos resultados, son necesarios más estudios para establecer la utilidad de los MRO como herramienta de cribado y seguimiento de la osteoporosis en la DM2. Por otro lado, se ha cuestionado su uso por la necesidad de estandarización, en la que trabaja el grupo de la IOF-IFCC. Un estudio realizado en población española45, diseñado para disminuir al máximo los posibles factores de variabilidad preanalítica, establece unos rangos robustos en población caucásica que concuerdan con los publicados con cohortes mayores. Esta similitud de resultados de varios estudios, que usan un ensayo en una plataforma automatizada para la determinación en laboratorios diferentes, demuestra que se puede minimizar la variabilidad con una adecuada metodología, lo que refuerza la utilidad clínica de los MRO en la valoración de la patología ósea.
Finalmente, el Trabecular Bone Score (TBS) se ha postulado como una herramienta que podría ser útil especialmente en el caso de osteoporosis secundarias, como la causada por la DM246. Se ha objetivado una disminución significativa del hueso trabecular en el paciente con diabetes, como muestra el estudio realizado por Dhaliwal et al.47 y realizado en 100 mujeres, donde aquellas con DM2 presentaron una mayor DMO y menor TBS (p=0,001 y 0,01, respectivamente), o el estudio retrospectivo realizado en una cohorte canadiense de 29.407 mujeres (2.356 con DM2), donde el TBS fue predictivo de fractura48. Esta disminución de hueso trabecular parece estar condicionada por un mal control glucémico47 y la presencia de resistencia a la insulina, objetivando una correlación negativa entre TBS y hemoglobina glucosilada A1c, glucemia basal y resistencia a la insulina49.
Las recomendaciones para la evaluación y el tratamiento de la osteoporosis asociada a enfermedades endocrinas y nutricionales del Grupo de trabajo de osteoporosis y metabolismo mineral de la SEEN50 encara este reto y recomienda evaluar esta complicación en el paciente con DM2, especialmente en caso de complicaciones crónicas, insulinoterapia o tratamiento con glitazonas. También sugiere, con grado de evidencia muy baja, el empleo del FRAX o TBS si estuviese disponible. Para el abordaje terapéutico recomiendan seguir las mismas recomendaciones que en población sin diabetes, aunque se sugiere que el déficit de función osteoblástica en esta enfermedad hace atractivo el empleo de fármacos anabólicos en pacientes de alto riesgo o en prevención secundaria.
ConclusionesLa población con DM2 presenta un riesgo incrementado de fractura, pese a tener una DMO normal o aumentada, como consecuencia de una compleja fisiopatología. Esto hace que las herramientas habituales de prevención infraestimen el riesgo. También se hace necesaria una cuidadosa evaluación rutinaria de los factores implicados, como el déficit de vitaminaD, la prevención del riesgo de caídas, medicamentos, etc., de cara a lograr minimizar su incidencia. En el abordaje diagnóstico el TBS parece prometedor, aunque es necesario que se disponga de mayor información prospectiva antes de recomendar su uso de manera rutinaria en la prevención de la fractura diabética.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.