La amiodarona es un antiarrítmico eficaz ampliamente utilizado. Su alto contenido en yodo y su efecto tóxico directo sobre el tiroides provoca alteraciones en la función tiroidea hasta en un 50% de los casos y puede aparecer incluso tras la suspensión del fármaco debido a su vida media prolongada.
Son 2 las formas principales de tirotoxicosis inducida por amiodarona (TIA): la tipo-1 se caracteriza por un incremento en la síntesis de las hormonas tiroideas (por sobrecarga de yodo en pacientes con enfermedad tiroidea de base) y la tipo-2 desencadena una liberación de hormonas preformadas al provocar una tiroiditis destructiva (por toxicidad directa del fármaco). Es importante diferenciarlos con el objeto de optimizar el tratamiento: tionamidas en la TIA tipo-1 y glucocorticoides en la TIA tipo-2.
Presentamos un caso que muestra el manejo complejo que puede llegar a suponer determinados casos de TIA y las posibles alternativas terapéuticas cuando existe resistencia al tratamiento convencional.
Se trata de un varón de 51 años de edad con antecedentes de miocardiopatía hipertrófica obstructiva y un episodio de fibrilación auricular hace 4 años, desde entonces en tratamiento con amiodarona (200mg/24h). En el contexto de un nuevo episodio de fibrilación auricular se detectó hipertiroidismo primario (TSH 0,008mUI/ml [0,27-4,2 mUI/ml], T4 7,5ng/dl [0,93-1,7ng/dl] y T3 10,99pg/ml [2,57-4,43pg/ml]). El paciente refería nerviosismo, palpitaciones y pérdida de 4kg de un mes de evolución. En la exploración física destacaba un soplo sistólico ii/vi en el borde esternal izquierdo con una frecuencia cardíaca arrítmica de 86lpm y un temblor fino distal. No se palpaba bocio ni se objetivó proptosis ni alteraciones en la motilidad extraocular.
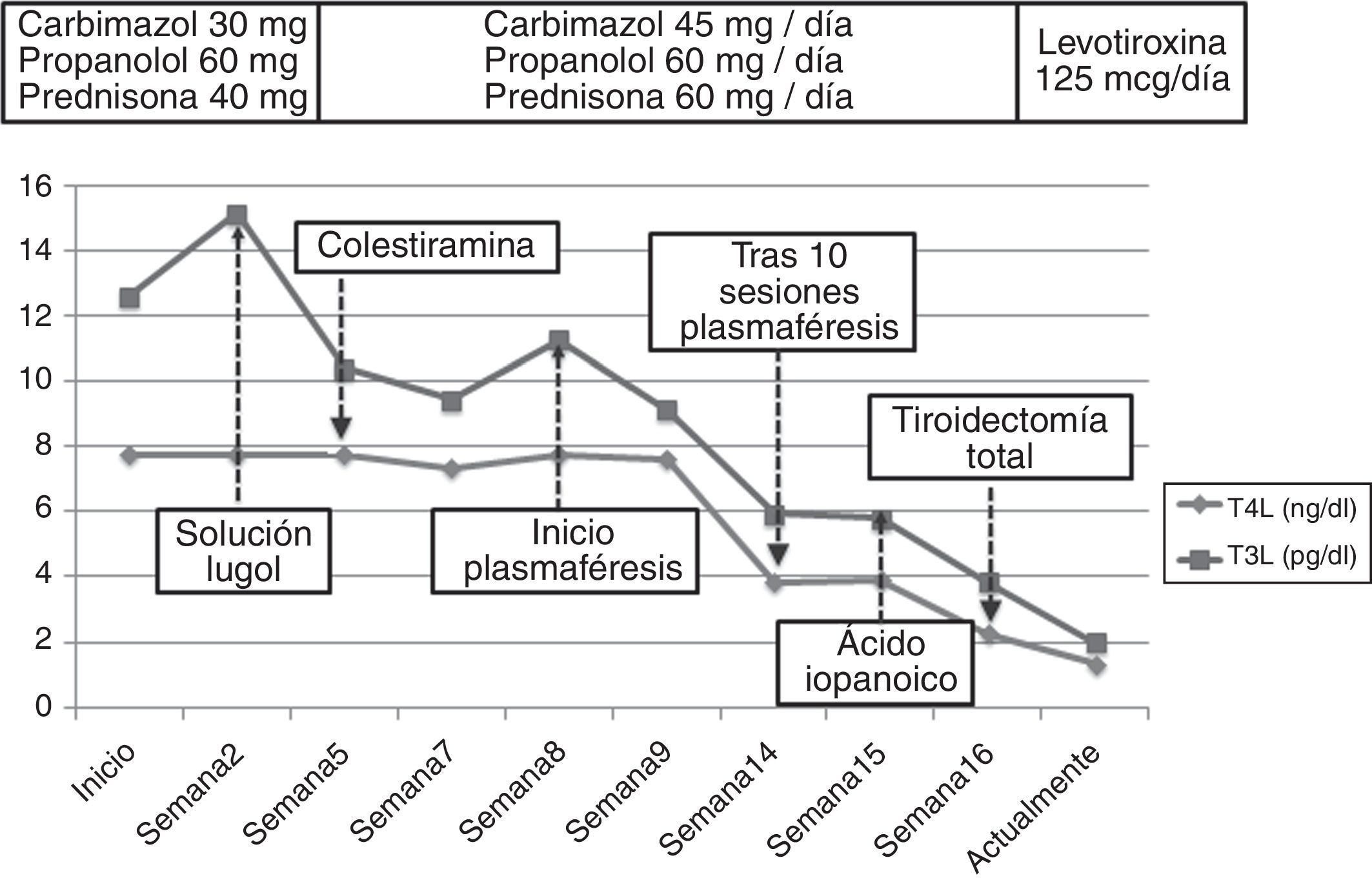
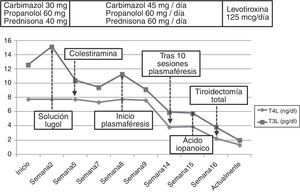
La autoinmunidad tiroidea resultó negativa. La ecografía tiroidea mostró una morfología conservada sin lesiones nodulares y con hipovascularización generalizada, mientras que la gammagrafía objetivó un bloqueo casi completo de la glándula. Con estos resultados se estableció el diagnóstico de TIA tipo-2. Se retiró la amiodarona y dado el alto riesgo de descompensación de la fibrilación auricular se inició un tratamiento mixto con altas dosis de tionamidas (45mg/d de carbimazol), glucocorticoides (60mg/d de prednisona) y betabloqueantes (60mg/d de propranolol). Tras 15d objetivamos un empeoramiento del hipertiroidismo (TSH 0,008mUI/ml, T4 superior a 7,7n/dl y T3 15,14pg/ml). Se intentó un bloqueo rápido de la liberación de las hormonas tiroideas con una solución de lugol (5 gotas/12h) durante una semana sin obtener mejoría, por lo que se añadió colestiramina (12g/d).
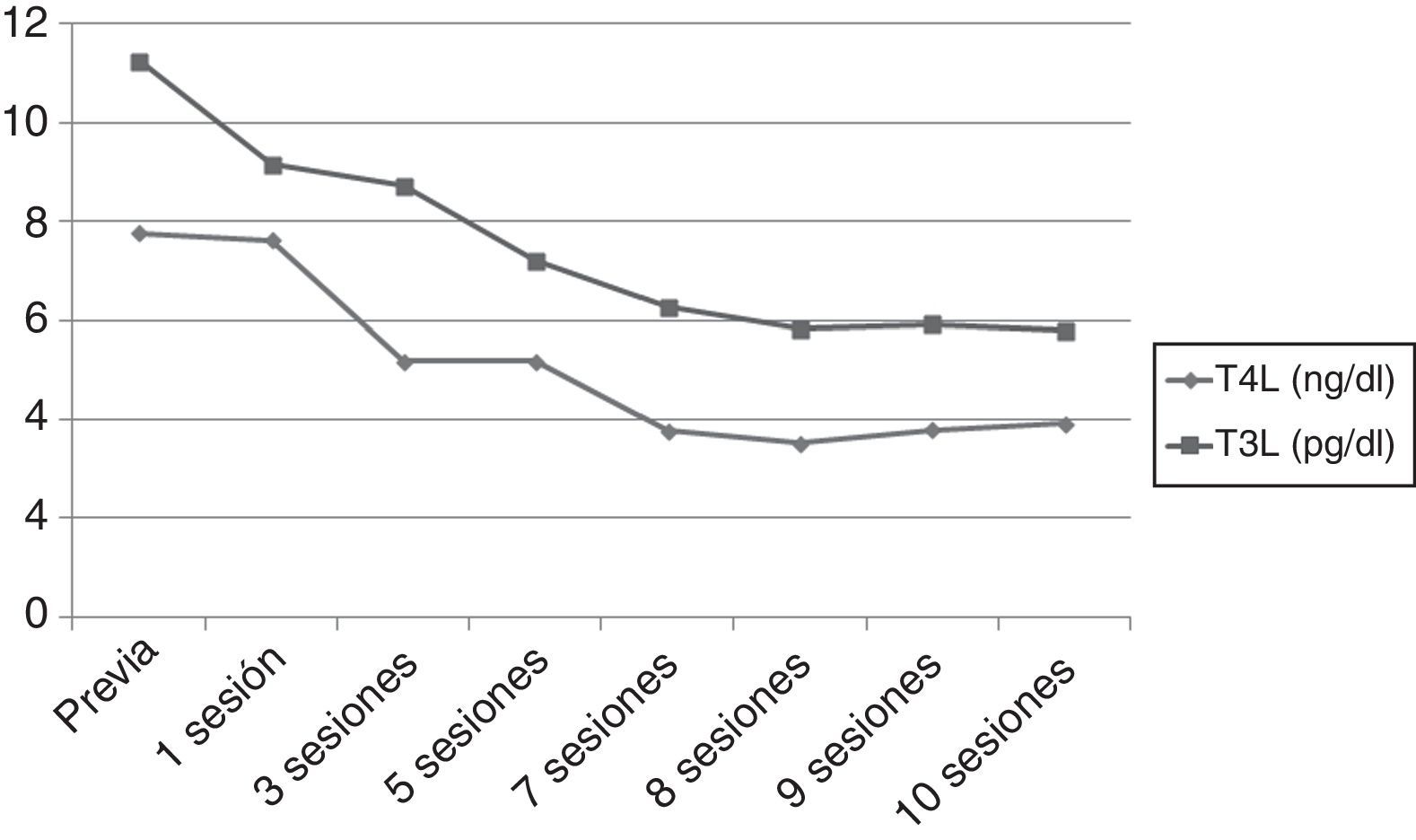
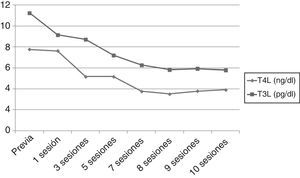
Sin embargo, tras 25d de tratamiento, el paciente desarrolló un flutter auricular de difícil control que obligó a la hospitalización. Al ingreso presentaba TSH 0,005mUI/ml, T4L superior a 7,77ng/dl y T3L 11,25pg/ml. Ante la refractariedad al tratamiento médico y el elevado riesgo quirúrgico se inició un tratamiento con plasmaféresis con objeto de disminuir de forma rápida las concentraciones de hormonas tiroideas. Se programó un volumen de aféresis de 2l de plasma. Inicialmente se realizaron en días alternos, espaciándose con posterioridad. Se obtuvo una respuesta (fig. 1) beneficiosa precoz (TSH 0,005mUI/ml, T4L 3,84ng/dl, T3L 5,93pg/ml) con recuperación del ritmo sinusal pero con estabilización posterior de las cifras de hormonas tiroideas, por lo que tras 10 sesiones se decidió interrumpir la plasmaféresis.
Con vistas al tratamiento quirúrgico se intentó un nuevo bloqueo tiroideo con ácido iopanoico (500mg/12h durante una semana), alcanzando unas concentraciones hormonales (fig. 2) aceptables (T4L 2,26ng/dl, T3L 3,84pg/ml). Finalmente, se realizó una tiroidectomía total y la anatomía patológica objetivó una glándula tiroidea de tamaño normal sin nódulos, con involución de los folículos tiroideos y cambios degenerativos, hallazgos compatibles con TIA tipo-2. Tras 12 meses de seguimiento bajo tratamiento con levotiroxina a 125mcg/d el paciente no ha presentado nuevos episodios de taquiarritmia.
La descompensación de una enfermedad cardíaca subyacente o el desarrollo de una fibrilación auricular en un paciente tratado con amiodarona obligan a descartar una TIA. No existe un consenso acerca de la recomendación de suspender la amiodarona. Por su vida media prolongada la interrupción del tratamiento no condiciona un beneficio inmediato. Además, bloquea la conversión de T4 a T3, así como los receptores beta-adrenérgicos, por lo que su supresión podría empeorar inicialmente los síntomas del hipertiroidismo1.
Otra opción terapéutica para el control de la tirotoxicosis son los secuestradores de los ácidos biliares. La colesterimina y el colestipol, aunque más conocidos por su indicación como hipolipidemiantes, inhiben la circulación enterohepática de las hormonas tiroideas y en diversos estudios han demostrado que su asociación con antitiroideos implica una normalización más rápida del perfil tiroideo2.
Por otra parte, las soluciones saturadas en yodo o los agentes colecistográficos (como el ácido iopanoico o las soluciones de lugol) actúan fundamentalmente bloqueando la conversión de T4 a T3 y han mostrado su utilidad en el control preoperatorio del hipertioridismo en diversos estudios3. Sin embargo, en nuestro caso, ninguna de estas opciones terapéuticas consiguió un control eficaz de la tirotoxicosis.
La plasmaféresis es un proceso que implica la filtración de la sangre para eliminar determinados componentes plasmáticos, entre ellos las hormonas tiroideas. Además de reducir las concentraciones circulantes de hormonas y yodo puede eliminar anticuerpos Thyroid stimulating inmunoglobulins (TSI) y determinados fármacos que se unan a las proteínas plasmáticas. A diferencia de la hemodiálisis, la plasmaféresis permite disminuir de forma transitoria las concentraciones plasmáticas de amiodarona. Por este motivo tiene interés su aplicación en los casos de tirotoxicosis graves resistentes al tratamiento. Este procedimiento es relativamente seguro con una tasa de mortalidad en torno al 0,03-0,05% y rara vez aparecen complicaciones4. Ezer et al. mostraron un descenso marcado de las concentraciones de FT3 y FT4 preoperatorios con plasmaféresis en una serie de 11 pacientes con tirotoxicosis por diversas causas con refractariedad o contraindicación al tratamiento antitiroideo convencional4. El papel de la plasmaféresis en los pacientes con TIA es controvertido, atendiendo a los casos publicados en la literatura. Diamond et al. publicaron una serie de 3 casos de TIA tratados con plasmaféresis; aunque en uno de ellos hubo que interrumpir el tratamiento por complicaciones, en los otros 2 pacientes se objetiva una franca disminución de las concentraciones de hormonas tiroideas tras solo 2 sesiones (de 77,2pmol/l a 54,3pmol/l y de 77pmol/l a 47,1pmol/l, respectivamente)5. Estos resultados beneficiosos son concordantes con otros casos publicados en pacientes con TIA6–8.
Sin embargo, el efecto de la plasmaféresis puede ser transitorio9. El mecanismo que subyace a esta recidiva es complejo: la disminución de las concentraciones plasmáticas de amiodarona implicaría una liberación del fármaco desde el tejido adiposo al plasma con riesgo de prolongar en el tiempo la disfunción tiroidea.
En ocasiones, ante la falta de respuesta al tratamiento convencional en pacientes con cardiopatía de base, es preciso realizar una tiroidectomía10. Sin embargo, la gravedad de la tirotoxicosis implica un riesgo quirúrgico alto, lo que obliga a optimizar previamente la función tiroidea.
Como conclusión, nuestro caso pone de manifiesto la dificultad en el manejo de determinados casos de TIA. La descompensación de la arritmia de base puede requerir en ocasiones una disminución rápida de las concentraciones circulantes de hormonas tiroideas. Si la respuesta al tratamiento convencional no es satisfactoria la plasmaféresis puede constituir una alternativa terapéutica transitoria previa al tratamiento quirúrgico definitivo.