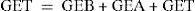La obesidad se ha convertido en un serio problema de salud a nivel mundial, por su estrecha vinculación con las principales causas de morbimortalidad, diabetes mellitus, hipertensión arterial, aterosclerosis y dislipemias. En este sentido, resulta de imperiosa necesidad para la comunidad científica conocer los principales factores ambientales y socioculturales, así como los desórdenes orgánicos originados a partir de la ruptura de los mecanismos fisiológicos que controlan el equilibrio energético en nuestro organismo, y que son en última instancia responsables todos ellos del desarrollo de obesidad. Luego, una adecuada comprensión de los mecanismos involucrados en la regulación del balance energético constituye la clave para comprender la etiopatogenia y fisiopatología de la creciente pandemia de obesidad. El objetivo de este trabajo ha sido revisar los principales factores implicados en el desarrollo de la obesidad, así como los avances en la comprensión de los mecanismos reguladores del peso corporal, el apetito y su fisiopatología.
Obesity has become a serious health problem worldwide because it is closely related to the leading causes of morbidity and mortality, including diabetes mellitus, hypertension, atherosclerosis, and dyslipidemia. It is therefore imperative for the scientific community to understand the main environmental and social-cultural factors, as well as organic disorders arising from breakdown of the physiological mechanisms that control energy balance in our body, all of which are ultimately responsible for development of obesity. Adequate understanding of the mechanisms involved in regulation of energy balance is therefore essential to understand the pathogenesis and pathophysiology of the growing pandemic of obesity. This study was intended to review the main factors involved in development of obesity and advances in understanding of the mechanisms that regulate body weight and appetite and their pathophysiology.
La obesidad representa un proceso patológico común en el ser humano. Dicho proceso ha perdurado durante siglos por factores genéticos y ambientales, hasta convertirse actualmente en una pandemia con consecuencias serias para la salud1.
Si consideramos la figura humana desde una perspectiva plástica a través de los tiempos, podremos verificar cómo entre las obras más antiguas de arte son representadas figuras humanas femeninas en estado de máxima adiposidad. Las denominadas venus paleolíticas, como la Venus de Willendorf, son figuras femeninas representativas para las que Leroi–Gourhan (1965)2 desarrolló una teoría acerca de la estructura anatómica con que fueron representadas. Plantea cómo las dimensiones corporales de todas ellas responden a una organización diafragmática, en la que predominaba el eje vertical a modo de rombo y en donde las mamas, abdomen y nalgas resultaban hipertróficas constituyendo una estructura circular en la mitad del rombo. En la actualidad, y extrapolándolo al estudio de la obesidad en el humano, vemos como este tipo de constitución corporal representada en el arte desde la prehistoria supone un acercamiento a los modelos y arquetipos obesogénicos actualmente planteados3.
Según datos de la Organización Mundial de la Salud, más de mil millones de personas en el mundo tienen sobrepeso, de los cuales 300 millones se pueden considerar obesos4. En Europa, uno de cada 6 niños, niñas y adolescentes tiene sobrepeso (20%), mientras que uno de cada 20 obesidad (5%)4.
Este incremento en la prevalencia de obesidad está relacionado con factores dietéticos y con un incremento en el estilo de vida sedentario5. El aumento del consumo de grasas saturadas y de carbohidratos, unido a una disminución de la ingesta de vegetales y unos bajos niveles de actividad física, son las causas más importantes en el desarrollo de este problema de salud mundial6. Por otra parte, las consecuencias de la obesidad alcanzan proporciones catastróficas. Entre ellas cabría destacar las enfermedades cardíacas y vasculares, alteraciones del metabolismo lipídico (dislipemias) y en consecuencia aterosclerosis; alteraciones en determinado tipo de hormonas con gran actividad metabólica como la insulina, originando problemas de resistencia celular a la misma (hiperinsulinemia); menor tolerancia a la glucosa, lo que origina riesgo de padecer diabetes mellitus tipo ii; hipertensión arterial con el riesgo de accidentes cerebrovasculares (ACV) que ello supone; déficit de hormona de crecimiento e hiperleptinemia. Al conjunto de estos factores o alteraciones se le denomina síndrome metabólico, y algunos pueden hacer ya su aparición a los 6 años de edad en niños y adolescentes obesos7.
Las investigaciones realizadas a lo largo de los últimos años han revolucionado los conocimientos sobre los mecanismos fisiológicos y moleculares que regulan el peso corporal8. El descubrimiento de la leptina, su receptor, el receptor de la melanocortina, así como el descubrimiento de la acción de ciertos mediadores hormonales implicados en el mantenimiento del peso corporal, han contribuido a la mejor comprensión de los procesos fisiológicos implicados en el desarrollo de la obesidad8.
Etiopatogenia de la obesidadLos conocimientos actuales sobre genética y biología molecular permiten plantear la etiopatogenia de la obesidad como un fenómeno complejo9. En este sentido, la teoría de un aumento de la ingesta mantenido en relación a un deficiente gasto energético resulta una teoría excesivamente simplista, ya que la obesidad es un trastorno muy heterogéneo en su origen, estando implicados diversidad de factores, tanto genéticos como nutricionales10,11.
Factores genéticosEstudios recientes sugieren que el desarrollo de la obesidad podría tener su origen en las etapas más precoces de la vida, esto es, durante el período fetal. Según esto, en el período fetal tendrá lugar un mecanismo de programación, el cual activará numerosos procesos nutricionales, hormonales, físicos y psicológicos, los cuales van a actuar en períodos críticos de la vida configurando ciertas funciones fisiológicas12. La existencia de uno o varios miembros en una misma familia con obesidad severa ha planteado la probable implicación de factores genéticos en la aparición de este cuadro a edades tempranas, implicación que ya ha sido verificada por diferentes estudios. Así, se ha podido determinar cómo el riesgo de padecer obesidad extrema a lo largo de la vida (IMC>45), se multiplica por 7 cuando uno de los progenitores la padece13–15. Es más, estudios sobre familias han puesto de manifiesto índices de heredabilidad para el total de grasa corporal que varían desde el 20 al 80%16. En el caso del patrón de distribución graso corporal, su estimación de heredabilidad para la proporción cintura–cadera varía del 28 al 61%, y desde un 29–82% para la circunferencia abdominal17.
De acuerdo a la séptima revisión del mapa de la obesidad humana, con datos recogidos hasta el año 2005, han sido publicados 47 casos de obesidad monogénica, 24 casos de alteraciones mendelianas y 115 loci diferentes y susceptibles de encontrarse implicados en obesidades poligénicas. En este sentido, el mapa de la obesidad indica que, excepto en el cromosoma Y, en todos los cromosomas hay genes con una potencial implicación en la aparición y desarrollo de la obesidad18. Actualmente, y en base a los resultados de los 222 estudios realizados sobre genes y obesidad, existe evidencia científica suficiente como para establecer en 71 el número de genes identificados como posibles inductores en la aparición de la obesidad19. Si además tenemos en cuenta las regiones cromosómicas, el número ascendería a más de 200. De ellos, 15 genes se asocian de manera íntima con el volumen de grasa corporal20. Uno de los genes descubiertos por su potencial implicación en el desarrollo de obesidad a edades tempranas es el gen FTO21. Se lo considera inductor de la ganancia progresiva de peso en aquellos sujetos en los que se encuentra sobreexpresado22. Por lo general, su expresión es mayor en las áreas hipotalámicas implicadas en el proceso de alimentación23. En esta misma línea, se ha podido comprobar cómo ante conductas de privación aguda alimentaria su expresión se encuentra modificada, circunstancia que nos sugiere su posible interrelación a nivel de las sensaciones de apetito y saciedad24. Así, datos de un estudio realizado con niños muestran la existencia de una relación estrecha entre la sensación de saciedad manifestada por estos y el grado de expresión del gen. De este modo, aquellos niños portadores de 2 alelos de riesgo, mostraban una significativa menor respuesta de saciedad25.
Por otra parte, desde la década de los años 80, se conocen mutaciones en determinados genes humanos responsables de la aparición de efectos pleiotrópicos que cursan con cuadros de obesidad mórbida como manifestación clínica26. Entre ellos podemos destacar el síndrome de Prader–Willi, de carácter autosómico dominante. En un 70% de los casos, el paciente muestra anomalías en varios genes localizados a su vez en el cromosoma 15 paterno27. Desde un punto de vista clínico, dicho síndrome en el niño se caracteriza por el desarrollo de un cuadro de obesidad, hipotonía muscular, retraso mental, hipogonadismo, criptorquidia y baja talla acompañada de manos y pies pequeños. En determinados casos, este síndrome suele venir asociado a la presencia de diabetes mellitus no insulino-dependiente, así como también de cetogénesis e hiperglucemia28. Este síndrome representa uno de los ejemplos más prevalentes de obesidad dismórfica en el ser humano28.
Y el síndrome de Alström-Hallgren, caracterizado por la aparición de ceguera por distrofia retiniana, sordera nerviosa, miocardiopatía, diabetes mellitus e insuficiencia renal, aunque sin polidactilia ni retraso mental. En dicho síndrome, la obesidad suele aparecer a partir de los 2 años de edad, destacando un incremento en las cifras de peso que a menudo superan en un 100% los valores normales para la edad y sexo del niño29. Otro rasgo característico de dicho cuadro es la presencia de alteraciones cutáneas, entre las que predomina la acantosis nigricans, cuyo origen estriba en la asociación crónica entre diabetes mellitus y una marcada resistencia a la insulina. Su transmisión hereditaria es de tipo autosómico recesiva, y es causada por una mutación en el gen ALMS1 situado en el cromosoma 230.
Microbiota intestinal y su influencia en el desarrollo de obesidadEn la actualidad existe cierta controversia sobre si la microbiota que coloniza el intestino humano se encuentra o no involucrada en el desarrollo de la obesidad. Se sabe que la microbiota intestinal desarrolla tareas bioquímicas esenciales tales como la obtención de energía a través de la dieta, síntesis de vitaminas y otros compuestos absorbibles31. Ahora bien, desequilibrios en la composición de la microbiota intestinal se han asociado con el desarrollo de resistencia insulínica y aumento del peso corporal32. Según esto, en la actualidad se han puesto en marcha numerosos estudios orientados a modular la composición de la microbiota intestinal al objeto de controlar aquellos trastornos que, como la obesidad,tienen una base metabólica. Así, en el estudio desarrollado por Sato et al. (2008)33 se comprobó como la administración de leche fermentada con Lactobacillus gasseri reducía el tamaño de los adipocitos del tejido adiposo mesentérico al mismo tiempo que reducía los niveles de leptina en suero. Ello evidenció el potencial efecto regulador que dichas bacterias tenían sobre el crecimiento del tejido adiposo y, en este sentido, sobre la obesidad. En otro estudio desarrollado por Ma et al. (2008)34, en el que se trabajó con ratones alimentados mediante una dieta rica en grasas, la administración en la dieta de Lactobacillus, Bifidobacterium y Streptococcus, mejoró la esteatosis y resistencia a la insulina inducida en estos ratones por el exceso de grasas. Este tipo de estudios está permitiendo comprender las posibles relaciones entre el metabolismo y determinados componentes de la microbiota. Sin embargo, es necesario seguir profundizando con nuevos estudios para despejar todas las incógnitas y factores implicados en el desarrollo de la obesidad y enfermedades metabólicas asociadas.
Cambios en el patrón de alimentación y de actividad físicaEn el mundo occidental, la emergencia de la biotecnología alimentaria, ha posibilitado consumir durante todo el año cualquier tipo de alimento. Esto, unido a una accesibilidad casi ilimitada a los alimentos por gran parte de la población, ha generado toda una serie de modificaciones en la dieta habitual de los sujetos.
En tal sentido se ha producido un incremento en el consumo de alimentos de origen animal, así como de bebidas carbonatadas de elevado contenido calórico, cuya ingesta representa entre el 20–30% del total de la energía ingerida a diario. Así, ciertos trabajos evidencian cómo un consumo excesivo de zumos de frutas (mayor a 350ml/día) en preescolares puede favorecer el desarrollo de obesidad, llegando incluso a limitar el crecimiento de los niños35. Cabe destacar como la sobrealimentación de los niños y jóvenes por estos productos constituye un elemento central que explica el acúmulo excesivo de grasa corporal36.
González et al. (2010)37, por su parte, plantean que el total de calorías, la composición, potabilidad de los alimentos, variedad de los mismos, tamaño y número de comidas diarias representan también factores estrechamente vinculados a la obesidad.
Ahora bien, otros factores a tener en cuenta son el estilo de vida actual, en el que los horarios laborales de los padres a menudo dificultan la tarea diaria de elaboración de los alimentos, optando en un gran número de casos por comidas precocinadas38 y bebidas ricas en carbohidratos como zumos artificiales de frutas y bebidas carbonatadas en lugar de agua39, por lo que el control sobre la dieta es prácticamente nulo.
Del mismo modo, el hábito de comer fuera de casa de manera permanente contribuye también al incremento progresivo de tejido adiposo ya que dichas comidas suelen ser ricas en grasas y con un elevado contenido calórico. Además, debemos considerar que algunos niños realizan la comida principal del día (almuerzo) en su centro escolar, muchos de ellos con comedores escolares que no cumplen los criterios de una dieta saludable40.
Además de todo lo mencionado, el aumento generalizado de la prevalencia de obesidad en los últimos 25 años responde, en parte, a una progresiva reducción en los niveles de actividad física41. En el caso concreto de los adolescentes se ha podido verificar cómo estos optan por la utilización del transporte público cuando la distancia a caminar excede los 15 minutos de tiempo. Según datos técnicos, ello se traduce en una reducción del 37% del número de desplazamientos a pie y una reducción del 20% del número de kilómetros caminados al año. Datos obtenidos en el estudio ENKID42, señalan que solo el 32,2% de los chicos y un 17,8% de las chicas entre los 6 y los 9 años de edad hacen deporte más de 2 días a la semana en su tiempo libre. Consideramos que los datos ofrecidos son realmente estremecedores. Respecto de la prevalencia de sedentarismo en nuestro país, y distinguiendo entre comunidades autónomas, se observa que son las comunidades de Andalucía, con un 64%, y el archipiélago canario, con un 68%, los territorios con mayores tasas de ocio sedentario entre su población infantil y adolescente37.
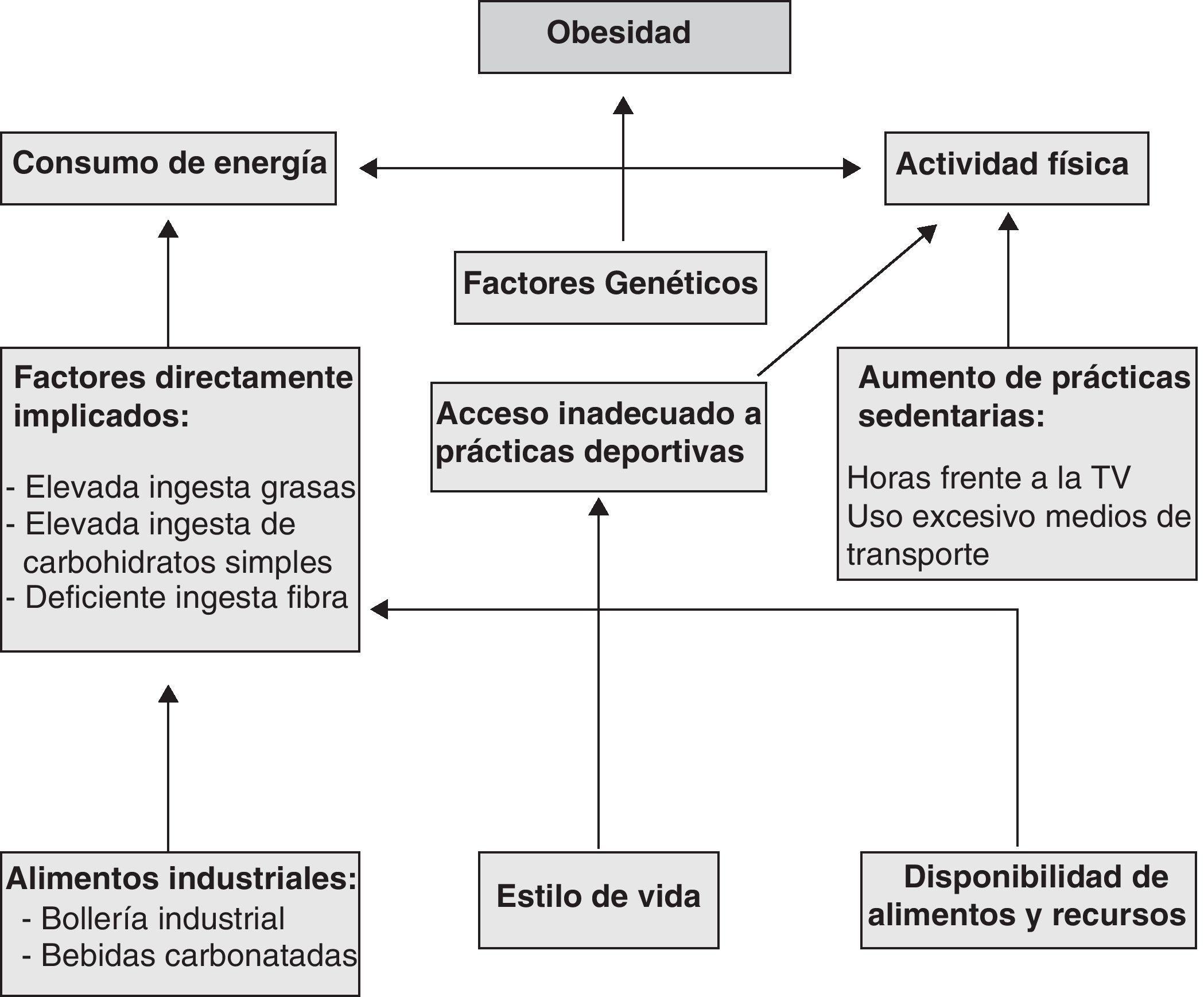
De acuerdo con Stefanick43, existe un mayor consenso acerca de que la actividad física diaria es el factor preponderante en el mantenimiento del peso corporal, y por consiguiente, importante para la pérdida ponderal. Sin embargo, debemos prestar especial consideración a todas aquellas actividades consideradas como de bajo gasto energético para el organismo, dado que en una amplia mayoría de casos será a expensas de estas como se logre alcanzar y mantener regulado el peso corporal44. En la figura 1 se muestran representados los factores implicados en el desarrollo de la obesidad.
Marco conceptual sobre los principales factores implicados en la obesidad.
Adaptado de: González E, 201037.
De acuerdo con la primera ley de la termodinámica, la obesidad es el resultado del desequilibrio entre el gasto y el aporte de energía. Esta energía procede, en el caso de nuestro organismo, de los principios inmediatos: carbohidratos, proteínas y grasas45. Los carbohidratos son el primer escalón en el suministro de energía. Cuando el consumo de carbohidratos excede los requerimientos, estos se convierten en grasas. En ausencia, o con niveles muy bajos de glúcidos, las grasas son movilizadas siendo utilizadas para la producción de energía. A este proceso se le conoce como lipólisis, y en él, las grasas son convertidas en ácidos grasos y glicerol. De este modo, el cuerpo humano cumple las leyes físicas representadas por este primer principio de la termodinámica, según el cual la energía ni se crea ni se destruye, solo se transforma. Todo exceso de energía introducida cambia la energía interna del organismo y se transforma en energía química, y como principal almacén está el tejido graso46. Un ingreso energético (IE) mayor que el gasto o consumo energético total (CET), inevitablemente causará un aumento del tejido adiposo, que siempre se acompaña del incremento de la masa magra, así como también del peso corporal, en cuyo control el CET desempeña una función importante47.
Según esto, el peso corporal podrá variar en relación con la ingestión y el gasto energético total (GET), que es igual al gasto energético en reposo o basal (GEB) más el gasto energético durante la actividad física (GEA) y el gasto energético derivado del proceso de termogénesis (GET)48. Todo ello vendría definido en la ecuación de balance energético:
Ahora bien, en la regulación del gasto energético y de la ingesta participan el sistema nervioso, el sistema digestivo con órganos como el hígado y el páncreas, y el adipocito 49. El adipocito es una célula altamente diferenciada con 3 funciones: almacén, liberación de energía y endocrino metabólica. Puede cambiar su diámetro 20 veces, y su volumen mil. Cada adipocito es capaz de almacenar en su interior un volumen máximo de 1,2 microgramos de triglicéridos. En este proceso, denominado esterificación, tendrá lugar la participación de 2 enzimas, la lipoproteinlipasa (LPL) y la proteína estimulante de acilación (ASP), ambas activadas a partir de la acción de la insulina y los quilomicrones. La cantidad de triglicéridos almacenados en el interior del adipocito no suele exceder los 0,6 microgramos por célula. Considerando que el número promedio de adipocitos presentes en cada sujeto es de 30 a 60×109, y que cada uno de estos contiene en su interior 0,5 microgramos de triglicéridos, podemos valorar o inferir un volumen graso total de 15 kg o lo que es lo mismo 135.000 kcal50.
Es, sin embargo, el descubrimiento de la leptina y de los genes que regulan su producción desde el adipocito, lo que ha originado la gran revolución en el conocimiento de la regulación ingesta-gasto y, por lo tanto, en el estudio de la obesidad. La leptina constituye el resultado o la síntesis final del gen-ob. Dicho gen se encuentra localizado, en el caso humano, en el cromosoma 7q 31,351. Cuenta con 650kb y está constituido por 3 exones separados a su vez por 2 intrones, siendo los exones 2 y 3 los portadores de la región que codifica la síntesis de leptina51.
Por su estructura bioquímica, se trata de un péptido compuesto por 167 aminoácidos cuya secuencia resulta similar en diferentes especies. Tanto es así que la leptina del ratón y la rata mantienen un 84 y un 83% de homología con la leptina del humano, respectivamente52. A través de esta hormona, el hipotálamo ejerce un efecto controlador de la homeostasis energética del organismo, modulando la ingesta y contrarrestando un potencial balance energético positivo53. Para ello, la leptina provoca una activación de los sistemas efectores catabólicos. Estos van a provocar una reducción de la adiposidad por medio de una inhibición del apetito (efecto anorexígeno), estimulando con ello el gasto energético e inhabilitando los sistemas efectores anabólicos cuyo objetivo es aumentar la adiposidad corporal (vía aumento de apetito), favoreciendo así el proceso de lipolisis del tejido adiposo54.
Su acción anorexígena la ejerce a través de su receptor ubicado en las neuronas del núcleo infundibular del hipotálamo. Una vez activado el receptor se pondrán en marcha un complejo entramado de mecanismos. En ellos, una disminución de la secreción de neuropéptido Y, el estimulador del apetito endógeno más potente55. En segundo lugar, y de forma paralela, tendrá lugar una disminución en la secreción de la proteína relacionada con el agouti. Dicha proteína es un antagonista de los receptores de la melanocortina 1 y 4, que a su vez son reguladores del apetito55.
La leptina, a través del hipotálamo, utiliza el sistema nervioso simpático para estimular la liberación de tirotropina56. Además, por mediación de la leptina, los receptores noradrenérgicos también modulan el peso corporal, mediante la estimulación de los receptores alfa 1 y beta 3 disminuyendo la ingesta y aumentando el gasto energético57.
Por su parte, el sistema nervioso parasimpático eferente modula el metabolismo hepático, la secreción de insulina y el vaciamiento gástrico, participando de este modo en el control y regulación del peso corporal.
Asimismo, los estímulos olfatorios y gustativos producidos por el alimento participan igualmente en la regulación de la ingesta. Dichos estímulos constituyen señales periféricas que a su vez serán integradas y procesadas a nivel del sistema nervioso liberando neurotransmisores, que van a modular nuestra ingesta. De ellos el mejor estudiado es la serotonina. Los receptores de la serotonina intervienen regulando la cantidad de alimento ingerido y la selección de macronutrientes. Su estimulación a nivel hipotalámico reduce la ingestión en general, y de forma específica la de las grasas58.
La hormona α–melanocito estimulante (α-MSH) es un péptido anorexígeno estrechamente implicado en la regulación de la ingesta. Es sintetizada en al núcleo arqueado desde donde se distribuye ampliamente por el sistema nervioso central, especialmente a nivel del núcleo paraventricular. Su administración en el sistema ventricular del cerebro causa disminución del apetito y aumento de la termogénesis59. Su acción se establece a nivel cerebral interaccionando con receptores tipo 3 y 4 (MC3 y MC4). Sus efectos en humanos son cada vez mejor conocidos, pudiendo constituir una de las piezas clave en el tratamiento de la obesidad59.
Otra biomolécula implicada en la modulación de la ingesta alimentaria es el neuropéptido Y. Este tiene como función principal incrementar la ingesta de alimentos, y constituye el neurotransmisor más potente de acción anabólica60.
Los péptidos intestinales poseen igualmente una acción moduladora respecto de la ingestión de alimentos. Así, péptidos como la colecistocinina, el péptido liberador de gastrina y la bombesina disminuyen la ingesta de alimentos. Por su parte, la insulina tiene un efecto anabólico, favoreciendo la captación de glucosa y el acúmulo de lípidos a nivel de los tejidos 61.
La grelina, descubierta en por Jojima (1999)62, constituye el primer péptido de efecto orexígeno descrito. Actúa a nivel del hipotálamo mediante 3 vías: por una parte, accediendo al núcleo arqueado a través de la circulación sanguínea atravesando la barrera hematoencefálica. Una segunda vía mediante aferencias vagales que llegan desde el estómago hasta el hipotálamo por medio del nervio vago. O bien, mediante una síntesis intra-hipotalámica63. Otros estudios han puesto de manifiesto como los niveles plasmáticos de ghrelina se elevan en períodos de balance energético negativo, esto es, en situaciones de ayuno para a continuación normalizarse al ingerir alimento64.
Otros péptidos gastrointestinales implicados en el proceso de saciedad son el polipéptido insulinotrópico dependiente de glucosa (GIP), con capacidad para inducir la secreción de insulina ante concentraciones elevadas de glucosa en sangre65. Estudios a partir de ratones deficientes en su receptor desarrollaron un fenotipo resistente a la obesidad inducida por la dieta, por lo que GIP puede estar involucrado en la patogenia de la obesidad central66. La secreción del péptido similar al glucagon tipo 1 (GLP-1) por las células L del intestino, preferentemente a nivel de íleon y colon, tiene lugar tras la ingestión de nutrientes (hidratos de carbono y ácidos grasos) y en proporción con el contenido calórico. En el estudio desarrollado por Näslund et al. 67, se evidenció como en pacientes obesos la administración subcutánea de GLP-1 antes de cada comida durante 5 días reducía en hasta un 15% su ingesta generando una pérdida de peso de 0,5kg. Finalmente el péptido YY (PYY) o tirosina-tirosina, perteneciente a la familia del polipéptido pancreático (PP). Es sintetizado por las células L del tracto gastrointestinal distal (colon y recto), aunque también está presente en estómago, páncreas y determinadas regiones del sistema nervioso central68. Dicho péptido es secretado en función de la ingesta calórica, siendo los lípidos los responsables mayores de su secreción68. En situaciones de ayuno, sus valores plasmáticos son bajos, elevándose en los 15-30 minutos previos al comienzo de la ingesta69. Su secreción y liberación a la sangre posibilita la absorción de nutrientes mediante el retrasado del vaciamiento gástrico y tránsito intestinal69.
Otra hormona sintetizada por el páncreas e igualmente implicada en la regulación de la ingesta alimentaria es el glucagón. Dicha hormona tiene como función principal estimular la degradación del glucógeno y la puesta en marcha de la gluconeogénesis favoreciendo con ello el catabolismo. Desde un punto de vista exocrino, el páncreas sintetiza la enterostatina (señal peptídica de la colipasa pancreática) cuya función es disminuir la ingesta de grasa y producir saciedad70.
En el caso de los sistemas eferentes de control del peso corporal cabe destacar por su importancia y participación el sistema endocrino y el neurovegetativo. El sistema endocrino está representado por las hormonas del crecimiento, las tiroideas, las gonadales, los glucorticoides y la insulina71.
Durante la etapa del desarrollo la hormona del crecimiento y las tiroideas trabajan al unísono para aumentar el crecimiento. La hormona del crecimiento, una vez en la sangre, estimula al hígado para que produzca otra hormona, el factor de crecimiento insulínico (IGF-1), el cual juega un papel clave en el crecimiento durante la niñez. Por su parte, las hormonas tiroideas actúan incrementando la síntesis de proteínas en todos los tejidos del organismo72.
Durante el desarrollo puberal comienzan a funcionar los esteroides gonadales. Así, la testosterona aumenta el peso corporal magro en relación con la grasa, mientras que los estrógenos realizan el efecto contrario. Por su parte, los niveles de testosterona disminuyen a medida que el varón avanza en edad, causando un aumento de la grasa visceral y corporal total así como una disminución del peso corporal magro72. En el caso de los glucocorticoides suprarrenales, estos desarrollan una acción importante en el control neuroendocrino de la ingesta alimentaria y el consumo energético72.
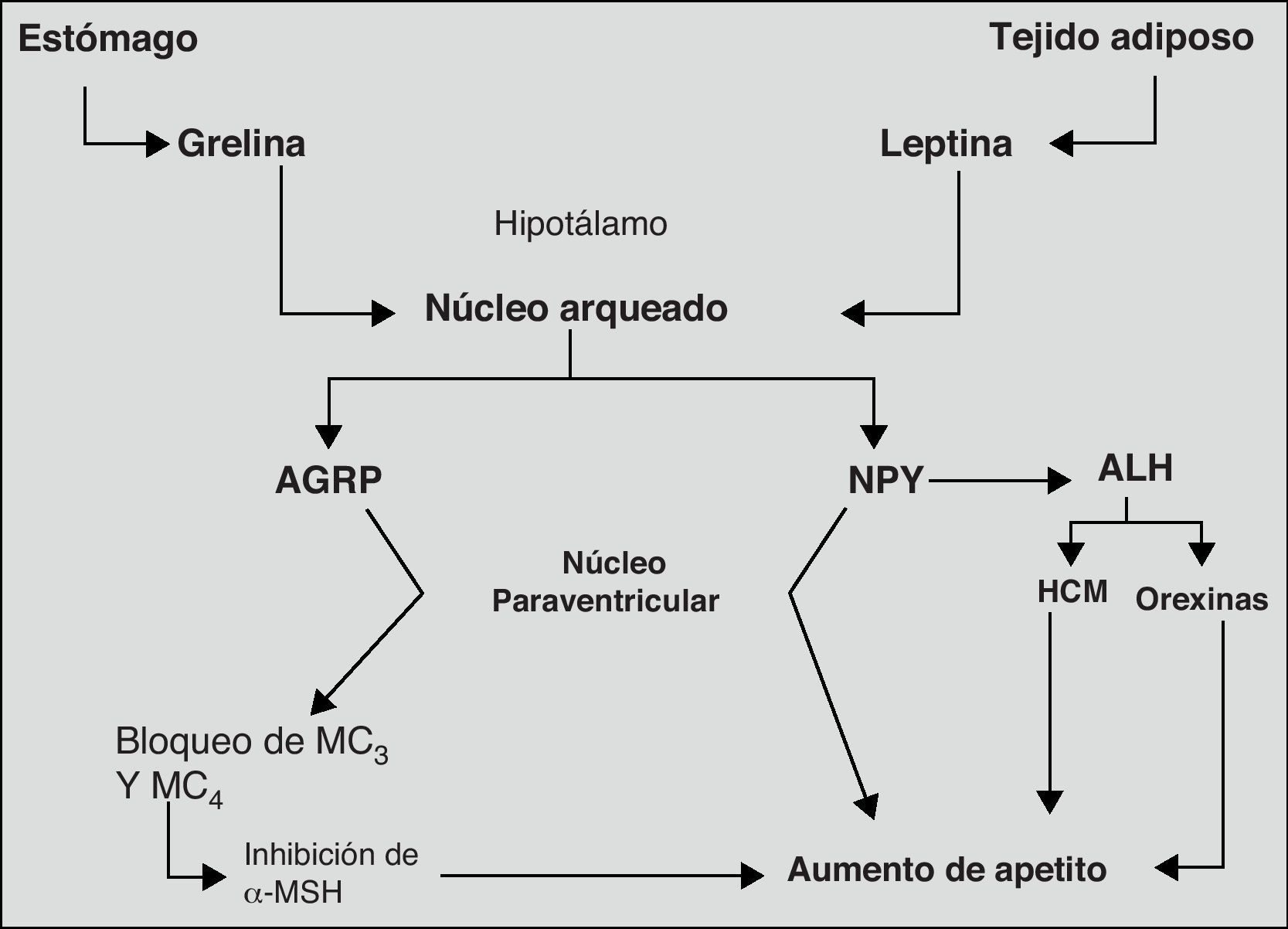
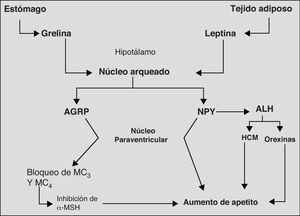
Finalmente, el sistema neurovegetativo representa el último eslabón en la cadena de procesos y biomoléculas que llevan a cabo el control del peso corporal. Su acción principal tiene lugar mediante la regulación de las secreciones hormonales y la termogénesis73. En la figura 2, se muestran más claramente los mecanismos, principales biomoléculas y estructuras del sistema nervioso implicadas en la regulación del apetito.
Principales mecanismos orexígenos implicados en la regulación del apetito.
Adaptado de: Tébar FJ et al., 200374
ALH: área lateral de hipotálamo; AGRP: péptido relacionado con agouti; HCM, hormona concentradora de melanocitos; MC, receptores de MSH; MSH, hormona melanocito estimulante; NPY, neuropéptido Y; NPV; núcleo paraventricular.
Sea cual sea la etiología de la obesidad, una adecuada comprensión de los mecanismos involucrados en la regulación del balance energético constituye la clave para comprender la etiopatogenia y fisiopatología de la creciente pandemia de obesidad.
Los 2 importantes sistemas eferentes de control del peso corporal, el sistema endocrino con la hormona del crecimiento, las hormonas tiroideas, gonadales, los glucocorticoides y la insulina, junto al sistema neurovegetativo contribuyen en su conjunto al mantenimiento y equilibrio del balance energético.
Por último, el gran avance en el conocimiento de las principales biomoléculas que regulan el peso corporal y la ingesta alimentaria tiene importantes implicaciones para el manejo clínico y abordaje terapéutico de la obesidad. A pesar de que la dieta y el ejercicio continúan siendo los pilares centrales en el manejo de la obesidad, son cada vez más los pacientes que requieren de un apoyo farmacológico para lograr o mantener una reducción de su peso corporal. En este sentido, la intervención a nivel de ciertos procesos o fases del sistema de homeostasis energética podría ser la clave para mejorar la salud y estado nutricional de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.