En la actualidad contamos con escasas herramientas terapéuticas eficaces para combatir la creciente prevalencia de obesidad y comorbilidades asociadas. La cirugía bariátrica es el único tratamiento que ha demostrado su efectividad a largo plazo. Sin embargo, la alta complejidad técnica de la misma, junto a las características de los propios pacientes, implican un elevado riesgo quirúrgico e importante coste económico. Esto está llevando al desarrollo de nuevos procedimientos por vía endoscópica con un menor riesgo clínico y coste económico, manteniendo los beneficios en cuanto a morbimortalidad, incluso pudiendo servir de elemento «puente» previamente a la cirugía en los casos en que esta sea inevitable, pero permitiendo una pérdida de peso y control de comorbilidades que mejoren el riesgo prequirúrgico. El objeto de nuestra revisión es el análisis de las técnicas endoscópicas más relevantes en estos momentos.
Few effective therapeutic tools are currently available to fight the increasing prevalence of obesity and its associated comorbidities. Bariatric surgery is the only treatment with proven long-term effectiveness, but is associated to a high surgical risk and significant economic costs because of its technical complexity and the characteristics of patients. This is leading to development of new endoscopic procedures with less clinical risks and economic costs, while maintaining the benefits in terms of morbidity and mortality, which could even serve as a bridging element before surgery in cases where this is unavoidable, allowing for preoperative weight loss and control of comorbidities in order to improve anesthetic risks and possible complications. The purpose of this review was to analyze the most relevant and promising endoscopic techniques currently available.
La obesidad es una de las grandes epidemias de nuestro tiempo. En España, el 22,9% (varones 24,4%, mujeres 21,4%) de la población presenta obesidad, y su prevalencia aumenta con la edad, como muestra el estudio ENRICA1. Además, las tendencias indican un aumento gradual y constante de la incidencia, lo que a la larga conllevará un notable aumento de la morbimortalidad (Estudio Di@bet.es2).
Actualmente el tratamiento de la obesidad se basa en medidas higiénico-dietéticas, existiendo una relativa escasez de alternativas farmacológicas. En los últimos años se han retirado del mercado varios compuestos, como fenfluramina y dexfenfluramina, sibutramina y rimonabant, y aunque recientemente la Food and Drug Administration (FDA) ha aprobado la asociación de fentermina y topiramato (Qnexa®) y la lorcaserina (Belviq®)3, en la actualidad la única alternativa farmacológica con indicación única en Europa como fármaco antiobesidad es el orlistat4,5.
En este contexto clínico, cobra cada vez más fuerza la cirugía de la obesidad, reservada habitualmente para los casos severos, como obesidades con un índice de masa corporal (IMC)>40kg/m2 o>35kg/m2 y comorbilidades asociadas, sobre todo la diabetes mellitus. No es infrecuente que estos pacientes presenten un elevado riesgo quirúrgico precisamente a causa de estas complicaciones asociadas, a veces inasumible. Asimismo, el aumento de la prevalencia de obesidad grado ii a iv, y lo limitado de los recursos obligan a buscar nuevas soluciones. Existen varias alternativas a los métodos tradicionales quirúrgicos, los conocidos como procedimientos mínimamente invasivos, que implican menores riesgos quirúrgicos, mejoran la calidad de vida del enfermo e incluso pueden disminuir los riesgos, permitiendo con el paso del tiempo realizar procedimientos quirúrgicos definitivos invasivos, de ser necesarios.
Métodos endoscópicos en el tratamiento de la obesidadLa obesidad es una de las principales causas de muerte prevenibles, aumentando la mortalidad a partir de un IMC superior a 30kg/m2 del 79 al 270% en la población entre 20 y 49 años6. Es una epidemia que, lejos de disminuir, parece ir in crescendo, así como las complicaciones y la morbimortalidad asociadas7. Actualmente, su tratamiento se basa en modificar la dieta, los estilos de vida y, en casos de obesidad grado iii o grado ii con comorbilidades asociadas, en la cirugía de la obesidad, con un papel limitado de las medidas farmacológicas. Recientemente, los conocidos como procedimientos mínimamente invasivos8–14 se postulan como alternativa a la cirugía de la obesidad. Tanto estos procedimientos como las técnicas de cirugía bariátrica se basan en los mismos conceptos: la restricción del volumen gástrico disminuyendo su capacidad para albergar alimentos y, por tanto, induciendo saciedad precoz, la malabsorción parcial de los nutrientes (alterando la fisiología de la digestión y la interacción enzima-sustrato y/o reduciendo directamente la superficie efectiva de absorción) y los mecanismos mixtos. Así, las técnicas endoscópicas en el tratamiento de la obesidad pueden clasificarse de manera resumida en: balones intragástricos, sistemas de sutura gástrica, implantes endoscópicos y otros dispositivos, tal y como se recoge en la tabla 1.
Métodos endoscópicos en el tratamiento de la obesidad
| A. Balones y prótesis |
| 1. BioEnterics® Gastric Balloon-Allergan. Balón esférico de silicona de 600-800ml de volumen, colocación endoscópica |
| 2. Balón intragástrico Ullorex®. Balón de poliuretano contenido en una cápsula que se ingiere por vía oral sin endoscopia. Al contacto con el ácido gástrico, libera CO2, expandiéndose hasta un volumen de 300cc. Permanece 25-30 días en el estómago |
| 3. Balón intragástrico ajustable de Spatz. Balón de silicona montado sobre un catéter de inflado en una de sus caras, que puede ser extraído por la boca, permitiendo ajustar el volumen mientras el balón permanece en el estómago, según los síntomas del paciente. Suele rellenarse con 500cc de suero salino |
| 4. Heliosphere Bag®. Balón relleno de aire, con un volumen de 550cc y 10cm de diámetro. Su bajo peso (<30g) limita los efectos secundarios |
| 5. Balón antral semiestacionario. Dispositivo piriforme relleno de 100-150cc de suero fisiológico de anclaje antral (con el polo cónico orientado a píloro). Dispone de un apéndice duodenal de 30cm de longitud con un contrapeso metálico |
| 6. Balón gástrico Silimed®. Balón esférico recubierto de silicona y con una válvula autoadhesiva que se rellena con 650cc de suero fisiológico |
| 7. Endogast® (prótesis intragástrica implantable totalmente ajustable). Prótesis ovalada de poliuretano inflada de aire (210-300ml) de inserción similar a la gastrostomía endoscópica percutánea; conectada a un sistema subcutáneo totalmente implantable que permite ajustar el volumen |
| B. Sistema de suturas |
| 1. Gastroplastia transoral |
| 2. Gastroplastia vertical endoluminal y variantes |
| 3. Cirugía primaria endoluminal de la obesidad (sistema POSE®) |
| 4. Otras |
| C. Implantes |
| 1. Implante restrictivo transoral endoscópico |
| D. Técnicas malabsortivas |
| 1. EndoBarrier® |
| 2. ValenTx® |
| E. Inyección de sustancias |
| 1. Toxina botulínica A |
| F. Otras: neuroelectroestimuladores, sistema Butterfly |
El balón intragástrico (BIG) es un dispositivo cuyo objetivo es producir sensación de saciedad y limitar la ingesta de alimentos por ocupación de espacio. Se coloca durante 6 a 8 meses, y su función es servir como medio de apoyo para la modificación de hábitos de vida y de conductas alimentarias. La primera descripción de un BIG data de 19829; los primeros modelos eran cilindros de poliuretano con un mecanismo valvular de inflado con 220ml de aire sin sistema de anclado y extracción endoscópica (Garren-Edwards® Gastric Bubble, aprobado por la FDA y comercializado en EE. UU. en 1985)13,15,16. Como complicaciones más frecuentes, se producían obstrucciones intestinales, desinflados del balón, erosiones gástricas, desgarros y laceraciones esofágicas en la colocación. Esto, unido a unos resultados pobres en los estudios de eficacia, atribuibles a sesgo de selección entre los participantes y a un volumen inferior al inicialmente previsto (400ml), determinó su retirada.
No fue hasta 1987 cuando tras una reunión de expertos en Tarpon Springs (Florida) se sentaron las características básicas que debía reunir un BIG13,15–17 (tabla 2).
Tras esta reunión surgieron nuevos dispositivos, como los de Ballobes (Dinamarca), Mill-Rose (Reino Unido), Willmen (Alemania) y Dow-Corning (Canadá), de volúmenes entre 400 y 550ml y rellenos de aire y líquido16. El más utilizado actualmente, con discretas modificaciones, es el modelo BioEnterics®, introducido en 1991 (BioEnterics® Gastric Balloon, compañía Inamed), aunque también se encuentra disponible el dispositivo Heliosphere® (relleno de aire, en forma de bolsa), de la compañía francesa Helioscopie Medical Implants, ambos aprobados para su uso en Europa, Sudamérica y Asia, incluyendo Japón, pero no por la FDA9,13. Asimismo, existe el dispositivo Endogast® (ATIIP, Districlass Medical, Francia), con inserción mixta endoscópica y quirúrgica al poseer un puerto de inflado y desinflado unido al balón de implantación subcutánea10,13,14,18.
La versión BioEnterics® Gastric Balloon actual, disponible desde 1999, consiste en un balón de elastómero transparente de silicona, resistente al ácido gástrico. Posee un sistema valvular radioopaco autosellable, y está relleno de suero salino, con volumen ajustable de 400-800ml. Se coloca bajo anestesia general o sedación profunda, y debe extraerse con anestesia general, recomendando algunos autores la intubación orotraqueal para proteger la vía aérea9. Las complicaciones son similares a las de los primeros dispositivos, aunque más raras15 (tabla 3).
Ventajas e inconvenientes del balón intragástrico
| Ventajas |
| Escaso riesgo |
| No implica modificaciones anatomofuncionales |
| No requiere cirugía |
| Reversible |
| Favorece cambios en el estilo de vida y hábitos alimentarios |
| Permite asociar otros tratamientos |
| Permite mejorar la autoestima y calidad de vida |
| Inconvenientes |
| Requiere seguimiento clínico estrecho |
| Necesidad de compromiso por parte del paciente |
| No es un tratamiento definitivo |
| No exento de complicaciones |
| Imprescindible cambios en el estilo de vida y hábitos de alimentación para que sea efectivo |
Su mecanismo de acción se basa en la inducción de un retraso del vaciamiento gástrico por mecanismos físicos, favoreciendo la sensación de plenitud y saciedad precoz mediada por la secreción de colecistocinina9, y reduciendo la ingesta. Asimismo, parece disminuir los niveles de leptina y aumentar los de adiponectina19. Se ha planteado también un posible papel de la ghrelina19, al haberse observado experimentalmente un descenso de sus niveles atribuido a la distensión mecánica del fundus gástrico, aunque no se ha confirmado en estudios posteriores20. El BIG permite, asimismo, un tratamiento conductual integral, ayudando a modificar actitudes y favoreciendo la implicación del paciente. En definitiva, se obtiene un efecto similar al de la dieta hipocalórica restrictiva, pero mejorando el cumplimiento.
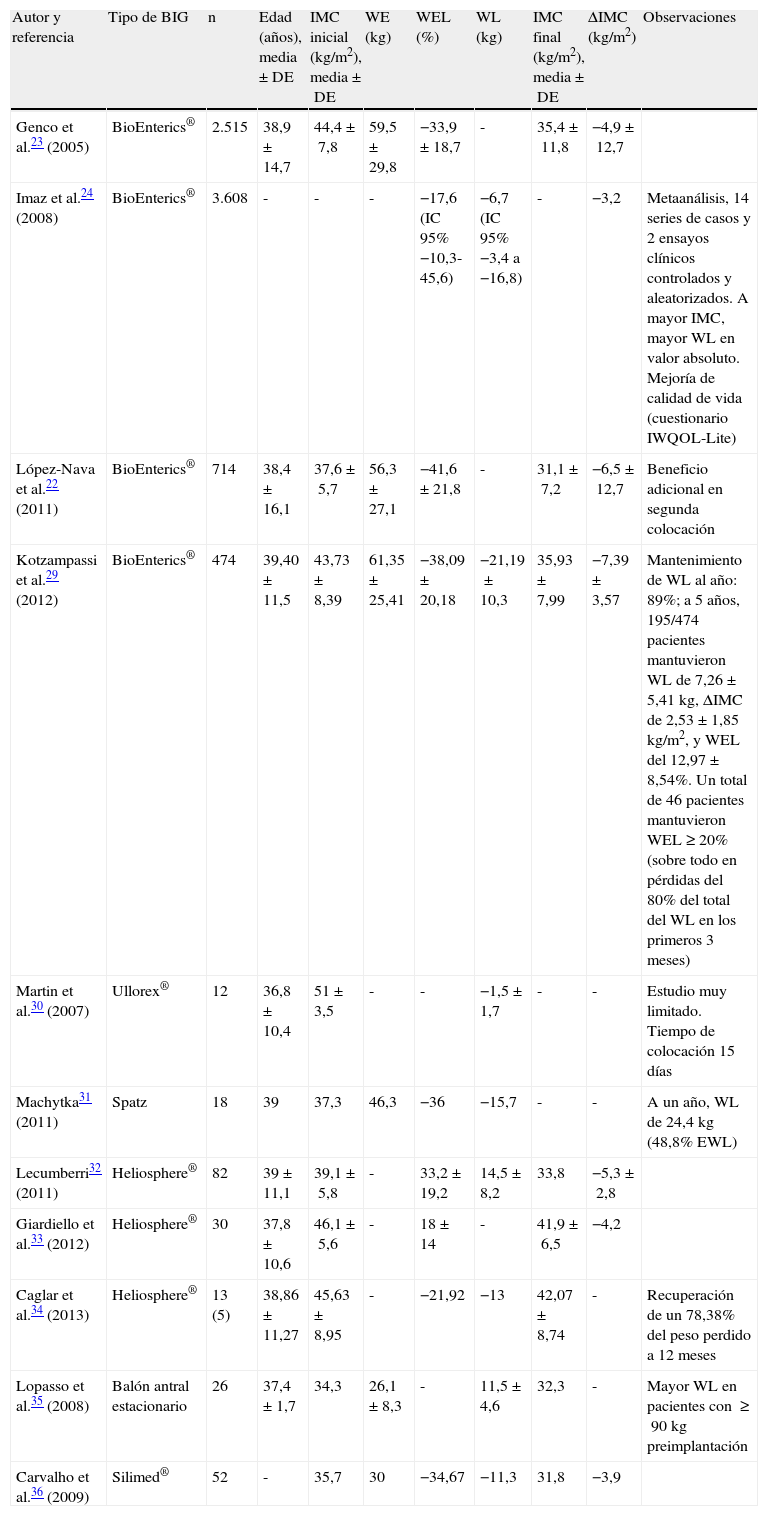
En cuanto a evidencias en términos de efectividad, los principales trabajos se centran en el balón intragástrico BioEnterics® (BIB®)-Allergan, el más utilizado. El BIB® es eficaz a corto plazo en un 66,6% de los pacientes, con una weight loss (WL, «pérdida de peso») media de 17,8kg y mejoría significativa a corto plazo de las comorbilidades21-24, obteniendo excelentes resultados con modestas WL y mejorando la calidad de vida (cuestionario IWQOL-Lite)25–28. En la tabla 4 se recogen distintos estudios con diversos balones22–36.
Eficacia del balón intragástrico
| Autor y referencia | Tipo de BIG | n | Edad (años), media±DE | IMC inicial (kg/m2), media±DE | WE (kg) | WEL (%) | WL (kg) | IMC final (kg/m2), media±DE | ΔIMC (kg/m2) | Observaciones |
| Genco et al.23 (2005) | BioEnterics® | 2.515 | 38,9±14,7 | 44,4±7,8 | 59,5±29,8 | −33,9±18,7 | - | 35,4±11,8 | −4,9±12,7 | |
| Imaz et al.24 (2008) | BioEnterics® | 3.608 | - | - | - | −17,6 (IC 95% −10,3-45,6) | −6,7 (IC 95% −3,4 a −16,8) | - | −3,2 | Metaanálisis, 14 series de casos y 2 ensayos clínicos controlados y aleatorizados. A mayor IMC, mayor WL en valor absoluto. Mejoría de calidad de vida (cuestionario IWQOL-Lite) |
| López-Nava et al.22 (2011) | BioEnterics® | 714 | 38,4±16,1 | 37,6±5,7 | 56,3±27,1 | −41,6±21,8 | - | 31,1±7,2 | −6,5±12,7 | Beneficio adicional en segunda colocación |
| Kotzampassi et al.29 (2012) | BioEnterics® | 474 | 39,40±11,5 | 43,73±8,39 | 61,35±25,41 | −38,09±20,18 | −21,19±10,3 | 35,93±7,99 | −7,39±3,57 | Mantenimiento de WL al año: 89%; a 5 años, 195/474 pacientes mantuvieron WL de 7,26±5,41kg, ΔIMC de 2,53±1,85kg/m2, y WEL del 12,97±8,54%. Un total de 46 pacientes mantuvieron WEL≥20% (sobre todo en pérdidas del 80% del total del WL en los primeros 3 meses) |
| Martin et al.30 (2007) | Ullorex® | 12 | 36,8±10,4 | 51±3,5 | - | - | −1,5±1,7 | - | - | Estudio muy limitado. Tiempo de colocación 15 días |
| Machytka31 (2011) | Spatz | 18 | 39 | 37,3 | 46,3 | −36 | −15,7 | - | - | A un año, WL de 24,4kg (48,8% EWL) |
| Lecumberri32 (2011) | Heliosphere® | 82 | 39±11,1 | 39,1±5,8 | - | 33,2±19,2 | 14,5±8,2 | 33,8 | −5,3±2,8 | |
| Giardiello et al.33 (2012) | Heliosphere® | 30 | 37,8±10,6 | 46,1±5,6 | - | 18±14 | - | 41,9±6,5 | −4,2 | |
| Caglar et al.34 (2013) | Heliosphere® | 13 (5) | 38,86±11,27 | 45,63±8,95 | - | −21,92 | −13 | 42,07±8,74 | - | Recuperación de un 78,38% del peso perdido a 12 meses |
| Lopasso et al.35 (2008) | Balón antral estacionario | 26 | 37,4±1,7 | 34,3 | 26,1±8,3 | - | 11,5±4,6 | 32,3 | - | Mayor WL en pacientes con ≥90kg preimplantación |
| Carvalho et al.36 (2009) | Silimed® | 52 | - | 35,7 | 30 | −34,67 | −11,3 | 31,8 | −3,9 |
ΔIMC: variación del índice de masa corporal; WEL: weight excess loss.
Sobre la diabetes mellitus, Genco et al. encuentran con BIB® remisión (32,8%) o mejoría (54,4%) en el momento de la explantación23, con descensos de hemoglobina glucosilada (HbA1c) significativos. En otro estudio, Crea et al. encontraron un descenso de HbA1c desde el 7,5±2,1% basal al 5,7±1,9% en el momento de la explantación, manteniéndose a 6 (5,6±0,7%) y 12 meses (5,5±0,9%) el efecto positivo en el control glucémico37. En todo caso, no disponemos de datos a más de un año.
El candidato a BIG debe ser un adulto motivado idealmente con sobrepeso moderado, predispuesto a cambiar el estilo de vida y colaborar con el equipo médico. Las indicaciones del BIG9,13,16,38 son:
- 1.
Tratamiento adyuvante de la obesidad en casos refractarios a medidas conservadoras:
- -
IMC 30-34,99kg/m2 con comorbilidades moderadas.
- -
IMC 35-39,99kg/m2.
- -
IMC 40-49,99kg/m2 no candidatos a cirugía bariátrica (elevado riesgo quirúrgico, comorbilidades o negativa a intervención).
- -
- 2.
Pacientes con IMC>50kg/m2 como adyuvante a la pérdida de peso precirugía bariátrica.
- 3.
Excepcionalmente, IMC entre 27-29,9kg/m2, con comorbilidades muy severas que podrían mejorar con la pérdida de peso.
Las contraindicaciones del BIG son9,13,16,38:
- 1.
Hernia hiatal gigante (>3-5cm).
- 2.
Alteraciones faringoesofágicas morfofuncionales (relativa).
- 3.
Esofagitis severa grado C-D (Escala de Los Ángeles, Lundell, 1999) (relativa).
- 4.
Varices esofágicas/hepatopatía severa. Lesiones susceptibles de sangrado.
- 5.
Ulcera péptica activa.
- 6.
Cirugía gástrica o abdominal previa (relativa)/gastroparesia.
- 7.
Gestación o deseo.
- 8.
Neoplasias activas o en remisión<5 años.
- 9.
Coagulopatía o uso de AINE (relativa)/dicumarínicos/corticoides.
- 10.
Enfermedad de Crohn (relativa).
- 11.
Alteraciones psiquiátricas severas.
- 12.
Alcoholismo activo. Toxicomanías.
- 13.
Enfermedades susceptibles de descompensación secundaria a vómitos y/o deshidratación.
- 14.
Edad>65 años (relativa) y<18 años.
- 15.
15 Paciente no colaborador.
- 16.
Imposibilidad técnica de retirada en<48h en caso de vaciado (relativa).
- 17.
Obesidad secundaria.
Los efectos secundarios más frecuentes son las náuseas y vómitos (99%), que comienzan a las 4-5h poscolocación y pueden prolongarse durante 4-5 días con pobre respuesta a antieméticos. En un 30% asocian epigastralgia, por lo que en todos los pacientes con BIG se recomienda tratamiento con inhibidores de la bomba de protones (IBP) mientras lo porten. También puede existir déficit de tiamina13,16,24,39 (tabla 5).
Complicaciones del balón intragástrico
| Tasa de retirada precoz (retirada voluntaria) | 4,2% (1,8%) |
| Vómitos | |
| Precoces, obligando a retirar dispositivo | 0,9% |
| Tardíos (tras la primera semana) | 8,6% |
| Reflujo gastroesofágico | 1,8% |
| Malestar abdominal | |
| Precoz, precisando retirar dispositivo | 0,9% |
| Tardío | 5,0% |
| Hipopotasemia | 1,6% |
| Deshidratación (mecanismo prerrenal) | |
| Precoz | 0,1% |
| Tardía | 1,6% |
| Alteraciones del tránsito (estreñimiento/diarrea) | 0,7% |
| Obstrucción intestinal | |
| Precoz | 0,6% |
| Tardía | 0,8% |
| Desinflado (>50% del volumen inicial) | |
| Precoz | |
| Con desplazamiento | 0,1% |
| Sin desplazamiento | 0,3% |
| Tardío | |
| Con desplazamiento | 2,5% |
| Sin desplazamiento | 0,9% |
| Esofagitis, gastritis, erosiones, desgarros por síndrome de Mallory-Weiss | 2,1% |
| Úlcera gástrica | |
| Precoz | 0,1% |
| Tardía | 0,4% |
| Perforación gástrica | 0,10% |
| Exitus | 0,10% |
En los dispositivos rellenos de suero salino se suelen añadir de 10 a 20ml de azul de metileno, a fin de detectar desinflados precozmente, ya que al pasar al torrente sanguíneo, tiñe de un color verdoso la orina9,13,15.
Debe asegurarse una ingesta mínima de 1,5L de agua/día. Se recomienda, una vez colocado, dieta hipocalórica e hipograsa cualitativa fraccionada en 5 tomas con inicio progresivo20, y visitas de control como mínimo una vez cada 15-30 días, durante los 6 meses posimplantación para comprobar peso y estado general, y una vez al mes posexplantación.
Métodos de suturaGastroplastia transoralEl sistema TOGA® (Satiety Inc., Palo Alto, CA, EE. UU.) es un procedimiento endoscópico similar a la cirugía restrictiva, pero menos invasivo, que consta de un par de grapadoras desechables. La grapadora de manga crea un grapado englobando todo el grosor de la pared del estómago proximal y realiza una plicatura, remedando un sleeve vertical paralelo a la curvatura menor. Seguidamente, con la de restricción se reduce la salida creando la «bolsa» de restricción de la gastroplastia vertical9–11,13,14,18,39,40. Los pacientes se recuperan en 24h, precisando radiografía de control y tránsito baritado previo al alta. Durante las 2 primeras semanas se limita la ingesta a líquidos poco espesos y suplemento proteico, progresando las 2 semanas siguientes en consistencia e introduciendo los sólidos tras la cuarta semana. Deben utilizarse IBP al menos entre 2-3 semanas antes y 4 semanas después del procedimiento40. Permite menores estancias hospitalarias que la cirugía, al realizarse en 30-120min y favorecer la tolerancia oral precoz, por lo que podría realizarse ambulatoriamente, sin mayores complicaciones que con otras técnicas11,40. Aunque el procedimiento es irreversible, en caso de fracaso terapéutico no incrementa la dificultad ni el riesgo de una reconversión a bypass gástrico laparoscópico, por lo que podría considerarse, en un esquema de abordaje en 2 tiempos, como paso previo a cirugía11. Su principal desventaja radica en que por su novedad existe escasa evidencia al respecto.
La primera serie de pacientes sometidos a TOGA® incluyó a 21 con obesidad grado iii o grado ii con comorbilidades e IMC medio de 43,3kg/m2. La weight excess loss (WEL) media fue del 16, 23 y 25% a uno, 3 y 6 meses postratamiento, con una media global de 24,4% y un IMC medio de 37,8kg/m2, sin complicaciones severas, y mejoría significativa en calidad de vida, en algunos casos también de comorbilidades (hipertensión y diabetes)41. Sin embargo, en la endoscopia de control a los 6 meses, se evidenciaron numerosas dehiscencias entre las grapas y huecos en 13 pacientes, lo que obligó a realizar modificaciones41,42. Tras esta primera evaluación, una vez depurados los fallos del primer examen, se realizó un segundo estudio piloto con 11 pacientes, incorporando el uso preoperatorio de AINE a fin de minimizar el proceso isquémico secundario al grapado e intentar disminuir las dehiscencias; con ello se obtuvo una WEL media del 19,2, 33,7 y 46% a uno, 3 y 6 meses, respectivamente42. Familiari et al. han publicado un ensayo clínico multicéntrico (Italia-Bélgica) prospectivo controlado de un solo brazo a un año con TOGA®, incluyendo 67 pacientes (47 mujeres) de entre 23-59 años (media 41 años) con criterios de cirugía bariátrica y comorbilidades asociadas. La media de IMC inicial fue de 41,5±3,6kg/m2 (n=27 con IMC<40), excluyendo a pacientes con IMC>55. Completaron el protocolo 53 pacientes, con una pérdida de exceso de IMC del 33,9, 42,6 y 44,8% a 3, 6 y 12 meses, respectivamente. La WL fue mayor en el subgrupo con IMC inicial>40kg/m2 frente al de<40kg/m2 a 12 meses (52,2 versus 41,3%, p<0,05). La calidad de vida mejoró significativamente a 6 y 12 meses (cuestionarios SF-36v2 e IWQOL-Lite, p<0,001 para todos los ítems)40. En pacientes diabéticos, la HbA1c descendió del 7 al 5,7% (p<0,01); en no diabéticos, partiendo de una HbA1c basal media de 5,9%, indicativa de prediabetes, a 12 meses mejoró significativamente (HbA1c del 5,4%, p<0,0005), consistente con el descenso de la secreción insulínica posintervención descrito por Chiellini et al.40,43. No encuentran diferencias significativas a 12 meses en colesterol total, aunque sí en HDL (+10,5mg/dl, de 47,0 a 57,5mg/dl, p<0,0001) y triglicéridos (−449mg/dl, de 142,9 a 98mg/dl, p<0,0001); el colesterol LDL aumentó levemente (113,7-120mg/dl, p=0,081)32, y se observó un descenso leve no significativo de cifras tanto de TA sistólica como diastólica a 12 meses, aunque en esta última con tendencia a la significación estadística (p=0,07). En relación con la dehiscencia de sutura y la aparición de huecos entre las mismas, con el nuevo dispositivo solo en 11 pacientes fueron lo suficientemente severas como para afectar a la efectividad40 (tabla 6).
Indicaciones y contraindicaciones del sistema de gastroplastia transoral
| Indicaciones |
| Criterios de cirugía bariátrica (IMC>40 o>35kg/m2 más comorbilidades) |
| Obesidad>2,5 años de duración |
| Fracaso de medidas higiénico-dietéticas y/o farmacológicas |
| Edad entre 18-60 años |
| Paciente capaz de comprender el procedimiento, riesgos y beneficios potenciales, y dispuesto a seguir las indicaciones del equipo multidisciplinar |
| Contraindicaciones |
| IMC>55kg/m2 |
| Alcoholismo/drogadicción activos |
| Enfermedad mental severa |
| Enfermedad inflamatoria intestinal |
| Alteraciones estructurales/funcionales esofágicas (esofagitis grado C-D, esófago de Barrett, acalasia, divertículo esofágico, esófago «en cascanueces», etc.) |
| Hernia hiatal≥2cm |
| Infección activa por Helicobacter pylori |
| Anormalidades congénitas o adquiridas del tracto gastrointestinal |
| Enfermedades cardiopulmonares o sistémicas severas, incluyendo VIH o neoplasias |
| Proceso infeccioso concomitante en el momento del procedimiento |
| Historia personal de escleroderma |
| Coagulopatía severa, uso de anticoagulantes orales o presencia de lesiones susceptibles de sangrado |
| Cirugía abdominal previa |
| Enfermedad tiroidea no controlada adecuadamente |
| Gestación o deseo y puerperio |
Las complicaciones habituales13,40–42 son dolor abdominal, náuseas, vómitos, disfagia, faringitis, disfunción temporomandibular y lumbalgia/cervicalgia. Se ha descrito un caso de insuficiencia respiratoria y otro de neumoperitoneo asintomático resuelto conservadoramente. El seguimiento requiere un equipo multidisciplinar, incluyendo visitas al mes y a 3, 6 y 12 meses, y posteriormente según criterio médico. Se recomiendan endoscopias de control y estudios de tránsito con contraste frecuentes42.
Gastroplastia vertical endoscópica transoral: sistemas EndoCinch™ y RESTORe™El dispositivo EndoCinch™ (C.R. Bard Inc., NJ, EE. UU.), inicialmente aprobado por la FDA en 2000 para el tratamiento endoluminal de la enfermedad por reflujo, ha adquirido nuevamente relevancia dentro de las técnicas bariátricas endoluminales restrictivas8,9,11,13,18,39. Consta de un sistema de cosido contenido en una cápsula ajustada al extremo de un endoscopio flexible, precargado con una aguja con hilo de polipropileno y de un sistema de vacío. En la zona deseada se aplica presión negativa en el sistema de vacío, introduciendo mucosa y submucosa de la pared gástrica dentro del sistema de cosido y permitiendo realizar varios tipos de sutura8,9,11,18,44. El sistema RESTORe™ (Bard-Davol, Warwick, RI, EE. UU.) es una modificación del anterior, que permite plicaturas más profundas englobando todo el grosor de la pared sin requerir retirada del endoscopio para recargar el kit de sutura8,13,45. La configuración de la sutura se realiza de modo continuo sobre 5-7 puntos entrecruzados entre sí, desde fundus gástrico a la porción más distal del cuerpo. Al tensar la sutura, esta actúa como cincha aproximando la cara gástrica anterior y posterior, conformando un sleeve gástrico que limita significativamente la distensión y la ingesta; la intervención se completa en 45min. Requiere screening de Helicobacter pylori en todos los pacientes, recibiendo los casos positivos tratamiento erradicador previo al procedimiento, y los pacientes con síntomas de reflujo gastroesofágico deben recibir un mínimo de 14 días de tratamiento con IBP preintervención44. Tras la misma, el paciente es monitorizado durante al menos una hora, y si no existen contraindicaciones, puede ser dado de alta con dieta líquida durante 3 días, revisándose en consulta tras este periodo. Si no hay incidencias, se progresa a dieta sólida blanda durante una semana, tras la cual se permite dieta libre sana y equilibrada44.
Fogel et al.44 realizaron el procedimiento con EndoCinch™ a 64 pacientes de entre 16-62 años (media de 31,5±10,1 años), completando 59 (94,1%) 12 meses de seguimiento. El IMC basal era de 39,9±5,1 (28,0-60,2kg/m2) y el peso medio preoperatorio de 104,8±18,5kg (74-178kg), describen WEL del 21,1±6,2, 39,6±11,3 y 58,1±19,9% a uno, 3 y 12 meses de seguimiento, respectivamente, con IMC a uno, 3 y 12 meses de 36,5±4,8, 33,5±4,5 y 30,6±4,7kg/m2, respectivamente. Los autores también realizan un análisis estratificando por grupos de IMC: grupo i, con IMC>40kg/m2 (n=33, peso medio preoperatorio 113,3±20,8kg, IMC medio preoperatorio 43,4±3,8kg/m2); grupo ii, con IMC entre 35-40kg/m2 (n=19, peso medio preoperatorio 101,3±64kg, IMC medio preoperatorio 38,5±1,2kg/m2); y grupo iii, con IMC<35kg/m2 (n=12, peso medio preoperatorio 86,9±7kg, IMC medio preoperatorio 32,4±2,4kg/m2). Las mayores WEL se registraron en el grupo iii (29,5±6,7, 54,0±13,5 y 85,1±24,0%, IMC 29,5±2,2, 27,3±2,2 y 24,4±2,4kg/m2) a uno, 3 y 12 meses, seguido del grupo ii (20,6±4,3, 39,4±7,1 y 56,5±13,9%, IMC 35,3±1,2, 32,4±1,4 y 29,8±2,3kg/m2) y el grupo i (18,6±4,5, 34,6±8,0 y 48,9±10,7%, IMC 39,7±3,8, 36,4±3,7 y 33,5±4,0kg/m2) en los mismo tiempos. No describen complicaciones graves, pero sí disrupciones de sutura en 3 casos, precisando nueva endoscopia en 244. No hemos encontrado datos sobre efecto en HbA1co glucemia.
En cuanto a RESTORe™, según Brethauer et al.45 es relativamente seguro, logrando reducir volumen gástrico en todos los pacientes de su estudio. Al año46, de 18 pacientes inicialmente tratados, con peso inicial medio de 105,6kg e IMC medio de 38,6kg/m2, 14 completaron el estudio (3 retiradas de consentimiento y una pérdida de seguimiento), con una WL de −11,0±10,0kg (rango −4,2kg a −33,3kg), un descenso medio de IMC de −4,0±3,5kg/m2 (rango −1,4 a −11,8kg/m2), y una reducción media de perímetro abdominal de −12,6±9,5cm (rango −27,0 a 4,5cm). La WEL media a 12 meses fue de −27,7±21,9% (rango −9,4 a −73,6%), presentando un 50% de pacientes una WEL≥30%. Las mayores diferencias se observaron a los 3 meses del procedimiento, sin cambios a 6 y 12 meses. Esto podría explicarse por los resultados observados en la endoscopia realizada al mes posintervención, en la que solo en 2 casos las plicaturas permanecían intactas, observándose dehiscencia parcial en 15 pacientes. Al año, en 8 pacientes las suturas se habían liberado parcialmente, y completamente en 5 de forma espontánea46. No hemos encontrado evidencias sobre su efecto en la diabetes.
Las indicaciones del sistema EndoCinch® son: edad entre 16-62 años, IMC>28kg/m2 y compromiso expreso de cumplir con el seguimiento. Está contraindicado en pacientes con evento vascular previo, diabetes mellitus mal controlada, hernia hiatal>3cm o cirugía gástrica previa44. La complicación más frecuente descrita son las molestias faríngeas44.
Las indicaciones del sistema RESTORe®45 son: edad entre 18-60 años, IMC entre 40-45 o 35-40kg/m2 con comorbilidades asociadas, obesidad de≥5años de evolución refractaria a medidas conservadoras, y peso estable en los 2 últimos meses (definido como variaciones≤5% del peso en ese tiempo). Como contraindicaciones: trastornos endocrinos mal controlados, cirugía gástrica o de la obesidad previa, gastroparesia diabética o diabetes de>10 años de evolución, hernia hiatal>2cm, infección activa por Helicobacter pylori, presencia de trastorno de la conducta alimentaria y, en general, cualquier condición médica o psicológica que limitase la adherencia al protocolo de seguimiento y/o supusiese un riesgo inasumible45. Parece tener un buen perfil de seguridad a corto45 y a largo plazo46, con complicaciones menores (dolor abdominal, distensión, diarrea y náuseas) posprocedimiento.
Cirugía primaria endoluminal de la obesidadRecientemente, se está popularizando la denominada «técnica POSE», o cirugía primaria endoluminal de la obesidad, consistente en realizar plicaturas con un sistema endoscópico a nivel de antro y fundus gástrico, a fin de limitar la superficie y el volumen gástrico e inducir así saciedad precoz. El procedimiento parece sencillo, pudiendo realizarse ambulatoriamente y sin complicaciones graves, con WEL de hasta un 45-49,4% y descensos del IMC de −5,8kg/m2. No obstante, dado lo novedoso de la técnica y la escasez de datos de eficacia o seguridad a día de hoy, desconocemos su potencial real. Tampoco existen datos sobre su efecto sobre la glucemia y los pacientes con diabetes13,47.
ImplantesImplante restrictivo transoral endoscópicoEl sistema de implante restrictivo transoral endoscópico8,9,11,14,18,39,48,49 es un complejo dispositivo de laboriosa inserción. Usando una grapadora, se realizan 5 plicaciones englobando todo el grosor de la pared aproximadamente a 3cm del cardias en sentido distal. La plicación resulta en 2 anillos concéntricos de grapas reforzados con un anillo de plástico. Tras cada plicación, se asegura un anclaje de silicona a través de la misma, hasta 5 plicaciones y anclajes respectivos, que sirven de base para el implante restrictivo. Necesita profilaxis antibiótica durante y 6h tras el procedimiento con amoxicilina-clavulánico iv48,49. Antes del alta, se realiza un tránsito baritado para determinar la presencia de fugas. Se inicia dieta líquida durante 2 semanas, progresando a triturada durante otras 2-4 semanas, con reintroducción posterior de alimentos sólidos48.
De Jong et al.48, en un estudio con 13 pacientes, partiendo de un IMC medio de 42,1kg/m2, describen reducciones a uno y 3 meses de −0,9 y −4,2kg/m2, respectivamente, y una WEL de 12,3 y 22,2% en los mismos tiempos. Asimismo, demuestran mejoría en la calidad de vida a 3 meses (cuestionario SF-36). Los efectos secundarios son leves, fundamentalmente odinofagia, náuseas, vómitos, fiebre, epigastralgia, dorsalgia y reflujo. Se han descrito 2 casos de neumoperitoneo tratados conservadoramente, y un caso de perforación que precisó cirugía48.
Técnicas malabsortivasSistema EndoBarrier® y sistema ValenTx®El bypass duodenoyeyunal en manga o sleeve (sistema EndoBarrier®, GI Dynamics Inc., Watertown, MA, EE. UU.) es un método malabsortivo reversible que consta de un anclaje de nitinol en su extremo proximal, asentado sobre el bulbo duodenal con un sistema antimigración, y una sutura para su retirada endoscópica. Desde este, se extiende una manga autoexpandible de unos 60cm de fluoropolímero impermeable, que evita que el quimo se una con la secreción biliopancreática y, por tanto, su digestión y absorción8–11,13,14,18. Puede implantarse en 30min9,11,18,50, y si se demuestra la colocación adecuada por radiografía simple y el paciente tolera dieta líquida, puede ser alta en 24h, con un IBP y suplementos multivitamínicos en su tratamiento50. Durante las 2 primeras semanas, el paciente recibe dieta líquida de 600Kcal y, posteriormente, dieta normal de 1.200Kcal en las mujeres y 1.500Kcal en los hombres, más 1.500ml de líquidos acalóricos/hipocalóricos en todas las fases50. A las 12-24 semanas EndoBarrier® es retirado endoscópicamente, requiriendo anestesia general9,50. Por sus características, podría servir de «puente» hacia una cirugía definitiva, permitiendo reducir riesgos prequirúrgicos50. Actualmente está ensayándose una variante de EndoBarrier®, el sistema ValenTx®, de 120cm, que incluye un componente restrictivo implantado en cardias mediante técnica endoscopicolaparoscópica y extracción endoscópica, remedando el bypass gástrico en Y de Roux13,18.
En su primer uso en humanos, EndoBarrier® consiguió una WEL del 23,6%9, con descenso significativo de la HbA1c11. En su ensayo, incluyendo a 25 pacientes seguidos durante 12 semanas, Tarnoff et al. describen una WEL media del 22,1%51. Schouten et al.50, en 26 pacientes, obtienen un 19±10,9% de WEL a 12 semanas, y un 24,3±5,8% a 24 semanas (−5,5 puntos respecto al IMC inicial), y un descenso de la HbA1c del 1,1% y de los requerimientos de medicación hipoglucemiante ya desde la primera semana, permitiendo incluso su retirada; la mejoría del control persistió tras finalizar la intervención13,50. El sistema ValenTx®, asimismo, muestra buenos resultados iniciales, con WEL de hasta un 40% a 12 semanas, sin efectos adversos graves13,18.
EndoBarrier® está indicado en pacientes entre 18-55 años con IMC entre 40-60 o>35kg/m2 con comorbilidades asociadas13,50. Las contraindicaciones incluyen el uso de anticoagulantes/coagulopatía severa, enfermedad inflamatoria intestinal, infección activa por Helicobacter pylori, enfermedad por reflujo severa, cirugía abdominal previa y trastorno de la conducta alimentaria o trastornos psiquiátricos mayores13,50. Las complicaciones que puede producir son náuseas, vómitos y dolor abdominal, sobre todo en la primera semana13,50. En la explantación pueden producirse fenómenos inflamatorios locales con formación de seudopólipos13,50,51. Los efectos secundarios más graves comunicados incluyen la hemorragia digestiva alta, la obstrucción del dispositivo y su migración9,10,13,51.
ConclusionesLa obesidad es la epidemia de nuestro tiempo, con gran morbimortalidad asociada, disponiendo para combatirla de muy escasos recursos terapéuticos. Actualmente, la cirugía de la obesidad es el único tratamiento definitivo capaz de proporcionar pérdidas ponderales significativas, e incluso inducir la remisión de la diabetes y otras comorbilidades, pero es invasiva, y a menudo de elevada complejidad técnica, implicando un elevado riesgo quirúrgico, más elevados costes en material y medios. Las técnicas endoscópicas pueden ser una opción terapéutica de bajo riesgo en comparación con la cirugía, que permitan evitar esta y reducir costes asociados, manteniendo beneficios en cuanto a morbimortalidad, y en casos en los que la cirugía sea inevitable, puede servir de elemento «puente», permitiendo mediante la WL y la mejora del control glucémico y otros factores reducir el riesgo prequirúrgico. Sin embargo, la novedad de estos métodos y la relativa escasez de estudios hacen que la evidencia, en términos de seguridad y eficacia a largo plazo, sea muy limitada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.