Los carcinoides gástricos tipo 1 son tumores producidos por el estímulo constante de la hipergastrinemia sobre las células enterocromafines-like que se produce en la gastritis crónica atrófica. Son los carcinoides gástricos más frecuentes (70%) y presentan buen pronóstico en la mayoría de las ocasiones. El curso indolente es confirmado por la presencia de un número bajo de mitosis medido por el índice Ki67, habitualmente menor de 30 por campo de gran aumento, y por un riesgo de angioinvasión o invasión submucosa del 0-10%1.
El porcentaje de metástasis observadas varía entre un 2-5%, habitualmente a nivel ganglionar regional o a nivel hepático. Los carcinoides gástricos tipo 1 se localizan en el cuerpo o fundus gástrico, con un tamaño habitualmente inferior a 2cm y a menudo con presentación múltiple. Debido a su asociación con la gastritis crónica atrófica el perfil de paciente más frecuente son mujeres con edad superior a los 50 años, siendo un hallazgo incidental en gastroscopias realizadas por anemia o dispepsia que representan manifestaciones dentro de la sintomatología de la gastritis crónica atrófica.
Los carcinoides gástricos tipo 1, se desarrollan basados en un modelo de carcinogénesis donde la hipergastrinemia produciría al inicio hiperplasia de las células enterocromafines-like, pasando posteriormente a formar neoplasias tras un periodo de displasia celular2. La presencia de displasia celular conlleva un riesgo 26 veces superior para la posterior formación de tumores carcinoides respecto a los pacientes con gastritis crónica atrófica sin displasia3. Como marcadores moleculares se describen en la literatura la elevación en la mayoría de los pacientes de V-MAT2, cromogranina A o sinaptofisina, y de forma ocasional de histamina, siendo dicha elevación bastante inespecífica respecto a otros tumores neuroendocrinos gástricos4.
Debido al curso indolente de los carcinoides gástricos tipo 1, el abordaje terapéutico es menos agresivo que en otros tumores exocrinos gástricos. Asimismo, dada la rareza de la enfermedad, el tratamiento óptimo y el seguimiento de los pacientes son debatidos, no existiendo ensayos clínicos amplios con aleatorización para poder sacar conclusiones claras al respecto. La resección endoscópica se suele realizar cuando el tamaño y el número de lesiones así lo permite; sin embargo, la tasa de recurrencia es elevada. La antrectomía se ha realizado con el objetivo de eliminar el origen de la hipergastrinemia, hecho fundamental en la fisiopatología del trastorno5. Cirugías más agresivas, incluyendo gastrectomía parcial o total se han realizado en tumores mayores o con invasión submucosa o vascular6. Además, los análogos de somatostatina pueden utilizarse como tratamiento eficaz para los carcinoides gástricos dado el control de la hipergastrinemia y la subsecuente hiperplasia de las células enterocromafines-like7,8. Algunos autores defenderían su uso en aquellos casos de carcinoides gástricos «funcionantes», y en aquellos casos de presentación múltiple, superior a 6 lesiones polipoides menores de un centímetro de diámetro. A continuación se presentan 3 casos con tratamiento médico y la evolución posterior presentada. Ninguno de ellos se encontraba en tratamiento con inhibidores de la bomba de protones al diagnóstico ni durante el seguimiento.
Caso 1Se presenta el caso de una mujer de 48 años con antecedentes personales de hipotiroidismo primario de origen autoinmune desde los 30 años, alopecia universalis, vitíligo y menopausia a los 35 años. De forma incidental, en una analítica de control, se encontró una vitamina B12 de 24pg/ml (N>200pg/ml) con un ácido fólico dentro de la normalidad. Los niveles de gastrina se encontraban marcadamente elevados, 1.023pg/ml (N<108pg/ml), y los niveles de cromogranina A eran de 6 nmol/l (N<4 nmol/l). El estudio de autoinmunidad presentaba positividad frente a anticuerpos anti-células parietales y anti-factor intrínseco. La gastroscopia realizada era compatible con gastritis crónica atrófica. Asimismo, se visualizaron dos pólipos de un centímetro de diámetro mayor. Se realizó una ecografía endoscópica para caracterizar mejor los hallazgos que no mostraba invasión submucosa de las neoformaciones. Se procedió a la polipectomía endoscópica con toma de biopsia múltiple a lo largo de la cavidad gástrica. Los hallazgos eran compatibles con gastritis crónica atrófica con ausencia de Helicobacter pylori. La anatomía patológica de los pólipos era compatible con tumores neuroendocrinos bien diferenciados sin angioinvasión y con un Ki 67<2%.
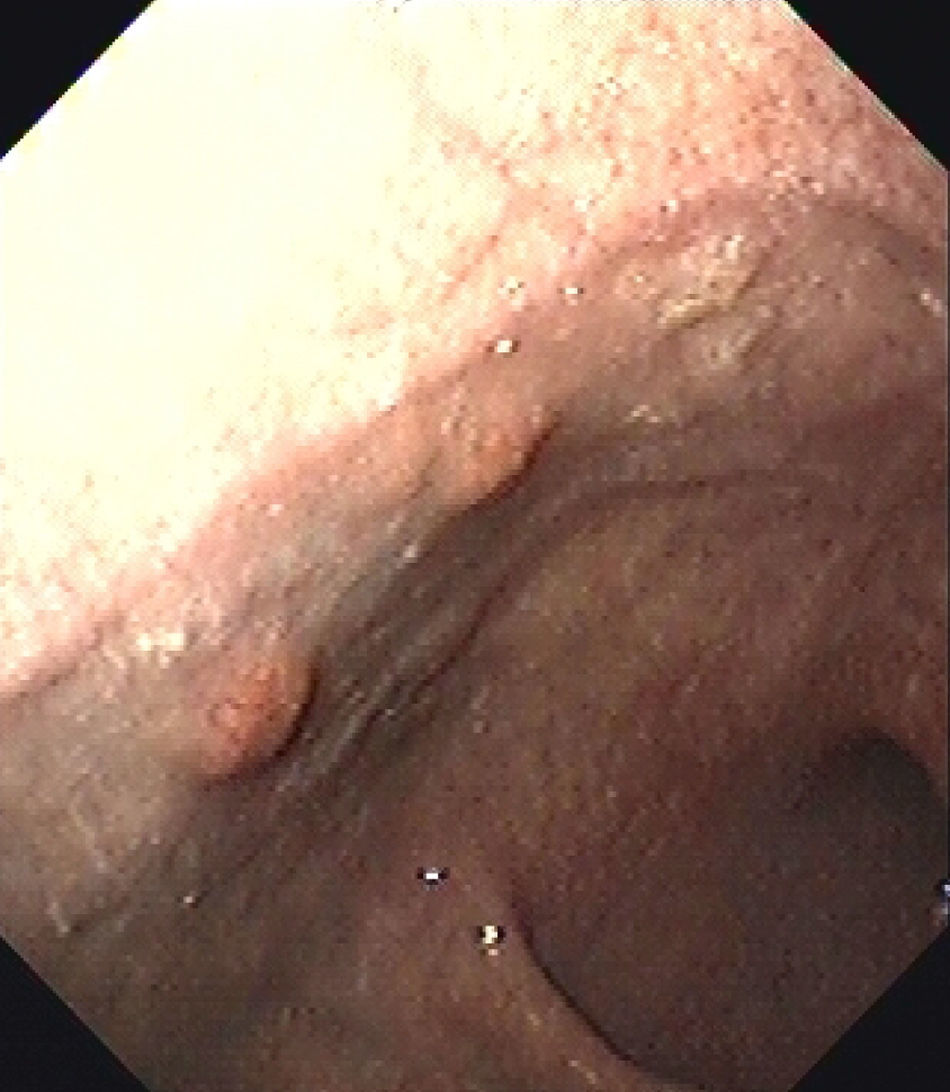
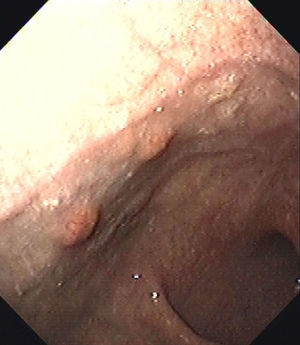
Durante el control endoscópico realizado un año después se visualizaron 6 pólipos gástricos de nueva aparición (fig. 1). Se resecaron 3 de ellos siendo compatibles con tumores carcinoides gástricos bien diferenciados.
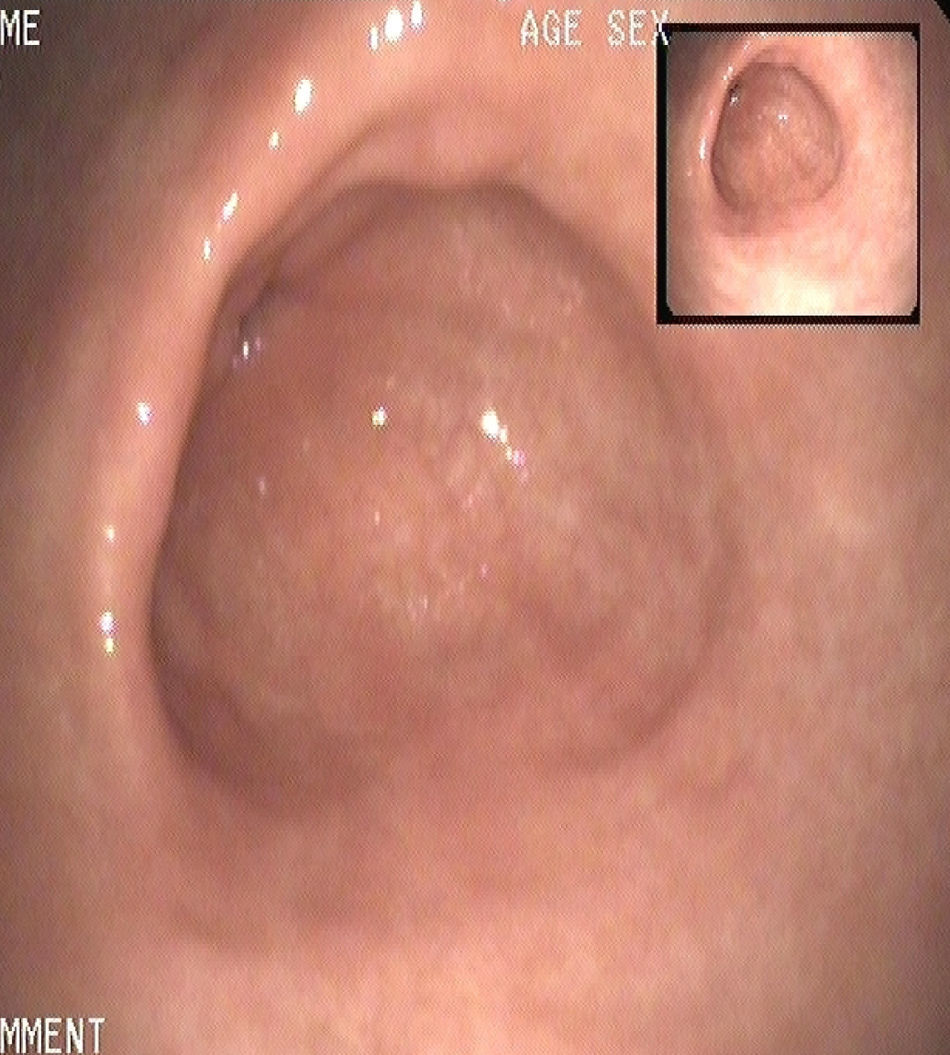
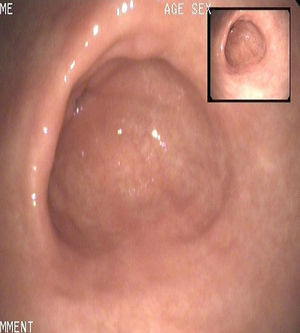
En ese momento, ante la recidiva de la enfermedad, se inició tratamiento con lanreótido en dosis de 90mg al mes por vía intramuscular durante 12 meses, con hallazgos en gastroscopias de control anuales durante los 3 años siguientes de ausencia de tumores y remisión de la enfermedad (fig. 2). Al año de tratamiento, la cromogranina A se encontraba dentro de los límites normales: 3nmol/l, y los niveles de gastrina se encontraban discretamente elevados: 167pg/ml.
Caso 2Se trata de una mujer de 36 años con antecedentes personales de síndrome pluriglandular autoinmune tipo II con enfermedad de Addison, hipotiroidismo primario y vitíligo. En tratamiento con hidrocortisona 20mg/día, fludrocortisona 0,05mg/día y levotiroxina 100 mcg/día. En una revisión de rutina refiere astenia inespecífica, y en analítica realizada destaca un hemograma con anemia de 10,5g/dl, con un VCM de 99 fl. Asimismo, presentaba una vitamina B12 de 45pg/ml (N>200pg/ml) con una gastrina plasmática de 502pg/ml (N<108pg/ml). Se realizó gastroscopia que mostró 3 pólipos de menos de un centímetro de diámetro mayor. Se resecó el mayor de ellos (0,8cm) y la anatomía patológica mostró un tumor neuroendocrino bien diferenciado con Ki67<2%. Se inició tratamiento con octreótido LAR 20mg al mes durante 12 meses, y en las 2 siguientes revisiones endoscópicas anuales los pólipos no resecados habían desaparecido y no se encontraron nuevas neoformaciones. La gastrina plasmática se había normalizado al año de tratamiento (101pg/ml).
Caso 3Se presenta un varón de 28 años con dolor epigástrico y náuseas de forma intermitente. En el estudio destaca una gastrina plasmática de 1.200pg/ml (N<108pg/ml) y cromogranina A de 6 nmol/l (N<4 nmol/l). La pHmetria intragástrica de 24 horas mostró un pH siempre superior a 4 y en la gastroscopia datos compatibles con gastritis crónica atrófica y seis lesiones polipoides inferiores a 0,8cm que fueron todas resecadas. El resultado anatomopatológico mostró tumores carcinoides bien diferenciados con un Ki67<2%. A los 6 meses en la nueva gastroscopia se visualizaron 4 nuevas lesiones menores de un centímetro que se resecaron y mostraron de nuevo tumores carcinoides bien diferenciados. Se inició tratamiento con octreótido LAR 20mg al mes intramuscular durante 6 meses, a los 6 y 12 meses la gastroscopia de control fue normal, así como los niveles de gastrina plasmática (103pg/ml) y de cromogranina A (3 nmol/l).
Dada la evolución de los tres casos descritos, el tratamiento con análogos de somatostatina parece ejercer un efecto antiproliferativo en carcinoides gástricos bien diferenciados, y supone una alternativa a otras terapias más cruentas. Se trata de una terapia bien tolerada con escasos efectos secundarios, pero de alto coste. La dosis óptima de tratamiento y el tiempo del mismo está todavía pendiente de esclarecer, así como su papel concreto en las guías de tratamiento de los tumores neuroendocrinos gástricos bien diferenciados. En los casos presentados, se muestra la remisión de la enfermedad hasta tres años tras suspensión del tratamiento.