Los adenomas hipofisarios no funcionantes son los macroadenomas hipofisarios más frecuentes en adultos y representan el 14-28% de todos los tumores hipofisarios clínicamente relevantes. Son un grupo heterogéneo de tumores que causan síntomas por compresión o por déficits hormonales. La posibilidad de crecimiento tumoral aumenta en macroadenomas y tumores sólidos en comparación con microadenomas y tumores quísticos. El diagnóstico se basa en técnicas de imagen (resonancia magnética) pero hay estudios prometedores sobre posibles biomarcadores. La cirugía transesfenoidal sigue siendo la primera opción terapéutica en tumores grandes con síntomas compresivos. No hay evidencia de que la técnica endoscópica mejore los resultados aunque disminuye la morbilidad. No hay unanimidad en encontrar factores pronósticos de recurrencia. La radiocirugía consigue control tumoral y, en ocasiones, reducción de tamaño del adenoma. Sus efectos adversos aumentan con las dosis altas y el tamaño tumoral>4cm3. El tratamiento farmacológico tiene escasa utilidad. En los tumores no funcionantes agresivos se puede emplear temozolomida (TMZ) pero con precaución, porque no hay estudios controlados hasta la actualidad. Consigue control tumoral en el 38-40% de tumores agresivos no funcionantes. La pauta de tratamiento óptima y la duración del mismo están por definir. La falta de respuesta a TMZ tras 3 ciclos predice resistencia al tratamiento, pero la respuesta inicial no asegura resultados óptimos a medio o largo plazo. La expresión de O6-metilguanina-ADN-metiltransferasa tiene escaso valor predictivo de respuesta al tratamiento con TMZ en tumores no funcionantes agresivos. Por eso no debe ser un determinante en la selección de pacientes para tratar con TMZ.
Non-functioning pituitary adenomas are the most common pituitary macroadenomas in adults, accounting for approximately 14%-28% of all clinically relevant pituitary tumors. They are a heterogeneous group of tumors that cause symptoms by compression and/or hormone deficiencies. The possibility of tumor growth is increased in macroadenomas and solid tumors as compared to microadenomas and cystic tumors. Diagnosis is based on imaging procedures (magnetic resonance imaging), but there are studies reporting promising potential biomarkers. Transsphenoidal surgery remains the first therapeutic option for large tumors with compressive symptoms. There is no evidence that endoscopic procedures improve outcomes, but they decrease morbidity. There is no unanimity in finding prognostic predictors of recurrence. Radiosurgery achieves tumor control and, sometimes, adenoma size reduction. Its adverse effects increase with higher doses and tumor sizes>4cm3. Drug treatment is of little value. In aggressive non-functioning tumors, temozolomide (TMZ) may be used with caution because no controlled studies are available. TMZ achieves tumor control in 38%-40% of aggressive non-functioning tumors. The optimal treatment regimen and duration have not been defined yet. Lack of response to TMZ after 3 cycles predicts for treatment resistance, but initial response does not ensure optimal mid or long–term results. O6-methylguanine-DNA methyltransferase expression has a limited predictive value of response to treatment with TMZ in aggressive non-functioning tumors. It should therefore not be a determinant factor in selection of patients to be treated with TMZ.
Los adenomas hipofisarios suponen al menos el 10-15% de las neoplasias intracraneales primarias1. Los adenomas hipofisarios no funcionantes (AHNF) representan el 14-28% de todos los adenomas de hipófisis clínicamente relevantes2,3 y la mitad de todos los macroadenomas hipofisarios4. Son un grupo heterogéneo de tumores con características clínicas y bioquímicas diferentes del resto de los adenomas hipofisarios funcionantes. El conocer el subtipo histológico del AHNF ayuda a predecir su evolución posquirúrgica, ya que algunos parecen tener un comportamiento más agresivo que otros. La mayoría de los AHNF expresan gonadotropinas o sus subunidades (α y β) y constituyen el 10% de todos los adenomas hipofisarios5,6. Casi el 15% de los AHNF son adenomas silentes capaces de expresar, pero no secretar, otras hormonas hipofisarias (ACTH, TSH, PRL y GH)6. El 30% de los AHNF, los adenomas de células nulas, no expresan ni secretan ningún tipo de hormona7. Los adenomas silentes subtipo 3 son muy raros, presentan un elevado índice de recurrencias y precisan microscopia electrónica para su diagnóstico. La mayoría de sus células tumorales son inmunonegativas, pero una minoría expresa de forma variable varios tipos de hormonas (GH, PRL, TSH, subunidad α, β-endorfina y ACTH)8.
Etiopatogenia de los adenomas hipofisarios no funcionantesLos AHNF son generalmente tumores monoclonales benignos9 formados por células epiteliales neoplásicas de la hipófisis anterior, siendo la mayoría de origen gonadotrópico10. Hasta la actualidad se han descrito numerosas alteraciones genéticas que pueden contribuir a la formación de los adenomas hipofisarios11–16 pero es difícil atribuir especial relevancia a una de ellas. Aproximadamente el 10% de los AHNF muestra mutaciones en el gen regulador GNAS, pero estos casos son pocos comparados con la frecuencia relativamente alta (>40%) encontrada en los somatotropinomas. Las alteraciones en diversas regiones de genes supresores tumorales, como el MEG310, son frecuentes, más en los casos de AHNF invasivos, pero no está claro si esto contribuye a la patogenia tumoral o es solo un epifenómeno. El gen transformador de tumor hipofisario (PTTG) podría ser un oncogén permisivo en la formación de los adenomas hipofisarios17. Mientras que su deleción facilita la hipoplasia hipofisaria y confiere cierta protección para el desarrollo de tumores hipofisarios18, su sobreexpresión, que ha sido detectada en adenomas de hipófisis19, se asocia con mayor aneuploidia y angiogénesis20. También se ha descrito deficiencia del gen de la apoptosis tumoral hipofisaria en algunos tumores hipofisarios. Esto puede modificar los mecanismos normales de la apoptosis dirigidos a eliminar células portadoras de alteraciones genéticas potencialmente tumorogénicas. De esta forma podría favorecerse la expansión de un clon celular anómalo para formar un tumor definitivo.
Los factores hipotalámicos de liberación y los factores de crecimiento producidos localmente por las propias células tumorales parecen actuar más como factores de progresión que como iniciadores de la tumorogénesis. Las interleucinas sintetizadas en la hipófisis también pueden tener algún efecto sobre el comportamiento tumoral. La interleucina 6 podría estimular la progresión del adenoma21 al ser capaz de inhibir el crecimiento de células hipofisarias normales y estimular el de células tumorales22.
Desafortunadamente, aún no se ha detectado una alteración molecular única en AHNF que permita servir como diana terapéutica o ayude a predecir el comportamiento tumoral y su posible recurrencia. Tampoco se conocen los mecanismos por los que algunos adenomas funcionantes son clínicamente silentes. En los adenomas corticotropos se ha detectado Tpit, un regulador específico tisular de la expresión de proopiomelanocortina, y algunos autores, pero no todos, han encontrado niveles más bajos cuando los adenomas corticotropos son silentes. No hay diferencias en la expresión de Pit-1 y ARNm del receptor de GHRH en tumores somatotropos, tirotropos o lactotropos, silentes o funcionantes.
Síntomas y signos clínicosLos AHNF se diagnostican entre los 20 y 60 años en el 78% de casos3 y son algo más frecuentes en varones23. Al no presentar signos o síntomas por hipersecreción hormonal, muchas veces se detectan casualmente en pruebas radiológicas realizadas por otros motivos (incidentalomas)3,24. Casi la mitad de los AHNF son incidentalomas en las series más recientes25.
Los AHNF solo causan síntomas clínicos cuando su tamaño es capaz de alterar la secreción hormonal, afectar al quiasma óptico, aumentar la presión intracraneal o dañar estructuras neurológicas. En el momento del diagnóstico, el 50-60% de los pacientes con macroadenomas presenta alteraciones visuales3,26 y el 50-62,1% cefalea3,24. Las deficiencias hipofisarias encontradas con mayor frecuencia son las de GH y gonadotropinas. Los casos en los que aparecen crisis uncinadas por extensión tumoral hacia el lóbulo temporal, o se producen alteraciones de la personalidad y anosmia por daño del lóbulo frontal, son muy raros.
Tras el tratamiento quirúrgico, los pacientes con macroadenomas no funcionantes pueden presentar también astenia y somnolencia que condicionan una disminución importante de su calidad de vida26. Ambos síntomas se han relacionado con la presencia de hipopituitarismo, pero pueden contribuir también las alteraciones del sueño que aparecen con frecuencia cuando existe expansión tumoral supraselar27.
DiagnósticoNo hay biomarcadores útiles en el diagnóstico de los AHNF pero recientemente se han aislado estructuras moleculares específicas en pacientes con AHNF comparando sus sueros con los de sujetos control28. Para ello se ha empleado espectrometría de masas que permite detectar proteínas de más bajo peso molecular (<15kDa) que los geles bidimensionales tradicionales. La heterogeneidad de moléculas halladas en pacientes con AHNF puede reflejar la existencia de varios subtipos tumorales y complica el diagnóstico analítico. Los resultados obtenidos son esperanzadores pero hacen falta más estudios, reclutando mayor número de pacientes, para determinar la sensibilidad y la especificidad de esta técnica.
Hasta la actualidad el diagnóstico de los AHNF se basa, principalmente, en las pruebas radiológicas. La técnica de elección es la resonancia magnética (RM) con contraste con gadolinio. En las series antiguas, hasta el 66,7% de los AHNF eran macroadenomas en el momento del diagnóstico3, pero esta proporción tiende a disminuir en los últimos años al emplearse más la RM en el estudio de diversos cuadros clínicos no relacionados con la patología hipofisaria. Aunque se ha intentando determinar si los hallazgos radiológicos sugestivos de agresividad en RM se correlacionan con alteraciones morfológicas de los adenomas, los resultados no son concluyentes29,30. Nishioka et al. en un estudio retrospectivo realizado en 388 pacientes con AHNF remitidos para tratamiento quirúrgico encuentran que los adenomas silentes son los que presentan con mayor frecuencia alteraciones radiológicas relacionadas con agresividad (gran tamaño, invasión de senos cavernosos y bordes supraselares lobulados) y que los índices de proliferación son mayores en los adenomas silentes no corticotropos y en los adenomas gigantes de cualquier tipo histológico. No observan relación entre los índices de proliferación y la edad, el sexo, la invasión de senos cavernosos o la extensión supraselar lobulada de los adenomas. También estudian la posibilidad de predecir el subtipo de AHNF según los hallazgos radiológicos y concluyen que, en el 91% de los casos, los tumores hipofisarios sin signos radiológicos de agresividad en pacientes mayores de 40 años son gonadotropinomas o adenomas de células nulas31.
Si los AHNF se detectan casualmente en el estudio radiológico se debe descartar la existencia de deficiencias o hipersecreción hormonal no sospechadas. La mayoría de los incidentaloma son adenomas clínicamente no funcionantes pero aproximadamente el 18% pueden ser funcionantes, sobre todo prolactinomas o adenomas secretores de GH. Por ello, algunos autores como Orija et al., sugieren que en los microincidentalomas (<1cm) asintomáticos sería suficiente determinar solo PRL e IGF-1, valorando el resto de las hormonas hipofisarias únicamente si se sospecha hiperfunción por el cuadro clínico que presenta el paciente32. Sin embargo, otros autores recomiendan descartar siempre la existencia de adenomas corticotropos. En el caso de macroincidentalomas, todos deberían ser estudiados para descartar alteraciones de hormonas hipofisarias y/o afectación visual32.
Historia naturalSe sabe poco de la historia natural de los AHNF porque la mayoría de casos son tratados quirúrgicamente, desconociéndose cuál hubiera sido su evolución. Se ha descrito un crecimiento tumoral en el 5,8% de los pacientes por año33. Los microadenomas no funcionantes suelen permanecer estables pero el 50% de macroadenomas tiene tendencia a crecer durante el seguimiento34,35 y, cuando esto ocurre, la mitad de los tumores muestra además empeoramiento clínico7. En un metaanálisis realizado por Fernández-Balsells et al., analizando Ia incidencia de acontecimientos adversos en pacientes con AHNF no tratados, se sugiere que las lesiones que con más frecuencia pueden causar complicaciones durante el seguimiento son las sólidas y las que presentan un tamaño >10mm. Sin embargo, los propios autores indican que el grado de evidencia encontrado es bajo, ya que la mayoría de los estudios analizados son de cohortes no comparativos, con importantes limitaciones metodológicas y, muchos, con escaso número de pacientes33.
En el seguimiento de los AHNF también hay que considerar que puede producirse una regresión tumoral espontánea hasta en un 11% de pacientes, posiblemente por isquemia silente4, y que, tras un episodio de apoplejía hipofisaria, puede aparecer nuevo crecimiento tumoral en otro 11% de casos36.
TratamientoLa decisión terapéutica en los AHNF se tomará considerando la edad, el tamaño, la presencia de alteraciones visuales, la función endocrina, si existe crecimiento durante el seguimiento y la historia natural de estos tumores. Si no está afectado el quiasma óptico se puede optar por tratamiento conservador con control de la función hipofisaria cada 6-12 meses y vigilancia del tamaño tumoral con RM anual durante 5 años. Si durante el seguimiento el tumor se mantiene alejado del quiasma y no se observa progresión de su tamaño, el estudio radiológico puede repetirse cada 2 años.
Tratamiento quirúrgicoCuando existe clínica compresiva, la cirugía es el tratamiento de elección. La edad, por sí misma, no debería considerarse como contraindicación quirúrgica23. El abordaje transesfenoidal es el más empleado en la actualidad y la técnica endoscópica permite mejor visión de zonas de difícil acceso como son la supraselar, paraselar y pared medial del seno cavernoso. La curación es menos probable en el caso de tumores grandes, cuando presentan configuración supraselar lobulada, o si hay invasión marcada del seno cavernoso31. Roelfsema et al. analizando las publicaciones de las series quirúrgicas de las 3 últimas décadas, describen remisión en el 44,4% de los AHNF tras la cirugía. Este porcentaje, significativamente inferior al que encuentran en acromegalia, prolactinomas y adenomas hipofisarios productores de ACTH (60,9; 61,7 y 72,7%, respectivamente), podría deberse al mayor tamaño de los AHNF en el momento del diagnóstico. No hallan mejores resultados en las series endoscópicas más recientes aunque presentan menores complicaciones37. Sin embargo, DeKlotz et al., en otro metaanálisis retrospectivo de la literatura, describen resecciones tumorales más amplias cuando se emplean técnicas endoscópicas38 y Swearingen, en una revisión, también considera superior la técnica endoscópica al lograr remisión tumoral en el 66-93% de los pacientes con AHNF39.
La extirpación de la masa tumoral hace desaparecer la cefalea en casi el 100% de los pacientes y mejora las alteraciones visuales en el 80%40. La recuperación de la visión puede seguir produciéndose hasta un año después de la cirugía41. La prevalencia de hipopituitarismo anterior posquirúrgico oscila entre un 30 y un 70%. La recuperación de la función hipofisaria es menos frecuente que en los adenomas funcionantes42 pero ha aumentado con la introducción de las técnicas endoscópicas. Messerer et al. encuentran mejoría en las deficiencias hormonales en el 56% de los pacientes con AHNF tratados con endoscopia y solo en el 25% de los tratados con cirugía transesfenoidal microscópica sublabial tradicional (p=0,01)43. La aparición de nuevas deficiencias hormonales es similar a la encontrada tras el tratamiento quirúrgico de prolactinomas o acromegalia y significativamente inferior a la que aparece en adenomas productores de ACTH37.
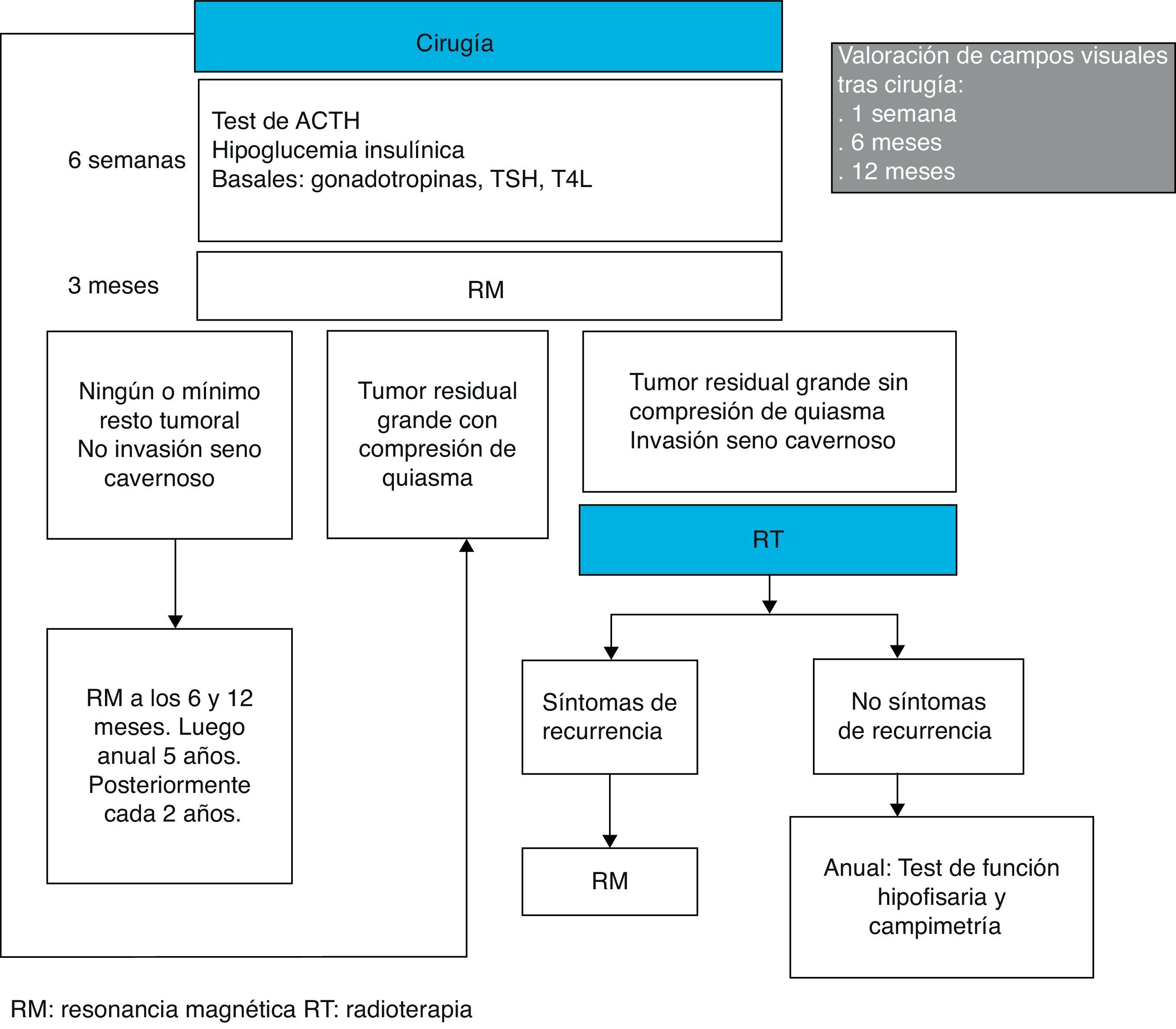
El seguimiento de los pacientes tras el tratamiento quirúrgico puede hacerse, como sugieren Wass et al., valorando la función hipofisaria a las 6 semanas de la cirugía, comprobando si persisten restos tumorales con RM a los 3 meses, y estudiando los campos visuales a la semana, 6 meses y un año. Si la resección tumoral es completa, el control radiológico con RM se puede repetir cada 6 meses el primer año, cada año durante los 5 años siguientes y cada 2 años posteriormente44(fig. 1).
RadioterapiaLa radioterapia (RT) convencional fraccionada se reserva para tumores inoperables en los que no se puede emplear radiocirugía por el tamaño, la mala definición de la masa tumoral, la localización cercana al quiasma o la extensión del tumor. Aunque puede conseguir el control en el 93% de casos e impide la progresión tumoral en el 75-90% de los pacientes a los 20 años, no está exenta de efectos colaterales indeseables como pueden ser la aparición de nuevos déficits hormonales o daños visuales. Hay otras complicaciones, tradicionalmente atribuidas a la RT, cada vez más cuestionadas en los últimos años. Brummelman et al. demuestran, en pacientes con macroadenomas no funcionantes tratados, un deterioro cognitivo mayor que en la población general, pero no aprecian diferencias entre los tratados con RT respecto a los que reciben solo cirugía45. Sattler et al. encuentran que los pacientes con adenomas de hipófisis tratados con RT posquirúrgica presentan una incidencia de segundos tumores similar a la de los pacientes tratados solo con cirugía. Los autores también observan que la mortalidad está aumentada en pacientes con adenomas hipofisarios respecto a la población general, aunque no observan diferencias entre los pacientes tratados o no con RT46. El hipopituitarismo y las elevadas dosis de reemplazamiento con glucocorticoides47 podrían contribuir a este aumento de mortalidad observado en los AHNF.
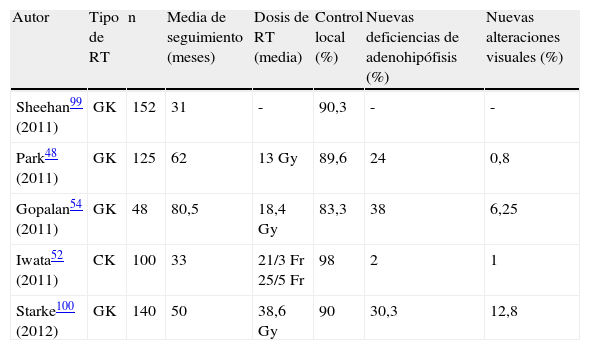
En los últimos años se han utilizado técnicas de radiocirugía en los AHNF con buenos resultados (tabla 1). En algunos pacientes seleccionados con elevado riesgo quirúrgico se pueden emplear como primera opción terapéutica, logrando el control tumoral en el 86,7% de los casos48; sin embargo, imposibilita realizar un diagnóstico histológico adecuado en un tipo de tumor que no tiene biomarcadores. La radiocirugía empleada como segunda línea de tratamiento, tras la cirugía, consigue el control tumoral en el 83-97% de los casos y su regresión en 42-78% de pacientes. Kim et al. revisan las publicaciones sobre las diversas técnicas de radiocirugía empleadas en el tratamiento de los adenomas hipofisarios, incluyendo los AHNF, y concluyen que todas son opciones terapéuticas efectivas y seguras, mínimamente invasivas, y útiles en tumores<4 cm3, separados al menos 3mm del quiasma óptico, y resistentes a otro tipo de tratamientos. Los autores también sugieren que las dosis entre 18 y 20Gy son las más adecuadas en AHNF49.
Tratamiento de adenomas hipofisarios no funcionantes con técnicas de radioterapia estereotáxica
| Autor | Tipo de RT | n | Media de seguimiento (meses) | Dosis de RT (media) | Control local (%) | Nuevas deficiencias de adenohipófisis (%) | Nuevas alteraciones visuales (%) |
| Sheehan99 (2011) | GK | 152 | 31 | - | 90,3 | - | - |
| Park48 (2011) | GK | 125 | 62 | 13Gy | 89,6 | 24 | 0,8 |
| Gopalan54 (2011) | GK | 48 | 80,5 | 18,4Gy | 83,3 | 38 | 6,25 |
| Iwata52 (2011) | CK | 100 | 33 | 21/3Fr 25/5Fr | 98 | 2 | 1 |
| Starke100 (2012) | GK | 140 | 50 | 38,6Gy | 90 | 30,3 | 12,8 |
CK: cyberknife; Fr: Fraccionada; GK: gammaknife; Gy: Gray; RT: radioterapia.
Se ha descrito que la aparición de nuevas deficiencias hormonales de adenohipófisis se correlaciona con las dosis altas de radiación50,51. Iwata et al. empleando RT estereotáxica hipofraccionada (21Gy en 3 fracciones o 25Gy en 5 fracciones) detectan aparición de nuevas deficiencias hormonales solo en el 2% de los casos52. Sus resultados son prometedores pero se necesita mayor seguimiento de los pacientes para determinar su verdadera utilidad. Marek et al. consideran que, si se administran sobre hipófisis e infundíbulo distal dosis inferiores a 15Gy y 17Gy, respectivamente, puede prevenirse el desarrollo de hipopituitarismo en pacientes tratados con gammaknife53. Sin embargo, Gopalan et al. estudiando también los efectos de radiocirugía con gammaknife en 48 pacientes con AHNF no encuentran dosis por volumen de tejido hipofisario funcionante por debajo de la cual no exista riesgo de hipopituitarismo, posiblemente porque durante la RT la hipófisis normal siempre recibe cierta radiación54. El uso concomitante con la RT de inhibidores de mTOR (rapamicina y sus derivados) podría permitir emplear dosis de radiación más baja, consiguiendo respuestas terapéuticas adecuadas. Teóricamente esto aumentaría la posibilidad de preservar la función hipofisaria pero aún es pronto para aconsejar esta asociación, ya que los trabajos publicados55 son escasos, incluyen pocos pacientes y no hay estudios prospectivos.
Tratamiento farmacológicoLos agonistas dopaminérgicos y los análogos de la somatostatina pueden producir reducciones tumorales modestas de los AHNF y solo en un pequeño número de pacientes. Esto hace que no se consideren como tratamiento de primera elección56,57.
Los AHNF presentan receptores dopaminégicos D4 en el 17% de los casos58 y D2 en el 21,6%59. Los gonadotropinomas y los adenomas de células nulas son los subtipos de AHNF con expresión relativamente mayor de receptores D260. La expresión de receptores D2 es muy baja en adenomas corticotropos silentes y en tumores plurihormonales60. Esta distribución de receptores sugiere que los agonistas dopaminérgicos pueden ser efectivos solo en una pequeña proporción de AHNF. Sin embargo se ha descrito que pueden llegar a estabilizar las alteraciones visuales en el 70% de los pacientes y el volumen tumoral en más del 60% de los casos52. Hay pocos estudios sobre la utilidad de los agonistas dopaminérgicos tras la cirugía61 pero se podría considerar el empleo de cabergolina en casos donde persisten restos quirúrgicos sobre todo en adenomas silentes con inmunohistoquímica positiva para PRL.
La expresión de los receptores de la somatostatina (SSTR) es muy variable en los adenomas hipofisarios. Los estudios realizados para determinarlos en AHNF no son concluyentes: mientras algunos encuentran que el SSTR3 es el subtipo de receptor dominante expresado por estos tumores62, otros hallan una mayor y más prevalente expresión de ARNm del SSTR263. Incluso los mismos grupos de trabajo tienen varias publicaciones con resultados contradictorios64,65 posiblemente por el empleo de diferentes anticuerpos. Ramírez et al., utilizando anticuerpos monoclonales específicos en AHNF, encuentran expresión de receptores SSTR2, SSTR3 y SSTR5, siendo este último el que lo hace con mayor frecuencia66. Esto puede tener implicaciones terapéuticas en el futuro y los propios autores apuntan la posibilidad de emplear en el tratamiento de AHNF determinados análogos de la somatostatina, fundamentalmente pasireotida que es capaz de actuar sobre SSTR3. Con octreotida se ha observado reducción del tamaño tumoral en el 5% de los pacientes y estabilización de la enfermedad en el 83%54.
Tratamiento de los restos tumorales tras cirugíaLa resección tumoral total es un factor pronóstico importante de curación a largo plazo67 y algunos estudios25,41, aunque no todos68, encuentran que el remanente tumoral es un marcador adverso de crecimiento posterior. Probablemente las discrepancias se deban en parte a diferentes periodos de seguimiento. El riesgo de recurrencia también parece relacionarse con la edad, siendo mayor en pacientes menores de 60 años69.
Si quedan restos tumorales tras cirugía se han descrito menores tasas de recurrencias cuando se emplea RT convencional en el postoperatorio inmediato que cuando se indica RT solo si se demuestra crecimiento de los mismos70. Según esto, se debería recurrir a la RT siempre que no haya seguridad de exéresis tumoral completa. Sin embargo, el crecimiento de restos tumorales es poco frecuente (9,7-13,5%) tanto en estudios retrospectivos67 como observacionales68. Por ello, algunos autores sugieren que la RT se emplee solo si se observa crecimiento de los restos para evitar posibles secuelas innecesarias para los pacientes67. Por otra parte, la demora en la indicación de RT no empeora el pronóstico, porque los pacientes tratados con RT convencional una vez detectado el crecimiento de restos tumorales también presentan estabilización o regresión del adenoma hipofisario70.
Al desconocer el balance entre los beneficios de la irradiación posquirúrgica y los efectos potenciales indeseables de la misma, debe individualizarse la decisión terapéutica. En general, si los restos tumorales son pequeños se puede optar por vigilar su tamaño con RM cada 6 meses el primer año, cada año durante los 5 años siguientes y cada 2 años posteriormente44. Si los restos son grandes, están cerca del quiasma óptico o lo comprimen, se puede realizar una segunda intervención a los 4 meses de la primera23. En caso de que la primera técnica quirúrgica empleada hubiera sido la transesfenoidal microscópica clásica, se podría considerar la técnica endoscópica para intentar mejorar los resultados71. Si los restos tumorales ocupan senos cavernosos o son >1cm pero no producen compresión de nervios ópticos ni están localizados cerca de estructuras que pueden afectarse con su crecimiento se puede emplear RT72 (fig. 1). Teniendo en cuenta el bajo grado de crecimiento de la mayoría de los AHNF, algunos autores recomiendan RT solo si la expectativa de vida del paciente es mayor de 10 años.
Wass et al. también proponen que, tras la RT, el seguimiento de los pacientes se realice anualmente con test de función hipofisaria y campimetría. También sugieren que solo se haga control radiológico con RM si aparecen síntomas o signos que hagan sospechar nuevo crecimiento tumoral44 (fig. 1).
Tratamiento de las recidivas tumorales tras cirugíaCasi el 30% de los pacientes (entre el 10 y el 69%) presenta recurrencia tumoral en los 5-10 años siguientes al tratamiento quirúrgico. La invasión microscópica de la duramadre que puede presentar hasta el 94% de macroadenomas con extensión supraselar en el momento de la cirugía no parece ser un factor pronóstico de recurrencia. En el metaanálisis realizado por Roelfsema et al., con una media de seguimiento de 5,13 años, se describe recidiva tumoral tras la cirugía en el 10,57% de los AHNF. Este porcentaje de recurrencia es inferior al encontrado en los prolactinomas, similar al de los adenomas productores de ACTH y significativamente mayor al observado en acromegalia. Aunque la mayoría de las recidivas en AHNF se producen en los primeros 5 años tras la cirugía, hay un número no despreciable que lo hace en los siguientes 5 años lo que obliga a prolongar el seguimiento de estos pacientes durante, al menos, 10 años. No hay unanimidad en los estudios analizados en considerar edad, sexo, tamaño tumoral, invasión tumoral o histología como factores pronósticos de recurrencia37.
Cuando se produce la recurrencia tumoral se puede optar por la reintervención quirúrgica, aunque los riesgos son mayores que en la intervención inicial y las posibilidades de éxito menores. Si el tumor ha crecido hacia senos cavernosos o hacia otras estructuras cerebrales que impidan la extirpación total, o no se pueda realizar la cirugía, se puede indicar RT.
Adenomas hipofisarios no funcionantes agresivosNo todos los AHNF se comportan de igual forma. Aunque suelen mostrar un crecimiento lento, los tumores a veces son agresivos, con crecimiento continuo a pesar de los tratamientos empleados, incluyendo cirugía y RT. El término carcinoma debe reservarse exclusivamente para aquellos tumores que muestren metástasis craneoespinales o sistémicas73.
Según la clasificación de la Organización Mundial de la Salud de 2004, el «adenoma hipofisario atípico» es un tumor con potencial agresividad que presenta aumento del índice mitótico, crecimiento invasivo, índice Ki67>3% y positividad nuclear para p53 generalmente en más del 5% de células. La frecuencia de este tipo de adenomas oscila entre el 2,7%, recogida en el registro alemán de tumores hipofisarios, y el 15% encontrada por Zada et al.74, aunque realmente se desconoce la prevalencia exacta de AHNF agresivos. Clínicamente se puede sospechar su existencia por el rápido crecimiento tras la cirugía y el gran tamaño inicial con invasión local en el 35-40% de casos. El valor predictivo del índice Ki67 es muy controvertido, sobre todo en los AHNF75. Algunos estudios, aunque no todos29, encuentran relación entre el índice Ki67 y el grado de recurrencia de AHNF. Tampoco hay acuerdo sobre cuál es el valor del índice Ki67 que mejor predice la agresividad tumoral. El valor de 3% propuesto por la Organización Mundial de la Salud tiene baja sensibilidad (53,8%) y elevada especificidad (89,5%)76. Probablemente sería mejor considerar los distintos tipos de adenomas hipofisarios y determinar diferentes niveles máximos de Ki67 para cada uno de ellos como proponen varios autores en la actualidad76,77. Tampoco está clara la relación de p53 con la agresividad de los AHNF29.
Aún hay pocos estudios sobre los factores moleculares relacionados con la agresividad de los AHNF esporádicos y se ha sugerido que los tumores recurrentes pueden tener un origen clonal diferente al de los tumores iniciales. Comparando hipófisis normales con tejidos de adenomas hipofisarios, hay datos que sugieren que la agresividad de estos adenomas se relaciona con la presencia de la isoforma truncada N-terminal del receptor 4 del factor de crecimiento fibroblástico (FGFR4) y con la sobreexpresión de la molécula de adhesión de la célula neural polisialilatada78 y de diversas metaloproteasas79. En un estudio genético y molecular realizado por Galland et al. se comparan 22 AHNF invasivos con 18 AHNF no invasivos. De los 35 genes estudiados, solo MYO5A e IGFBP5 se expresan de distinta forma en los 2 subgrupos. El análisis inmunohistoquímico muestra mayor positividad en la expresión de MYO5A en los tumores invasivos, pudiendo ser este un marcador útil de agresividad80. También se ha asociado la capacidad invasiva de ciertos adenomas con la sobreexpresión del PTTG81 pero se desconoce si guarda relación con una mayor agresividad tumoral. Mientras algunos estudios encuentran que la proteína PTTG1 se correlaciona positivamente con el índice Ki6782 y le atribuyen capacidad para predecir recurrencias tumorales con una sensibilidad del 79,2% y una especificidad del 100%83, otros no hallan asociación relevante con índices de proliferación, tamaño o invasividad tumoral.
También se piensa que la densidad de microvasos en la angiogénesis puede ser un factor de invasividad tumoral, independientemente de la proliferación celular. Los factores angiogénicos, como el endocan y la ciclooxigenesa-2 (COX-2), podrían ser marcadores predictivos de recurrencia. El endocan, proteoglicano secretado por células endoteliales, está relacionado con la agresividad de diversos tumores. Recientemente se ha detectado en tejido de adenomas hipofisarios, mostrando su inmunorreactividad en relación con la progresión y el tamaño tumoral, el aumento de mitosis y la expresión p5384. La COX-2 se expresa en el 83-100% de los adenomas hipofisarios y, aunque algunos autores encuentran mayor sobreexpresión de COX-2 en AHNF que en el resto de adenomas, otros consideran que no es un factor predictivo de recurrencia o progresión tumoral85.
Hay estudios clínicos que sugieren que el desequilibrio entre las acciones de los receptores estrogénicos α y β se asocia con invasión de tumores de origen epitelial. Ambos receptores estrogénicos se han detectado en tejido hipofisario y se ha demostrado que los AHNF invasivos presentan una concentración nuclear de receptores estrogénicos α más alta que los AHNF no invasivos (p<0,01) y una concentración de receptores estrogénicos β más baja86. Este disbalance podría contribuir al comportamiento agresivo de ciertos AHNF.
Se ha empezado a cuestionar la mayor agresividad de los adenomas corticotropos silentes respecto al resto de los AHNF. Alahmadi et al. no encuentran aumento de recurrencias tumorales en 20 pacientes con adenomas corticotropos silentes87. Ioachimescu et al. en un estudio retrospectivo comparan las características clínicas, radiológicas y hormonales de 33 macroadenomas corticotropos silentes con 126 macroadenomas no funcionantes. Los pacientes con adenomas corticotropos silentes son más jóvenes, presentan más deficiencias hormonales y una mayor tendencia a la invasión de senos cavernosos, pero el crecimiento tumoral posquirúrgico es parecido en ambos grupos empleando un protocolo similar de RT adyuvante en los casos en los que persisten restos tumorales. Según los autores, estos hallazgos indican que, probablemente, no habría que alterar el plan de tratamiento de los AHNF solo por la positividad para ACTH encontrada en el análisis inmunohistoquímico. Sin embargo también recomiendan que se mantenga un seguimiento estrecho de los pacientes88. Otros autores consideran que, aunque las recurrencias no sean más frecuentes en adenomas corticotropos silentes, si aparecen, son más agresivas que en el resto de AHNF35.
Tratamiento de tumores hipofisarios no funcionantes agresivosHasta la actualidad hay escasas opciones terapéuticas en los AHNF agresivos. Se puede considerar la reintervención quirúrgica si el tumor está cerca del quiasma o lo comprime pero la cirugía puede no ser curativa aunque controle la sintomatología por periodos variables de tiempo89. La RT, sobre todo si se emplea precozmente, puede evitar el crecimiento tumoral pero solo en raras ocasiones induce verdadera regresión del tumor. Por otro lado, la mayoría de los tumores agresivos muestra resistencia al tratamiento farmacológico con agonistas dopaminérgicos o análogos de la somatostatina.
Se han empleado varios tratamientos quimioterápicos, aunque casi siempre la respuesta lograda es parcial y transitoria90. A nivel experimental, el everolimus, inhibidor de la vía mTOR, reduce la viabilidad celular al inducir apoptosis, y el cotratamiento con pasireotida, pero no con cabergolina, tiene efecto aditivo91. La temozolomida (TMZ), agente alquilante oral de segunda generación, se empezó a emplear en el tratamiento de carcinomas hipofisarios92, demostrando una actividad significativa contra este tipo de tumores. Por eso, posteriormente, se utilizó en pacientes con adenomas hipofisarios agresivos. Sin embargo, los AHNF agresivos y carcinomas no funcionantes son los que peor responden al tratamiento con TMZ, consiguiéndose control tumoral solo en el 38-40% de los casos93,94, frente al 73% de prolactinomas y al 60% de tumores secretores de ACTH. Dentro de los AHNF, responden mejor los gonadotropinomas (66,6%) que los tumores de células nulas (20%)93.
El efecto citotóxico de la TMZ se basa en la metilación del ADN en la posición O6 de guanina, inhibiendo así su replicación. Se administra por vía oral, se activa a pH fisiológico y presenta pocas variaciones farmacocinéticas interpacientes95. La TMZ es bien tolerada, en comparación con otros agentes quimioterápicos. Se han propuesto varias pautas de administración (tabla 2) y, aunque no se sabe cuál es la mejor en tumores hipofisarios, la más empleada es la estándar (200mg/m2 durante 5 días cada 28 días). Tampoco se ha establecido el tiempo máximo que se puede mantener el tratamiento. La falta de respuesta a la TMZ tras 3 ciclos predice resistencia a la misma. Por otro lado, la respuesta inicial no siempre asegura control a medio y largo plazo93.
Pautas de administración de temozolomida
| Pauta estándar | 150-200 mg/m2/día durante 5 días cada 28 díasEn ocasiones:-Dosis de ciclo inicial: 150 mg/m2/día durante 5 días-Dosis posteriores, si buena tolerancia: 200 mg/m2/día durante 5 días cada 28 días |
| Pautas menos habituales | 50-75 mg/m2/día sin interrupción150 mg/m2/día los días del 1 al 7 y del 14 al 21 en un ciclo de 28 días80-100 mg/m2/día durante 21 días seguidos en ciclos de 28 días |
La presencia dentro de las células tumorales de O6-metilguanina-DNA-metiltransferasa (MGMT), enzima reparadora de ADN, puede inducir resistencia a la acción de TMZ y escasa respuesta terapéutica al fármaco. Por eso se ha propuesto que la expresión de MGMT debería ser evaluada por inmunohistoquímica antes de administrar TMZ a los adenomas agresivos96. Sin embargo, hasta la actualidad hay pocos estudios que cuantifiquen la expresión de MGMT y no se sabe qué límites son los adecuados para considerar si los niveles son altos, moderados o bajos. Widhalm et al. demuestran baja expresividad de MGMT en el 50% de tumores no funcionantes con comportamiento agresivo97. Empleando un análisis semicuantitativo de la expresión de MGMT, Raverot et al. encuentran que el valor de esta determinación para predecir la respuesta al tratamiento con TMZ es solo del 25% de pacientes con AHNF, claramente inferior al encontrado en prolactinomas (67%), Cushing ACTH-dependiente (79%) y acromegalia (100%). Por tanto, los autores consideran que la expresión de MGMT no debe ser determinante en la selección de pacientes que pueden beneficiarse del tratamiento con TMZ93.
La toxicidad más frecuente de la TMZ es la mielosupresión, con aparición de trombocitopenia en el 7-17% de los casos y de neutropenia con menor frecuencia98. La mayor incidencia de estos efectos adversos se produce entre los días 21 y 28 de cada ciclo de administración, con recuperación en 1-2 semanas. No hay evidencia de toxicidad hematológica acumulativa. Parece que el riesgo de mielotoxicidad es mayor cuando se emplean dosis altas y continuas de TMZ y cuando la expresión de MGMT antes del tratamiento es baja. La aparición de síndrome mielodisplásico, anemia aplásica o cáncer hematológico es menos frecuente. Otros efectos indeseables no hematológicos incluyen náuseas y vómitos (34%), astenia (20%), rash cutáneo, cefalea, anorexia y diarrea. Cuando se emplean dosis altas y continuas, o se asocia RT o corticoides, aumenta el riesgo de infecciones, por lo que se recomienda asociar trimetropin-sulfametoxazol o pentamidina en estas situaciones.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.