Degludec es la última molécula de las insulinas basales de acción ultra-lenta aprobada para su uso en humanos. Forma multihexámeros solubles que tras la inyección subcutánea se transforman en monómeros que son absorbidos lenta y continuamente por la circulación sanguínea. Este mecanismo de acción le confiere un perfil de acción ultra-lento y estable, sin picos de concentración. En este trabajo se han recogido los últimos ensayos en pacientes con diabetes mellitus tipo1 y 2, en los que degludec demostró no-inferioridad en la disminución de la HbA1c asegurando un control óptimo de la glucemia de forma similar a como lo hicieron glargina o detemir. Además, presentó un perfil de seguridad mejorado, al estar asociado a una tasa significativamente inferior de hipoglucemias nocturnas en ambos tipos de diabetes y potencialmente de hipoglucemias globales en el tipo2. Degludec abre, además, la posibilidad de utilizar pautas con mayor flexibilidad.
Degludec is the most recent molecule of the ultra-long-acting basal insulin analogues approved for human use. It forms soluble multihexamers which after subcutaneous injection are converted into monomers, and are thus slowly and continuously absorbed into the bloodstream. This absorption mechanism confers degludec an ultra-long and stable action profile, with no concentration peaks. This paper discusses the most recent studies in patients with type1 and 2 diabetes mellitus, which showed degludec to be non inferior in decreasing HbA1c, ensuring optimum glycemic control similar to that achieved with insulin glargine or detemir. Degludec also had an improved safety profile, as it was associated to a significantly lower rate of nocturnal hypoglycemia in both types of diabetes and to a potentially lower overall hypoglycemia rate in type2DM. Degludec also opens the possibility to use more flexible regimens.
Debido a la alta prevalencia de la diabetes mellitus (DM), calculada en 2011 en 366millones de personas, lo que representa el 8,3% de la población mundial1, esta enfermedad ha adquirido características de epidemia. El aislamiento de la insulina en 1921 supuso uno de los avances médicos más importantes del siglo xx, abriendo un extenso campo de investigación sobre el tratamiento de la DM. El uso de las insulinas purificadas de origen animal para uso clínico en humanos dio paso a la insulina humana obtenida mediante técnicas de ADN recombinante. Estas moléculas presentan una gran variabilidad farmacocinética, fundamentalmente en la absorción y en la duración de la acción, lo que produce picos de concentración que pueden contribuir a la aparición de hipoglucemias. La secreción de insulina fisiológica tiene 2componentes, uno basal continuo, que se presenta entre ingestas, y otro agudo, desencadenado por el aumento de la glucemia. En los últimos años se han desarrollado los análogos de insulina basal con acción ultra-lenta, cuyo objetivo es producir un control sostenido de la glucemia, lo que reduciría el riesgo de hipoglucemias. Las primeras insulinas de este tipo, glargina y detemir, son hoy en día una herramienta fundamental en el manejo de los pacientes con DM tanto en el tipo1 (DM1) como en el tipo2 (DM2). Se ha demostrado que proporcionan un control óptimo de la glucosa similar al obtenido con insulina neutral protamine Hagedorn (NPH), con un riesgo significativamente menor de hipoglucemia, especialmente nocturna2-4. Asimismo, estos compuestos se caracterizan por presentar una menor variabilidad día a día en los valores de glucosa plasmática en ayunas5-7. No obstante, estas insulinas no son capaces de reproducir fielmente la secreción basal de insulina endógena durante más de 24h, como idealmente se requeriría en los pacientes con DM1. La insulina degludec ha sido formulada para formar complejos de multihexámeros solubles que después de la inyección subcutánea producen depósitos de monómeros que son absorbidos lentamente por la circulación sanguínea8. Este mecanismo de acción único le confiere un perfil farmacocinético plano y estable, con una semivida de eliminación de más de 25h y una duración de la acción de más de 40h8,9. En este artículo de revisión se recogen los estudios más recientes que confirman la noinferioridad de insulina degludec con respecto al tratamiento estándar en el control glucémico de pacientes con DM1 y DM2, así como sus beneficios para reducir el riesgo de hipoglucemias. Se describe además el perfil de seguridad de insulina degludec observado en la fase iii del desarrollo clínico de este nuevo análogo de insulina basal de acción ultra-lenta.
Avances clínicos en el estudio de degludec en diabetes tipo1En el caso de la DM1 se requiere, además de un aporte sostenido de insulina exógeno para asegurar que se alcanzan los niveles basales, un bolo de insulina de acción rápida para hacer frente a la hiperglucemia generada durante las comidas. Con frecuencia, la complejidad y la falta de flexibilidad de las pautas de insulina, el rechazo del paciente ante la administración de múltiples dosis de insulina y el miedo a presentar hipoglucemias repercuten en la adherencia y en la eficacia del tratamiento, así como en la calidad de vida relacionada con la salud10-12. En un estudio exploratorio en fase ii, la terapia combinada de degludec e insulina aspart de acción rápida redujo el riesgo de hipoglucemias en un 28% más que la misma combinación con glargina, y hasta en un 58% más las nocturnas, mientras que el control de la glucemia fue similar para ambas pautas de insulina a las 16semanas de tratamiento13,14. También fue comparable el perfil de seguridad, incluso cuando se estudió el aumento de peso. Un sub-estudio del anterior evaluó la calidad de vida de los pacientes según la encuesta de salud SF-36, observándose una mejora significativa en la función social y de salud mental de los pacientes a los que se les había administrado la combinación con degludec. Aunque es necesario realizar más estudios, estos resultados podrían estar relacionados con la reducción del riesgo de hipoglucemias15.
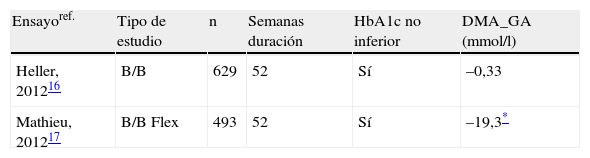
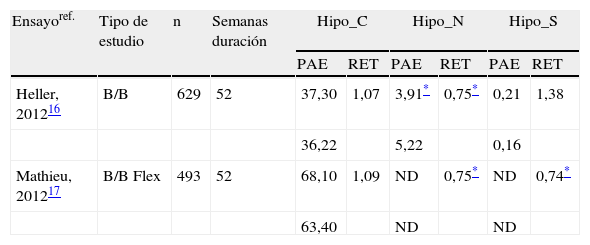
A la vista de los resultados, da comienzo la fase iii del desarrollo clínico de este nuevo análogo de insulina basal de acción ultra-lenta en DM1, cuyos resultados de eficacia se muestran en la tabla 1 y la tasa de hipoglucemias en la tabla 2. El estudio aleatorizado, controlado, paralelo, abierto y multicéntrico BEGIN Basal-Bolus Type1 evaluó la eficacia y la seguridad de la administración de insulina degludec o glargina durante 52semanas de seguimiento16. Se aleatorizaron 629pacientes adultos con DM1 en una ratio 3:1 para recibir el nuevo análogo de insulina o glargina una vez al día, ambos combinados con insulina aspart durante las comidas. Las dosis de insulina fueron ajustadas para obtener un objetivo de control de la glucemia en ayunas (GA) de 70-90mg/dl. El objetivo primario del estudio fue el descenso de la HbA1c en la semana 52. Los resultados demostraron la noinferioridad de degludec en el control de la glucemia, con una diferencia de 0,40% para degludec y 0,39% para glargina (–0,01%; intervalo de confianza [IC] 95%: –0,14 a 0,11; p<0,0001 para el test de noinferioridad). Además, no se detectaron diferencias significativas en la disminución de la GA, siendo la diferencia estimada entre los tratamientos de –5,94mg/dl (IC95%: –18,54 a 6,48; p=0,35). La disminución en los perfiles glucémicos de 9puntos detectada durante las 52semanas de tratamiento fue igualmente similar entre ambas terapias insulínicas, y únicamente con degludec resultó significativamente inferior la glucemia antes del desayuno (–9,9mg/dl; IC95%: –18,54 a –1,44; p=0,023). La tasa global de episodios de hipoglucemia confirmada fue similar entre ambos grupos de estudio tanto en la primera fase de seguimiento como durante el periodo de mantenimiento (de la semana 16 a la 52). Sin embargo, sí se observó una disminución en la tasa de hipoglucemias nocturnas, que fue significativamente menor en el grupo experimental con degludec durante todo el seguimiento del estudio (tasa por paciente-año de exposición: 4,41 vs. 5,86; razón estimada de tasas [RET]: 0,75; IC95%: 0,59 a 0,96; p=0,021). La incidencia de efectos adversos graves y no graves fue muy parecida para ambas pautas de insulina.
Eficacia de degludec frente a glargina en el desarrollo clínico en fase iii en pacientes con diabetes mellitus tipo 1
| Ensayoref. | Tipo de estudio | n | Semanas duración | HbA1c no inferior | DMA_GA (mmol/l) |
| Heller, 201216 | B/B | 629 | 52 | Sí | –0,33 |
| Mathieu, 201217 | B/B Flex | 493 | 52 | Sí | –19,3* |
B/B: basal-bolus; DMA_GA: diferencia media ajustada de glucosa plasmática en ayunas [degludec-glargina]; Flex: degludec Flex (intervalos de 8-40h) vs glargina; Sí: se confirma la hipótesis de noinferioridad de degludec frente a glargina (Δ≤4%).
Tasa de hipoglucemias en el desarrollo clínico en fase iii de degludec frente a glargina en pacientes con diabetes mellitus tipo 1
| Ensayoref. | Tipo de estudio | n | Semanas duración | Hipo_C | Hipo_N | Hipo_S | |||
| PAE | RET | PAE | RET | PAE | RET | ||||
| Heller, 201216 | B/B | 629 | 52 | 37,30 | 1,07 | 3,91* | 0,75* | 0,21 | 1,38 |
| 36,22 | 5,22 | 0,16 | |||||||
| Mathieu, 201217 | B/B Flex | 493 | 52 | 68,10 | 1,09 | ND | 0,75* | ND | 0,74* |
| 63,40 | ND | ND | |||||||
B/B: basal-bolus; Flex: degludec Flex (intervalos de 8-40h); Hipo_C: hipoglucemia confirmada; Hipo_N: hipoglucemia nocturna; Hipo_S: hipoglucemia grave; ND: información no disponible; PAE: tasa de episodios por paciente-año de exposición; RET: razón estimada de tasas [degludec/glargina].
Hasta la fecha se ha considerado indispensable mantener una hora fija de inyección de insulina basal a diario para asegurar un control de la glucemia estable. Disponer de una mayor flexibilidad para la administración de insulina basal puede representar en los pacientes diabéticos una ventaja añadida, ya que les permitiría amoldar el momento de la inyección a sus necesidades individuales a lo largo del día. Recientemente se han presentado en un congreso los resultados de un ensayo clínico aleatorizado, abierto y multicéntrico, BEGIN Flex Type 1, de 52semanas de duración, en el que se compararon la eficacia y la seguridad de degludec administrado según una pauta flexible y glargina administrada según ficha técnica17. En la primera fase de 26semanas de estudio, los pacientes se administraron degludec una vez a la misma hora (n=165) o en pauta flexible con intervalos de administración entre 8 a 40h (n=164). En la fase de extensión de este estudio todos los pacientes fueron unificados en un solo grupo de degludec en pauta flexible (n=329) para ser comparados con glargina (n=164). Los resultados a las 52semanas mostraron noinferioridad, con un descenso en la HbA1c basal del 0,13 y del 0,21% en el grupo de degludec en pauta flexible y glargina, respectivamente (diferencia estimada entre ambos grupos: 0,07%; IC95%: –0,05 a 0,19). Por su parte, la disminución obtenida en la GA fue significativamente mejor para degludec en pauta flexible, con una diferencia estimada de la GA con respecto a glargina de –19,3mg/dl (–32,7 a –5,8; p=0,005). La tasa global de hipoglucemias registradas (paciente-año de exposición) fue similar para degludec y glargina (68,1 vs. 63,4, respectivamente; RET: 1,09; IC95%: 0,91 a 1,29; p=no significativa [NS]). Sin embargo, el grupo degludec con pauta flexible registró una disminución estadísticamente significativa del 25% de las hipoglucemias nocturnas (RET: 0,75; IC95%: 0,58 a 0,97; p=0,025), así como un 26% menos de hipoglucemias graves (RET: 0,74; IC95%: 0,38 a 1,42; p=NS). Ambos grupos de estudio notificaron una tasa similar de efectos adversos.
Avances clínicos en el estudio de degludec en diabetes tipo2En los pacientes con DM2 el tratamiento farmacológico inicial suele realizarse con antidiabéticos orales (ADO), además de las recomendaciones generales para la DM en cuanto a ejercicio y dieta. Sin embargo, por la disfunción progresiva de las célulasβ, el tratamiento insulínico es necesario si no se alcanzan los objetivos de control. Algunos estudios indican que la terapia con insulina en estos pacientes habitualmente suele ser necesaria unos 9años después del diagnóstico18. En un ensayo de fase ii, la adición de insulina degludec administrada una vez al día junto a una terapia oral con metformina demostró un buen control glucémico en pacientes con DM2, además de presentar una menor incidencia de hipoglucemias comparado con la misma terapia con glargina (aunque la diferencia no fue estadísticamente significativa)19.
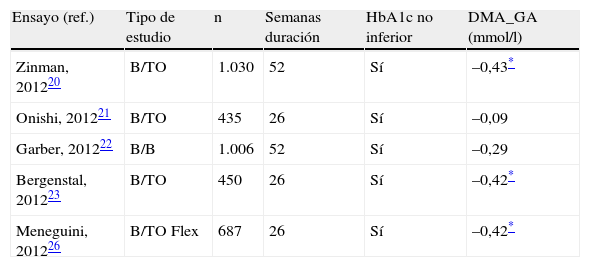
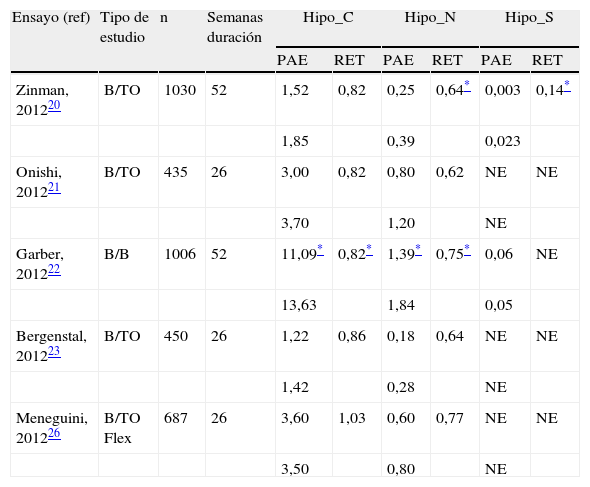
Los estudios de fase iii en pacientes con DM2 se resumen en las tablas 3 y 4, y dieron comienzo con el ensayo clínico aleatorizado, controlado, abierto y multicéntrico de 52semanas de seguimiento en el que se eligieron pacientes con DM2 que no habían recibido insulina anteriormente pero que podían estar en tratamiento con ADO (metformina±inhibidores de la dipeptidil-peptidasa-4 [DPP-4])20. Los resultados mostraron noinferioridad en la eficacia de degludec con respecto a glargina, con una diferencia estimada en la disminución de la HbA1c entre ambos grupos de 0,09% (IC95%: –0,04 a 0,22) y una diferencia estimada entre ambos grupos estadísticamente significativa de –7,74mg/dl (p=0,005) para la GA favorable a degludec. La tasa de hipoglucemias globales confirmadas fue similar entre ambos grupos. Sin embargo, el riesgo de hipoglucemias nocturnas y graves fue significativamente inferior con degludec (tasa de episodios nocturnos por paciente-año de exposición: 0,25 vs. 0,39; RET: 0,64; IC95%: 0,42 a 0,98; p=0,038, y tasa de episodios graves: 0,003 vs. 0,023; RET: 0,14; IC95%: 0,03 a 0,70; p=0,017). No se encontraron diferencias significativas en la tasa de acontecimientos adversos ni en la ganancia de peso entre los 2tratamientos.
Eficacia de degludec frente a glargina en el desarrollo clínico en fase iii en pacientes con diabetes mellitus tipo 2
| Ensayo (ref.) | Tipo de estudio | n | Semanas duración | HbA1c no inferior | DMA_GA (mmol/l) |
| Zinman, 201220 | B/TO | 1.030 | 52 | Sí | –0,43* |
| Onishi, 201221 | B/TO | 435 | 26 | Sí | –0,09 |
| Garber, 201222 | B/B | 1.006 | 52 | Sí | –0,29 |
| Bergenstal, 201223 | B/TO | 450 | 26 | Sí | –0,42* |
| Meneguini, 201226 | B/TO Flex | 687 | 26 | Sí | –0,42* |
B/B: basal-bolus; B/TO: basal-terapia oral; DMA_GA: diferencia media ajustada de glucosa plasmática en ayunas [degludec-glargina]; Flex: degludec Flex (intervalos de 8-40h) vs glargina; HbA1c: hemoglobina glucosilada; Sí: se confirma la hipótesis de noinferioridad de degludec frente a glargina (Δ≤4%).
Tasa de hipoglucemias registradas en el desarrollo clínico en fase iii de degludec frente a glargina en pacientes con diabetes mellitus tipo 2
| Ensayo (ref) | Tipo de estudio | n | Semanas duración | Hipo_C | Hipo_N | Hipo_S | |||
| PAE | RET | PAE | RET | PAE | RET | ||||
| Zinman, 201220 | B/TO | 1030 | 52 | 1,52 | 0,82 | 0,25 | 0,64* | 0,003 | 0,14* |
| 1,85 | 0,39 | 0,023 | |||||||
| Onishi, 201221 | B/TO | 435 | 26 | 3,00 | 0,82 | 0,80 | 0,62 | NE | NE |
| 3,70 | 1,20 | NE | |||||||
| Garber, 201222 | B/B | 1006 | 52 | 11,09* | 0,82* | 1,39* | 0,75* | 0,06 | NE |
| 13,63 | 1,84 | 0,05 | |||||||
| Bergenstal, 201223 | B/TO | 450 | 26 | 1,22 | 0,86 | 0,18 | 0,64 | NE | NE |
| 1,42 | 0,28 | NE | |||||||
| Meneguini, 201226 | B/TO Flex | 687 | 26 | 3,60 | 1,03 | 0,60 | 0,77 | NE | NE |
| 3,50 | 0,80 | NE | |||||||
B/B: basal-bolus; B/TO: basal-terapia oral; Flex: degludec Flex (intervalos de 8-40h); Hipo_C: hipoglucemia confirmada; Hipo_N: hipoglucemia nocturna; Hipo_S: hipoglucemia grave; NE: no eventos suficientes para el análisis; PAE: tasa de episodios por paciente-año de exposición; RET: razón estimada de tasas [degludec/glargina].
En otro estudio en población asiática se eligieron los pacientes con DM2 que no habían recibido anteriormente tratamiento insulínico pero que podían estar recibiendo de forma estable ADO (n=435)21. Los pacientes de ambos grupos registraron disminuciones similares de la HbA1c (degludec: 1,24%; glargina: 1,35%) y la GA (99,9 y 101,8mg/dl, respectivamente). La tasa global de hipoglucemia confirmada fue un 18% menor en el grupo tratado con insulina degludec a las 26semanas de seguimiento, mientras que fue un 37% menor en la fase de mantenimiento (tras la semana 16 de estudio), aunque sin significación estadística. Con degludec se redujo asimismo la tasa de hipoglucemia confirmada nocturna en un 38%, registrándose 0,8 episodios por paciente-año para degludec en comparación con 1,2 de glargina (p=NS). Esta reducción se incrementó al 48% en la fase de mantenimiento (a partir de la semana 16), pero este aumento no tuvo significación estadística. El perfil de seguridad de ambos regímenes insulínicos fue similar, incluyendo el incremento de peso.
La intensificación del tratamiento mediante la administración de una pauta basal/bolo se evaluó en el estudio BEGIN Basal-Bolus Type2 en una población de 1.006 pacientes adultos con DM2, donde se estudiaron la eficacia y la seguridad de una administración diaria de degludec o glargina (ratio 3:1) durante 52semanas, siendo posible mantener un régimen oral con metformina y/o pioglitazona22. La insulina basal se ajustó en base a un valor de GA de 70-90mg/dl. Tras el análisis del objetivo primario de estudio se confirmó la noinferioridad de degludec con respecto a la reducción de los niveles de HbA1c a las 52semanas, siendo la diferencia media desde el inicio de –1,10% para degludec y de –1,18% para glargina (0,08%; IC95%: –0,05 a 0,21; p=NS). No hubo diferencias significativas en la tasa de pacientes que alcanzaron una HbA1c<7% (degludec 49% vs. glargina 50%), en la disminución de la concentración de GA o en la reducción de los perfiles glucémicos de 9 puntos. En cambio, la tasa de hipoglucemias globales confirmadas (expresadas como tasa por paciente-año de exposición) fue significativamente inferior en el grupo con degludec en comparación a glargina (11,1 vs. 13,6, respectivamente; RET: 0,82; IC95%: 0,69 a 0,99; p=0,0359; 18% de reducción de riesgo). Además, se registró una menor incidencia de hipoglucemias confirmadas nocturnas (1,4 vs. 1,8, respectivamente; RET: 0,75; IC95%: 0,58 a 0,99; p=0,0399; 25% de reducción de riesgo). Estos datos se confirmaron en el análisis del periodo de mantenimiento (semanas 16 a 52). La incidencia de episodios graves de hipoglucemia fue baja en ambos grupos, sin que se detectaran diferencias significativas. Por otro lado, el perfil de seguridad de degludec fue similar al de glargina, con una tasa de acontecimientos adversos graves y no graves similar entra ambos grupos. Adicionalmente, los datos del cuestionario de salud SF-36 mostraron una mejora en el componente de dolor corporal tras la terapia con degludec (p=0,032).
Los sistemas de administración de insulina actuales permiten la administración de dosis máximas de 80UI de insulina, pero se ha observado que hasta el 20-30% de los pacientes requieren dosis superiores. Por ello, y a fin de poder administrar dosis más altas de insulina en una única inyección (hasta 160unidades), se estudió una formulación de degludec de 200UI/ml en un ensayo clínico por intención de tratar, abierto, controlado, de 26semanas de duración23. El tratamiento combinado de degludec y ADO resultó ser noinferior en cuanto a eficacia con respecto a la misma combinación con glargina, con una disminución similar en la HbA1c de 1,3% puntos. La reducción de los niveles de GA, en cambio, sí fue significativamente mayor en el grupo de degludec (–7,59mg/dl; p=0,02). Las tasas de hipoglucemia confirmada global y nocturna por paciente y año de exposición fueron igualmente menores para degludec, aunque no se alcanzó significación estadística. La formulación de 200UI/ml de degludec registró una incidencia de acontecimientos adversos similar a glargina. En un sub-estudio del anterior se evaluó la calidad de vida relacionada con la salud de la formulación de degludec 200UI/ml en comparación con glargina en pacientes con DM2 y bajo tratamiento con ADO24. Según los cambios registrados en los resultados del cuestionario SF-36 tras las 26semanas de estudio, los componentes de salud física y mental fueron en general similares para ambas terapias. Únicamente se observó una mejora significativa en los dominios de dolor corporal y vitalidad con degludec (1,6 [0,1-3,2] y 1,5 [0,1-3,0], respectivamente).
También en pacientes con DM2 se ha evaluado la posibilidad de implementar una pauta flexible de administración de degludec, con un intervalo de 8-40h entre inyecciones. En un estudio en fase ii se concluyó que la pauta flexible de degludec aseguraba un control glucémico óptimo (noinferioridad en el estudio de reducción de la HbA1c a las 16semanas de tratamiento) y una tasa similar de hipoglucemias comparando con su administración una vez al día o la de glargina25. El ensayo en fase iii fue aleatorizado, controlado, paralelo, abierto y multicéntrico, de 26semanas de seguimiento, en el que se seleccionaron 459pacientes adultos con DM2 a los que se les administró en un ratio 1:1:1 insulina degludec de forma fija, o flexible, o glargina26. Además, estaba permitido a criterio médico el tratamiento con ADO (metformina, pioglitazona o sulfonilureas). La dosis de insulina basal se ajustó para alcanzar un valor de GA de 70-90mg/dl. El grupo experimental con pauta flexible de degludec demostró noinferioridad con respecto a la pauta fija a las 26semanas de tratamiento. La diferencia estimada entre los tratamientos de GA al final del estudio fue significativamente menor para la pauta flexible de degludec con respecto a glargina (–7,56mg/dl; p<0,05); en cambio, no hubo diferencias significativas entre el tipo de administración flexible o fija. La tasa de hipoglucemias confirmadas globales fue similar entre los 3grupos, solo se apreció una disminución del 23% en la incidencia de hipoglucemias nocturnas en el grupo de pauta flexible de degludec en comparación con glargina (tasa de episodios por paciente-año: 0,6 vs. 0,8; RET: 0,77; IC95%: 0,44 a 1,35; p=NS), aunque esta tasa fue un 18% superior a la obtenida en el grupo de pauta fija de degludec (p=NS). Los datos de seguridad mostraron una tasa de acontecimientos adversos similar entre los 3grupos, con una ganancia de peso igualmente comparable.
Futuro de degludec: estudios en desarrolloEl nuevo análogo de insulina basal de acción ultra-lenta degludec está incluido en varios estudios en marcha como parte de un extenso desarrollo clínico. Una de las mayores limitaciones a las que hoy en día deben hacer frente pacientes y clínicos en la DM es la aparición de hipoglucemias, habitualmente asociadas a la terapia insulínica. Basándose en las ventajas que aportarían las características farmacológicas de degludec en relación con el riesgo de hipoglucemias, se ha puesto en marcha una batería de ensayos clínicos a fin de ampliar la experiencia y comprobar el perfil de seguridad de degludec, cuya finalización se estima para el año 2013. El estudio del riesgo de hipoglucemias durante el ejercicio y la evaluación del efecto de estas en la calidad del sueño, en la función cognitiva o en la activación cerebral de los pacientes tratados con degludec son algunos de los estudios abiertos. Asimismo, la Agencia de Alimentos y Medicamentos de Estados Unidos (FDA) ha requerido la realización de un estudio para evaluar la seguridad cardiovascular de degludec.
En el momento de esta publicación, degludec estaba aprobado en Japón y en Europa para el tratamiento de pacientes con DM1 y DM2.
ConclusionesA la vista de los resultados de los últimos ensayos clínicos en fase iii disponibles, el tratamiento con degludec, un nuevo análogo de insulina basal de acción ultra-lenta, presenta beneficios de seguridad adicionales sobre los agentes terapéuticos ya disponibles. Fundamentalmente se ha observado una menor tasa de hipoglucemias nocturnas en los pacientes con DM de ambos tipos y existe evidencia de una disminución de hipoglucemias globales confirmadas en los pacientes con DM2. Se debe tener presente, no obstante, que estos estudios fueron abiertos, principalmente utilizaban glargina como comparador y estaban promovidos por el laboratorio fabricante.
Degludec presenta un perfil farmacocinético plano y vida media larga, lo que implica una menor variabilidad, una reducción significativa del riesgo de hipoglucemias, así como flexibilidad en la forma de administración. Estas características pueden favorecer el cumplimiento terapéutico y mejorar la eficacia de las pautas de insulina en pacientes con DM1 y DM2. La posibilidad de formulaciones combinadas con análogos de acción rápida es una ventaja añadida que está siendo evaluada en ensayos clínicos.
Conflicto de interesesEl autor ha participado en asesorías de Novo Nordisk, Lilly, AMGEN, AbbVie y MSD, ha sido investigador en ensayos clínicos realizados con degludec y degludec plus (Novo Nordisk) y ha participado en conferencias remuneradas organizadas por Lilly-Boehringer Ingelheim, Novo Nordisk, MSD, FAES, Novartis y GSK.
AgradecimientosEl autor ha contado con el apoyo de Irantzu Izco-Basurko y Teresa Hernando (COCIENTE S.L.) para la redacción de este manuscrito. Esta ayuda ha sido financiada por Novo Nordisk Pharma S.A., que además ha revisado la fidelidad de la información presentada en este manuscrito.