La realización del cribado universal de la disfunción tiroidea en la mujer embarazada es uno de los temas de mayor controversia en la endocrinología actual. Frente a las guías clínicas de la American Thyroid Association (ATA) que aconsejan el cribado selectivo en la población de riesgo1, otras sociedades científicas abogan por el cribado universal en la población gestante, entre ellas la Sociedad Española de Endocrinología y Nutrición (SEEN)2. Sin embargo, los intervalos de referencia de tirotropina (TSH) y tiroxina libre (T4L) en la mujer embarazada propuestos por la ATA son asumidos sin la valoración crítica necesaria. El artículo publicado por Lombardo Grifol et al. inciden en este aspecto al igual que estudios previos ya publicados previamente en el órgano de difusión de la SEEN3.
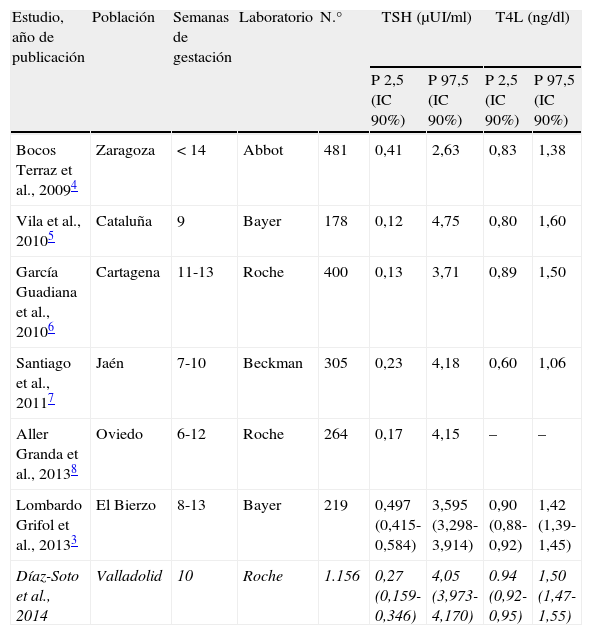
Resulta especialmente significativo cómo los intervalos de referencia de la TSH en la población española de áreas muy distantes geográficamente y obtenidas mediante diferentes técnicas de laboratorio y metodología estadística, difieren mucho de los aconsejados por las guías internacionales (TSH<2,5μUI/ml, durante el primer trimestre del embarazo), y son muy semejantes entre sí3–8.
En enero de 2013, en colaboración con los Servicios de Ginecología y Obstetricia y Análisis Clínicos, el Hospital Clínico Universitario de Valladolid inició el cribado universal de la disfunción tiroidea en la gestación. Durante el año 2013, fueron estudiadas 1.316 mujeres (edad media:32,6±5,6 años) en la 10.ª semana de gestación, evaluando retrospectivamente los niveles de TSH, T4L y autoinmunidad tiroidea (Cobas® 6000 Roche Diagnostics). Se excluyeron un total de 160 mujeres por: autoinmunidad positiva (115 mujeres, 8,7%), enfermedad tiroidea previa y/o tratamiento modificador del perfil tiroideo. Se calcularon los intervalos de referencia para TSH y T4L en la 10.ª semana de gestación según las recomendaciones de la Internacional Federation of Clinical Chemistry (IFCC). Para ello se realizó la normalización de la distribución de los niveles de T4L y TSH mediante su transformación logarítmica, y el posterior cálculo de los intervalos de confianza para los percentiles 2,5 y 97,5, que corresponden a los límites inferior y superior de los valores de referencia, respectivamente9.
Los resultados obtenidos en nuestra población son semejantes a los publicados previamente en la población española, con mínimas diferencias atribuibles a la semana gestacional, la técnica utilizada y la zona de origen (tabla 1)3–8, pero difieren significativamente de los aconsejados por la ATA y la SEEN1,2. Esta situación, que resulta llamativa, no es exclusiva, sino que estudios recientes comunican intervalos de referencia similares en mujeres embarazadas sanas en otros países, lo que apoya la importancia del cálculo de los valores de referencia para cada laboratorio10. A este respecto, es importante resaltar cómo las guías americanas y españolas aconsejan niveles de TSH por debajo de 2,5μUI/ml solo en el caso de no disponer de valores de referencia para las técnicas propias y para la misma población en estudio durante el primer trimestre. Sin embargo, a la luz de los resultados, las concentraciones hormonales de las poblaciones españolas son insistentemente más elevadas con independencia de la técnica utilizada y de la población estudiada. Esta realidad debería reflejarse en un futuro en las guías clínicas/recomendaciones publicadas por la SEEN a este respecto. No hay que olvidar que no existe un nivel de evidencia científica suficiente sobre la eficacia del tratamiento del hipotiroidismo subclínico con niveles TSH por encima de 2,5μUI/ml en embarazadas11,12.
Parámetros de normalidad para TSH y T4L en la población española con autoinmunidad negativa
| Estudio, año de publicación | Población | Semanas de gestación | Laboratorio | N.° | TSH (μUI/ml) | T4L (ng/dl) | ||
| P 2,5 (IC 90%) | P 97,5 (IC 90%) | P 2,5 (IC 90%) | P 97,5 (IC 90%) | |||||
| Bocos Terraz et al., 20094 | Zaragoza | <14 | Abbot | 481 | 0,41 | 2,63 | 0,83 | 1,38 |
| Vila et al., 20105 | Cataluña | 9 | Bayer | 178 | 0,12 | 4,75 | 0,80 | 1,60 |
| García Guadiana et al., 20106 | Cartagena | 11-13 | Roche | 400 | 0,13 | 3,71 | 0,89 | 1,50 |
| Santiago et al., 20117 | Jaén | 7-10 | Beckman | 305 | 0,23 | 4,18 | 0,60 | 1,06 |
| Aller Granda et al., 20138 | Oviedo | 6-12 | Roche | 264 | 0,17 | 4,15 | – | – |
| Lombardo Grifol et al., 20133 | El Bierzo | 8-13 | Bayer | 219 | 0,497 (0,415-0,584) | 3,595 (3,298-3,914) | 0,90 (0,88-0,92) | 1,42 (1,39-1,45) |
| Díaz-Soto et al., 2014 | Valladolid | 10 | Roche | 1.156 | 0,27 (0,159-0,346) | 4,05 (3,973-4,170) | 0.94 (0,92-0,95) | 1,50 (1,47-1,55) |
En cursiva los datos del presente studio.
IC: intervalo de confianza; P: percentil; TSH: tirotropina; T4L: tiroxina libre.
Obviamente, establecer un determinado intervalo de referencia condiciona la práctica clínica, pero también supone importantes consecuencias económicas y asistenciales. En nuestra población y durante el año 2013, establecer como límite superior de TSH un valor de 2,5μUI/ml hubiera supuesto el seguimiento y tratamiento con levotiroxina de 436 mujeres gestantes, es decir un 38% de nuestra población, frente al tratamiento de 130 mujeres (11%) según los criterios de normalidad calculados para nuestra área (TSH≥4,05μUI/ml).
Además, es fundamental resaltar cómo, de la totalidad de los diagnósticos de hipotiroidismo primario realizados durante el año 2013, exclusivamente 62 mujeres (5%) presentaron niveles de TSH≥5μUI/ml, y de ellas, tan solo 7 gestantes (0,6%) mostraron valores de TSH≥10μUI/ml clasificables como hipotiroidismo franco.
En conclusión y desde nuestro punto de vista, el cribado universal de la disfunción tiroidea en la mujer gestante está justificado ya que permite el diagnóstico y tratamiento adecuado de un porcentaje pequeño pero significativo de mujeres embarazadas con hipotiroidismo que podría afectar a la adecuada evolución del embarazo y probablemente al desarrollo fetal e infantil11,12. Sin embargo, la universalización del cribado exige del cálculo de los valores de referencia para la población y técnica de laboratorio de cada hospital en una determinada semana gestacional6. Este análisis no debe ser considerado como una labor excepcional en el contexto de estudios de investigación, sino de máximo interés asistencial y constituye un imperativo previo a la puesta en marcha de cualquier sistema de cribado de disfunción tiroidea gestacional. El establecimiento universal de un punto de corte sin tener en cuenta las características de cada población (ingesta de yodo, enfermedad autoinmune subclínica, etc.) no solo supone una elevada sobrecarga asistencial con su consiguiente gasto económico asociado, sino también una importante carga psicológica durante un periodo especialmente sensible, e indudablemente el sobretratamiento de un amplio porcentaje de la población con el consiguiente riesgo añadido.
FinanciaciónEl presente estudio no ha recibido ningún tipo de financiación pública ni privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.