En la actualidad, la colangiopancreatografía retrógrada endoscópica (CPRE) es el estándar de diagnóstico para colangitis esclerosante primaria (CEP), sin embargo, la colangiografía por resonancia magnética (CRM) se prefiere por ser menos invasiva. El diagnóstico de colangitis esclerosante primaria por medio de ultrasonografía endoscópica (USE) es poco frecuente, y hasta el momento existen pocos reportes. En el presente trabajo se muestra el caso de un paciente con historia de colitis ulcerativa crónica inespecífica (CUCI), que acude siete años después con un cuadro de ictericia obstructiva, con una imagen de CRM sugerente de neoplasia de la vía biliar. El estudio de USE permitió la sospecha de CEP, y por medio de la CPRE se confirmó. Las características ultrasonográficas del colédoco pueden hacer sospechar el diagnóstico, cuando se observan zonas engrosadas de la pared del colédoco que alternan con zonas dilatadas.
Currently, endoscopic retrograde cholangiopancreatography (ERCP) is the standard of diagnosis for primary sclerosing cholangitis, but magnetic resonance cholangiopancreatography (MRC) is preferred because it is less invasive. The diagnosis of primary sclerosing cholangitis by endoscopic ultrasonography (EUS) is rare and so far there are few reports. This paper shows the case of a patient with a history of ulcerative colitis and who has seven years later with obstructive jaundice with a picture of MRC suggestive of malignancy of the biliary tract. The EUS study allowed suspected primary sclerosing cholangitis and through ERCP confirmed. Ultrasonographic features of the bile duct allow that diagnosis may be suspected when viewed thickened areas of the bile duct wall alternating with dilated areas.
Introducción
La colangitis esclerosante primaria (CEP) se caracteriza por la destrucción crónica de los conductos biliares, que genera fibrosis y estenosis de los conductos intra y extrahepáticos llevando a enfermedad hepática terminal.1,2 Se ha reportado que aproximadamente el 44% de los pacientes con CEP son asintomáticos al momento del diagnóstico,3 pero con el paso del tiempo se pueden desarrollar síntomas, llegando a ser del 22% a 5 años.3 El diagnóstico se basa en la evidencia de estenosis cortas de la vía biliar. La imagen típica de CEP en la colangiografía es de estenosis biliares multifocales cortas, intercaladas con segmentos normales o dilatados, con involucro de conductos biliares intra y extrahepáticos.4 En la actualidad, la colangiopancreatografía retrógrada endoscópica (CPRE) es el estándar de diagnóstico, pero la colangiografía por resonancia magnética (CRM) se prefiere por ser menos invasiva.2 El diagnóstico de CEP por medio de ultrasonografía endoscópica (USE) es poco frecuente, y hasta el momento existen pocos reportes.5
El objetivo de este artículo es presentar un caso clínico en el que mediante hallazgos en el USE se sospechó el diagnóstico, y la confirmación se realizó por medio de CPRE.
Presentación del caso
Hombre de 58 años de edad, con antecedente de hipertensión arterial sistémica, hiperplasia prostática benigna y colecistectomía. Siete años atrás fue diagnosticado con colitis ulcerativa crónica inespecífica (CUCI), y debido a sangrado incontrolable fue llevado a colectomía total con anastomosis y reservorio íleo-anal. En esta ocasión, una semana antes de su ingreso inició con dolor abdominal opresivo en hipocondrio derecho, distensión, fiebre de 38.5ºC y coluria. Negó pérdida de peso, prurito, náusea o vómito. En la exploración física presentaba ictericia y dolor abdominal en epigastrio e hipocondrio derecho, sin datos de irritación peritoneal. Los exámenes de laboratorio reportaron hemoglobina 17.2 g/dL, plaquetas 250 x 103/μl, leucocitos 11.7 x 103/μl, neutrófilos absolutos 10.5 x 103/μl, glucosa 134 mg/dL, creatinina 1.28 mg/dL, sodio 133 mmol/L, potasio 3.66 mmol/L, albúmina 3.07 g/dL, bilirrubina total 7.38 mg/dL, bilirrubina directa 3.25 mg/dL, bilirrubina indirecta 4.13 mg/dL, ALT 184 U/L, AST 79 U/L, FA 136 U/L, GGT 533 U/L, DHL 126 U/L, lipasa 32 U/L. Se realizó un ultrasonido de hígado y vías biliares que reportó ausencia de dilatación de la vía biliar intrahepática, con colédoco de 7.8 mm. Se realizó CRM que evidenció una estenosis larga a nivel del conducto biliar principal, de contornos regulares, con dilatación distal y proximal (Figura 1). Se decidió realizar USE para caracterizar la causa de la ictericia. En el USE, a nivel del conducto biliar principal se observaron zonas de dilatación que alternaban con zonas de engrosamiento de la pared del conducto (hasta 4 mm de grosor), lo cual ocasionaba disminución importante de la luz (Figura 2). Por las alteraciones mencionadas y el cuadro clínico, se sospechó el diagnóstico de CEP y el paciente fue sometido a CPRE. Los hallazgos de la CPRE fueron: un conducto biliar principal con zonas de estenosis que alternan con zonas de dilatación, y los mismos hallazgos se documentaron en la vía biliar intrahepática (Figura 3). Los datos mencionados sustentaron el diagnóstico de CEP.
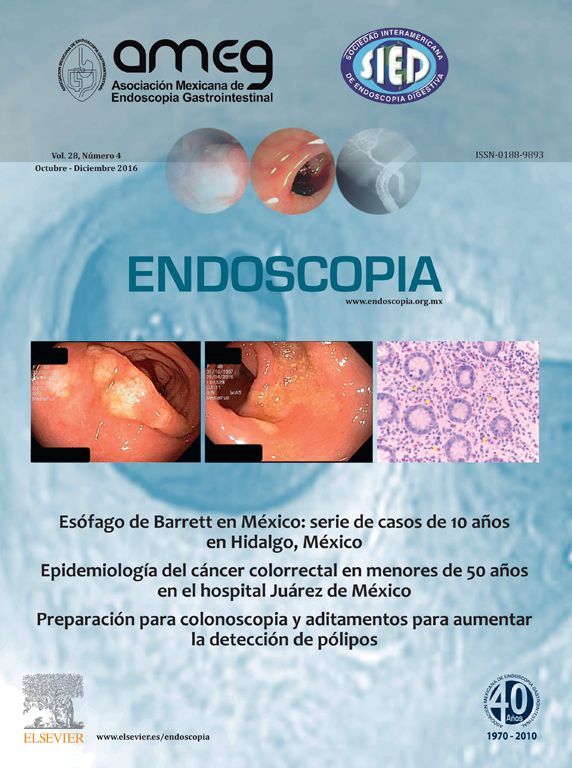
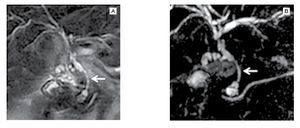
Figura 1. Colangiorresonancia magnética. A) Estenosis de aproximadamente 17 mm de longitud, de contornos regulares que permite el paso del contenido biliar, causando ligera dilatación proximal y periampular (flecha). B) Reconstrucción del árbol biliar con magnificación de la estenosis del conducto colédoco, que muestra los contornos regulares (flecha).
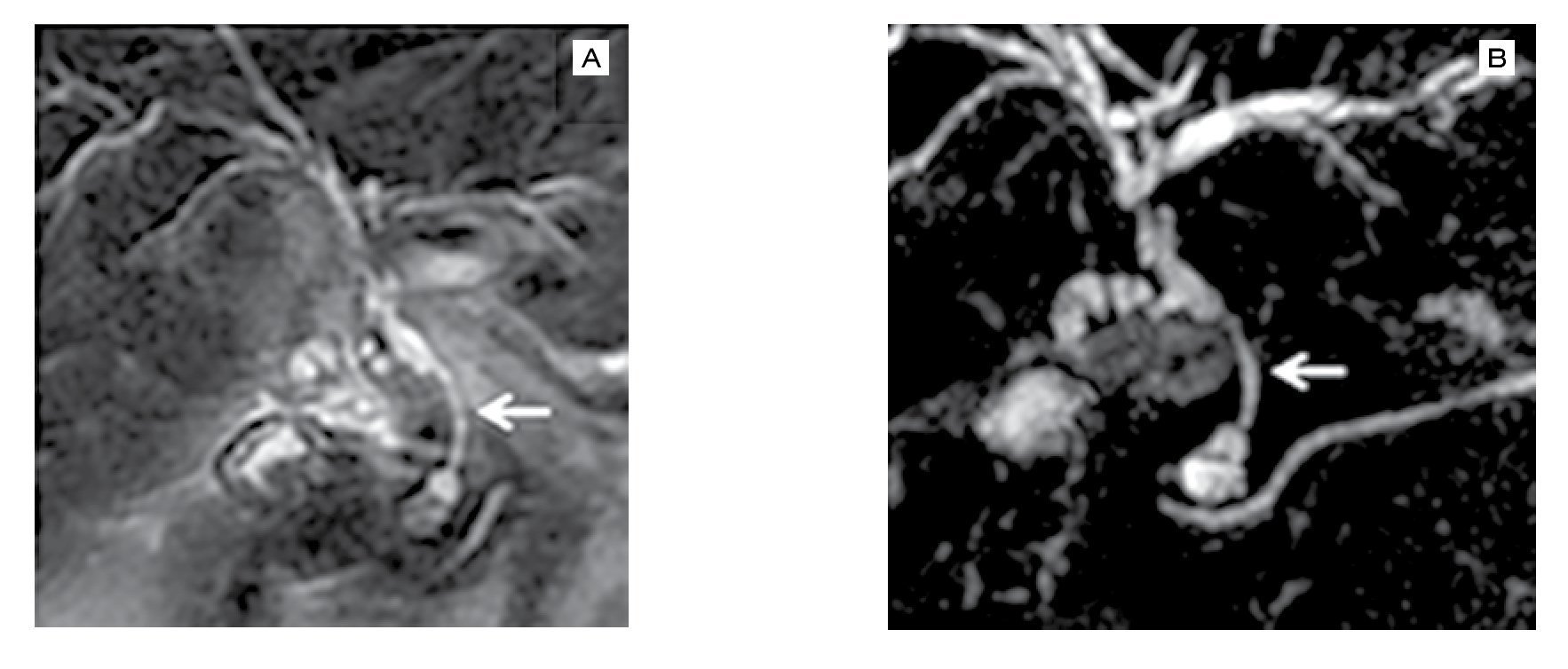
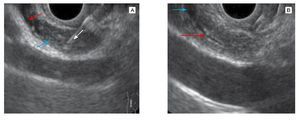
Figura 2. Imagen por ultrasonografía endoscópica. A) Se observa el momento de la toma de la USE-BAAF con aguja 22G (flecha blanca), en una estenosis proximal con engrosamiento de la pared del colédoco que cierra totalmente la luz (flecha azul) y provoca dilatación proximal (flecha roja). B) Zona de dilatación proximal del conducto biliar proximal (flecha azul), con zona distal con engrosamiento de las paredes del conducto biliar con estenosis importante (flecha roja).
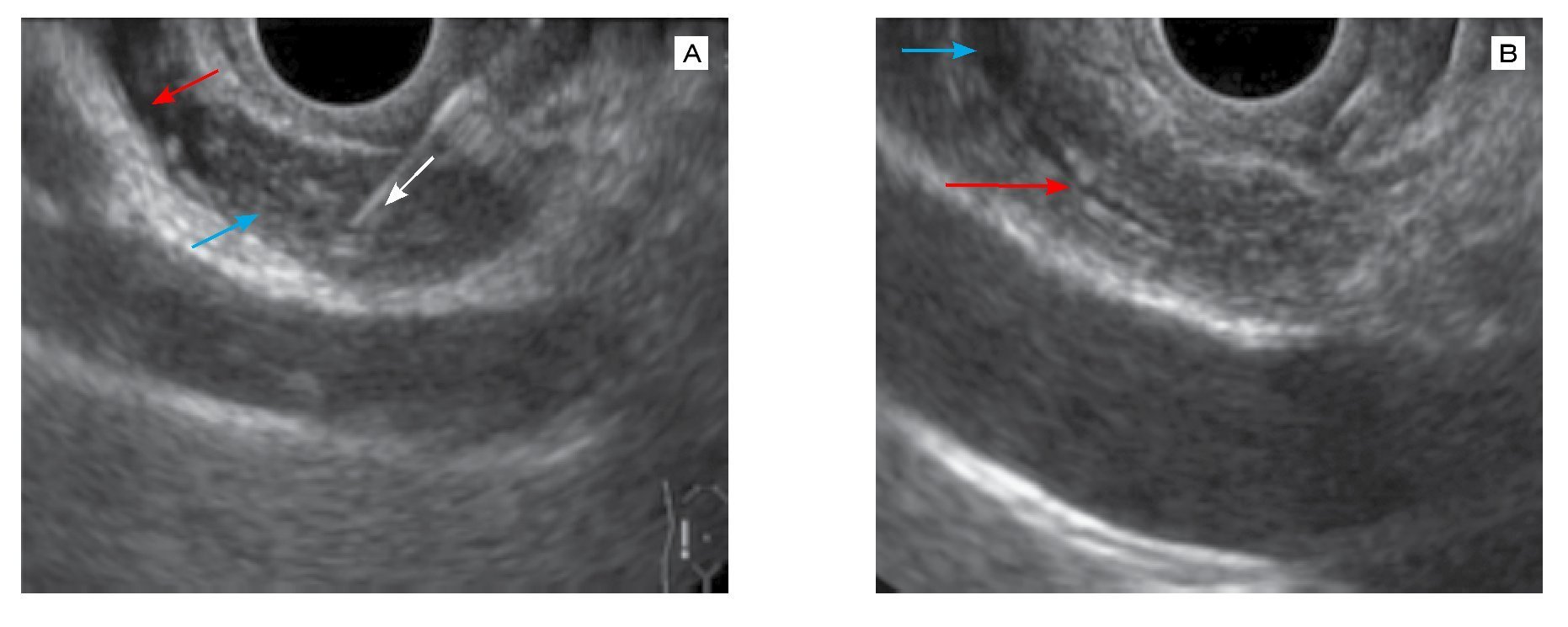
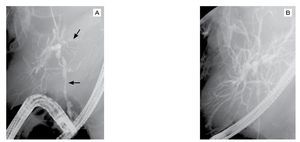
Figura 3. Colangiopancreatografía retrógrada endoscópica. A) El colangiograma muestra zonas dilatadas que alternan con zonas de estenosis en vía biliar intra y extrahepática, que provocan una imagen "arrosariada" de la vía biliar (flechas). B) Acercamiento de la imagen de la vía biliar intrahepática.
Discusión
En este artículo se describe el caso de un paciente con antecedente de CUCI que se presenta con colangitis, debido a una estenosis dominante del conducto biliar común secundaria a CEP, se muestran los hallazgos del USE y su utilidad en el diagnóstico de esta enfermedad.
Los mecanismos causales de este padecimiento aún no son claros, pero se piensa que resultan de la combinación de una predisposición genética y eventos autoinmunes que conducen a daño continuo del conducto biliar.2 En general, la incidencia de CEP oscila entre 0-1.3/100 000 habitantes/año y la prevalencia va de 0 a 16.2 por 100 000 habitantes.6,7 Afecta principalmente a los hombres con una razón 2:1, con edad media de diagnóstico a los 40 años.6 Aproximadamente el 70%-80% de los pacientes con CEP tiene o desarrollará enfermedad inflamatoria intestinal (EII).2 La gran mayoría presentará CUCI, y hasta el 10% de los pacientes tendrán enfermedad de Crohn (EC) típicamente con extensión a colon.2,8 De manera contraria, apenas el 5% de los pacientes con EII tiene o desarrollará CEP.2 El curso de la EII en contexto de CEP tiene características únicas, como mayor prevalencia de pancolitis e incremento del riesgo para el cáncer colorrectal. Además, la CEP incrementa el riesgo de otras malignidades como colangiocarcinoma, cáncer de vesícula biliar y carcinoma hepatocelular, por lo que se recomienda realizar de manera anual estudios de laboratorio incluyendo Ca 19-9, CRM, ultrasonido vesicular y colonoscopia, así como imágenes hepáticas cada seis meses para la vigilancia en pacientes con cirrosis.2
Hasta el 50% de los pacientes con CEP desarrollan estenosis dominantes durante el curso de su enfermedad, manifestándose como deterioro de las pruebas hepáticas, ictericia, empeoramiento del prurito, colangitis bacteriana, o signos de descompensación.9 El tratamiento endoscópico es necesario en el caso de las estenosis dominantes.2 La dilatación con balón se prefiere a la dilatación con colocación de stent, debido a una mayor tasa de complicaciones asociadas a los stents.10
La imagen típica de CEP en la colangiografía es de estenosis biliares multifocales cortas, intercalados con segmentos normales o dilatados, con involucro de conductos biliares intra y extrahepáticos.4 El 25% de los pacientes presentan alteraciones aisladas de la vía biliar intrahepática y sólo en el 5% de los pacientes se puede afectar exclusivamente la vía biliar extrahepática. La vesícula biliar, el cístico y el conducto pancreático también pueden estar dañados en los pacientes con CEP.11
En la actualidad, la CPRE es el estándar de diagnóstico, pero la CRM se prefiere por ser menos invasiva,2 por lo que es la primer herramienta de elección para el diagnóstico de CEP.11 La CRM es un método no invasivo, con una sensibilidad (85%-88%) y especificidad (92%-97%) similares a la CPRE y con buen acuerdo entre observadores.12 La CPRE se reserva para casos con una alta probabilidad de necesitar una intervención biliar, y en quienes la CRM no fue diagnóstica.11
El ultrasonido abdominal y la tomografía computarizada no suelen proporcionar información útil para el diagnóstico de CEP. Sin embargo, es importante tener en cuenta que se pueden hallar anormalidades no específicas de la vía biliar y vesícula, como aumento de volumen y engrosamiento la pared vesicular.13 Otro hallazgo radiológico inespecífico pero frecuente, es la linfadenopatía intraabdominal.14
El diagnóstico de CEP por medio de USE es poco frecuente y hasta el momento existen pocos reportes.5 Lutz y colaboradores5 realizaron un estudio piloto prospectivo de 2009 a 2011, con 138 pacientes con hepatopatía colestásica crónica y 32 con posible CEP, con el objetivo de determinar si el USE de la vía biliar es una herramienta útil en el diagnóstico de CEP. Para la evaluación se utilizaron ultrasonidos radial (7.5 MHz) EG-3630 UR® (Pentax Medical Co., Tokio, Japón) y Hitachi® EUB 6500 RS (Hitachi, Tokio, Japón); se evaluó el grosor de la pared del conducto biliar, la estructura irregular de la pared, los cambios significativos en el calibre y la presencia de linfadenopatías perihiliares. Se indicaron como criterios para CEP: a) el engrosamiento de la pared ≥ 1.5 mm; b) la estructura irregular de la pared del conducto biliar común, definido por un cambio significativo del espesor en una longitud corta (espesor ≥ 1 mm en una longitud máxima de 5 mm); c) el calibre irregular del conducto biliar común, mediante un cambio significativo del diámetro en una longitud corta (diámetro ≥ 2 mm en una longitud máxima de 5 mm) y; d) la presencia de ganglios linfáticos mayores a 10 mm de diámetro en la región perihiliar.15,16
Los autores reportaron que cuando dos de los cuatro parámetros mencionados mostraron positividad para CEP, la sensibilidad y especificidad fueron de 76.4% y 100%, con valores predictivos positivo y negativo de 100% y 79%, respectivamente, por lo que concluyen que el USE puede ser una herramienta valiosa en la sospecha de CEP, con una buena exactitud diagnóstica para la enfermedad extrahepática, y que se debe evaluar ampliamente como procedimiento de diagnóstico temprano.5 En la literatura se ha hecho mención al reporte,17 sobretodo se cuestiona acerca de la habilidad técnica para medir la pared del conducto biliar común y se ha descrito que los resultados encontrados por USE podrían ser similares a los encontrados en otras entidades como colangitis o pancreatitis autoinmune; sin embargo se destaca que el USE presenta buen perfil de seguridad en comparación a la CPRE, por lo que tendría que considerarse como una posible herramienta para el diagnóstico de CEP. Es claro que se requieren estudios prospectivos para evaluar los criterios del USE para el diagnóstico de CEP en la vía biliar extrahepática, y realizar comparaciones con los estándares actualmente aceptados.17
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
No se recibió patrocinio para llevar a cabo este artículo.
Correspondencia:
Félix I. Téllez-Ávila M.D., M. Sc., Ph. D.
Departamento de Endoscopia Gastrointestinal,
Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan,
C.P. 14000, México D.F., México. Teléfono: 5487 0900, ext. 2150.
Correo electrónico: felixtelleza@gmail.com