La ectasia vascular gástrica antral es una causa rara pero severa de hemorragia gastrointestinal alta, responsable de aproximadamente el 4% de las hemorragias gastrointestinales altas no varicosas. El diagnóstico se basa en los hallazgos endoscópicos, habitualmente representados por puntos rojos organizados en bandas que se encuentran en forma radial partiendo del píloro, conocido como estómago en sandia o estómago en panal. El patrón histológico se caracteriza por 4 alteraciones: la ectasia vascular de los capilares de la mucosa, trombosis focal, proliferación celular a nivel del músculo liso y fibrohialinosis. El principal diagnóstico diferencial se hace con la gastropatía hipertensiva portal, la cual es frecuente que se presente (un 30% de los pacientes con ectasia vascular gástrica antral tiene cirrosis hepática). Enfermedades autoinmunes, como el fenómeno de Raynaud y la esclerodactilia, están presentes en el 60% de los pacientes con ectasia vascular gástrica antral. Ocasionalmente se pueden presentar enfermedades autoinmunes y del tejido conectivo como el síndrome de Sjogren, lupus eritematoso sistémico, cirrosis biliar primaria y esclerosis sistémica. En el resto de los casos se puede presentar en pacientes con falla renal crónica, trasplante de médula ósea o enfermedades cardíacas. La patogénesis de la enfermedad no se conoce del todo; los factores humorales, autoinmunes y alteraciones hemodinámicas son las principales hipótesis. Se han descrito a su vez muchas opciones terapéuticas. La terapia farmacológica no ha dado buenos resultados y la cirugía se reserva para los casos severos y refractarios. La terapia endoscópica, en particular la coagulación con argón plasma, ha demostrado ser más efectiva y segura que la cirugía, y se considera la primera línea de tratamiento en esta entidad. Se presenta un caso clínico así como su abordaje diagnóstico y terapéutico.
Gastric antral vascular ectasia is a rare and severe cause of upper gastrointestinal bleeding, responsible for about 4% of non-variceal upper gastrointestinal haemorrhage. The diagnosis is mainly based on endoscopic findings, usually represented by red spots organized in stripes radially departing from pylorus, and also called watermelon stomach or honeycomb stomach. The histological pattern is characterised by four changes: vascular ectasia of mucosal capillaries, focal thrombosis, spindle cell proliferation, and fibro-hyalinosis. The main differential diagnosis is with portal hypertensive gastropathy, with which it can frequently co-exist (about 30% of patients with gastric antral vascular ectasia have liver cirrhosis). Autoimmune disorders, mainly represented by Reynaud's phenomenon and sclerodactyly, are present in about 60% of patients with gastric antral vascular ectasia. Autoimmune and connective tissue disorders such as Sjogren's syndrome, systemic lupus erythematosus, primary biliary cirrhosis, and systemic sclerosis have occasionally been reported. In a few cases, gastric antral vascular ectasia syndrome has been presented in patients with chronic renal failure, bone marrow transplantation, and cardiac diseases. The pathogenesis of gastric antral vascular ectasia is still not fully known, humoural, autoimmune factors and haemodynamic alterations, being the principal hypothesis. Many therapeutic options have been described. No satisfactory results have been observed with medical therapy, and surgery should only be considered for refractory severe cases. Endoscopic treatment, particularly with argon plasma coagulation, has shown to be as effective, and also safer, than surgery, and should be considered the first-line treatment for patients with gastric antral vascular ectasia related bleeding. A case report is presented, along with the diagnostic and therapeutic approach of this pathology.
La ectasia vascular gástrica antral (EVGA) es una causa rara y severa de hemorragia gastrointestinal alta, representando el 4% de los sangrados no varicosos. Este padecimiento fue descrito por primera vez por Ryder y sus colaboradores en 19531. En 1984 Jabbari le dio el nombre de estómago en sandia por su patrón endoscópico característico: manchas rojas organizadas en líneas y distribuidas en forma radial partiendo del píloro, o distribuidas en forma difusa conocido como estómago en panal2. Típicamente se localiza a nivel del antro gástrico, aunque puede encontrarse en otras áreas del tracto gastrointestinal como duodeno, yeyuno o recto3.
El patrón histológico se caracteriza por 4 alteraciones: la ectasia vascular de los capilares mucosos, trombosis focal, proliferación celular de músculo liso y miofibroblastos, y fibrohialinosis que consiste en el depósito de una sustancia homogénea rodeando los capilares ectópicos de la lámina propia. En 1989 se describió una puntuación basada en los 2 primeros hallazgos histopatológicos conocida como Gilliam Score, a la que posteriormente se le agregaron los otros datos con los cual se desarrolló el EVGA Score mediante el cual se puede hacer un diagnóstico diferencial con la gastropatía hipertensiva portal con una precisión mayor al 80% basándose en los hallazgos al microscopio de las biopsias de la mucosa gástrica4.
Aunque hasta un 30% de los pacientes con EVGA pueden presentar en forma concomitante cirrosis hepática, la gastropatía hipertensiva portal es uno de los principales diagnósticos diferenciales. Endoscópicamente se diferencian, ya que en la gastropatía hipertensiva portal incluye el fondo y cuerpo gástrico, con patrón de la mucosa en forma de mosaico con los característicos puntos rojos cereza. Además que, desde el punto de vista terapéutico, los pacientes con gastropatía hipertensiva portal responden al uso de B-bloqueadores o cortocircuitos portosistémicos5,6.
Los pacientes con EVGA habitualmente pueden tener otras enfermedades asociadas. Las más comunes son las autoinmunes, hasta en un 60%, que incluyen el fenómeno de Raynaud, esclerodactilia, síndrome de Sjogren, esclerosis, cirrosis biliar primaria y lupus eritematoso sistémico. Además se ha descrito su asociación con falla renal crónica, trasplante de médula ósea o enfermedades cardíacas3.
Con relación a su etiopatogenia, aún queda mucho por conocer, pero está bien establecido que es una enfermedad adquirida más que congénita. Se han propuesto varias hipótesis, entre las cuales la más reconocidas son el estrés mecánico, en donde se propone que la fuerte peristalsis gástrica produce un prolapso y trauma de la mucosa antral, ocasionando una obstrucción intermitente en el flujo sanguíneo a nivel del antro lo que ocasiona la ectasia vascular; por otro lado, se han estudiado varias sustancias humorales como la gastrina, el péptido inhibidor vasoactivo, glucagón y catecolaminas, las cuales se han visto incrementadas en esta entidad; y, por último, como ya se comentó previamente, su alta asociación con enfermedades autoinmunes apoya esta teoría, en donde se ha demostrado la existencia de autoanticuerpos específicos que ocasionan una reacción cruzada contra algunas proteínas específicas de los vasos de la mucosa y submucosa1,3,4.
Se han descrito 3 modalidades terapéuticas: farmacológica, quirúrgica y la endoscópica. La cirugía habitualmente está reservada para paciente con recidivas y en los que otras terapias no han tenido éxito. El procedimiento que se utiliza habitualmente es la antrectomía, con excelentes resultados en cuanto al control de la hemorragia pero con una alta morbimortalidad7. Desde el punto de vista farmacológico se ha descrito el uso de estrógenos y progesterona, con resultados aceptables, pero con el inconveniente de que al reducir las dosis habitualmente presentan recaídas y su uso prolongado se asocia a varios efectos adversos8. Se conoce que el uso de octreotide a dosis de 0.1mg en forma subcutánea cada 8h durante 6meses reduce el sangrado y ocasiona regresión parcial de las lesiones. Existen reportes aislados del uso de ácido tranexámico y ciclofosfamida, pero con serios efectos adversos. Por lo cual, la terapia farmacológica puede estar limitada a pacientes en los cuales no se tenga acceso a otras terapias, evaluando de forma integral los posibles efectos adversos7–9.
En la actualidad el método terapéutico que ha mostrado los mejores resultados es el endoscópico incluyendo el uso de ablación con láser, argón plasma o crioablación8. El láser (Nd:YAG) ha sido utilizado para el manejo de hemorragia secundaria a EVGA, con reducción de la necesidad de transfusión hasta en el 80% de los casos con 3 sesiones de tratamiento. Las complicaciones descritas van desde la perforación gástrica hasta la obstrucción pilórica (8%); habitualmente a las 2 semanas de la terapia van a presentar una úlcera que sanará en un lapso de 4 semanas, y desarrollo posterior de un pólipo hiperplásico. Una de las desventajas de la terapia con láser es su precio y necesidad de una curva de aprendizaje extensa7,10. Otra terapia que ha cobrado fuerza es el uso del argón plasma con la ventaja de un menor precio y menor curva de aprendizaje. El argón plasma es un método de electrocoagulación libre de contacto, que utiliza alta frecuencia de energía transmitida a través del gas argón ionizado; de esta forma, al no estar en contacto el aparato que transmite la energía no existe riesgo de que quede adherido el coágulo al mismo, evitando de esta forma el riesgo de resangrado. Las complicaciones descritas habitualmente son la distensión por el flujo del gas, y en raras ocasiones, el enfisema intestinal, la obstrucción y la perforación. Su eficacia se reporta en el rango de 90-100%, sin necesidad de transfusiones después de la terapia. La unidad electroquirúrgica se utiliza con un flujo de gas entre 1-2.5L/min con 40-100W de energía; requiriendo habitualmente 2 a 3 sesiones para su erradicación completa9,11,12. También se han descrito otras terapias como la crioterapia, la cual es cara y de difícil acceso; y el uso de ligaduras, que ha demostrado su eficacia y seguridad en varios estudios13.
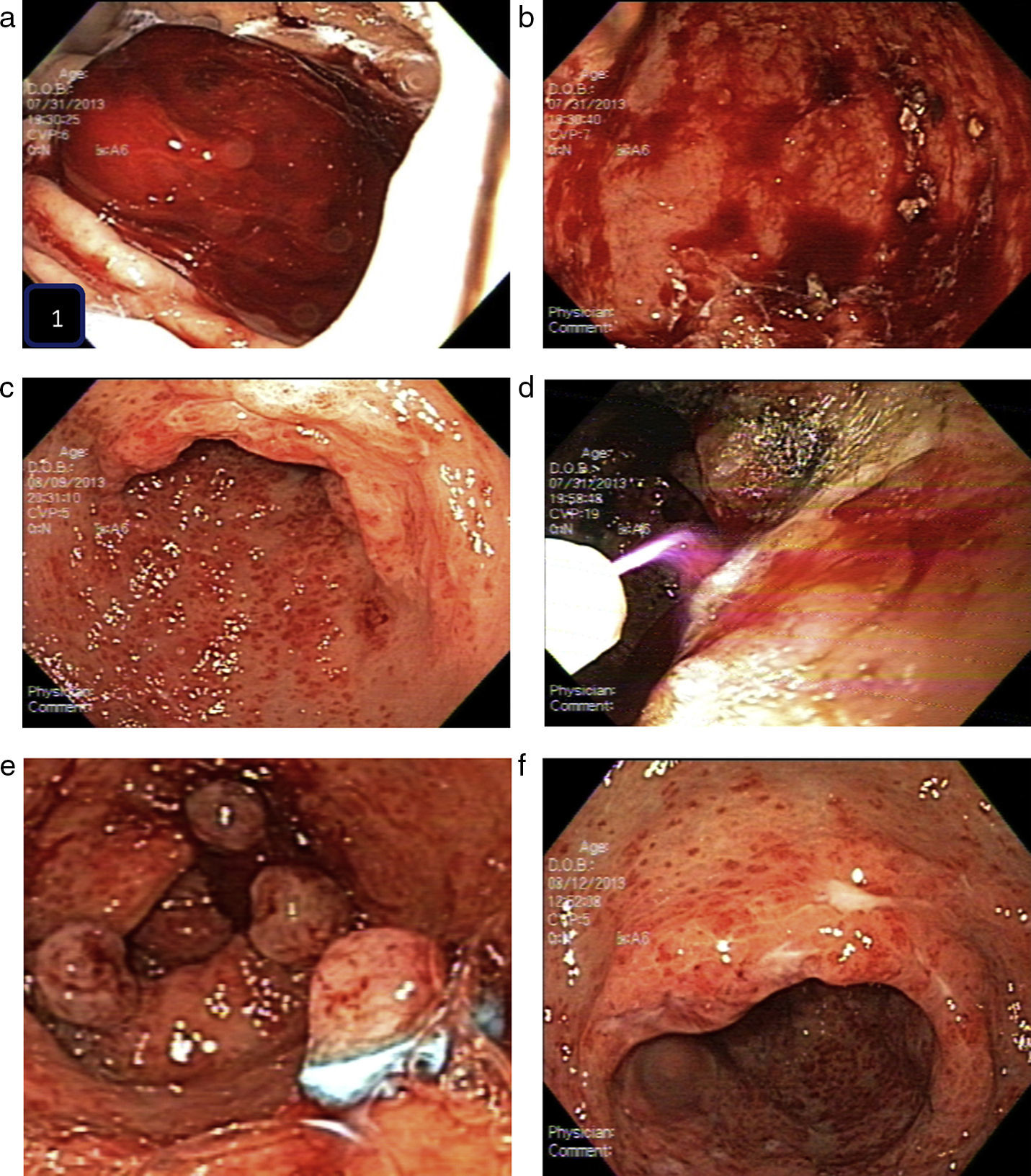
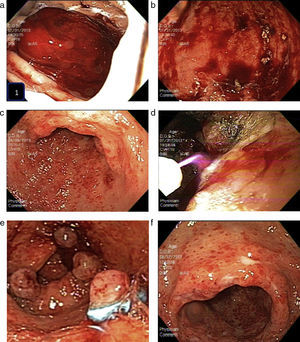
Presentación del casoSe trata de paciente femenino de 62 años de edad con antecedentes de etilismo crónico (aproximadamente 48g diarios), se encuentra en seguimiento por servicio de psiquiatría por depresión. Niega enfermedades crónicas degenerativas. Ha estado en estudio por anemia crónica. Se presenta a urgencias en esta ocasión por pérdida del estado de alerta. A la exploración se encuentra una paciente orientada y reactiva, con palidez importante de piel y tegumentos, examen cardiológico con taquicardia, pulmonar sin alteraciones, abdomen globoso a expensas de panículo adiposo, blando y depresible no doloroso. Extremidades integras sin alteraciones. Los exámenes de laboratorio muestran anemia hipocrómica con hemoglobina de 5.7g/dl y hematocrito de 19.3%; el resto de los exámenes de laboratorio se encuentran dentro de parámetros normales. Se solicita valoración por parte del servicio de endoscopia y se realiza panendoscopia bajo sedación moderada con los siguientes hallazgos: esófago con lesiones compatibles con acantosis glucogénica, estómago de forma, tamaño y distensibilidad adecuada, con rastros de sangre fresca y coágulos organizados (Imagen 1a y 1ba y b), por lo cual se decide realizar lavado y aspirado, posterior a los cual se observa que la mucosa de cuerpo presenta edema, hiperemia, con algunas erosiones en cuerpo. En antro y región prepilórica se observa mucosa con presencia de múltiples puntos rojos submucosos, distribuidos de forma difusa y radialmente que abarcan el 50% el antro, de forma circunferencial y que confluyen en el píloro con sangrado en capa de estas lesiones (Imagen 1cc). Píloro y duodeno sin alteraciones. En ese mismo momento se decide hacer ablación de las lesiones con argón plasma a 2L/min con 50W de energía; antes de dar por terminado el procedimiento se realiza lavado y aspirado de estómago ya sin observar sangrado activo (Imagen 1-Dd). Su evolución en hospitalización fue favorable, iniciando la vía oral a las 24h del procedimiento endoscópico. Posterior a transfusión de hemoderivados y con corrección de anemia se decidió su egreso. Se realizaron 3 sesiones más, 2 de las cuales se hicieron con argón plasma y la última con ligaduras súper 7 (Cook), cada sesión con 3 semanas de separación (Imagen 1-Ee). Durante la terapia de erradicación la paciente no presentó nuevos eventos de hemorragia gastrointestinal o anemia. Además en cada sesión se observó una franca mejoría de las lesiones. Después de la última sesión se realizó una endoscopia un mes después sin observar hemorragia, las lesiones estaban erradicadas en un 80% y sin complicaciones como estenosis (Imagen 1-Ff), por lo cual se decidió continuar seguimiento por consulta externa de gastroenterología.
1a y 1b. Primer estudio endoscópico donde se observa el estómago con rastros de sangre fresca y coágulos organizados. 1c. Antro y región prepilórica con mucosa con presencia de múltiples puntos rojos submucosos, distribuidos de forma difusa y radialmente que abarcan el 50% el antro, de forma circunferencial y que confluyen en el píloro. 1d. Momento en el que se realiza ablación de las lesiones con argón plasma a 2L/min con 50W de energía. 1e. Imagen posterior a aplicación de ligaduras. 1f. Endoscopia un mes después de la última sesión, sin observar hemorragia, con erradicación de un 80% y sin complicaciones.
A pesar de que la EVGA es una condición rara, se reporta hasta en el 4% de las hemorragias digestivas altas no varicosas, y hasta en uno de cada 40 pacientes con enfermedad hepática terminal. La etiología no es bien entendida, pero se ha asociado a varias condiciones que tienen relación directa con el incremento de la presión portal; aunque estas teorías son contradictorias ya que la terapia médica para disminuir la hipertensión portal no mejoran la enfermedad.
El diagnóstico habitualmente es endoscópico, pero en los casos en los que exista duda se puede hacer el diagnóstico definitivo con biopsias para diferenciar la gastropatía hipertensiva portal de la EVGA. Existen varias opciones de tratamiento: las más estudiadas, con mejores resultados y menos comorbilidades son las terapias endoscópicas con argón plasma o láser Nd:YAG, además de la aplicación de ligaduras. También se ha descrito la antrectomía, la cual tiene buenos resultados pero con alta comorbilidad; la terapia farmacológica con progesterona o talidomida no tienen buenos resultados. Como se aborda en este caso, la combinación de 2 terapias endoscópicas dio excelentes resultados. La aplicación de argón plasma en la etapa aguda ayudó a un control adecuado de la hemorragia, y la colocación de ligaduras ayudo en forma óptima a la erradicación de la enfermedad.
El argón puede no estar disponible en todas las salas de endoscopia, pero las ligaduras son una opción más accesible, por lo cual se deben tener presentes como opción terapéutica en todos los pacientes que las requieran.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.