El ultrasonido endoscópico ha pasado de ser una herramienta diagnóstica a una pieza fundamental en la terapéutica endoscópica. El drenaje de colecciones pospancreatitis (seudoquistes y necrosis encapsulada) y posquirúrgicas ha virado del manejo quirúrgico y percutáneo al abordaje endoscópico que ha demostrando ser equivalente en la tasa de éxito pero con menor morbimortalidad. Las técnicas empleadas han mejorado con el tiempo, logrando una tasa de éxito aún mayor y una recurrencia menor a las descritas previamente en la literatura lo que demuestra el papel de la endoscopia en estos padecimientos. En el abordaje endoscópico de pacientes posquirúrgicos el ultrasonido endoscópico se posiciona como una alternativa para el manejo de estos pacientes. Técnicas como el «rendezvous» o la realización de fístulas al conducto pancreático son procedimientos que han demostrado ser útiles y exitosos con menor morbilidad que los procedimientos quirúrgicos.
El papel del ultrasonido endoscópico en la enfermedad pancreática seguirá aumentando conforme se perfeccionen las técnicas actuales y el éxito obtenido sea mayor.
Endoscopic ultrasound, which began as a purely diagnostic procedure, has become a key element in therapeutic endoscopy. Drainage of post-pancreatitis collections (pseudocyst and walled off necrosis), as well as postoperative collections has changed from surgical and percutaneous management to an endoscopic one, with equal or even more success, but with less morbidity and mortality. Endoscopic drainage techniques have improved over time and with even more success and a lower recurrence than previously reported, which demonstrates how important endoscopy is in treating these diseases nowadays. The endoscopic approach of endoscopic ultrasound postoperative collections has become a reference procedure for the management. Techniques, such as «Rendezvous» or pancreaticogastrostomy performed using endoscopy are useful, successful and with less morbidity than surgical ones.
Role of endoscopic ultrasound in pancreatic diseases will improve while current techniques continue changing to become even more successful than now.
Las colecciones pancreáticas se forman como consecuencia de cuadros de pancreatitis aguda, pancreatitis crónica, traumatismos y/o cirugías; de la primera entidad la Clasificación de Atlanta maneja 2 tipos de colecciones posteriores a la pancreatitis aguda de acuerdo a las lesiones previas: el pseudoquiste pancreático (PQP) por una pancreatitis intersticial y necrosis encapsulada posterior a una pancreatitis necrótica1,2.
Debido a que la gran mayoría de las colecciones son asintomáticas y a que el 50% se reabsorben de manera espontánea, se aconseja que inicialmente se tenga un manejo expectante y el consenso actual es que solo en aquellos pacientes que presenten sintomatología se realice algún tratamiento. Los principales síntomas que pueden ocasionar estas colecciones son dolor abdominal, sepsis, obstrucción gástrica, obstrucción biliar e intolerancia a la vía oral3.
El drenaje de colecciones, no importando la etiología, ha evolucionado a lo largo de los años conforme nuevas técnicas se desarrollan. Actualmente el drenaje endoscópico es una de las técnicas más eficaces y seguras. El uso del ultrasonido endoscópico (USE) ha demostrado ser tan exitoso como el abordaje endoscópico convencional y con semejante tasa de complicaciones en casos seleccionados; sin embargo el uso de USE tiene como consecuencia que un número mayor de colecciones sean susceptibles de ser drenadas1,4,6.
A pesar de no haber demostrado ser superior a las diferentes técnicas existentes, el USE presenta algunas ventajas que lo hacen un tratamiento de elección para estos pacientes: la primera es la colocación de un drenaje interno en lugar de uno externo como el drenaje percutáneo, evitando molestias al paciente y el riesgo de infección por malos cuidados del catéter. Otra ventaja es que se puede colocar una sonda de irrigación interna, igualmente disminuyendo la recurrencia por disfunción de catéteres la cual se ha reportado hasta en el 70% de los casos. Finalmente una ventaja frente al drenaje convencional es la visualización de vasos en la zona de punción, evitando lesionarlos y provocar sangrado durante el procedimiento5,6. Los pacientes con hipertensión portal son un grupo con especial beneficio en este sentido. Un metaanálisis realizado por Panamonta et al. en el 2012 no demostró diferencias entre drenaje guiado por USE y el endoscópico convencional, concluyendo que el USE se recomienda en pacientes con coagulopatía, hipertensión portal y con seudoquistes no protruyentes6.
Drenaje de colecciones pospancreatitisSeudoquistesLas indicaciones para drenaje de colecciones pospancreatitis han cambiado a lo largo de los años. Al inicio se utilizaba la regla de los 6, en la que las colecciones que median más de 6cm y persistían más de 6 semanas eran candidatas a drenaje endoscópico; actualmente han surgido modificaciones al respecto, en general se consideran candidatas aquellas colecciones que ocasionan síntomas con una pared bien definida, habitualmente después de 4 semanas del evento de pancreatitis y que tengan menos de 1cm de distancia con la pared gástrica o duodenal; con estas indicaciones el éxito tanto clínico como técnico es superior al 90% en PQP, llegando hasta el 100% en algunas series de casos7. Algunos autores aún argumentan que los PQP mayores de 6cm corren el riesgo de infectarse, sangrar o perforarse a la cavidad peritoneal y deben ser drenados aun siendo asintomáticos para evitar estas complicaciones7,17.
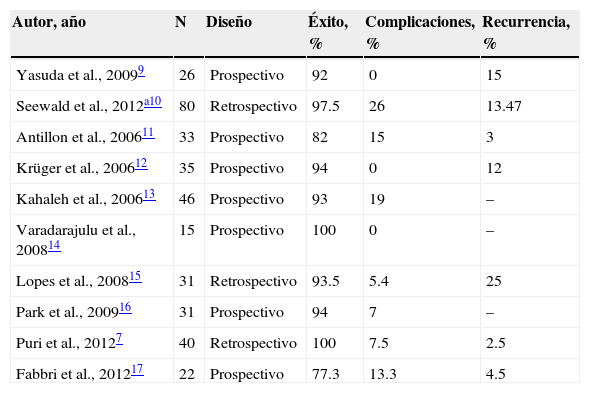
En la tabla 1 se muestran los estudios y resultados obtenidos en relación con el drenaje de PQP vía endoscópica.
Estudios reportados hasta el momento en relación con el drenaje endoscópico guiado por ultrasonido endoscópico de seudoquistes pancreáticos
| Autor, año | N | Diseño | Éxito, % | Complicaciones, % | Recurrencia, % |
|---|---|---|---|---|---|
| Yasuda et al., 20099 | 26 | Prospectivo | 92 | 0 | 15 |
| Seewald et al., 2012a10 | 80 | Retrospectivo | 97.5 | 26 | 13.47 |
| Antillon et al., 200611 | 33 | Prospectivo | 82 | 15 | 3 |
| Krüger et al., 200612 | 35 | Prospectivo | 94 | 0 | 12 |
| Kahaleh et al., 200613 | 46 | Prospectivo | 93 | 19 | – |
| Varadarajulu et al., 200814 | 15 | Prospectivo | 100 | 0 | – |
| Lopes et al., 200815 | 31 | Retrospectivo | 93.5 | 5.4 | 25 |
| Park et al., 200916 | 31 | Prospectivo | 94 | 7 | – |
| Puri et al., 20127 | 40 | Retrospectivo | 100 | 7.5 | 2.5 |
| Fabbri et al., 201217 | 22 | Prospectivo | 77.3 | 13.3 | 4.5 |
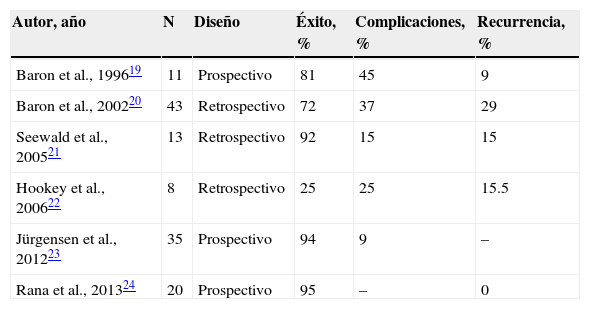
Los casos de necrosis pancreática encapsulada tienen un manejo semejante, sin embargo las características propias de este tipo de colecciones hacen que la tasa de éxito sea menor que la obtenida en el caso de los PQP, en algunas series tan baja como del 25%. Para mejorar la efectividad del drenaje endoscópico se han utilizado estrategias como la colocación de múltiples prótesis, el uso de prótesis de mayor calibre y la colocación de sonda nasoquística para irrigación e incluso, ya de manera más invasiva, la necrosectomía endoscópica18. La implementación de estas técnicas ha aumentado el éxito del drenaje endoscópico hasta un 70-90% como lo demuestran los estudios publicados19–24.
En la tabla 2 se muestran los estudios reportados hasta el momento.
Estudios reportados hasta el momento en relación con el drenaje de necrosis pancreática por endoscopia
| Autor, año | N | Diseño | Éxito, % | Complicaciones, % | Recurrencia, % |
|---|---|---|---|---|---|
| Baron et al., 199619 | 11 | Prospectivo | 81 | 45 | 9 |
| Baron et al., 200220 | 43 | Retrospectivo | 72 | 37 | 29 |
| Seewald et al., 200521 | 13 | Retrospectivo | 92 | 15 | 15 |
| Hookey et al., 200622 | 8 | Retrospectivo | 25 | 25 | 15.5 |
| Jürgensen et al., 201223 | 35 | Prospectivo | 94 | 9 | – |
| Rana et al., 201324 | 20 | Prospectivo | 95 | – | 0 |
La formación de colecciones peripancreáticas secundarias a una fístula es la complicación más frecuente de la cirugía pancreática, los reportes van desde el 5% hasta el 60% en cirugías como pancreatoduodenectomía, pancreatoyeyunoanastomosis o pancreatectomía distal, siendo más frecuentes en esta última. El 80% se resuelven con manejo conservador25. El manejo del 20% restante ha sido tradicionalmente quirúrgico o percutáneo, sin embargo la utilidad probada del USE en otro tipo de colecciones abdominales ha provocado que esta técnica sea valorada en este tipo de pacientes26. Existen pocos estudios, todos retrospectivos, comparando el drenaje percutáneo con el drenaje endoscópico; todos concluyen que ambos tienen tasas de éxito clínico y técnico semejantes con la ventaja del USE de no contar con un drenaje externo, un menor número de estudios de imagen y, en un estudio, una menor tasa de recurrencia que, sin embargo, no tuvo significación estadística4,27. El tiempo entre la cirugía y el drenaje endoscópico en colecciones postoperatorias no está bien estipulado; se recomienda que sea de 4 semanas, sin embargo Tilara et al. concluyeron que el drenaje antes de 30 días es seguro, con tasas de complicación del 6%, menores que las reportadas en otras series26.
Debido a la poca información existente, no se cuenta con indicaciones claras sobre el drenaje endoscópico guiado por USE de colecciones postoperatorias, pero la evidencia apunta a que el USE es una alternativa viable y eficaz que podría ser tomado como primera línea de tratamiento28,29. En la tabla 3 se muestran los estudios existentes en este tema.
Técnica drenaje endoscópicoSe requiere el uso de un ecoendoscopio lineal con un canal de trabajo terapéutico30. Una vez el paciente está anestesiado y con intubación orotraqueal se introduce el ecoendoscopio hasta el estómago o el duodeno y se procede a la localización de la colección; se identifica la zona más cercana al tubo digestivo y se visualiza la pared y los vasos circundantes, intentando obtener una posición adecuada para la punción donde no haya torsión excesiva del equipo y nos permita una buena ventana terapéutica (fig. 1a). Usualmente los PQP son fáciles de identificar por su franco contenido líquido, no así las colecciones necrosadas cuyo contenido heterogéneo puede hacer más compleja la identificación y delimitación de la colección y más difícil su drenaje8. Después de conseguir una visión adecuada del sitio a puncionar se introduce una aguja calibre 19G al canal del equipo y se realiza la punción, se aspira brevemente y se observan las características del líquido y se obtiene muestra para cultivo o análisis de laboratorio. Posterior a la punción y toma de muestras se avanza una guía de 0.035” al interior de la colección y posteriormente se amplía la fístula creada para lo cual se puede utilizar un cistostomo 10F (fig. 1b) utilizado principalmente en Europa, que cuenta con un aditamento para cauterizar la zona de punción; aunque ha hecho más sencillo el procedimiento, no parece tener ventajas significativas o aumento de complicaciones31. Como opción al cistostomo se pueden utilizar dilatadores de Soehendra de 6F. Posterior al uso de cistostomo o Soehendra, se utilizan balones de dilatación (CRE, Max Force, Hércules) para dilatar la fistula hasta 10-12mm en PQP y hasta 20mm en los casos de necrosis (fig. 1c); después se colocan las prótesis plásticas o metálicas, que perpetuarán la fístula recién creada (fig. 1d)9,32. En colecciones con detritus que comprendan más del 30% del contenido de la colección o en casos de necrosis, se aconseja utilizar un drenaje nasoquístico, con éxito reportado del 79-85% (fig. 2)33. La necrosectomía endoscópica directa (fig. 3) es recomendada por la mayoría de los autores. Esta consiste en introducir un endoscopio dentro de la colección y con ayuda de diferentes accesorios como canastillas de Dormia, pinzas de diente de ratón o cepillos se retiran los restos necróticos (fig. 3) y posteriormente se irriga con solución fisiológica, algunos autores usan peróxido de hidrógeno o incluso antibióticos, en ambos casos aún se requieren más estudios para evaluar su eficacia. Este procedimiento se repite hasta obtener un completo drenaje de la colección8,30,34,35. En los últimos años han sido publicados varios estudios sobre el uso de prótesis metálica y/o plásticas, sus ventajas y desventajas; dentro de las ventajas teóricas que ofrecen las prótesis metálicas se encuentran el tiempo más corto de procedimiento al colocar solo una prótesis, mayor facilidad, el calibre mayor por el que incluso puede pasar un endoscopio y la menor tasa de obstrucción36. Se han desarrollado prótesis tipo «yo-yo» que evitan la migración de las mismas sin necesidad de prótesis plásticas8,37.
2a: aspecto tomográfico del pseudoquiste infectado; 2b: punción del pseudoquiste con aguja 19G guiada por ultrasonido endoscópico; 2c: ampliación de la fístula gastrocística con cistostomo 10F; 2d: ampliación de la fístula con balón CRE; 2e: colocación de 2 prótesis doble cola de cochino con presencia de una tercera guía para colocación de drenaje nasoquístico; 2f: visión endoscópica de la colocación del drenaje nasoquístico; 2g: imagen fluoroscópica de las prótesis y el drenaje nasoquístico.
3a: punción del seudoquiste con aguja 19G guiada por ultrasonido endoscópico; 3b: ampliación de la fístula gastrocística con cistostomo 10F; 3c: dilatación de la fístula con balón CRE; 3d: aspecto endoscópico de la fístula creada hacia la necrosis con presencia de 2 guías, se pueden observar algunas fibras musculares con desgarro; 3e: aspecto del interior de la necrosis encapsulada con presencia de estructuras vasculares; 3f: extracción de tejido necrótico a la cámara gástrica con pinza trípode.
A pesar de las ventajas teóricas que se esperan con las prótesis metálicas, estudios recientes han concluido que no existe diferencia en el éxito en comparación con la colocación de múltiples prótesis plásticas; la única ventaja demostrada fue un menor tiempo del procedimiento. Aún así existen casos reportados de éxito de prótesis metálica posterior al fracaso de las plásticas36,38–40. Un metaanálisis que incluyó 17 estudios no encontró significación estadística entre las diferentes prótesis (metálicas vs. plásticas) ni con el uso de una o múltiples prótesis plásticas con tasas de éxito clínico, recurrencias y complicaciones similares tanto en drenaje de PQP como de necrosis pancreática41. Un dato que aún queda sin respuesta, tanto en las prótesis metálicas como en las plásticas, es el tiempo de permanencia, que algunos autores recomiendan mínimo un mes de tratamiento y posterior valoración, o incluso mantener la prótesis de manera permanente42.
Con relación a las complicaciones, Seewald et al. reportaron que en necrosectomías endoscópicas el sangrado ocurrió en el 15% de las realizadas, seguida por la perforación en el 8.7% y el embolismo portal en el 1.25%, requiriendo 4 pacientes cirugía. Aún así, la tasa de éxito global con una media de seguimiento de 31 meses fue del 72.5%10.
Puntos de debate en el drenaje de colecciones peripancreáticasDentro del tratamiento guiado por USE de las colecciones peripancreáticas existen aún múltiples puntos no resueltos. Los más importantes que debemos considerar son:
- 1.
Evaluación del conducto pancreático y drenaje transpapilar
- 2.
Tipo de prótesis (metálicas vs. plásticas)
- 3.
Uso de drenaje nasoquístico y tipo de irrigación
En un trabajo retrospectivo por realizado por Gordon et al. en 79 pacientes con PQP y necrosis encapsulada no se encontró diferencias entre los grupos con relación al éxito, tiempo para la resolución o complicaciones, sin embargo los pacientes con prótesis al pancreático tuvieron un mayor número de estudios realizados43. En un estudio retrospectivo multicéntrico de 13 centros en 6 años, se incluyeron 310 pacientes divididos en 2 grupos: transmural únicamente (n=177; 57%) vs. drenaje mixto (transmural+transpapilar; n=133; 43%). De acuerdo a sus resultados no se encontró diferencia entre los grupos con relación a la resolución clínica o radiológica o recurrencia a las 2 semanas después del retiro de las prótesis44. Resultados similares se reportaron de un metaanálisis de 7 estudios publicados entre 1995-2013 con un total de 551 pacientes, todos retrospectivos, en donde no encontraron diferencias entre los grupos en relación con el éxito clínico, complicaciones y recurrencia45.
Hasta el momento no existen estudios dirigidos a estimar el mejor momento para evaluar el conducto pancreático por medio de pancreatografía endoscópica. Aunque los estudios mencionados anteriormente evalúan el papel del drenaje del conducto pancreático con relación a la tasa de resolución y tiempo a la misma nosotros creemos que la verdadera pregunta en la evaluación del conducto pancreático debe estar dirigida a la probabilidad de recurrencia de la colección. En caso de pacientes con PQP o necrosis pancreática en los cuales se tenga una fístula del conducto pancreático o síndrome del conducto desconectado es de vital importancia lograr el diagnóstico y/o tratamiento de esta situación ya que de no hacerlo y retirar en algún momento las prótesis transmurales, dicho retiro dará pie a la recurrencia de la colección. En los pacientes con necrosis pancreática encapsulada el síndrome del conducto desconectado puede ocurrir hasta en el 50% de los casos. Por lo anterior el conocer el estado del conducto pancreático puede dar pie a dejar de manera indefinida las prótesis transmurales.
¿Las prótesis metálicas ofrecen una mayor tasa de resolución comparadas con las prótesis plásticas?, ¿es verdad que su mayor diámetro contribuye al éxito del tratamiento?Recientemente han sido expuestos estudios en relación con prótesis metálicas que tienen la capacidad de afrontar las paredes de las estructuras en los cuales están sus extremos (axios). En un estudio multicéntrico europeo de Larghi et al.46 se demostró que el sistema de estas prótesis es seguro, fácil de realizar y altamente efectivo técnica y clínicamente47. Un punto importante en la discusión del uso de prótesis metálicas vs. plásticas está en los costos. Un interesante estudio demostró que en caso de necrosis pancreática, el uso de prótesis metálicas disminuye los costos totales al permitir que el procedimiento se realice en un solo paso y se repita sin necesidad de utilizar nuevamente numerosos accesorios como guías, balones de dilatación y nuevas prótesis plásticas48. Hasta el momento, un solo estudio ha evaluado el efecto de las prótesis metálicas sobre la tasa de recurrencia de las colecciones líquidas. En dicho estudio se demostró que la tasa de recurrencia es baja con el uso de estas prótesis (10%)49.
¿El uso de drenaje nasoquístico debe ser en todos los pacientes?, ¿cuál debe ser la solución y cantidad de la misma para la irrigación de la colección drenada? ¿La irrigación debe ser de manera continua o en bolos?En el drenaje de las colecciones líquidas peripancreáticas es necesario en algunas ocasiones dejar un drenaje nasoquístico. Hasta hace muy poco tiempo este era un tópico no estudiado. Recientemente, Siddiqui et al.47 realizaron un estudio retrospectivo donde se demostró que los pacientes con colecciones que contengan detritus y a los que se les realiza el drenaje con la presencia de un drenaje nasoquístico tienen hasta 3 veces más posibilidades de éxito clínico comparados con los pacientes en los cuales solo se colocan las prótesis transmurales. Contrario al estudio mencionado, Lopes, et al. reportaron que la colocación de un drenaje nasoquístico no demostró mayor éxito que la solo colocación de múltiples prótesis15. Jurgensen et al., en un estudio prospectivo con 35 pacientes con seguimiento durante una media de 23 meses, concluyeron que sin irrigación la tasa de éxito era comparable con la literatura existente23.
Existen pocos datos en relación con el tipo de irrigación. Los resultados han sido muy buenos con catéteres de 7-10F y con irrigación de 200ml/3-4h o 1,000/24h y aspiración diaria para ver las características de la colección31. Aunque comúnmente se ha utilizado solución salina para la irrigación por el catéter nasoquístico varios autores han usado peróxido de hidrógeno o antibióticos. El tiempo recomendado de permanencia del mismo es aproximadamente 2 semanas o cuando los signos de sepsis mejoren. Rana et al. aconsejan la aspiración diaria de contenido por el drenaje nasoquístico y cuando este sale claro realizar tomografía; si la colección ha mejorado, se procede a retirar el catéter24,33.
ConclusionesLa primera línea para el drenaje de colecciones peripancreáticas debe ser actualmente endoscópico y guiado por USE. Si bien el drenaje endoscópico sin guía de USE ha demostrado ser efectivo y las complicaciones bajas, se debe mencionar que cuando estas se presentan son graves incluyendo la muerte. El empleo del USE aumenta de manera significativa el número de pacientes candidatos al drenaje endoscópico y disminuye sustancialmente las complicaciones mayores.
Conflicto de interesesTodos los autores declaran no tener ningún conflicto de intereses para la publicación de este trabajo.
FinanciamientoNinguno.