La enfermedad de Ménétrier es una entidad clínica poco frecuente que se caracteriza por un engrosamiento de los pliegues gástricos, secundario a una hiperplasia de las células mucosas foveolares, frecuentemente asociada con pérdida de proteínas entéricas e hipoalbuminemia. Su etiología es desconocida. Es una condición preneoplásica. Se presenta un paciente de 27 años que ingresa por presentar epigastralgia, pérdida de peso y vómitos. La enfermedad se diagnosticó por endoscopia y biopsia. Se realiza una revisión al manejo, ya que no está claramente definido.
Ménétrier's disease is an infrequent clinical condition consisting of thickening of the gastric folds secondary to hyperplasia of the foveolar mucosa cells, and is frequently associated with loss of enteric proteins and hypoalbuminaemia. Its aetiology is unknown. At present it is considered to be pre-malignant. The case is presented of a 27-year-old patient who was admitted for abdominal pain, loss of weight, and vomiting. This disease is diagnosed using endoscopy and biopsy of stomach tissue. An update is presented on the therapeutic approach, which has not yet been clearly defined.
La enfermedad de Ménétrier (EM) es una enfermedad rara que se caracteriza por hiperplasia foveolar gástrica asociada a pérdida secundaria de proteínas. Se desconoce cuáles son la etiología y patogenia de este trastorno.
El objetivo de esta revisión es dar a conocer un caso de EM y las imágenes obtenidas en estudios de endoscopia, así como una revisión de la literatura.
Presentación de casoPaciente masculino de 27 años de edad, que presentaba epigastralgia intensa, acompañada de vómitos inicialmente alimentarios y posteriormente de contenido biliar y pérdida de peso. Por este motivo acudió a varios centros médicos y fue tratado con antiparasitarios e inhibidores de bomba de protones, con mejoría transitoria del cuadro clínico. Posteriormente empeoraron los síntomas, con deterioro de su estado general y nutricional y fue hospitalizado.
Durante su ingreso se le realizaron exámenes de laboratorio que revelaron: anemia moderada(hemoglobina en 8.6g/dl), recuento de leucocitos de 13.6×109/L e hipoproteinemia (proteínas totales en 50g/L) con hipoalbuminemia (24g/L). La serología para VIH fue negativa.
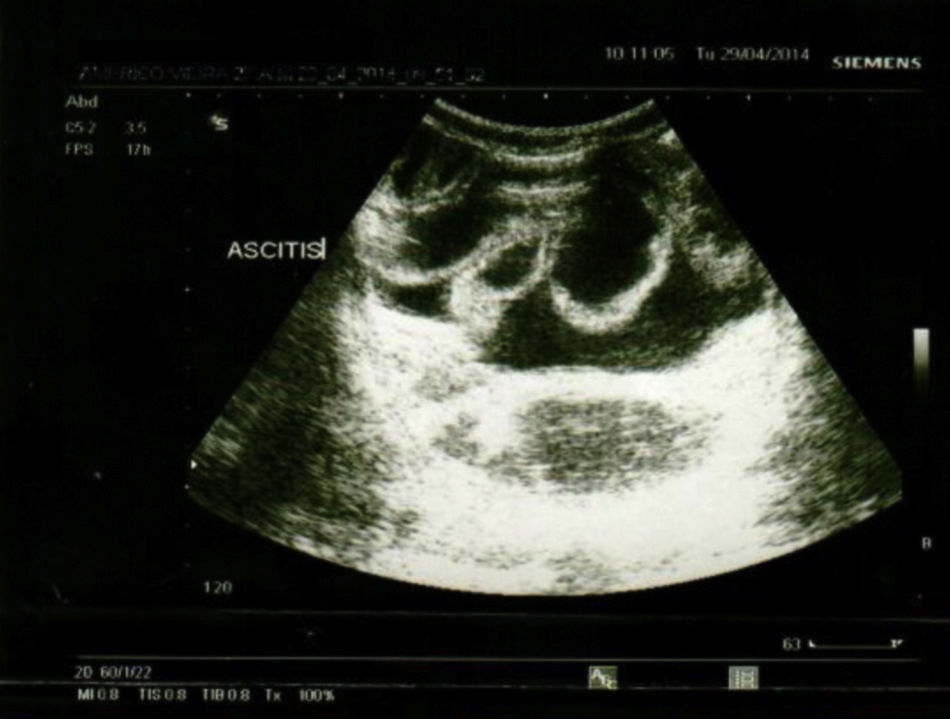
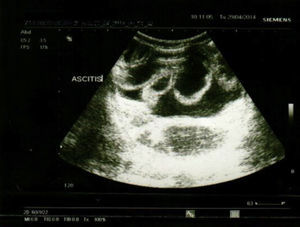
La ecografía abdominal (fig. 1) evidenció ascitis mínima y estómago con engrosamiento de los pliegues gástricos. La tomografía axial computarizada abdominal mostró pliegues gástricos prominentes.
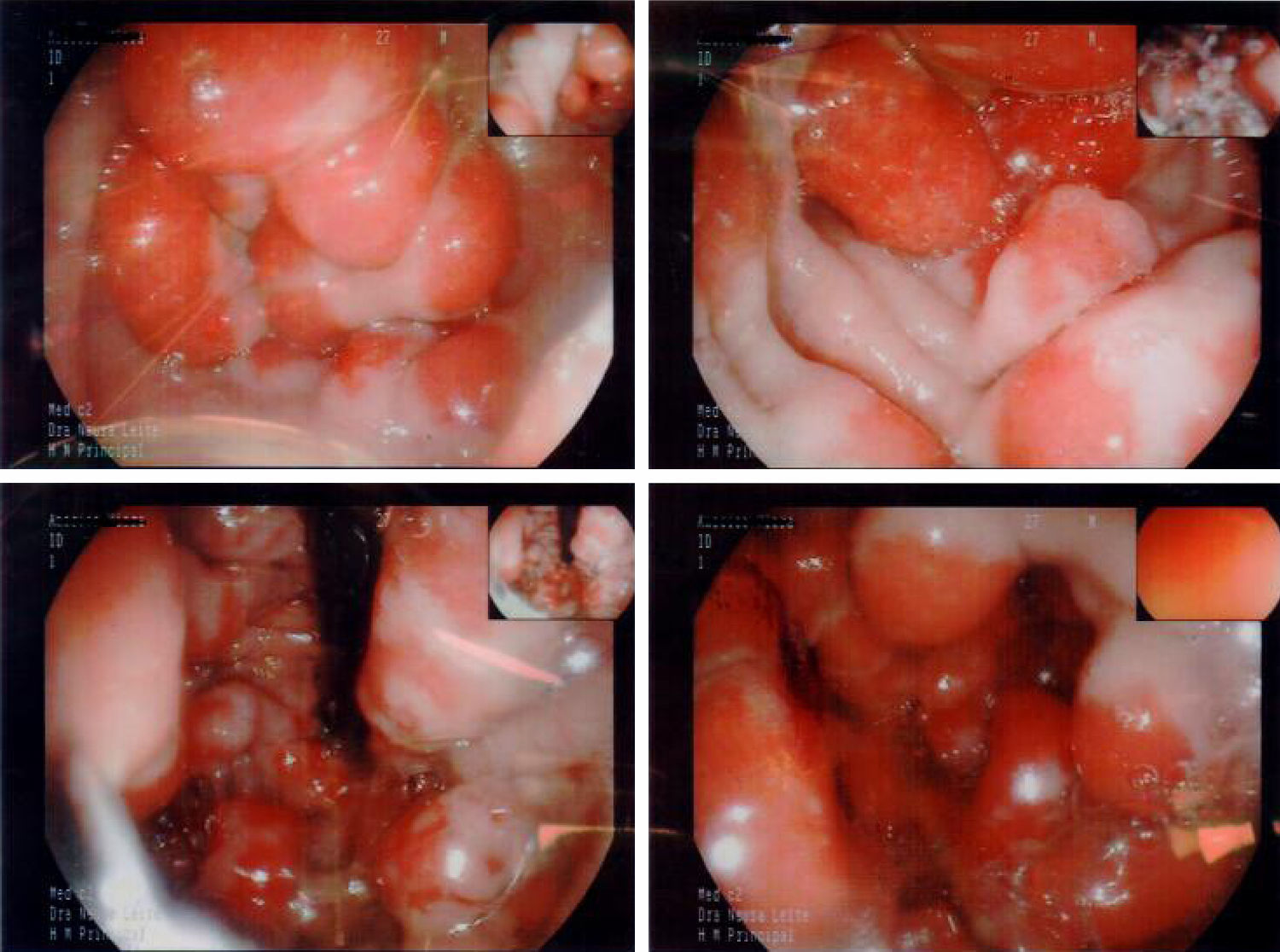
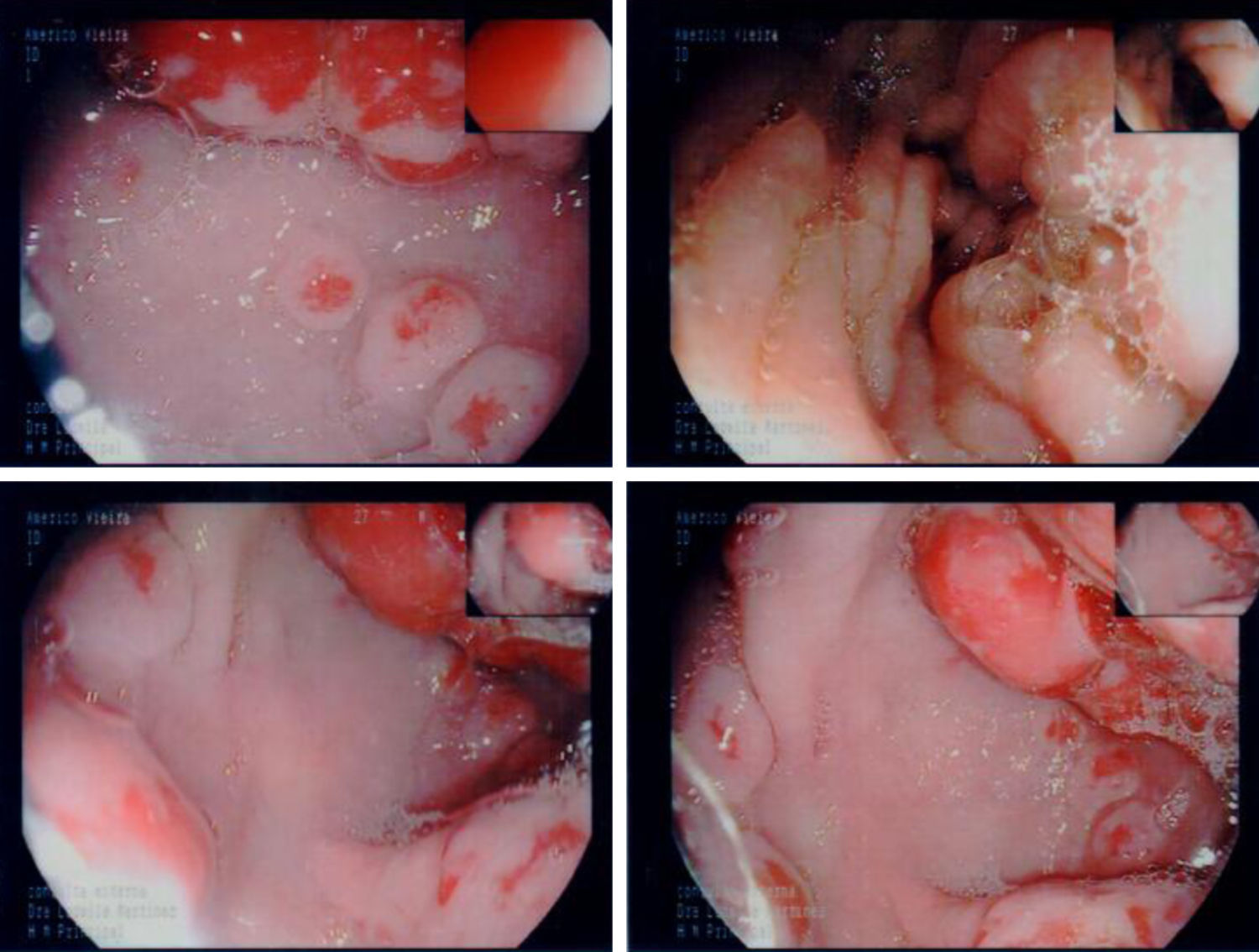
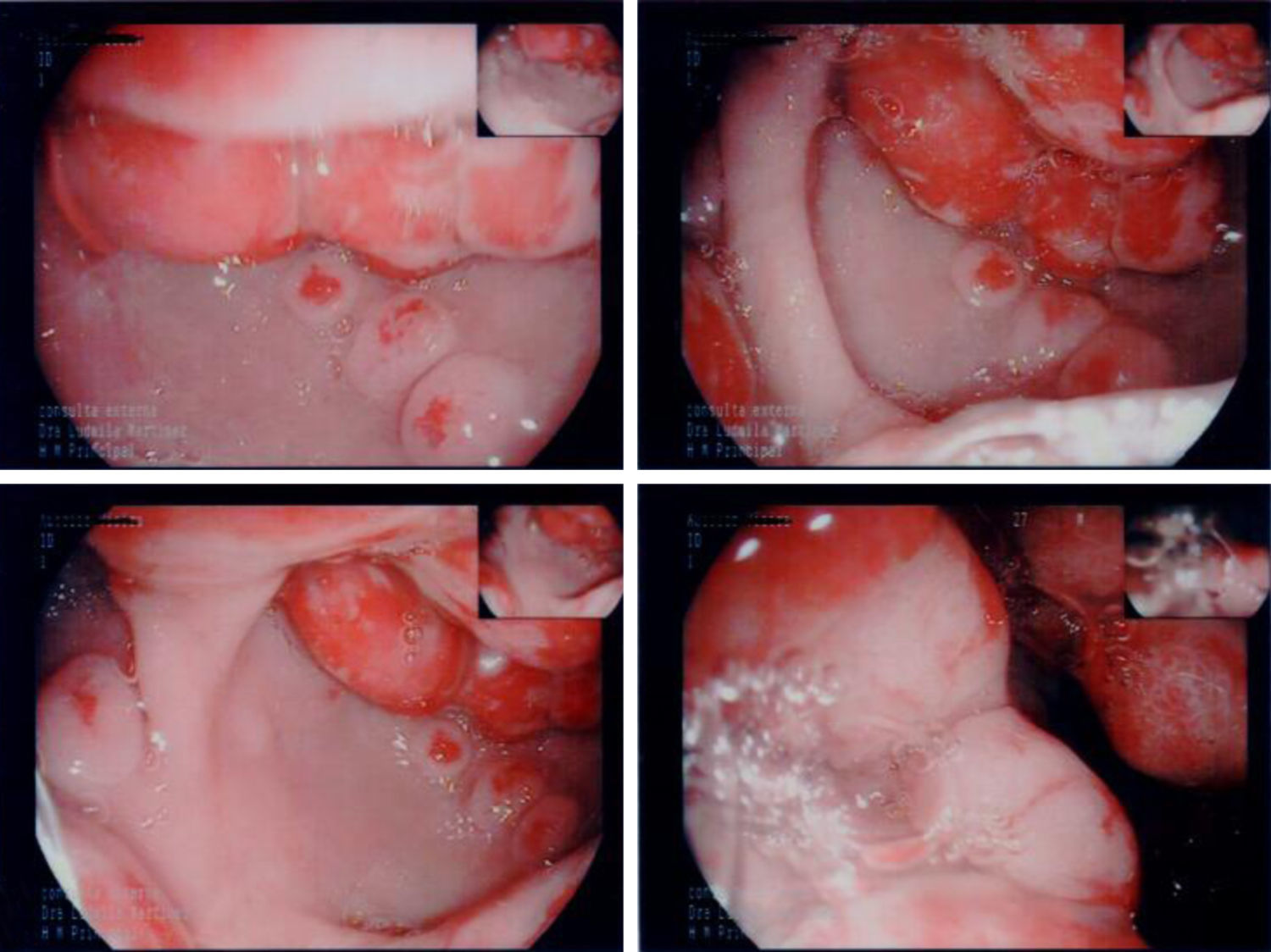
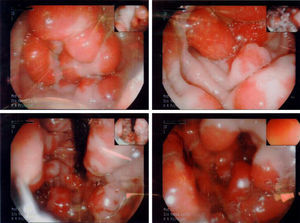
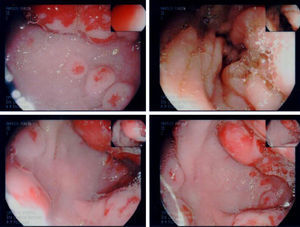
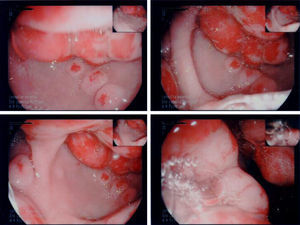
En la endoscopia digestiva alta (figs. 2 y 3) se encontró marcada hipertrofia de los pliegues gástricos más acentuado hacia fundus y cuerpo gástricos. El informe endoscópico concluyó: «Sospecha de EM, linfoma gástrico o enfermedad de Crohn de localización gástrica».
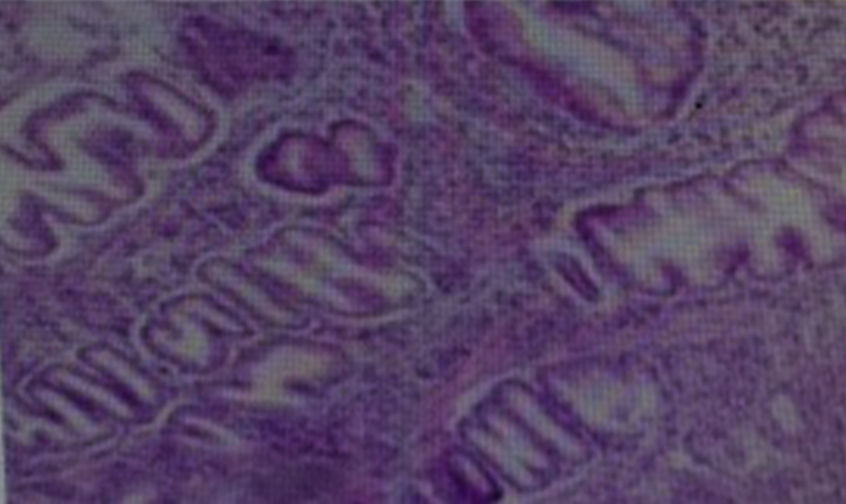
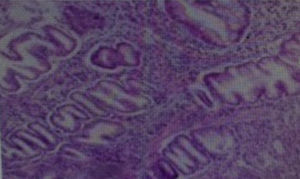
La biopsia gástrica (fig. 4) confirmó hipertrofia foveolar acentuada, atrofia de las glándulas y escaso infiltrado inflamatorio crónico de la lámina propia, compatible con EM. Fue sometido a cirugía y se le realizó una gastrectomía total, con evolución clínica satisfactoria (fig. 5).
Revisión de la literaturaLa EM o gastroenteropatía hipertrófica, como también se la conoce, fue descrita por Pierre Ménétrier en 1888, en pacientes con cáncer gástrico. Se caracteriza por hipertrofia de los pliegues gástricos de fundus y cuerpo, hipersecreción de la mucosa, pérdida de proteínas e hipoclorohidria1.
La etiología es desconocida y en ella se plantean diversas hipótesis como son: causas infecciosas, autoinmunes (exposición a alérgenos y anticuerpos anticélulas parietales), hormonales y genéticas2. Esta enfermedad se ha asociado a mayor riesgo de cáncer gástrico, pero la magnitud de este riesgo es incierto y oscila entre el 10-15%3.
Es más frecuente en adultos, generalmente entre los 30 y 60 años de edad, con predominio en hombres. El diagnóstico en la infancia es raro (afecta por lo general a pacientes menores de 6 años), de evolución benigna, inicio brusco y con presencia constante de edema1. En la mayoría de los casos pediátricos publicados se considera al citomegalovirus (CMV) como el agente etiológico más probable. Entre otros posibles agentes infecciosos, se encuentra el Helicobacter pylori (H. pylori) y otros menos frecuentes, como Mycoplasma pneumoniae, Giardia intestinalis y herpes simple4.
No se conoce completamente el mecanismo por el que la infección por CMV en la infancia afecta a la mucosa gástrica. Estudios realizados demostraron el posible efecto del CMV a través del factor transformador del crecimiento alfa. Normalmente el factor transformador del crecimiento alfa estimula la proliferación y la secreción de mucina por parte de las células epiteliales gástricas. En la EM del adulto, el factor transformador del crecimiento alfa se incrementa y produce hiperplasia gástrica e hipersecreción, por lo que existe una similitud patogénica4.
Los síntomas más frecuentes son el dolor epigástrico, anorexia, pérdida de peso, vómitos persistentes, anemia, diarrea, edema y la hemorragia digestiva alta5. En la EM infantil la sintomatología inicial es inespecífica, similar a cualquier cuadro viral. El edema periférico aparece cuando existe una hipoalbuminemia establecida y puede producirse anasarca, con ascitis, derrame pleural y pericárdico4.
En los exámenes de laboratorio es característica la presencia de hipoproteinemia e hipoalbuminemia. La realización de α-1-antitripsina fecal, como marcador sensible y específico de pérdida proteica a nivel del tubo digestivo, es factible en estos casos.
A veces, resulta complejo confirmar el diagnóstico de la infección aguda por CMV. La hibridación in situ y la inmunohistoquímica se han propuesto como las técnicas de laboratorio más sensibles. Para evidenciar la existencia de infección por CMV se tiene en cuenta la presencia de células infectadas en la mucosa gástrica, mediante técnicas de PCR, detección de antígenos virales por inmunohistoquímica, cultivo viral de mucosa gástrica o la visualización de inclusiones virales típicas. Otros estudios, como la detección de antigenemia, PCR en sangre o las serologías, son menos sensibles para la detección de la afectación gastrointestinal. No obstante, al detectar la infección, permiten establecer la sospecha diagnóstica4.
Los hallazgos radiológicos en la EM de la infancia son similares a los observados en el adulto. Los estudios de imágenes (radiografía contrastada de esófago-estómago-duodeno, ecografía abdominal y tomografía computarizada) muestran engrosamiento de los pliegues gástricos, con predominio en cuerpo y fundus. En la mayoría de los casos el antro está respetado.
En la endoscopia digestiva alta también se confirma engrosamiento de los pliegues gástricos, con diferentes grados de inflamación mucosa y pueden observarse áreas de tejido ulcerado o necrótico. También es posible observar un incremento de la secreción gástrica de característica espesa, viscosa y transparente4.
Las alteraciones histológicas típicas incluyen hiperplasia foveolar, glándulas tortuosas y dilatadas, disminución de células parietales, leve infiltrado inflamatorio2,6 y aumento de las células productoras de mucus, las cuales pueden formar quistes3.
En el diagnóstico diferencial deben tenerse en cuenta otros procesos que pueden cursar con hipertrofia de pliegues gástricos, entre ellos:
- •
Síndrome de Zollinger-Ellison
- •
Enfermedad de Crohn
- •
Gastropatía hipertrófica asociada a infecciones: H. pylori, CMV, histoplasmosis, sífilis y Mycoplasma.
- •
Gastritis linfocítica
- •
Enfermedades granulomatosa (como la sarcoidosis)
- •
Gastritis alérgica eosinofílica
- •
Síndrome de Cronkhite-Canada
- •
Neoplasias gástricas (linfoma, sarcoma y otras)
- •
Tratamiento con prostaglandina E1
Hasta el momento no hay un tratamiento establecido para esta enfermedad. Contrariamente a lo que acontece en el adulto, en la edad pediátrica la resolución clínica completa de manera espontánea suele ser alrededor de las 5 semanas7. En aquellos pacientes infectados por H. pylori se recomienda su erradicación, con lo cual puede lograrse el control de los síntomas. También se han empleado una dieta rica en proteínas, antisecretores (inhibidores de la bomba de protones o ranitidina), octreótido, anticolinérgicos e incluso anticuerpos monoclonales5. No existe un acuerdo unánime ni certeza de los beneficios del tratamiento con ganciclovir, aunque algunos autores han descrito mejoría clínica de los pacientes luego de su administración en pacientes inmunocompetentes. Puede valorarse el tratamiento con ganciclovir en aquellos pacientes con curso prolongado y ausencia de mejoría en torno a 4-6 semanas o de gravedad significativa2.
El manejo quirúrgico se prefiere en los individuos con pérdida no controlable de proteínas, sangrado y con enfermedad localizada cerca del cardias o con displasia8, ya que además se elimina el riesgo de malignización9. Es objeto de debate la extensión de la gastrectomía a realizar. Algunos autores sugieren la realización de una gastrectomía total (porque elimina el riesgo de malignización). Los partidarios de una cirugía más conservadora plantean que permite controlar los síntomas con menor morbilidad. Lo más acertado es adaptar la técnica quirúrgica a la localización de la EM y el grado de displasia: gastrectomía total en los casos difusos, localizados cerca del cardias, como ocurre habitualmente, o con displasia/neoplasia y gastrectomía subtotal en las lesiones antrales sin signos de displasia5,9.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.