A diferencia del carcinoma colorrectal, no se recomienda el escrutinio de neoplasias del tubo digestivo alto para la población general. Sin embargo, existe evidencia sólida que avala que el cáncer del tubo digestivo superior puede desarrollarse en asociación con múltiples patologías subyacentes, conocidas como lesiones premalignas. En esta revisión se abordarán los aspectos de escrutinio y seguimiento endoscópico correspondientes a las siguientes condiciones premalignas: acalasia, ingestión por cáusticos, esófago de Barrett, pólipos gástricos, atrofia y metaplasia intestinal gástrica.
Unlike colorectal carcinoma, screening for upper digestive tract cancer in the general population is not recommended. However, there is solid evidence that supports the development of upper digestive tract cancer from underlying conditions known as premalignant lesions. This review will discuss screening and endoscopic surveillance aspects on the following premalignant conditions: achalasia, caustic injury, Barrett's esophagus, gastric polyps, gastric atrophy and intestinal metaplasia.
Introducción
Las neoplasias malignas gastrointestinales representan una importante causa de mortalidad en México, su incidencia ha aumentado en los últimos años. En el periodo de 1993-2002, el adenocarcinoma colorrectal y el cáncer gástrico ocuparon el quinto y sexto lugar, respectivamente, dentro de las neoplasias malignas más frecuentes en nuestro país.1
Para las neoplasias malignas del tubo digestivo superior, a diferencia del carcinoma colorrectal, no existen recomendaciones en cuanto a escrutinio en la población general. La frecuencia de neoplasias como adenocarcinoma gástrico, es aún baja en comparación con países como Japón, en donde se justifica un programa de escrutinio bien estructurado. Sin embargo, existe evidencia sólida que avala que el cáncer del tubo digestivo superior puede desarrollarse en asociación con múltiples patologías subyacentes, conocidas como lesiones premalignas. Es en la identificación y vigilancia de estas lesiones, en donde se puede incidir para la detección oportuna y tratamiento temprano de las neoplasias malignas del tubo digestivo superior.
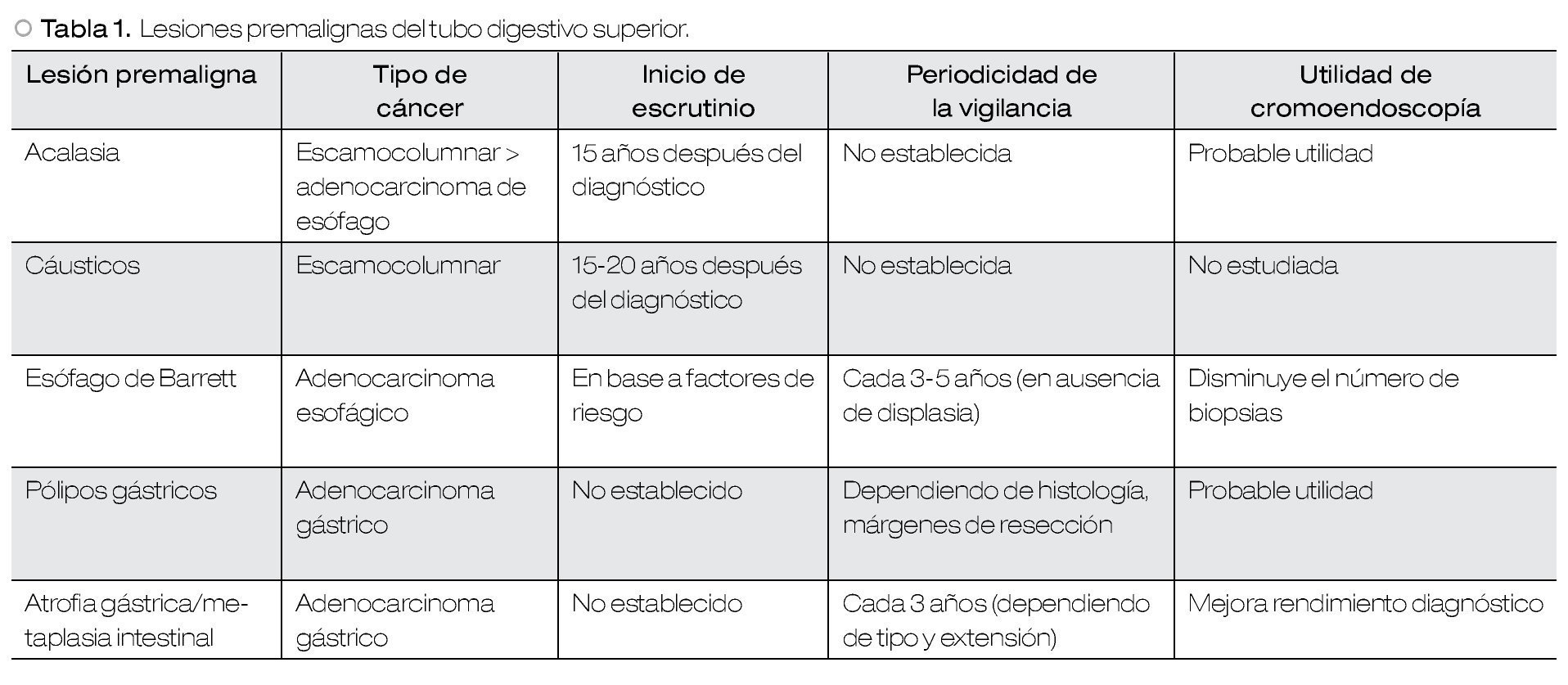
En esta revisión se abordarán los aspectos de escrutinio y seguimiento endoscópico correspondientes a: acalasia, ingestión por cáusticos, esófago de Barrett, pólipos gástricos, atrofia y metaplasia intestinal gástrica. En la Tabla 1 se resumen las características de las lesiones premalignas del tubo digestivo superior.
Acalasia
Diversos estudios han demostrado un riesgo relativo alto para el desarrollo de carcinoma esofágico en acalasia.2-4 La estasis alimentaria observada en esta patología ocasiona inflamación crónica de la mucosa esofágica, lo cual incrementa el riesgo de desarrollar hiperplasia, displasia y carcinoma de células escamosas.5-7 Sin embargo, la incidencia de adenocarcinoma también se encuentra aumentada. Un posible mecanismo está en relación con el tratamiento, al disminuir la presión del esfínter esofágico inferior aumenta el reflujo gastroesofágico, lo cual puede provocar eventualmente esófago de Barrett y adenocarcinoma.8,9 En un estudio prospectivo reciente, se demostró una razón de riesgo de 28 para carcinoma esofágico en pacientes con acalasia en comparación con controles pareados.3 Sin embargo, a pesar de una vigilancia regular, la mayoría de los casos de cáncer fueron diagnosticados en un estadio avanzado. Los síntomas de carcinoma esofágico en los pacientes con acalasia a menudo son interpretados erróneamente como síntomas propios de la acalasia, y la endoscopia convencional con luz blanca no es sensible para la detección de displasia, lo cual lleva al diagnóstico de cáncer en estadio avanzado y a un mal pronóstico.3
La introducción de nuevas técnicas endoscópicas como cromoendoscopia, endoscopia de alta resolución, imagen de banda estrecha (NBI) y cromoendoscopia virtual, ha aumentado de manera importante la detección de lesiones tempranas tanto en esófago como en colon.10,11 La sensibilidad del Lugol para la detección de lesiones displásicas en epitelio escamoso es variable en la literatura médica, oscilando entre 80% y 96%, por lo que podría proponerse como una herramienta útil en el escrutinio endoscópico para carcinoma en pacientes con acalasia.12,13 Estos datos sugieren que debe llevarse a cabo el escrutinio endoscópico regular, especialmente en pacientes con acalasia de larga evolución (más de 15 años) y en pacientes con estasis esofágica. No obstante, se requieren estudios adicionales para determinar el beneficio de dicho escrutinio.
En las guías más recientes de la Sociedad Americana para la Endoscopia Gastrointestinal (ASGE, por sus siglas en inglés) sobre lesiones premalignas del tubo digestivo superior, se recomienda iniciar el escrutinio 15 años después del inicio de los síntomas de acalasia, sin definir el intervalo de vigilancia subsecuente.14
Lesión por cáusticos
Se ha aceptado la existencia de un riesgo incrementado de desarrollar carcinoma de células escamosas del esófago después de una lesión por cáusticos severa, principalmente después de la ingestión de soda cáustica. La incidencia de cáncer en estenosis secundarias a cáusticos se ha estimado entre 2.3% y 6.2%, estando presente la historia de ingestión de cáusticos en 1% a 4% de pacientes con cáncer esofágico.15-18 Una serie de pacientes de Finlandia encontró que la magnitud del riesgo estaba incrementada en aproximadamente 1 000 veces, en comparación con una población similar.15
Las características clínicas de los pacientes que han desarrollado cáncer de esófago después de lesión por cáusticos incluyen: edad promedio entre 35 y 51 años, intervalo promedio de aproximadamente 40 años entre la ingestión de los cáusticos y el desarrollo de cáncer y cáncer en esófago medio.16-20 El pronóstico en algunas series aparenta ser mejor que para los pacientes con cáncer de esófago esporádico.15,17,20 No existen datos de programas prospectivos de escrutinio y vigilancia.
Las recomendaciones de la ASGE proponen iniciar vigilancia endoscópica, 15 a 20 años después de la ingestión de cáusticos. La regularidad de la vigilancia endoscópica requiere de mayores estudios aunque generalmente se recomienda realizarla no antes de cada uno a tres años.14
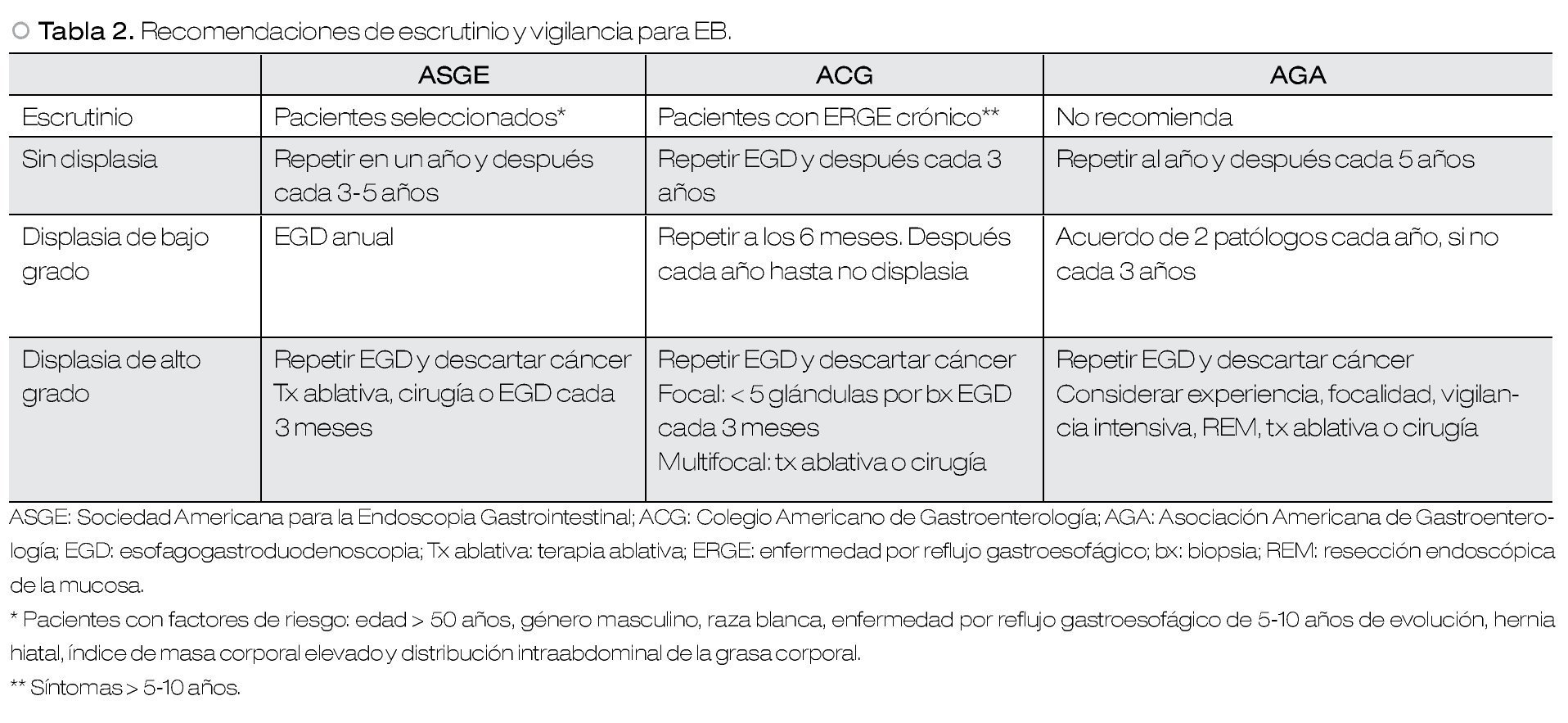
Esófago de Barrett
El reconocimiento del esófago de Barrett como la lesión premaligna del adenocarcinoma esofágico ha motivado la publicación de guías y recomendaciones, por parte de diversas sociedades científicas en cuanto a escrutinio y vigilancia endoscópica. Un acuerdo generalizado es que el escrutinio no debe realizarse a la población general. Sin embargo, existe aún controversia acerca del beneficio clínico del escrutinio y la vigilancia en sujetos con factores de riesgo, e incluso diagnóstico ya establecido de esófago de Barrett .
Las guías actuales sobre escrutinio y vigilancia endoscópica se basan en gran medida en un riesgo asumido de adenocarcinoma esofágico, de aproximadamente 0.5% por año.21 Estas estimaciones están en relación con un meta-análisis del año 2000, en donde se reconoció que el sesgo de publicación había resultado en una sobreestimación sistematizada del riesgo. Más recientemente, un estudio poblacional encontró que el riesgo absoluto de adenocarcinoma esofágico después del diagnóstico de esófago de Barrett es significativamente menor, que el encontrado en estudios previos, con un riesgo estimado de adenocarcinoma esofágico de 0.12% por año (IC95%:0.09-0.15). El riesgo relativo calculado para adenocarcinoma esofágico entre pacientes con esófago de Barrett comparado con el riesgo en la población general, fue de 11.3.22 Estos hallazgos hacen aún más cuestionables las medidas actuales de escrutinio y vigilancia.
Los factores de riesgo bien establecidos para esófago de Barrett incluyen: edad avanzada, género masculino, raza blanca, enfermedad por reflujo gastroesofágico (ERGE), hernia hiatal, índice de masa corporal elevado y distribución intraabdominal de la grasa corporal. Se recomienda una endoscopia de escrutinio en pacientes con ERGE crónica (5-10 años), con estos factores de riesgo. Si la endoscopia de escrutinio resulta normal, no se requiere de revisiones endoscópicas adicionales.14,21
En todo estudio endoscópico en donde se identifique esófago de Barrett, debe utilizarse una escala de estadificación validada. La clasificación de Praga fue desarrollada con el fin de estandarizar la estadificación endoscópica del esófago de Barrett, y con esto evitar el uso de términos subjetivos como esófago de Barrett de segmento largo, corto o ultra corto. La clasificación de Praga utiliza el valor C para describir la extensión circunferencial del esófago de Barrett, y el valor M para describir la extensión máxima de éste, por arriba de la unión gastroesofágica en centímetros.23
En caso de identificarse esófago de Barrett en la endoscopia inicial, se deben obtener múltiples biopsias del epitelio sospechoso así como de cualquier lesión macroscópica. Si bien no se ha establecido un protocolo óptimo de biopsias, un abordaje ampliamente aceptado es el denominado protocolo de Seattle, en donde se obtienen biopsias de los cuatro cuadrantes cada 2 cm a lo largo del epitelio columnar, así como biopsias de cualquier irregularidad de la mucosa (nódulos, masas o úlceras), que pudiera estar asociada con displasia.24
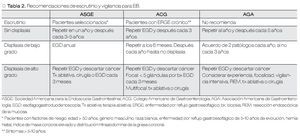
En pacientes con esófago de Barrett sin evidencia de displasia en la endoscopia inicial, se debe realizar una nueva endoscopia un año después. De no confirmarse displasia, estos pacientes son considerados de bajo riesgo de progresión o desarrollo de adenocarcinoma esofágico. Tomando en cuenta estos datos, se ha recomendado vigilancia endoscópica adicional en intervalos de tres a cinco años. En pacientes con displasia de bajo grado se ha sugerido endoscopia de seguimiento en intervalos de seis a 12 meses, y en pacientes con displasia de alto grado que no recibirán tratamiento invasivo, se sugiere endoscopia cada tres meses. En estos últimos casos, se debe llevar a cabo un protocolo de biopsias más extenso (biopsias jumbo de los cuatro cuadrantes cada 1 cm, con biopsias adicionales de anormalidades macroscópicas).14,21 Si no se encuentra displasia en dos endoscopias consecutivas, se puede extender el intervalo de revisión a cada seis meses durante uno a dos años, y posteriormente cada año, siempre y cuando no se encuentre displasia nuevamente.25 Si la presencia o grado de displasia es indeterminada, y además existe evidencia de inflamación aguda debido a reflujo gastroesofágico, se debe realizar nueva toma de biopsias después de ocho semanas de tratamiento efectivo para supresión de ácido.14 En la Tabla 2 se describen las recomendaciones de escrutinio y vigilancia para esófago de Barrett, propuestas por diversas asociaciones.
El protocolo de Seattle consume tiempo, es costoso y susceptible de error de muestreo. Es por ello que se han propuesto técnicas endoscópicas alternas para mejorar la detección de metaplasia intestinal y displasia en esófago, incluyendo cromoendoscopia y magnificación.
Al combinar la endoscopia con magnificación y la aplicación de tinciones como índigo carmín, azul de metileno y ácido acético, se pueden reconocer diferentes patrones mucosos en el epitelio columnar del esófago de Barrett. Guelrud y colaboradores al utilizar ácido acético, describieron cuatro patrones de criptas en el epitelio del esófago de Barrett (redondo, reticular, velloso y surcado); encontraron que los patrones surcado/velloso se asociaban con metaplasia intestinal.26 Sharma y colaboradores estudiaron 80 pacientes con esófago de Barrett, utilizando índigo carmín y encontraron que el patrón mucoso surcado/ velloso tuvo una alta sensibilidad (97%) y especificidad aceptable (76%) para metaplasia intestinal.27 De manera adicional, los seis pacientes con displasia de alto grado tuvieron un patrón glandular distorsionado o irregular. Sin embargo, un ensayo cruzado, prospectivo y aleatorizado de 28 pacientes demostró que la cromoendoscopia con índigo carmín no aumentó la sensibilidad para la detección de neoplasia temprana en esófago de Barrett, más allá que la endoscopia con luz blanca de alta resolución.28 Por otro lado, los reportes sobre el uso de azul de metileno han arrojado resultados variables. En un estudio prospectivo, aleatorizado y cruzado que comparó biopsias dirigidas con azul de metileno vs. el protocolo estándar de biopsias en los cuatro cuadrantes en 48 pacientes con esófago de Barrett, ambas técnicas resultaron similares para la detección de éste y displasia, aunque el promedio de biopsias requerido para su detección fue significativamente menor con la tinción de azul de metileno.29 Finalmente, un meta-análisis reciente de nueve estudios que incluyeron un total de 450 pacientes, encontró que la tinción con azul de metileno y la técnica de biopsias en los cuatro cuadrantes, tienen tasas similares de detección de metaplasia intestinal y displasia.30
Con el fin de mejorar la detección de displasia y cáncer temprano, se ha estudiado recientemente la aplicación de la "cromoendoscopia digital", utilizando técnicas como la imagen de banda estrecha (NBI), la imagen óptima en banda y el i-Scan®. Se ha demostrado que NBI puede detectar significativamente más pacientes con displasia y grados más altos de displasia con menor número de biopsias, en comparación con luz blanca de resolución estándar.31 Adicionalmente, en un meta-análisis acerca del desempeño y utilidad clínica de NBI en endoscopia superior, se encontró una sensibilidad de 97% (IC95%:0.89-0.99), una especificidad de 94% (IC95%:0.60-0.99) y una exactitud global de 96% (IC95%:0.72-0.99) para diferenciar displasia de epitelio no displásico en esófago de Barrett.32
La cromoendoscopia en esófago de Barrett consume tiempo, puede tener múltiples problemas técnicos (lograr la aplicación uniforme de colorante), no es inocua (en el caso de azul de metileno), no está estandarizada (en cuanto a la interpretación de los patrones mucosos) y está sujeta a variabilidad interobservador importante. Por otro lado, las técnicas de cromoendoscopia digital consumen menos tiempo y son más fáciles de realizar técnicamente, pero están sujetas a problemas como una pobre estandarización y variabilidad interobservador.
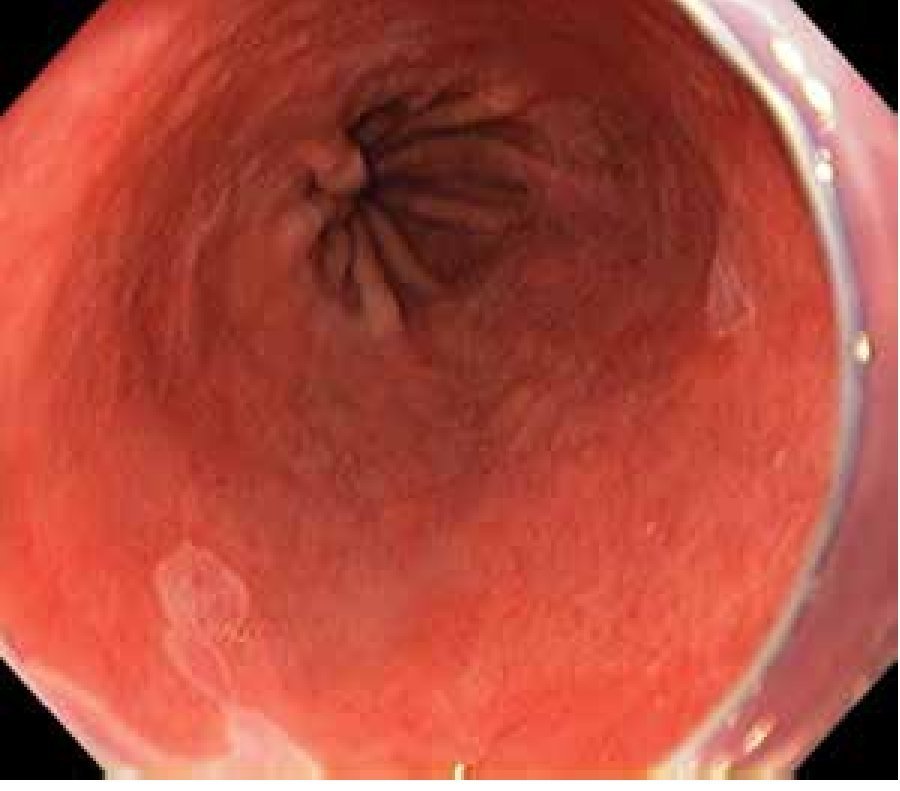
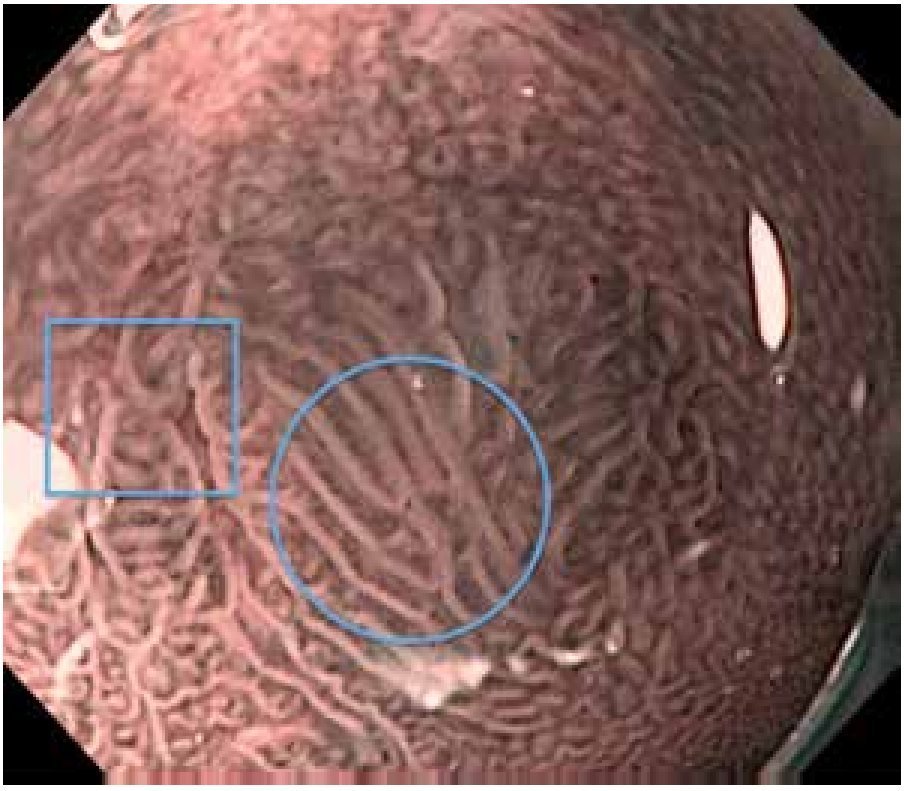
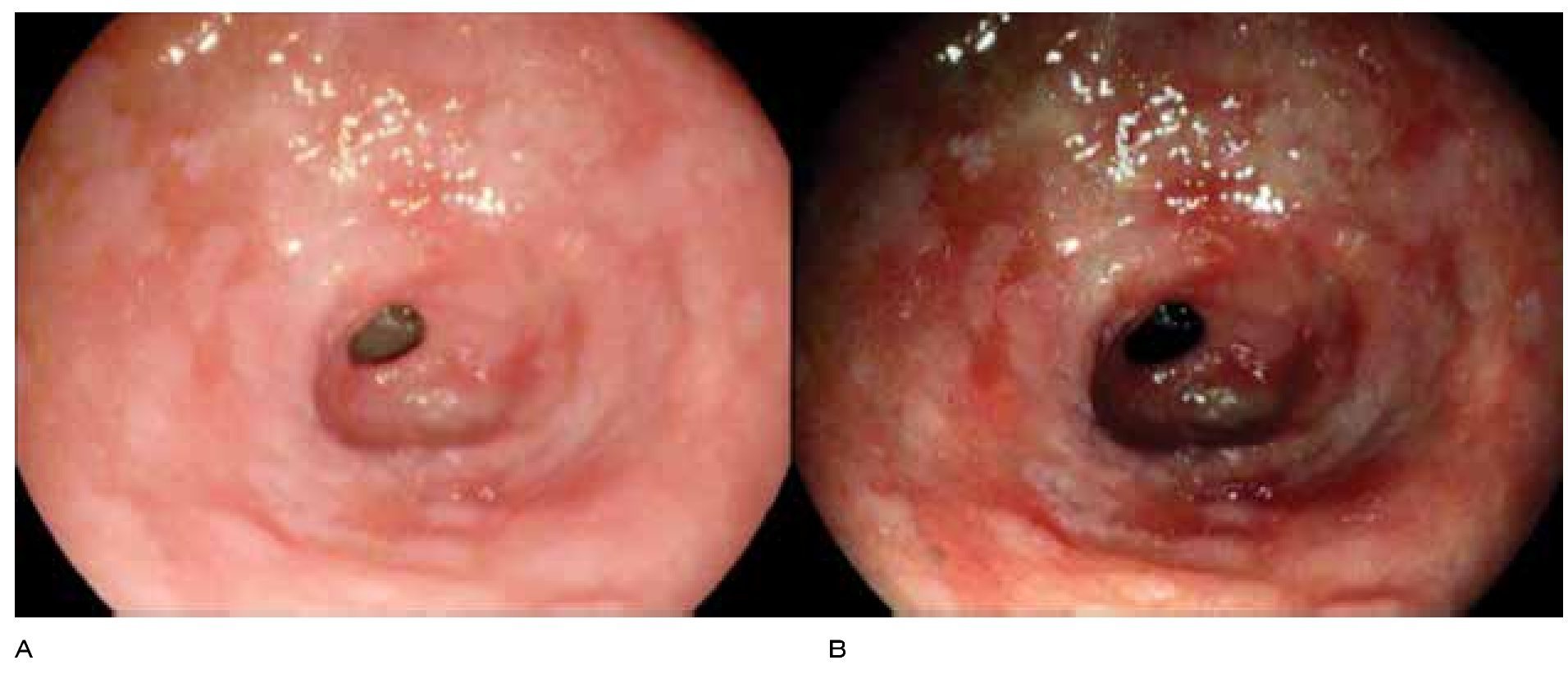
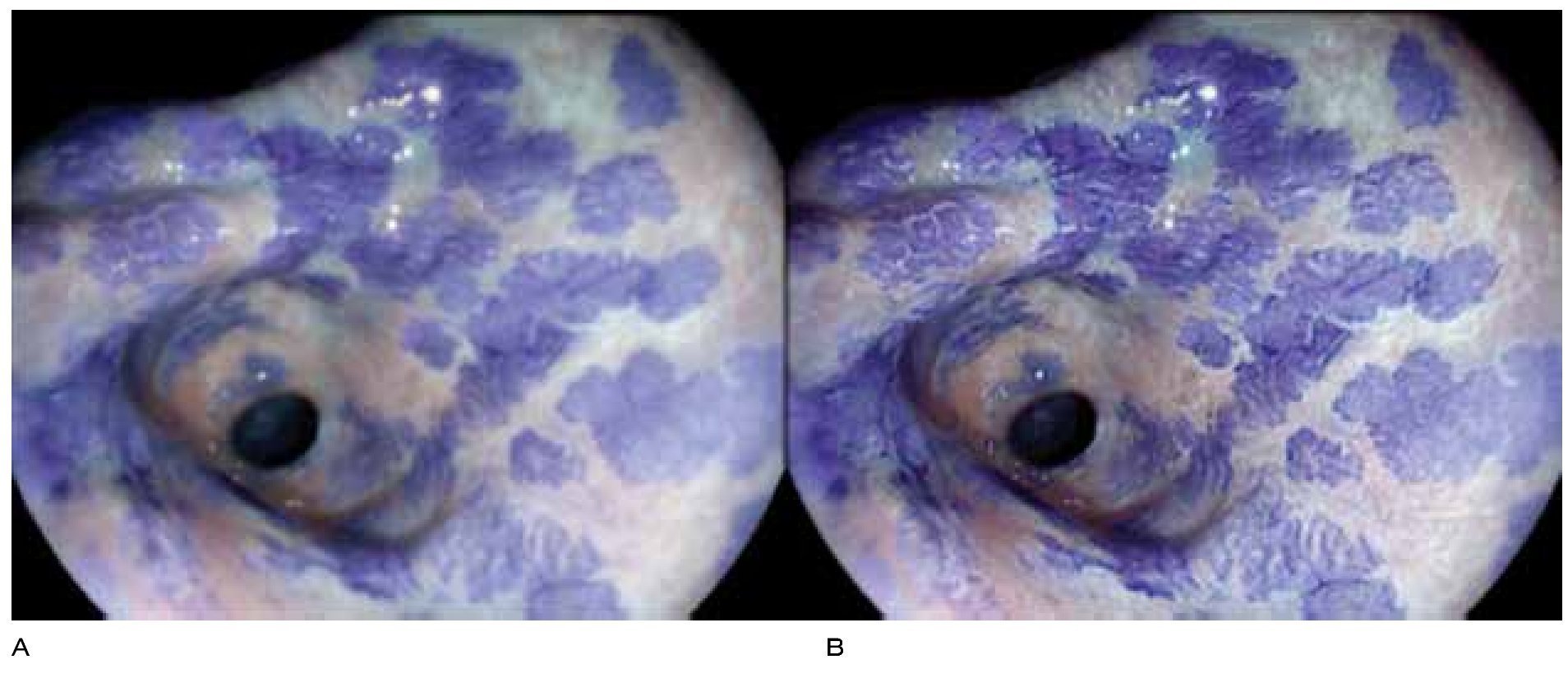
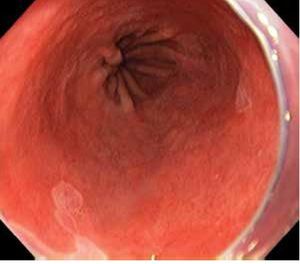
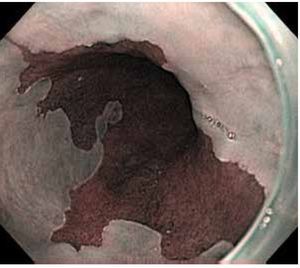
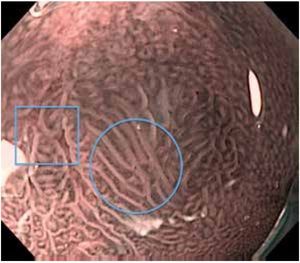
Debido a lo anterior se concluye que la vigilancia endoscópica se debe realizar con una inspección cuidadosa del epitelio columnar del esófago, utilizando endoscopia de luz blanca de alta resolución, con toma de biopsias en base a protocolo de Seattle. No es posible en este momento apoyar o rechazar la utilización de técnicas de cromoendoscopia digital o convencional21 (Figuras 1, 2 y 3).
Figura 1. Esófago de Barrett. Clasificación de Praga: C3, M4, luz convencional.
Figura 2. Esófago de Barrett. Clasificación de Praga: C3, M4, NBI.
Figura 3.Esófago de Barrett, NBI y magnificación. Se caracteriza patrón mucoso como velloso (óvalo) e irregular (rectángulo), con sospecha de displasia. El resultado de patología fue de esófago de Barrett sin displasia y con displasia de bajo grado, respectivamente.
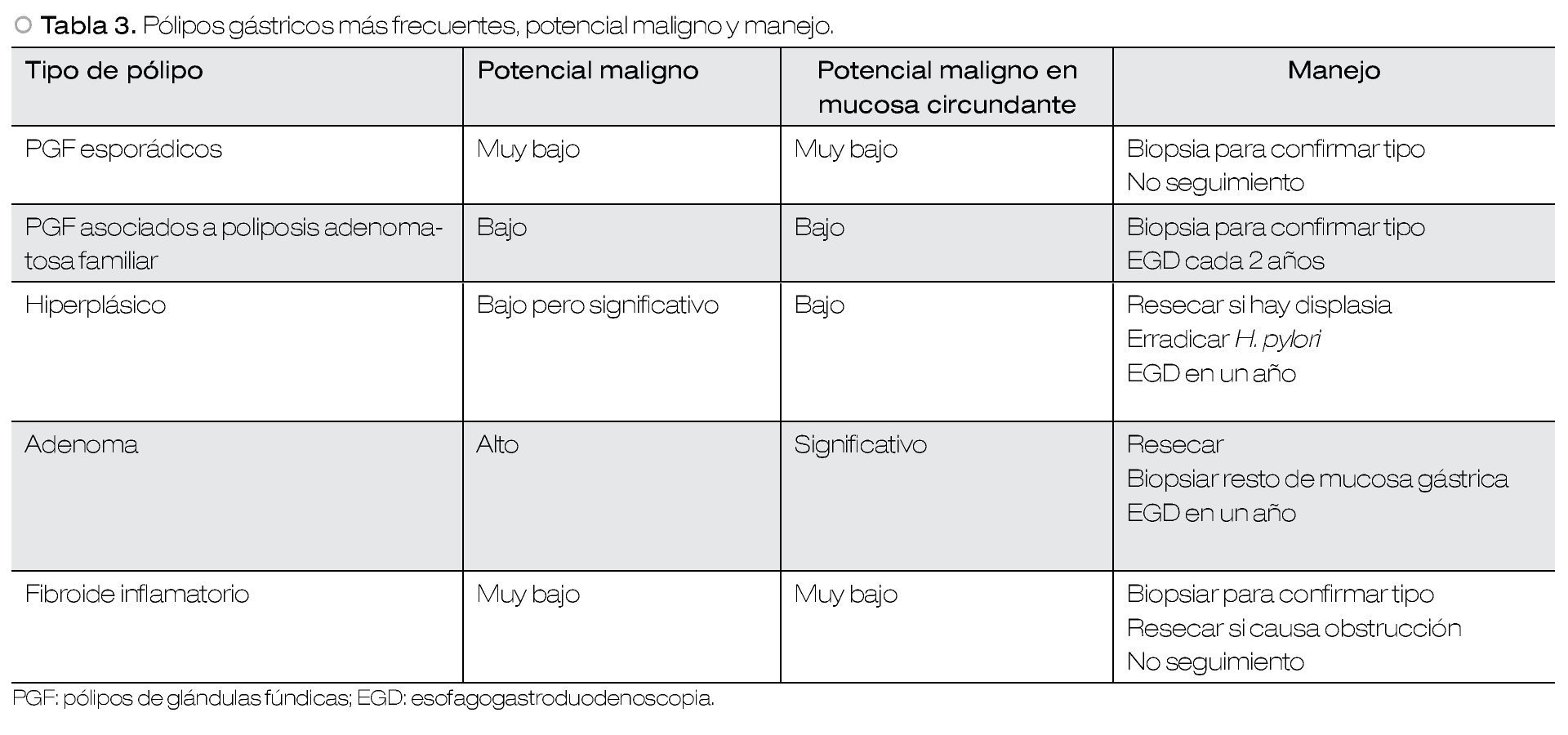
Pólipos gástricos
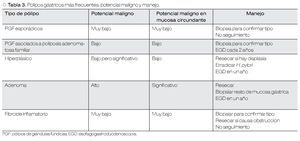
El uso generalizado de la endoscopia ha provocado el aumento en la detección de lesiones gástricas mucosas, muchas de las cuales son diagnosticadas de manera incidental. Dependiendo del tipo histológico, algunos pólipos gástricos tienen potencial maligno y son precursores de cáncer gástrico temprano. Asimismo, pueden traducir un riesgo mayor de neoplasia maligna intestinal o extraintestinal. En esta revisión se abordarán los pólipos de glándulas fúndicas, hiperplásicos y adenomatosos. En la Tabla 3 se resumen las características en cuanto a potencial maligno y manejo de los pólipos gástricos más frecuentes.
Pólipos de glándulas fúndicas (PGF)
También llamados quistes glandulares de Elster, estos pólipos ocurren en dos contextos clínico-patológicos distintos: PGF esporádicos y los relacionados con la poliposis adenomatosa familiar (PAF).
Los PGF esporádicos constituyen 16% a 51% de los pólipos gástricos,33-35 pueden observarse en 0.8% a 23% de las endoscopias.36-38 La displasia ocurre en < 1%, no se asocian con gastritis atrófica y la prevalencia de la infección por Helicobacter pylori (H. pylori) es muy baja en estos pacientes.39 Por otro lado, los PGF son frecuentes en pacientes con PAF y se generan por mutaciones del gen APC. Es por ello que en este contexto son generalmente múltiples, ocurriendo displasia en 25% a 41% de ellos.40
Las recomendaciones para el manejo endoscópico de este tipo de pólipos se resumen en:41
• No se requiere polipectomía para PGF esporádicos.
• Tomar biopsia de probables PGF para excluir displasia o adenocarcinoma (y posible PAF), y para excluir la necesidad de polipectomía.
• En pacientes con numerosos PGF (más de 10 pólipos), menores de 40 años, o en quienes se demuestre displasia, se debe realizar exploración colónica para excluir PAF.
Pólipos hiperplásicos (PH)
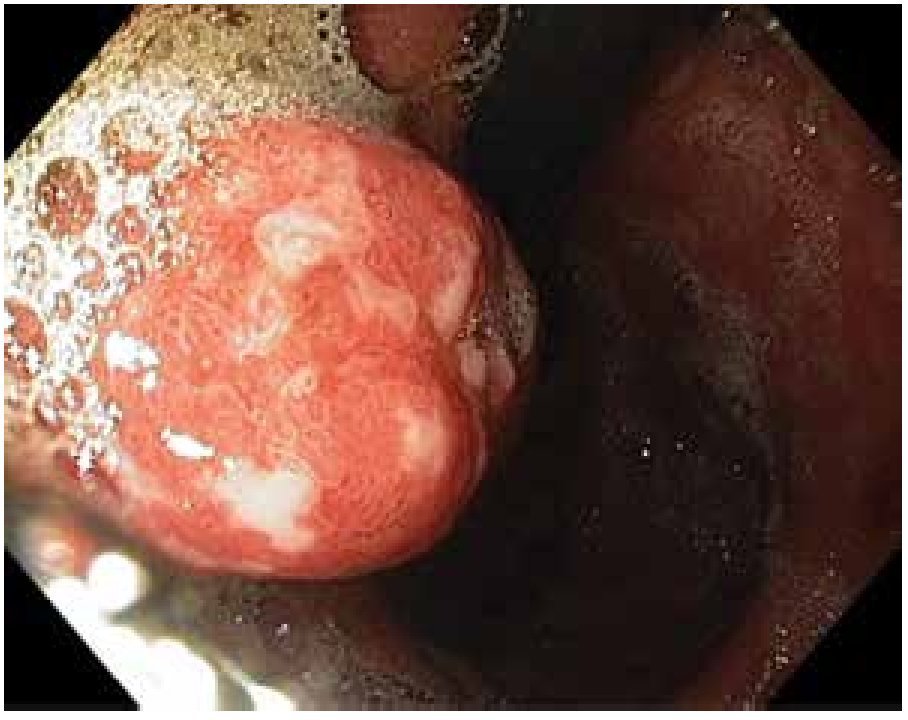
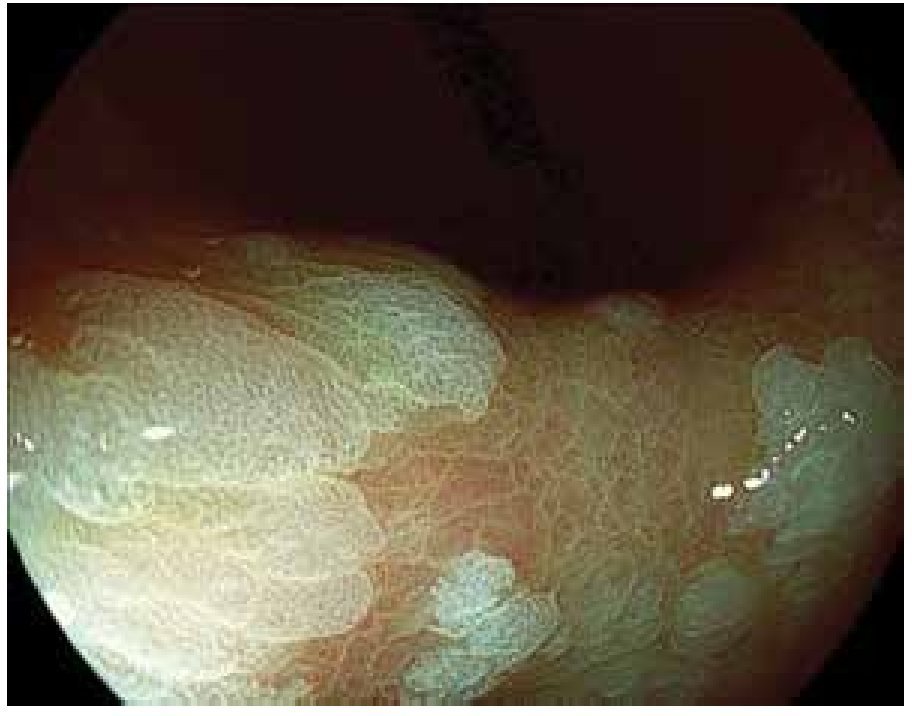
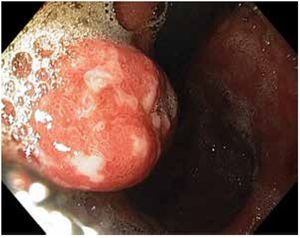
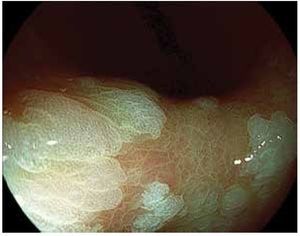
Los PH constituyen 30% a 93% de todos los pólipos gástricos.33-35 Su origen está fuertemente relacionado con gastritis crónica, gastritis asociada a H. pylori, anemia perniciosa, gastritis reactiva o química adyacente a erosiones o úlceras y alrededor de estomas.42,43 Estos pólipos rara vez sufren progresión neoplásica directamente a través de cambios neoplásicos en el pólipo como tal, sino que se asocian con un riesgo incrementado de cáncer sincrónico en la mucosa gástrica circundante. La prevalencia de displasia real originada en los pólipos hiperplásicos es debatida, aunque se han reportado tasas de 1.9% a 19% y casos de adenocarcinoma con tasas de 0.6% a 2.1%. El riesgo de adenocarcinoma en la mucosa circundante es probablemente mayor, que en el pólipo mismo41 (Figura 4).
Figura 4.Pólipo hiperplásico mayor de 2 cm, con despulimiento de la mucosa superficial y fibrina.
Las recomendaciones para el manejo de los PH se resumen en:14,41
• Deben tomarse biopsia y hacerse una revisión de todo el estómago, en busca de anormalidades de la mucosa. En pólipos mayores a 0.5 cm (debido al mayor riesgo de displasia) o aquellos que han provocado síntomas como hemorragia, se recomienda realizar polipectomía. De no encontrarse anormalidades adicionales en mucosa gástrica, se recomienda realizar un "mapeo" con biopsias (dos de antro, dos de cuerpo y uno de incisura angular) en busca de gastritis y metaplasia intestinal.
• La vigilancia de PH que no son retirados (ya sea por su número o por su tamaño), es probablemente más segura que el realizar múltiples polipectomías, sin embargo no existe evidencia sólida en cuanto a la mejor conducta. Una endoscopia un año después parece ser una conducta razonable, aunque el realizar mayor vigilancia después de un año no se recomienda, debido a falta de evidencia.
• Buscar H. pylori y erradicarlo en caso de ser positivo.
Pólipos adenomatosos
Constituyen 3% a 26% de los pólipos gástricos y son verdaderas neoplasias precursoras de cáncer gástrico. Histológicamente se clasifican en tubulares, vellosos y túbulo-vellosos. A menudo surgen en el contexto de gastritis atrófica y metaplasia intestinal, pero no se ha probado su asociación con H. pylori.44 La progresión neoplásica es mayor con pólipos mayores a 2 cm, ocurre en 28.5% a 40% de los adenomas vellosos y 5% de los tubulares. Asimismo, se ha identificado una asociación fuerte entre adenoma gástrico y adenocarcinoma gástrico sincrónico o metacrónico.41
Las recomendaciones para el manejo de pólipos adenomatosos se resumen en:14,41
• Debe realizarse resección completa del adenoma siempre que sea factible.
• Debe realizarse una revisión completa del estómago, con el fin de biopsiar cualquier anormalidad.
• Debe realizarse vigilancia endoscópica después de la resección de un adenoma en el lapso de un año, con el fin de valorar recurrencia, pólipos nuevos o no detectados o aparición de carcinoma. Si esta revisión resulta negativa, debe valorarse realizar endoscopia de vigilancia en intervalos no menores a tres a cinco años. Debe realizarse una nueva endoscopia a los seis meses, en los casos de pólipos resecados de manera incompleta o aquellos con displasia de alto grado. Se puede repetir la endoscopia después de un año en cualquier otro caso.
Atrofia y metaplasia intestinal gástrica
La atrofia de la mucosa gástrica y la metaplasia intestinal confieren un alto riesgo para el desarrollo de cáncer gástrico, ya que constituyen el contexto en el que se desarrollan la displasia y el adenocarcinoma gástrico de tipo intestinal. Ambas son consideradas condiciones precancerosas.
Se ha clasificado a la metaplasia en completa ("tipo intestino delgado" o tipo I) e incompleta ("enterocolónica" o tipo IIA/II y "colónica" o tipo IIB/ III). El tipo de metaplasia intestinal se ha relacionado con el riesgo de desarrollo de displasia. Los pacientes con metaplasia intestinal incompleta parecen presentar un mayor riesgo de cáncer gástrico, en comparación con aquellos que presenta metaplasia intestinal completa. En un estudio reciente realizado en España, se desarrolló carcinoma gástrico en 16 (18.2%) de 88 pacientes con metaplasia intestinal incompleta, mientras que sólo se presentó en uno (0.96%) de 104 pacientes metaplasia intestinal completa después de un seguimiento de 12.8 años. La metaplasia intestinal incompleta también se relacionó con el mayor riesgo de desarrollar cáncer gástrico en el análisis multivariado (RR=11.3; IC95%:3.8-33.9).45 Por otro lado, el patrón de distribución de la metaplasia intestinal en el estómago también ha demostrado tener un papel importante en el riesgo de cáncer gástrico, siendo mayor si la afección es difusa (antro y cuerpo gástrico).46
A pesar de la certidumbre en cuanto a su potencial maligno, la ASGE, en sus últimas guías sobre lesiones premalignas del tubo digestivo superior, no apoya la vigilancia endoscópica de pacientes con metaplasia intestinal.14 En nuestro país no existen guías que aborden lesiones premalignas de estómago. Sin embargo, recientemente fueron dadas a conocer las guías europeas sobre el manejo de condiciones y lesiones precancerosas del estómago, en donde se hacen amplias recomendaciones en cuanto al diagnóstico y vigilancia tanto de atrofia gástrica como de metaplasia intestinal.47
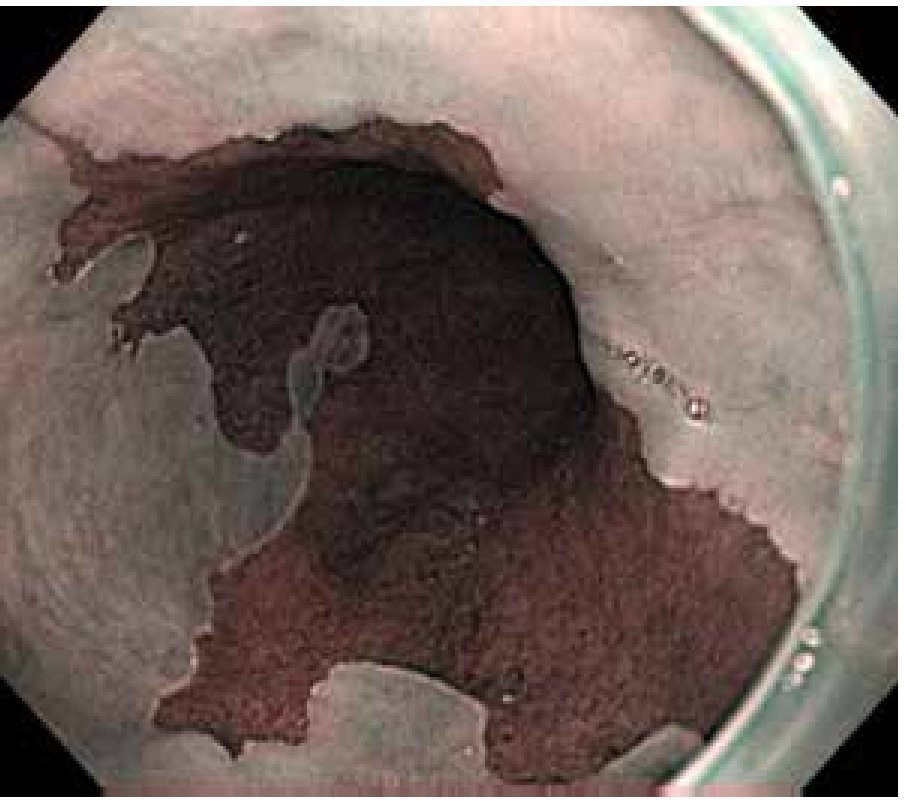
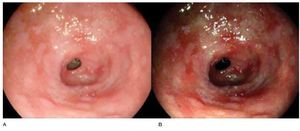
En cuanto al diagnóstico de estas lesiones, la endoscopia convencional con luz blanca no permite diferenciar ni diagnosticar de manera confiable, las condiciones premalignas de estómago. La ausencia de pliegues y la presencia de vasos visibles en la mucosa gástrica predicen atrofia severa, pero con una sensibilidad relativamente baja.48 Por otra parte, la metaplasia intestinal puede mostrarse como depósitos mucosos blanquecinos y delgados, sin embargo, el valor diagnóstico de este hallazgo o algún otro no se ha establecido (Figura 5).49
Figura 5.Metaplasia intestinal. A) Luz convencional, áreas en placa sugestivas de metaplasia intestinal. B) Cromoendoscopia digital con i-Scan®, acentuándose áreas en placa sugestivas de metaplasia intestinal.
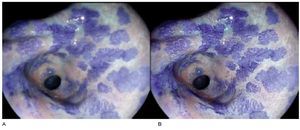
Es por ello que, la cromoendoscopia con magnificación se ha propuesto como método para identificar lesiones de metaplasia intestinal y displasia. Dinis-Ribeiro y colaboradores propusieron una clasificación para el diagnóstico de estas lesiones, utilizando azul de metileno50 (Figura 6). Esta clasificación fue reproducible, exacta y mantuvo estas características al ser sometida a validación externa. Sin embargo, esta técnica prolonga el tiempo del procedimiento endoscópico, además de que puede comprometer la tolerancia del paciente. Debido a lo anterior, la práctica rutinaria de cromoendoscopia con magnificación no puede recomendarse de manera generalizada y su uso debe restringirse a centros con experiencia en estas técnicas. De la misma forma, en los últimos años se han publicado múltiples estudios en donde se aborda el uso de cromoendoscopia digital (NBI) con magnificación, para la identificación de patrones mucosos de metaplasia intestinal. Características endoscópicas como la presencia de la llamada cresta azul claro y la banda turbia marginal, han mostrado rendimientos diagnósticos aceptables para metaplasia intestinal.51,52 Sin embargo, no se ha estandarizado ningún sistema de clasificación utilizando estas técnicas, no se ha llevado a cabo una validación externa ni se ha evaluado su reproducibilidad (Figura 7).
Figura 6. Metaplasia intestinal. A) Luz convencional más cromoendoscopia con azul de metileno. B) Filtro de contraste y superficie 1 de i-Scan®, más cromoendoscopia con azul de metileno.
Figura 7. Metaplasia intestinal. Imagen de alta definición con magnificación digital más filtro de contraste y superficie i-Scan® 1, en donde se definen perfectamente las áreas de metaplasia.
Las recomendaciones para el diagnóstico de atrofia/metaplasia intestinal se resumen en lo siguiente:47
• Se deben tomar al menos dos biopsias del antro (curvatura mayor y menor) y dos biopsias del cuerpo (curvatura mayor y menor).
• Las biopsias deben incluirse en frascos separados, etiquetados de acuerdo al sitio de muestreo.
Las recomendaciones para la vigilancia se resumen en lo siguiente:47
• Debe ofrecerse vigilancia endoscópica a pacientes con atrofia/metaplasia intestinal extensa (compromiso de antro y cuerpo) cada tres años después del diagnóstico.
• No se recomienda vigilancia a pacientes con atrofia/metaplasia intestinal leve a moderada localizada en antro.
• Pacientes con displasia de bajo grado en ausencia de alguna lesión endoscópicamente definida, deben ser vigilados con una endoscopia en un año después del diagnóstico. Ante la presencia de una lesión definida por endoscopia debe considerarse la resección endoscópica, con el fin de obtener un diagnóstico histopatológico más preciso.
• Pacientes con displasia de alto grado en ausencia de lesiones endoscópicamente definidas, deben revalorarse por endoscopia de manera inmediata y realizar toma de biopsias de manera extensa para después vigilarse en intervalos de seis meses a un año.
Conclusiones
Las lesiones premalignas del tubo digestivo superior se han caracterizado en las últimas décadas. A pesar de que no existe uniformidad en el escrutinio y vigilancia de estas lesiones, las sociedades científicas más importantes a nivel internacional lo recomiendan. En todos los casos habrá que individualizar el manejo, se tendrá que hacer uso de los recursos disponibles en cada Unidad de Endoscopia, y de ser necesario se tendrá que referir al paciente a un centro con experiencia en el manejo de estas lesiones.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
No se recibió patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Guido Grajales Figueroa.
Departamento de Endoscopia Gastrointestinal, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Delegación Tlalpan, C.P. 14080, México D.F., México,
Teléfono: 5487 0900, ext. 2158.
Correo electrónico: guidograjalesf@hotmail.com