El sangrado variceal representa 10-30% de todos los casos de sangrado gastrointestinal alto. Las varices gástricas están presentes en cerca del 10-30% de los pacientes con hipertensión portal. El riesgo de sangrado de las mismas es de 50-80%, con una mortalidad cercana al 45%. Si bien sangran menos frecuentemente que las esofágicas, cuando lo hacen, su severidad es mayor y el control más difícil. Algunas series de casos han mostrado más de 90% de tasa de hemostasia, tasas de obliteración variceal 70-90% y tasa de resangrado menos de 30%. De los métodos disponibles para su tratamiento, las terapias de obturación constituyen la opción de primera línea para las varices del fondo gástrico (GOV 2 e IGV 1).
ObjetivosDeterminar la eficacia de la inyección de cianoacrilato en varices gástricas y el impacto en la supervivencia de los pacientes.
Material y métodosSe realizó el análisis retrospectivo de los expedientes de pacientes con varices gástricas en programa de aplicación de cianoacrilato de enero del 2005 a mayo de 2013, en la Unidad de Endoscopia del Servicio de Gastroenterología del Hospital General de México; se investigó prospectivamente la sobrevida de los pacientes del programa.
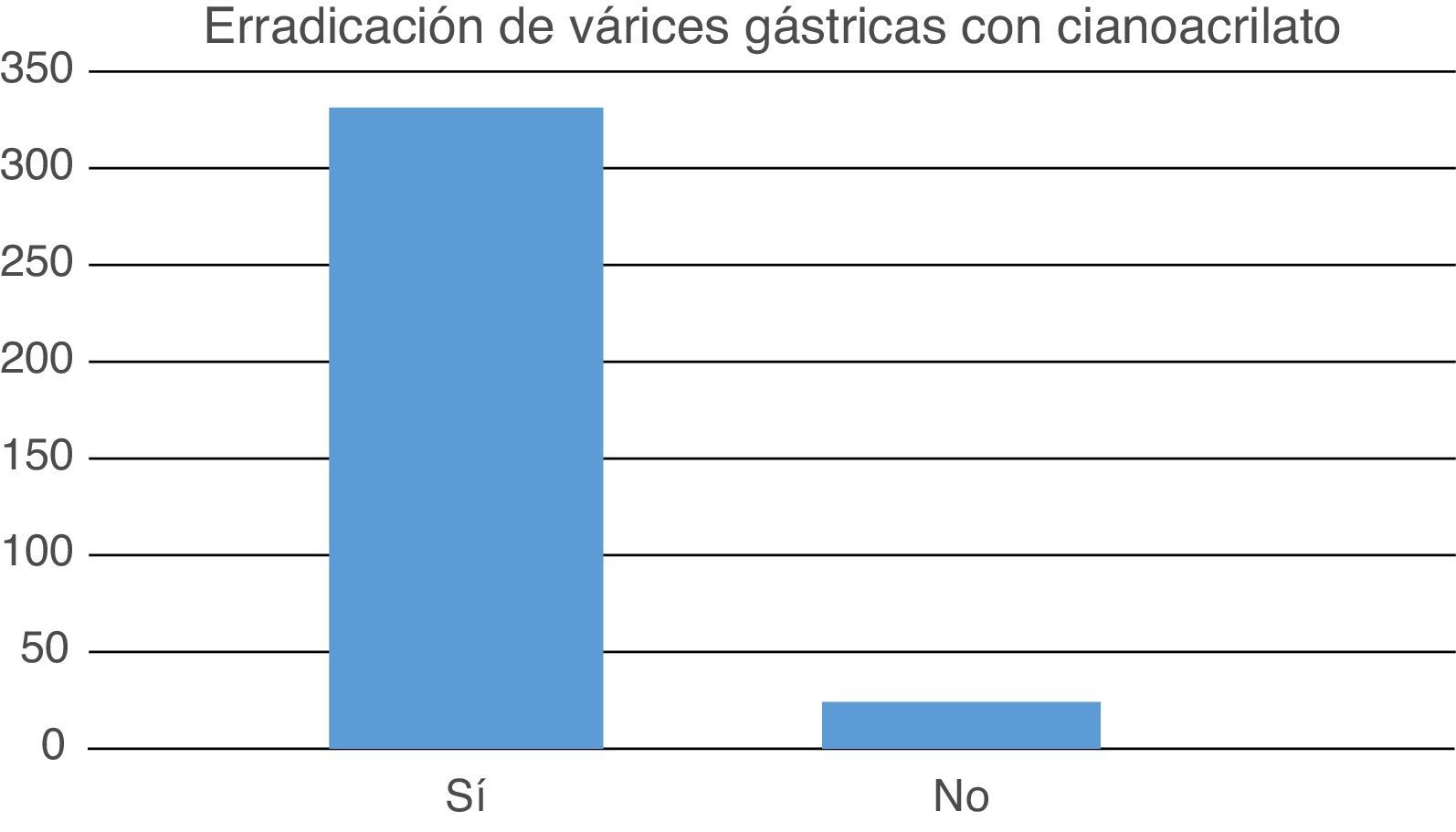
ResultadosSe incluyeron 333 pacientes, 185 (55.6%) fueron hombres. El promedio de edad fue 53.44±14.9 años. La etiología de la cirrosis hepática fue etílica en 155 pacientes (46.5%), hepatitis viral en 82 (24.6%) y no determinada en 96 (28.8%). El grado de Child-Pugh fue A en 66 (19.81%) pacientes, B en 126 (37.83%) y C en 141 (42.34%). El promedio de aplicaciones de cianoacrilato fue de 1.83±0.574 con un promedio de la cantidad de ampolletas de 2.07±0.703. Las complicaciones observadas incluyeron un caso de trombosis de la vena esplénica (0.3%) y un caso de pleuritis (0.3%) ambas remitieron con tratamiento médico. Se logró erradicación variceal en 309 casos (92.8%). La supervivencia de los pacientes fue alta, encontrando 281 pacientes vivos (84.4%). Veintiocho pacientes fallecieron (8.4%) Las causas de defunción documentada en 21 (6.3%) casos fue por insuficiencia hepática y otras causas infecciosas (peritonitis bacteriana, neumonía) en 7 casos (2.1%). No se registró ningún caso de hemorragia digestiva como causa de muerte. No se encontró mortalidad asociada a la aplicación del cianoacrilato.
ConclusionesLa aplicación de cianoacrilato en varices gástricas es un procedimiento seguro y efectivo con alta tasa de erradicación variceal. La tasa de complicaciones y mortalidad asociada es baja.
Variceal bleeding causes 10%-30% of upper gastrointestinal bleeding cases and gastric varices develop in 10%-30% of patients with portal hypertension. Although gastric varices bleed less frequently than oesophageal varices, when this occurs, it is associated with a 45% mortality rate. Obstructive methods using with tissue adhesives are the treatment of choice for gastric varices.
ObjectivesTo determine the efficacy and safety of cyanoacrylate injection in gastric varices and its impact on survival.
Material and MethodsThis was a retrospective analysis of patients with gastric varices treated with cyanoacrylate injection between January 2005 and May 2013 at the Endoscopy Unit of Hospital General de Mexico.
ResultsA total of 333 patients were included, with male predominance (55%) and a mean age of 53.44±14.9 years. Alcohol was the most common cause of cirrhosis (46.5%), followed by chronic viral hepatitis (24.6%) and cryptogenic (28.8%). The Child-Pugh grade was A in 66 patients (19.81%), B in 126 (37.83%) and C in 141 (42.34%). The mean cyanoacrylate sessions until eradication were 1.83±0.574, with a mean 2.07±0.703 cyanoacrylate doses per session. Complications observed included splenic vein thrombosis (0.3%) and pleuritis (0.3%). Both were managed conservatively. Variceal eradication was achieved in 309 patients (92.8%). The survival rate was high, with 281 patients remaining alive (84.4%). Causes of death were associated to liver failure (6.3%) and infections (2.1%). No cases of mortality associated to bleeding were recorded.
ConclusionsInjection of cyanoacrylate in gastric varices is a safe and effective procedure with a high eradication rate and a low complication/mortality rate.
Las varices esofágicas son venas colaterales tortuosas y dilatadas, entre la vena gástrica izquierda y la ácigos, que se desarrollan debido a la congestión venosa por obstrucción del sistema portal, pueden presentarse a cualquier nivel del esófago, fundamentalmente en la submucosa del tercio distal y del estómago proximal. En el 90% de los pacientes su rotura se produce en la región cardial, debido a que a este nivel son subepiteliales, haciéndose submucosas a partir de los 3-4cm de la unión gastroesofágica. La presión aumentada dentro de vasos sanguíneos conduce a dilatación, con adelgazamiento de la pared. El riesgo de ruptura existe cuando la presión portal es superior de 10-12mm Hg. Los vasos rodeados de tejido tienen mejor apoyo y radio más pequeño a la misma presión, resultando la tensión de la pared más baja que en vasos similares superficiales. Las varices grandes al presentar protrusión hacia la luz del esófago y carecer de apoyo con tejido tienen más riesgo de ruptura y hemorragia. La cirrosis hepática es frecuente en México, siendo la cuarta causa de muerte general; las etiologías predominantes son ingesta crónica de etanol y hepatitis crónicas por virus B y C1.
El manejo es primario si no ha ocurrido hemorragia o secundario si hay antecedente de la misma. El tratamiento es farmacológico, endoscópico, radiológico-intervencionista, quirúrgico o una combinación de estas2–10. El sangrado variceal representa 10-30% de todos los casos de sangrado gastrointestinal alto. Las varices gástricas están presentes en cerca del 10-30% de los pacientes con hipertensión portal. El riesgo de sangrado de las mismas es de 50-80%, con una mortalidad cercana al 45%. Si bien sangran menos frecuentemente que las esofágicas, cuando lo hacen su severidad es mayor y el control más dificultoso. Algunas series de casos han mostrado más de 90% de tasa de hemostasia, tasas de obliteración variceal 70-90% y tasa de resangrado menos de 30%6. De los métodos disponibles para su tratamiento, las terapias de obturación constituyen la opción de primera línea para las varices del fundus gástrico (GOV 2 e IGV 1). Dicho procedimiento fue descripto por primera vez por Nib Soehendra en 1986, en Alemania, y a partir de entonces se ha utilizado como método endoscópico de primera elección para el tratamiento de las varices gástricas en varios países del mundo11–21. El presente trabajo tuvo como objetivo determinar la eficacia de este procedimiento y el impacto en la supervivencia de los pacientes.
Material y métodosSe realizó un estudio retrospectivo de pacientes con varices gástricas secundarias a cirrosis hepática con criterios para aplicación de cianoacrilato. Se estudiaron pacientes de la clínica del hígado del Servicio de Gastroenterología del Hospital General de México O.D., en un periodo de enero 2005 a mayo del 2013.
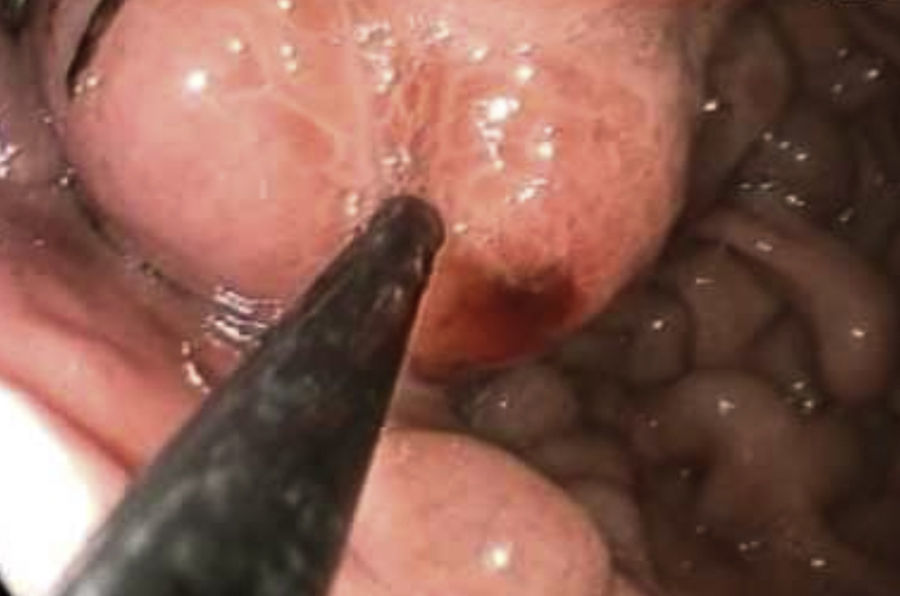
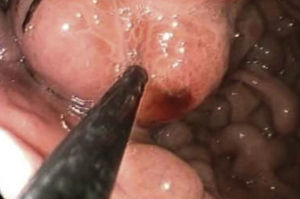
Los criterios de inclusión fueron: a) con cirrosis hepática por alcohol o por hepatitis viral demostrado por biopsia hepática, o por impresión clínica más hallazgos de laboratorio y ultrasonido hepático, b) sexo indistinto, c) mayor de edad, d) cualquier grado de Child-Pugh, e) diagnóstico endoscópico de varices gástricas GOV 1, GOV 2, IGV 1, f) indicación clínica y endoscópica para iniciar tratamiento endoscópico de inyección de cianocrilato. Se excluyeron pacientes con tratamiento radiológico previo (embolización, TIPS), negativa del paciente a recibir tratamiento, obstrucción de vena cava superior en su porción infraácigos, obstrucción y trombosis de vena cava inferior, embarazo, trombosis de la vena hepática. Se recolectaron datos demográficos así como tipo de varices gástricas, número ampolletas aplicadas, número de sesiones necesarias para erradicación, etiología de hepatopatía y complicaciones del procedimiento. Previo a la endoscopía se tomaron los signos vitales del paciente además de su talla y peso; se realizó estudio de endoscopia previa aplicación de lidocoaina spray 30mg en orofaringe y se utilizó videopanendoscopios Olympus 150 o 180. Se realizó la introducción de panendoscopio por boca hasta la segunda porción del duodeno, registrando presencia y grado de varices esofágicas, presencia de signos rojos, de gastropatía hipertensiva, varices gástricas, gastritis varioliforme y se tomó dato de cualquier hallazgo extra. El material utilizado fueron 2 jeringas de 10ml con agua destilada, jeringa de 3ml con 0,8ml de lipiodol+0,5ml de cianoacrilato, aguja de esclerosis de 0.8mm de diámetro/8mm de longitud, gafas de protección ocular. El inyector fue purgado con agua destilada. Una vez identificada la varice gástrica a tratar se inyectaron 2ml de agua destilada dentro de la misma. Si se producía «lifting» submucoso se retiraba la aguja y se buscaba otro sitio. Si no existía «lifting» entonces se introducía la mezcla de lipiodol-cianoacrilato dentro de la varice a tratar. Al término se inyectaban 0.8ml de agua destilada para liberar la mezcla del adhesivo dentro de la varice (fig. 1). Se retiraba el endoscopio junto con el catéter inyector por fuera del canal de trabajo para evitar dañar el equipo. Se verificó la hemostasia y se comprobó induración con toque gentil de la punta del catéter sobre várice gástrica. Al terminar la sesión el paciente ambulatorio se envió a su domicilio. Las citas ulteriores de inyección de cianoacrilato se programaron cada mes hasta erradicar las varices gástricas. Se realizaron llamadas telefónicas para determinar la sobrevivencia de los pacientes.
Análisis estadísticoSe utilizó estadística descriptiva, mediante cálculo de medias y desviaciones estándar para variables cuantitativas; así como frecuencias y porcentajes para variables cualitativas. Se utilizó prueba de Chi cuadrado y se consideró p valor <0.05 como significativo.
ResultadosSe incluyeron 333 pacientes, 185 (55.6%) hombres y 148 (44.4%) mujeres, con un promedio de edad de 53.44±14.9 años. La etiología de la cirrosis hepática fue etílica en 155 pacientes (46.5%), hepatitis viral en 82 (24.6%) y no determinada en 96 (28.8%). El grado de Child-Pugh fue A en 66 (19.81%) pacientes, B en 126 (37.83%) y C en 141 (42.34%).
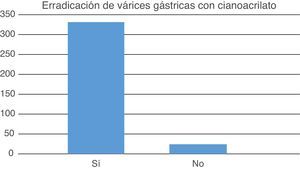
El promedio de aplicaciones de cianoacrilato fue de 1.83±0.574, el promedio de la cantidad de ampolletas del cianoacrilato fue de 2.07±0.703. Las complicaciones observadas incluyeron un caso de trombosis de la vena esplénica (0.3%) y un caso de pleuritis (0.3%) ambas remitieron con tratamiento médico. Se logró erradicación variceal en 309 casos (92.8%) (fig. 2). En el análisis se intentó relacionar el éxito de la erradicación variceal con la etiología de la hepatopatía, el tipo de varices gástricas y el grado de Child-Pugh, en cada caso la prueba de Chi cuadrado resultó no significativa lo que se atribuyó a las altas tasas de erradicación observadas.
Finalmente se realizaron llamadas telefónicas para determinar la sobrevivencia de los pacientes encontrando 281 pacientes vivos (84.4%), fallecieron 28 (8.4%) y no fue posible determinarlo en 24 casos (7.2%). Como causas de defunción se documentaron 21 (6.3%) casos por insuficiencia hepática y otras causas como peritonitis bacteriana y neumonía en 7 casos (2.1%); no se registró ningún caso de hemorragia digestiva como causa de muerte. Tampoco se encontró mortalidad asociada a la aplicación del cianoacrilato.
DiscusiónLa inyección endoscópica de cianoacrilato en varices fúndicas sangrantes fue reportada por primera vez en 1986 por Soehendra et al.10. Este gel tisular se polimeriza en contacto con la sangre, solidificándose dentro de la varice instantáneamente, obliterándola y previniendo o deteniendo así el sangrado. El molde del gel caerá espontáneamente entre semanas y meses después. Debido a su excelente eficacia, el cianoacrilato es considerado el tratamiento de primera línea del sangrado por varices fúndicas en muchos países del mundo.
Dos estudios controlados mostraron que la inyección de cianoacrilato es superior a otros 2 métodos de esclerosis propuestos, como la inyección de alcohol y de oleato de etanolamina11,12. Otro estudio mostró superioridad del N-Butyl-2-cianoacrilato sobre la ligadura con bandas en el tratamiento de varices fúndicas sangrantes13. La hemostasia primaria fue mayor al 90% de los casos con cianoacrilato, en comparación con el 62% para el alcohol, 57% para el oleato de etanolamina y del 40% para la ligadura con bandas elásticas. Existe un gran número de series de casos que demuestran que el tratamiento con cianoacrilato controla exitosamente el sangrado en más del 90% de los casos.
A pesar de la amplia diseminación de este procedimiento en el tratamiento de varices fúndicas sangrantes y los excelentes resultados obtenidos, existen diferencias en la literatura concernientes a la técnica, seguridad y resultados a largo plazo. En un estudio multicéntrico llevado a cabo en centros de Hamburgo, Alemania, El Cairo y en otras ciudades de Egipto, se evaluaron los resultados obtenidos en el tratamiento de varices fúndicas sangrantes con N-Butyl-2- cianoacrilato, siguiendo una técnica estandarizada, obteniendo muy buenos resultados en cuanto a hemostasia, resangrado, erradicación, perfil de seguridad y daño del instrumental14–21.
En nuestro servicio se realiza este procedimiento siguiendo la técnica mencionada, con buenos resultados. Aunque no existe consenso, la indicación sigue siendo el tratamiento de varices gástricas de techo con sangrado activo o previo (profilaxis secundaria). Respecto a nuestros resultados, tuvimos una tasa de hemostasia definitiva comparable con la propuesta en la literatura, un perfil de seguridad aceptable. Dentro de las limitaciones del trabajo esta su naturaleza retrospectiva, y la falta de un seguimiento estandarizado de los pacientes, lo que motivó a la perdida de algunos, o falta de datos en otros.
ConclusionesEn nuestra experiencia el tratamiento de varices gástricas fúndicas con inyección de cianoacrilato constituye una opción efectiva y segura. El estudio sugiere un impacto positivo en la supervivencia de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes. Por favor, añadir una remark para que los autores confirmen las responabilidades éticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.