Hemorragia de tubo digestivo alto. Terapias de hemostasia estándar
Ángel Mario Zárate-Guzmán
Gastroenterólogo Endoscopista, Jefe de la Unidad de Endoscopia, Hospital General de México "Dr. Eduardo Liceaga", México D.F., México
Correspondencia:
Tuxpan N° 29, 5º piso, Consultorio 503, Colonia Roma Sur, Delegación Cuauhtémoc, C.P. 06760, México D.F., México.
Teléfono: 5264 1376.
Correo electrónico:zaguz98@yahoo.com
Resumen
La hemorragia de tubo digestivo alto condiciona un estado de emergencia en los pacientes, hay 110/100 000 hospitalizaciones por año y con una mortalidad de hasta el 25% de los pacientes con alto riesgo, el presente artículo es una revisión de los últimos dos años.
Palabras clave: Hemorragia gastrointestinal, terapéutica, escalas, México.
Abstract
The upper gastrointestinal bleeding conditions a state of emergency in patients, there are 110/100 000 hospitalizations per year, with a mortality of up to 25% of patients at high risk, this article is a review of the last two years in management for this patients.
Keywords: Gastrointestinal bleeding, therapeutic, scores, Mexico.
Hemorragia (terapias de hemostasia estándar) DDW 2013
La hemorragia de tubo digestivo (HTD) sigue siendo una causa frecuente de hospitalización, con prevalencias que van desde 90-108 casos/100 000 habitantes por año en la última década, esto significa un decremento en la presentación de la hemorragia en los países occidentales, debido tal vez a la disminución en la incidencia de infección por Helicobacter pylori (H. pylori) y haber adoptado medidas de gastroprotección en pacientes con ingesta de antiinflamatorios no esteroides (AINE) y aspirina (ASA),1 es así que Hakura y colaboradores reportan en una población de Japón, decremento en la prevalencia de H. pylori, un incremento importante en el consumo de AINE y ASA a bajas dosis como protección de enfermedades cardiovasculares y la misma prevalencia en aquellos pacientes con ingesta de ASA relacionados con úlcera péptica hemorrágica.2 Hreinsson y colaboradores informan en un estudio reciente, en el que se incluyeron todas las gastroscopías de un hospital de enseñanza en una población de 150 000 habitantes en un periodo de dos años, la relación entre HTD con la ingesta de AINE, ASA y anticoagulantes, encontraron que la incidencia de HTD es de 4-16 veces mayor en consumidores de ASA a bajas dosis y warfarina contra la población general. En este estudio, el 24% de los pacientes requirió terapia endoscópica.3
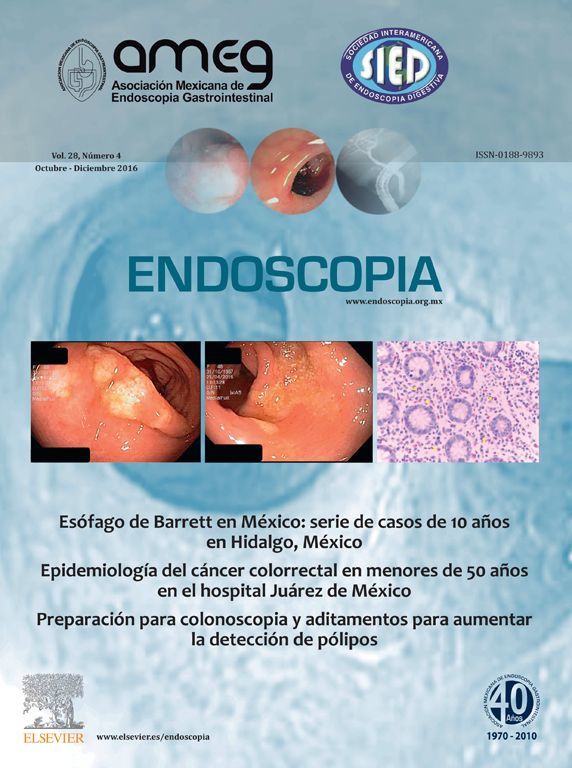
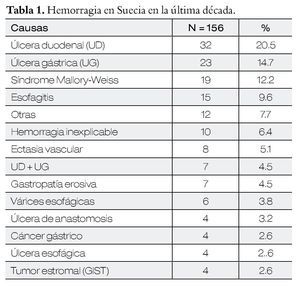
La mortalidad varía entre el 3% a 14% de los pacientes en los primeros 30 días como causa directa, las principales causas de hemorragia en la última década en Suecia se muestran en la Tabla 1.1
Las tasas de recurrencia de hemorragia ocurren del 10% a 15% después de un tratamiento adecuado y la mortalidad en estos casos alcanza hasta 25% de los pacientes.
Marmo y colaboradores reportan en un meta-análisis que no hay diferencia en la mortalidad entre causas no ulcerosas y por úlcera.4 Igualmente, el mismo grupo reporta en otro meta-análisis en pacientes italianos con cirrosis hepática y HTD por úlcera duodenal, gástrica o erosiones, así como lesiones vasculares, que el pronóstico de mortalidad es cercano al 95%.5
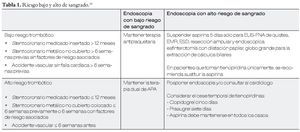
Hay tres consensos recientes, uno del 2010 del American College of Internal Medicine y dos del 2012, la guía clínica de la American Society for Gastrointestinal Endoscopy y la del American College of Gastroenterologists en la Tabla 2 están condensadas las recomendaciones de la primera.5-7
La primera acción deberá ser la adecuada selección de aquellos pacientes, que requieran de una intervención urgente de los que sólo ameritan observación. Los principales factores de mal pronóstico son el antecedente de cirrosis hepática y hematemesis, hipotensión, taquicardia y hemoglobina menor a 8 g/dL.
Es por esto que se han valorado escalas de medición como la Blatchford, Blatchord/Glasgow (modificada) y Rockall para identificar qué paciente requiere de intervención endoscópica, además de predecir la mortalidad.
La escala de Blatchford modificada ha demostrado en diversos estudios que correlaciona mejor que la de Rockall para aquellos pacientes con riesgo bajo, y que requieren de manejo clínico.8,9
La de Blatchford y Rockall determinan quien requiere manejo endoscópico de urgencia,10 y en algunas patologías como en el síndrome de Mallory-Weiss pueden no tener utilidad.11
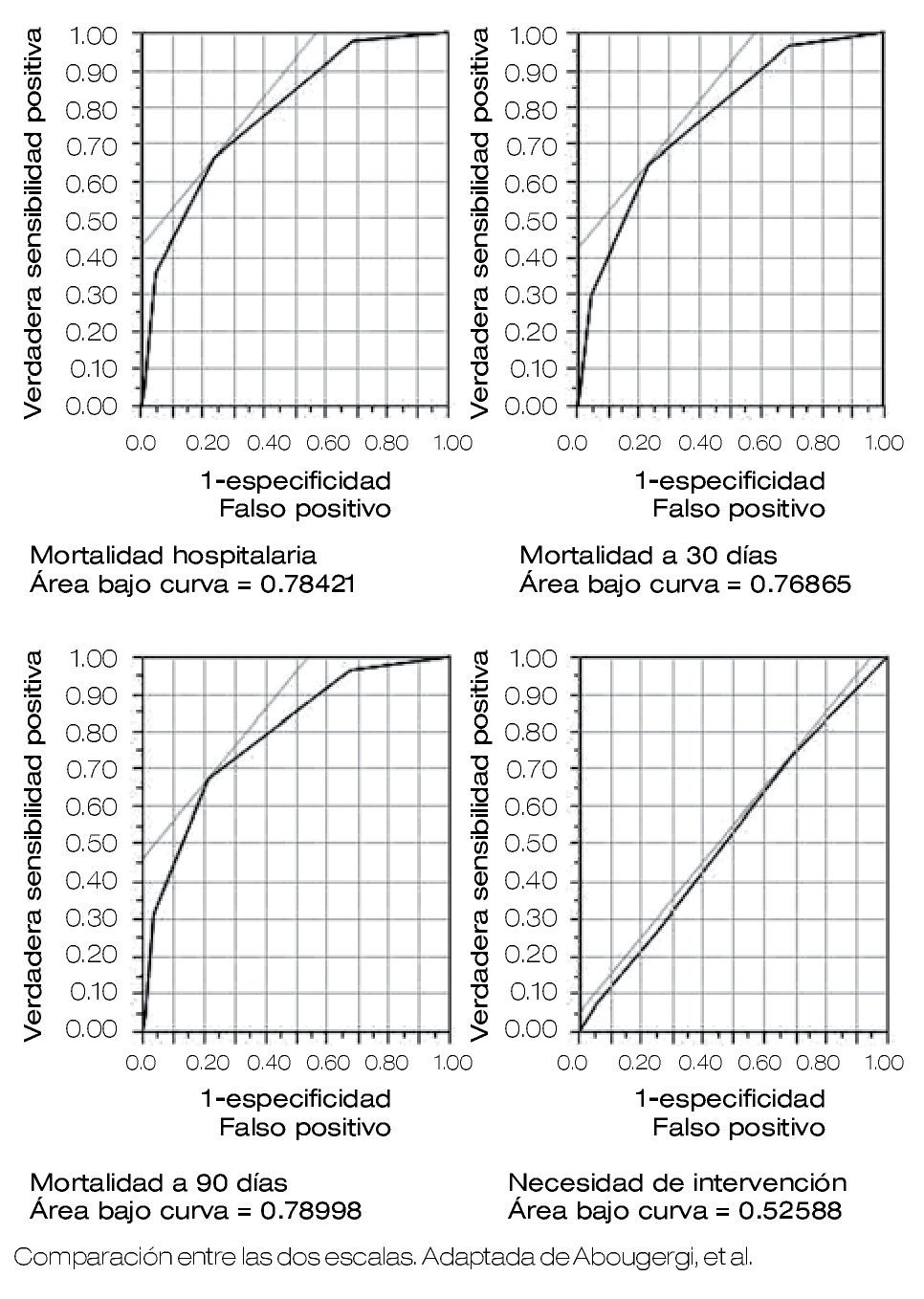
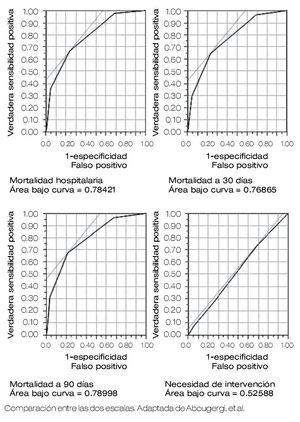
En el 2011 se publicó una nueva escala AIMS65 que predice con mayor exactitud la mortalidad, ésta evalúa cinco parámetros: 1) A albúmina sérica < 3.0 g/dL, 2) I INR ≤ a 1.5, 3) M alteración del estado mental, 4) S hipotensión con presión sistólica < 90 mmHg, 5) > de 65 años.12 Chandra y colaboradores investigan si la escala es útil para predecir la mortalidad y necesidad de intervención temprana, concluyen en una muestra de 18 pacientes que la escala determina un pronóstico de mortalidad exacta, pero no permite estimar la necesidad de intervención en forma aguda con el paciente internado.13 Abougergi y colaboradores presentan un estudio prospectivo multicéntrico en que comparan las escalas AIMS65 con la Glasgow-Blatchford, para predecir complicaciones en pacientes con HTD. Concluyen que el AIMS65 es superior a la escala de Glasgow-Blatchford para predecir mortalidad hospitalaria, pero ambas escalas son equivalentes para evaluar la mortalidad a los 30 días, para predecir complicaciones como recurrencia de hemorragia o la necesidad de intervención endoscópica14 (Figura 1). Kawaguchi y colaboradores validan el AIMS6 en Japón, en un estudio retrospectivo que valora 387 pacientes con HTD,15 y concluyen que es una escala útil para catalogar a pacientes con HTD de bajo y alto riesgo. Los pacientes con riesgo alto deben de ser manejados en forma acuciosa.7
Figura 1. AIMS65 vs. escala de Blatchford.
Una vez que se han identificado a los pacientes con riesgo alto de hemorragia se deberá de iniciar manejo intensivo con reposición de volumen, inicio de inhibidor de bomba de protones, procinéticos y lavado gástrico.
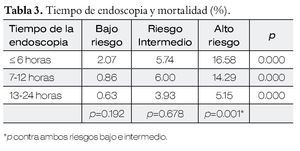
Tiempo de la endoscopia
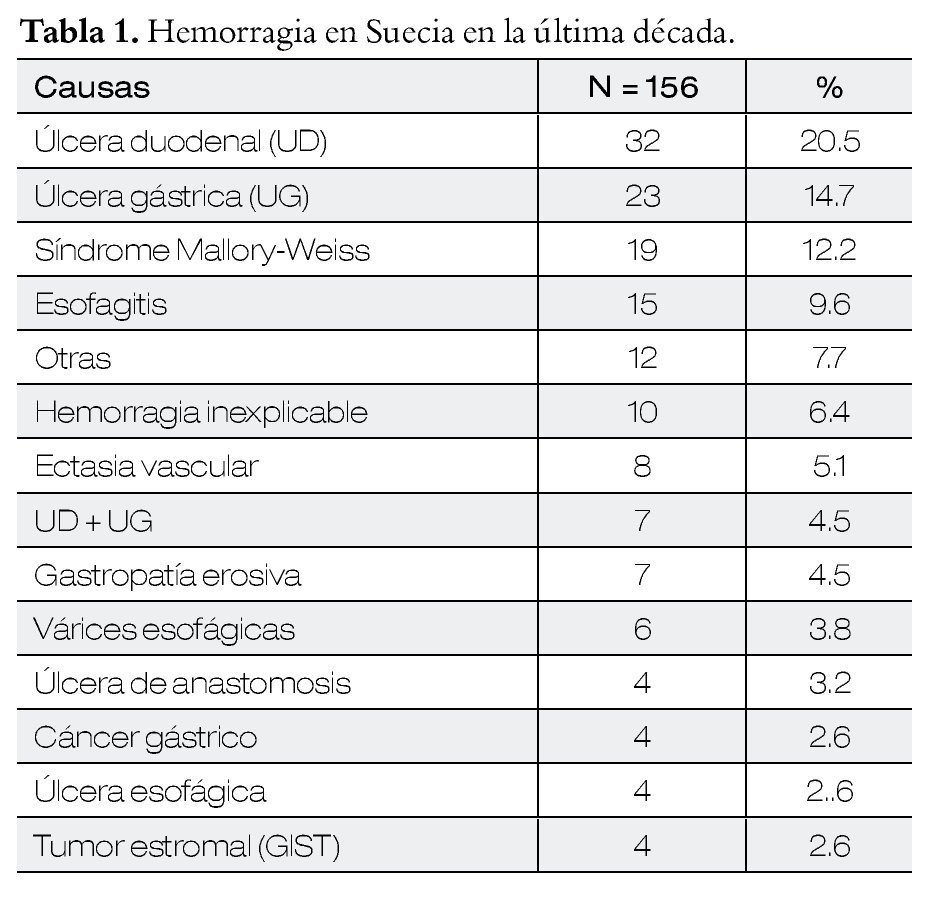
Se considera como endoscopia de emergencia antes de las seis horas y endoscopia temprana entre las 7-24 horas. La endoscopia dentro de las primeras 24 horas ha demostrado eficacia en disminuir costo y duración de los internamientos, y dentro de las primeras 12 horas disminución en la mortalidad. Pero existen ciertas condiciones que pueden empeorar las endoscopias tempranas como: a) la endoscopia en una persona con reanimación inadecuada, b) endoscopia realizada sin ayudantes ni técnicos, c) el procedimiento en horarios inusuales pueden cursar con fatiga del endoscopista y disminuir la calidad en la misma, d) además en algunos horarios no contar con servicios de apoyo como radiología intervencionista y cirugía (Tabla 3). Las endoscopias en los fines de semana se asocian a mayor recidiva de hemorragia y aumento de la mortalidad.16,17
Uso de lavado con sonda nasogástrica y procinéticos
La adecuada visualización de la mucosa en pacientes con HTD es fundamental para determinar la etiología, disminuir el tiempo endoscópico y facilitar las acciones terapéuticas. El uso de sonda nasogástrica no es rutinario, nos sirve para confirmar la presencia de sangre, pero su ausencia no excluye el diagnóstico de HTD.6,7,14 El uso de azitromicina IV ha demostrado ser seguro y equiparable al uso de la eritromicina IV,18 en nuestro país tenemos acceso a esta presentación. Los procinéticos no deben de utilizarse de forma rutinaria.
Hemotransfusión
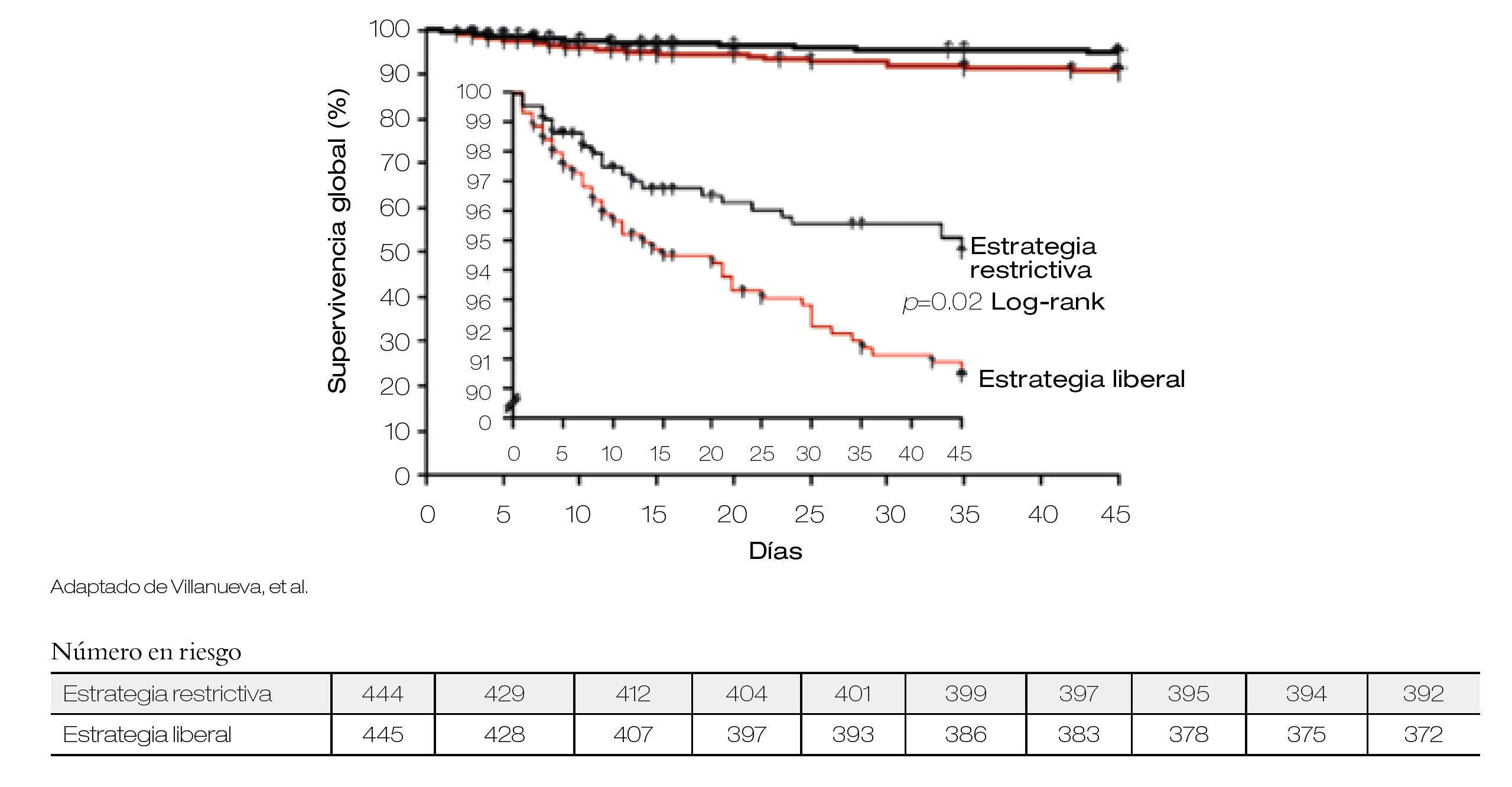
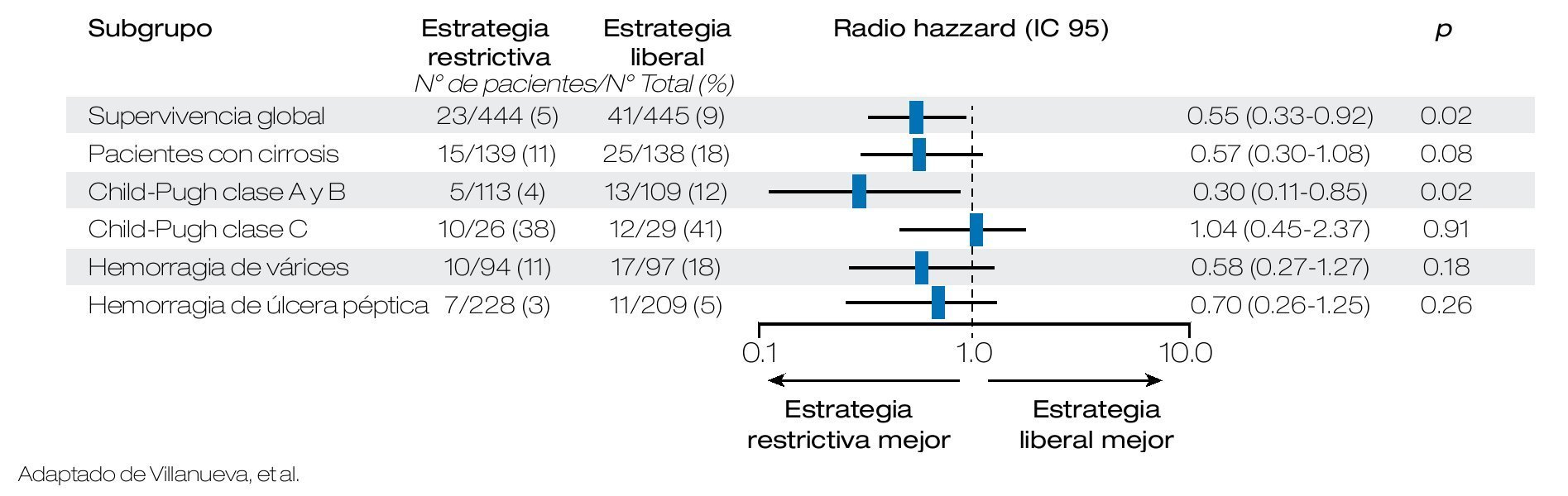
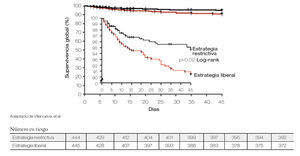
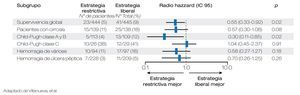
El uso de hemoderivados en los pacientes con HTD es controversial, Villanueva y colaboradores publicaron un estudio en 921 pacientes que fueron aleatorizados en dos grupos con diferente estrategia transfusional. La aleatorización se estratificó de acuerdo a la presencia o no de cirrosis. Al primer grupo se le asignó terapia transfusional restrictiva definida como transfusión con cifras de Hb de < 7 g/dL y la estrategia liberal en la que se transfundía con cifras de Hb < 9 g/dL. Se compararon ambos grupos con respecto a la mortalidad, riesgo de recurrencia de hemorragia, eventos adversos y necesidad de tratamiento de rescate, encontrando que en los pacientes manejados con terapia restrictiva, se presentaban estos desenlaces con menor frecuencia siendo la diferencia significativa, independientemente de la presencia de cirrosis o no. En base a estos hallazgos es pertinente la realización de más estudios en nuestro medio, que valorar el riesgo-beneficio de la terapia transfusional (Figuras 2 y 3).19
Figura 2. Tiempo de supervivencia acorde a transfusión de hemoderivados.
Figura 3. Muerte a las seis semanas de acuerdo a los subgrupos.
Corrección de anticoagulación
Se recomienda corregir los índices de coagulación, el INR no predice el riesgo de recurrencia de sangrado, probablemente esté más ligado a riesgo de mortalidad asociado a comorbilidades. Se deben de corregir estos con la aplicación de vitamina K y plasma fresco congelado.5,20,21
Uso de Inhibidores de bomba de protones(IBP´s)
Las guías actuales recomiendan iniciar el uso de IBP´s, ya que reducen el riesgo del estigma endoscópico, disminuyendo la necesidad de terapia endoscópica.
Endoscopia
Es aceptado que la endoscopia en los pacientes con riesgo elevado y los métodos de tratamiento endoscópico disminuyen los riesgos de recurrencia hemorrágica, los costos y la mortalidad en los pacientes.
Las opciones de tratamiento endoscópico se dividen en terapia de inyección, métodos térmicos y mecánicos. Laine y colaboradores publicaron en el 2009, un meta-análisis muy completo de comparación de todas las técnicas disponibles hasta ese momento.22
Terapia de inyección
En un meta-análisis se demostró que la monoterapia con inyección de adrenalina es menos efectivo en prevenir la recurrencia hemorrágica, que otros métodos endoscópicos solos o con tratamiento combinado de otras sustancias o métodos, es por esto que la monoterapia de inyección de adrenalina con lesión Forrest I y II no es recomendado.5
Terapia térmica
Heater-Probe (HPC), Gold Probe (GPC). Se utiliza corriente bipolar, se recomienda uso de endoscopio terapéutico, ya que las sondas de 10 F tienen mayor efectividad en la coagulación del vaso y requieren conducto de trabajo mayor de 2.8 mm. Utiliza corriente térmica y compresión para hacer el efecto terapéutico, se recomienda energía de 15 W con periodos de 8-10 segundos en pulsos. En un estudio comparativo entre HPC y pinza de coagulación monopolar, esta última presentó mejores resultados.23
La terapia combinada de inyección de adrenalina y Gold Probe en algunos artículos mejora los resultados, disminuye la recurrencia de hemorragia, disminuye las hemotransfusiones y la mortalidad asociada.
Terapia con argón plasma (APC)
No es una terapia de contacto, la quemadura es superficial por lo que su mayor utilidad es en angiectasias vasculares, sin embargo se ha utilizado junto con inyección de adrenalina en el manejo de úlceras pépticas, en un estudio comparativo con 185 pacientes no hubo diferencias en la hemostasia inicial, la recurrencia, días de estancia hospitalaria, cirugía, hemotransfusiones y mortalidad comparada con HPC + inyección.
Terapia mecánica: endoclips
Hay varias marcas y tipos de clips, por lo menos deberán de conocerse dos tipos de clips y el personal auxiliar de enfermería o técnicos deben de estar familiarizados con el uso de los mismos, la hemostasia inicial se puede lograr hasta con varios clips y dependiendo del sitio como en curvatura menor y cara posterior de duodeno dificultar las maniobras de colocación de los mismos, otra desventaja es que algunos modelos de clips, no cierran por completo dejando una zona hueca donde se necesita compresión intensa. No existen estudios comparativos entre los clips, está por publicarse un estudio de costo-beneficio entre el uso profiláctico del clip en polipectomía endoscópica o no.23 En dos estudios tiene menos recidiva el manejo de termocoagulación con pinza fórceps que con los clips.24-26 La ligadura es la terapia recomendada en las várices esofágicas, pero también se han utilizado para lesiones como úlcera de Dieulofoy´s e inclusive hemorragia diverticular.27,28
Las complicaciones son más frecuentes entre los pacientes que reciben terapia endoscópica que entre los que no, la hemorragia inducida y la perforación son más frecuentes entre los pacientes tratados. Deberá de removerse de ser posible el coágulo adherente para no dejar sin tratamiento lesiones con estigma de riesgo.
Algunas recomendaciones con falla en el tratamiento: 1) Repetir la endoscopia. 2) La angiografía puede ser considerada después de ser aplicados los máximos tratamientos endoscópicos por expertos. 3) Usar moderada sedación o intubación del paciente. 4) Considerar referir al paciente a un tercer nivel. 5) Infusión de IBP posterior a la hemostasis por 72 horas. 6) Se deberá de estar familiarizado con todas las técnicas de hemostasia endoscópica. Se puede utilizar sondas de ultrasonido Doppler para rastrear las bases de las úlceras y mejorar el rendimiento de riesgo y tratamiento adecuado de las lesiones no ulcerosas y con aplicación a las várices gástricas.
El manejo de un paciente con HTD deberá de ser multidisciplinario, valorando el riesgo individual, ofreciendo el mejor tratamiento, esto garantiza el mejor resultado.
Referencias
1. Hreinsson J, Kalaitzakiz E, Gudmundsson S, et al. Upper gastrointestinal bleeding: incidence, etiology and outcomes in a population-based setting. Scand J of Gastroenterol 2013;48:439-447.
2. Fujinami H, Kudo T, Hosokawsa A, et al. A study of the changes in the cause of peptic ulcer bleeding. World J Gastrointest Endosc 2012;4(7):323-327.
3. Hreinsson J, Kalaiyzakis E, Gudmundsson S. Acute Upper Gastrointestinal Bleeding in a population-Based Setting: Incidence,Role of Drugs and Outcome. Su 1906 DDW 2013.
4. Marmo R, Del Plano M, Rotondano G, et al. Mortality from non ulcer bleeding is similar to that of ulcer bleeding in high-risk patrients whit non variceal hemorrhage: a prospective database study in Italy. Gastrointest Endosc 2012;75:263-272.
5. Marmo R, Del Plano M, Cipolleta L, et al. Mortality From non Variceal Upper Gastrointestinal Bleeding in Patients With Liver Cirrhosis: an Individual Patient Meta-Analysis. 1039 DDW 2013.
6. Barkun A, Bardou M, Kuipers EJ, et al. International Consensus Recommendations on the Management of Patients With Nonvariceal Upper Gastrointestinal Bleeding for the International Consensus Upper Gastrointestinal Bleeding Conference Group. Ann Intern Med 2010;152:101-113.
7. Laine L, Jensen D. Management of Patients With Ulcer Bleeding Am J of Gastroenterol 2012;107:345-360.
8. The role of endoscopy in the management of acute non-variceal upper GI bleeding GIE 2012;7(5):1132-1138.
9. Guerra I, Bermejo A, Franco A, et al. Clinical Utility of Glasgow Blatchford Score in Acute Upper Non Variceal Gastrointestinal Bleeding As a Predictor of Low Risk for the need of Clinical Intervention. Sa 1605 DDW 2013.
10. Chan H, Goh Y, Ong H, et al. Predicting Acute Non-Variceal Upper Gastrointestinal Bleeding-Wich System Triages Best? Sa 1606 DDW 2013.
11. Meltzer AC, Burnett S, Pinchbeck C, et al. Pre-Endoscopic Rockall and Blatchford Scores to Identify Wich Emergency Department Patients With Suspected Gastrointestinal Bleed Do Not Need Endoscopic Hemostasis: J Emerg Med 2013:01;736-742.
12. Banerjee S, Bellamkonda S, Gumaste VV. The Blatchford score is an useful index in the management of mallory-Weiss tear and gastrointestinal bleeding experience froma an urban community hospital. Acta gastroenterol Belg 2012;75(4):432-437.
13. Saltzman J, Tabak Ying, Hyett B, et al. A simple risk score accurately predicts in-hospital mortality, length of stay, and cost in accute upper GI bleeding. Gastrointest Endosco 2011;74(6):1215-1224.
14. Subhash Ch, Sangita Y, Ramcet T, et al. Accuracy of AIMS65 Score in Predicting Need-for-Intervention and Short-Term Mortality in Acute Upper Gastrointestinal Bleeding. Su 1911 DDW2013.
15. Kawaguchi K, Yashima K, Takeda Y, et al. Validation of the Risk Scoring System AIMS65 for Patients With Acute NonvaricealUpper Gastrointestinal Bleeding in Japan Su 1920 DDW2013.
16. Shaheen A, Gilaad A. Weekend versus Weekday Admission and Mortality Fron Gastrointestinal Hemorrhage Caused by Peptic Ulcer Disease. Clinic Gastroenterol Hepatol 2009;7:303-310.
17. Anantharkrishnan A, Mcginley E, Saeian K. Outcomes of Weekend Admissions for Upper Gastrointestinal Hemorrhage: A Nationwide Analysis Clinic Gastroenterol and Hepatol 2009;7:296-302.
18. Greenspoon J, Barkun A, Bardou M, et al. Management of Patients With Nonvariceal Upper Gastrointestinal Bleeding. Clin Gastroenterol and Hepatol 2012;10:234-239.
19. Pilla T, Jabeen S, Devanna, et al. Azytromycin Intravenoius Bolus Improves the Quality of Visualitazion of EGD in Acute Upper Gastrointestinal Bleeding- a retrospective study. Tu 1273 DDW 2013.
20. Villanueva C, Colomo A, Bosch, et al. Transfusion Strategies for Acute Upper Gastrointestinal Bleeding. N Engl J of Medicine 2013;368(1):11-21.
21. Shingina A. Systematic review: the presenting international randomised ratio (INR) as a predictor of outcome in patients with upper nonvariceal gastrointestinal bleeding Aliment Pharmacol Ther 2011;33(9):1010-1018.
22. Laine L, McQuaid R. Endoscopic Therapy for Bleeding Ulcers: An Evidence Based Approach Based on Meta-Analyses of Randomized Controlled Trials. Clinic Gastroenterol and Hepatol 2009;7:33-47.
23. Noriko O, Ryuta T, Tomokazu N, et al. A Prospective Randomized Trial of Soft Coagulation Versus Heater Probe Thermocoagulation for Peptic Ulcer Bleeding DDW 2013 Su 1923.
24. Lee JH, Kim BK, Seol DC, et al. Rescue Endoscopic Bleeding Control for Nonvariceal Upper Gastrointestinal Hemorrhage usin clippin an techable snaring.
25. Kataoka M, Kawai T, Hayama Y, et al Comparision of hemostasis using bipolar hemostasic forceps with hemostasis by endoscopic hemoclipping forn nonvariceal upper gastrointestinal bleeding in a prospective non randomized trial. Surg Endosc 2013;7.
26. Parikh N, Zanocco K, Keswani R, et al. A Cost-Efficacy Decision Analysis of Prophylactic Clip Placement After Endoscopic Removal of Large Polyps Clinical Gastroenterol and Hepatol 2013 Articule in Press.
27. Dong A, Sang L, Young P, et al. Hemostatic eff icacy and clinical outcome of endoscopic treatment of Dieulafoy´s lesion: comparision of endoscopic hemoclip placement an endoscopic band ligation. Gastrointest Endosc 2012;75:32-38.
28. Ishii N, Setoyama T, Deshpande G, et al Endoscopic band ligation for colonic diverticular hemorrhage. Gastrointest Endosc 2012;75:382-287.
Nuevas técnicas endoscópicas de hemostasia
Ángel Andrés Reyes-Dorantes
Subdirector médico, Hospital del Estado Mayor Presidencial, México D.F., México
Correspondencia:
Apartado Postal 35-594, Adm. de Correos N° 35, C.P. 11642, México D.F., México.
Celular: (+52) 555438 0496.
Correo electrónico:angelreyesd@hotmail.com
Resumen
Las técnicas convencionales de hemostasia endoscópica como inyección, métodos térmicos, clips y ligaduras permiten al especialista controlar la gran mayoría de los casos de hemorragia gastrointestinal activa. Los casos de sangrado por tumores, después de resecciones endoscópicas de la mucosa, en pacientes bajo terapia antitrombótica o los casos de sangrado recurrente, siguen representando un reto y un área de oportunidad. El presente artículo discute algunos de los nuevos procedimientos de hemostasia de lesiones del tubo digestivo. Se mencionan el uso del hemospray, los clips montados sobre el endoscopio (OTSC) y la hemostasia asistida por ultrasonido endoscópico (USE).
Palabras clave: Endoscopia, hemorragia, sangrado, hemostasia, hemospray, clips, ultrasonido endoscópico, México.
Abstract
Endoscopist are able to stop active GI bleeding in most cases by using conventional hemostatic modalities (injection, ablation, clipping, or banding). Diffuse bleeding from malignancy, after EMR, in patients under antitrombotic therapy or cases of rebleeding remaing challenging. This review article discuss new modalities of endoscopic hemostasis for GI bleeding such as Hemospray, Over-the-scope closure devices (OTSC) and EUS-guided hemostasis.
Keywords: Endoscopy, bleeding, hemostasia, hemospray, hemoclips, EUS-guided, Mexico.
La terapia endoscópica por medio de inyección o por métodos térmicos y mecánicos (clips y ligaduras), se considera el estándar de oro para lograr la hemostasia de lesiones sangrantes del tubo digestivo con una efectividad mayor al 90%, sin embargo, en sitios de difícil acceso, con cierto tipo de lesiones como neoplasias o con sangrados arteriales o en pacientes que están recibiendo terapia anticoagulante, en ocasiones se recurre a la embolización arteriográfica o a la cirugía de urgencia para el control del sangrado agudo o de los episodios de resangrado.1 El presente artículo discute algunas nuevas modalidades de desarrollo reciente de terapia endoscópica.
Hemospray
El hemospray es un polvo (TC-325) desarrollado para uso militar, mezcla de sustancias minerales que al contacto con la sangre absorbe todo el componente líquido llevando a una concentración de factores de la coagulación y plaquetas, dando por resultado un efecto cohesivo y adhesivo, formando un coágulo que detiene la hemorragia. Dicho polvo no se absorbe ni sufre metabolismo y se elimina de manera natural por el tracto digestivo. Su uso clínico ha sido aprobado en Hong Kong, Canadá y varios países europeos. Se rocía con un catéter, empujado por un flujo a chorro de dióxido de carbono. Se aplican pequeños disparos del polvo sobre la lesión hasta que el sangrado se detiene. Su principal ventaja es la de cubrir extensas áreas de sangrado, por lo que es ideal para casos de hemorragia de tumores o posteriores a resecciones endoscópicas de la mucosa o ampulectomías. Es un método de no contacto que no requiere ponerse totalmente enfrente a la lesión, y que es relativamente fácil de aplicar aún por operadores con poca experiencia. Se deben tener precauciones semejantes a las consideradas en la aplicación de coagulación con plasma de argón (APC), para que la punta no entre en contacto con la mucosa, pues puede generar una muy alta presión de CO2 (hasta 55 mmHg) y puede inadvertidamente administrarse grandes volúmenes de gas. Si la punta se moja, el polvo se adhiere y el catéter se puede obstruir y tapar.
En un estudio piloto con 20 pacientes con úlceras pépticas con sangrado activo resumante, la hemostasia con hemospray se logró en 19 de ellos.2 En el paciente que fracasó la hemostasia tenía un sangrado pulsátil en una lesión seudoaneurismal, sugiriendo que el flujo sanguíneo arterial hace un "lavado" del polvo, restándole eficacia. Hubo resangrado en dos pacientes, para un índice de hemostasia total del 85%. En las endoscopias de control a las 72 horas, se encontraron úlceras con bases limpias y sin coágulos.
En una pequeña serie de cinco pacientes con sangrado relacionado a cáncer, se logró hemostasia en todos pero hubo resangrado en un paciente.3 El polvo no induce cicatrización por lo que no sorprende el resangrado, pero se sugiere que puede disminuir las necesidades de transfusión con fines paliativos. Su uso también se ha ensayado en pacientes bajo terapia antitrombótica (aspirinacopidogrel o con anticoagulantes), con una efectividad total en estos casos del 63%.4
Dispositivos de cierre (clips) montados sobre el endoscopio (Over-the-scope OTSC)
Los hemoclips endoscópicos convencionales tienen la limitación de que para ser efectivos deben ser aplicados con mucha precisión sobre el sitio o vaso sangrante, y esto es particularmente complicado en sitios como la pared posterior del bulbo duodenal o sobre la curvatura menor del estómago, que implica un abordaje muy tangencial. También se dificulta su colocación sobre úlceras muy duras y fibróticas. Los clips OTSC tienen un diseño significativamente diferente que permite incluir en la sujeción, una buena porción de tejido circundante al vaso.5
Están fabricados de nitinol con memoria y se asemejan a una trampa para osos. El dispositivo de aplicación es muy similar al de aplicación de ligaduras endoscópicas. El dispositivo viene comercialmente premontado en un capuchón con tamaños de 11, 12 y 14 mm y existe en variedades "romo" y "afilado" y su uso clínico ha sido aprobado por la FDA en los Estados Unidos. El vaso y el tejido circundante se introducen al capuchón por aspiración por vacío o jalando el tejido con una pinza de tracción (retractor). El dispositivo se libera rotando la manivela sobre el segmento del instrumento colocado sobre la entrada del canal de trabajo del endoscopio (una vez más, semejante al dispositivo para aplicar ligaduras para várices esofágicas). Habitualmente, un solo clip es suficiente para lograr la hemostasia por lo que el procedimiento suele ser más rápido que aplicar múltiples hemoclips convencionales. Se requiere menor grado de precisión para incluir el vaso sangrante, pues se captura más tejido y el grado de aposición y compresión es mayor. Su empleo es fácil de aprender y se les facilita a los operadores con experiencia en el uso de ligaduras de várices esofágicas.6 Los inconvenientes potenciales incluyen: que al identificar el sitio de sangrado, el endoscopio debe ser retirado para montar el dispositivo, la limitación de la visión por el capuchón y por la sangre que se puede introducir a él y que la introducción de tejido al capuchón puede dificultarse por el ángulo de aproximación al tejido o en lesiones muy fibróticas.
En las series de casos publicadas hasta la fecha, el éxito en la hemostasia ha sido cercano al 100% para una variedad de lesiones que incluyen úlceras pépticas, desgarros de Mallory-Weiss, lesiones de Dieulafoy, divertículos sangrantes y sangrados posbiopsias o pospolipectomías. En el seguimiento se ha reportado resangrado aproximado en 7% y casos aislados de perforación.7,8 También se han señalado incidentes de desacoplamiento prematuro del dispositivo, pero que no han resultado en lesión.
En la DDW 2013 en Orlando se presentó una serie alemana del uso de 101 OTSC en 84 pacientes, para tratamiento de sangrado y cierre de fístulas. Como terapia hemostática fue efectiva en 38/44 pacientes (86.3%) y se reporta el incidente de haber atrapado el retractor entre las mandíbulas del clip, al cerrarlo prematuramente como un detalle a observar para evitarlo.9 Otra serie de seis pacientes con lesiones de Dieulafoy presentado en el mismo congreso, reportó un éxito del 100% para el control del sangrado en esta alteración, pero con un caso de laceración de la mucosa esofágica por el paso del endoscopio con el dispositivo montado, que ameritó manejo con hemoclips convencionales.10
Hemostasia guiada por ultrasonografía endoscópica
Desde hace varias décadas, los radiólogos intervencionistas han empleado la embolización selectiva de los vasos como una técnica efectiva de hemostasia. El ultrasonido endoscópico (USE) permite la visualización de vasos sanguíneos adyacentes a la pared del tubo digestivo, pero no visibles a la endoscopia de la superficie de la mucosa. Esta visualización, complementada con la exploración con Doppler, permite el acceso directo a estos vasos por medio de las agujas estándar de aspiración (FNA) y emplearlas para la inyección de esclerosantes, cianoacrilato o agentes trombóticos como los "coils". Inicialmente, esta técnica se empleó para várices esofagogástricas,11,12 pero hay algunos casos de tratamiento de sangrado por lesiones de Dieulafoy, úlceras duodenales y tumores estromales.13
Una ventaja de este método es que posibilita la aplicación del agente embolizante directamente dentro del vaso, sin necesidad de la visualización directa de la várice por lo que se puede emplear con seguridad aún en presencia de alimento o sangre retenidos que impidan la vista endoscópica.
Un estudio prospectivo y aleatorizado con 50 pacientes consecutivos con sangrado por várices esofágicas comparando la ligadura de las várices esofágicas contra la escleroterapia guiada por USE, mostró que ésta evidenciaba recurrencia de las várices en menor número y más tardía.14
La aplicación de "coils" seguido de la inyección de cianoacrilato parece disminuir el riesgo de embolismo, pues los "coils" funcionan como un andamiaje para atrapar y retener el cianoacrilato dentro de la vena.15
Referencias
1. Laine L. Endoscopic therapy for bleeding ulcers: room for improvement? Gastrointest Endosc 2003;57:557-560.
2. Sung JJ, Luo D, WU JC, et al. Early clinical experience of the safety and efectiveness of Hemospray in achieving hemostasis in patients with acute peptic ulcer bleeding. Endoscopy 2011;43:291-295.
3. Chen YI, Barkun AN, Soulellis C, et al. Use of the endoscopically applied hemostatic powder TC-325 in cancer-related upper GI hemorrhage: preliminary experience (with video). Gastrointest Endosc 2012;75:1278-1281.
4. Holster IL, Kuipers EJ, Tjwa. Hemospray in the treatment of upper gastrointestinal hemorrhage in patients on antithrombotic therapy. Endoscopy 2013;45:63-66.
5. Kato M, Jung Y, Gromski MA, et al. Prospective, randomized comparison of 3 different hemoclips for the treatment of acute upper GI hemorrhage in an established experimental setting. Gastrointest Endosc 2012;75:3-10.
6. Kirschniak A, Kratt T, Stuker D, et al. A new endoscopic over-the-scope clip for treatment of lesions and bleeding in the GI tract: first clinical experiences . Gastrointest Endosc 2007;66:162-167.
7. Kirschniak A, Subotova N, Zieker D, et al. The Over-The-Scope Clip (OTSC) for the treatment of gastrointestinal bleeding, perforations, and fistulas. Surg Endosc. 2011;25:2901-2905.
8. Albert JG, Friedrich-Rust M, Woeste G, et al. Benefit of a clipping device in use in intestinal bleeding and intestinal leakage. Gastrointest Endosc 2011;74:389-397.
9. Wedi E, Hochberger J. Capability of the Otsc (Over-the-scope-clip) in the endoscopic treatment of gastrointestinal complications. DDW 2013 Sa1443.
10. Kyanam Kabir K, Woodward T, Kratt T. Over the scope clip for therapy of Dieulafoy lesions - a case series. DDW 2013 1044.
11. Lee YT, Chan FK, Ng EK, et al. EUS-guided injection of cyanoacrylate for bleeding gastric varices. Gastrointest Endosc 2000;52:168-174.
12. Romero-Castro R, Pellicer-Bautista FJ. EUS-guided injection in perforating veins in gastric varices: results in 5 cases. Gastrointest Endosc 2007;66:402-407.
13. Levy MJ, Wong Kee Song LM, Farnell MB, et al. Endoscopic ultrasound(EUS)-guided angiotherapy of refractory gastrointestinal bleeding. Am J Gastroenterol 2008;103:352-359.
14. de Paulo GA, Ardengh JC, Nakao FS, et al. Treatment of esophageal varices: a randomized controlled trial comparing endoscopic sclerotherapyand EUS-guided sclerotherapy of esophageal collateral veins. Gastrointest Endosc 2006;63:396-402; quiz 463.
15. Binmoeller KF, Weiler F, Shah JN, et al. EUS-guided transesophageal treatment of gastric fundal varices with combined coiling and cyanoacrylate of gastric fundal varices with combined coiling and cyanoacrylate glue injection. Gastrointest Endosc 2011;74:1019-1025.
Enteroscopia y cápsula en hemorragia de intestino medio
Juan Manuel Blancas-Valencia
Jefe del Servicio de Endoscopia, Hospital de Especialidades CMN Siglo XXI, IMSS, México D.F., México
Correspondencia:
Nicolás San Juan N° 702-207, Colonia Del Valle, Delegación Benito Juárez, C.P. 03100, México D.F., México.
Teléfono oficina: 5627 6900, ext. 21317. Fax: 5574 0535.
Correo electrónico: blancasoropeza@prodigy.net.mx
Resumen
Se exponen los conocimientos actuales y nuevas aportaciones de la cápsula endoscópica y la enteroscopia profunda en la hemorragia gastrointestinal de origen oscuro (HGOO), siendo en la actualidad son métodos complementarios. Se expone brevemente además el número de trabajos presentados en la semana americana de gastroenterología en el pasado mes de mayo en Orlando.
Abstract
Capsule endoscopy (CE) is now widely accepted as a first-line diagnostic modality for obscure gastrointestinal bleeding (OGIB). Also balloon enteroscopy (BE) is accepted like the ideal complement for the treatment of the small bowel diseases and nowadays both are complementary.
Introducción
Esta revisión está basada en el congreso de la Semana Americana de Enfermedades Digestivas (DDW, por sus siglas en inglés), celebrada en la ciudad de Orlando, en la cual se presentaron 5 465 trabajos: 81 correspondieron a cápsula endoscópica (CE) y 55 a enteroscopia asistida con dispositivos (EAD), que son los métodos de diagnóstico y tratamiento de las enfermedades del intestino medio. La más común es la hemorragia gastrointestinal de origen oscuro (HGOO), sobre este tema se presentaron también varias conferencias magistrales. Esta revisión está basada principalmente en la presentación del Dr. Ross,1 que realizó en el curso de posgrado de la Asociación Americana de Endoscopia Gastrointestinal.
Objetivos
1. Describir el uso de las tecnologías endoscópicas actuales para el diagnóstico del sangrado gastrointestinal oscuro.
2. Identificar un algoritmo para el abordaje de la HGOO.
3. Identificar las ventajas y desventajas de la cápsula y la enteroscopia profunda, para el diagnóstico y tratamiento de la HGOO.
Se presentó la evolución de los métodos de diagnóstico para las enfermedades del intestino delgado desde el siglo pasado hasta nuestros días, con la aparición de la CE y la enteroscopia de doble balón (EDB).
Etiología
En pacientes mayores de 50 años son más frecuentes las lesiones vasculares del tipo malformaciones arteriovenosas, úlceras, erosiones secundarias a la ingesta de antiinflamatorios no esteroideos (AINE´s), mientras que en menores son tumores, divertículos de Meckel o Dieulafoy, divertículos colónicos.
Cápsula endoscópica
Fue desarrollada por Iddan y colaboradores en el año 2000, publicada en Nature de ese año; en los Estados Unidos se cuenta con dos opciones Pillcam® y Olympus®, la cual permite la exploración no quirúrgica de todo el intestino delgado examinando su mucosa a través de una cámara endoscópica, actualmente la experiencia acumulada sobrepasa una década.
Ventajas
Se realiza ambulatoriamente, en la mayoría de los casos no se requiere sedación, es mínimamente invasivo, y el riesgo de complicaciones también es mínimo.
Desventajas
Únicamente es útil para el diagnóstico, no hay insuflación de aire, los hallazgos pueden ser oscuros por sangre o contenido intestinal, se requiere de un tiempo importante para su lectura; un tránsito intestinal acelerado puede ocultar lesiones proximales; hay variabilidad de acuerdo a los observadores, es difícil localizar la ubicación exacta. Otra desventaja es la posibilidad de que se quede retenida.
Enteroscopia asistida con dispositivos
Existen dos modalidades con balón: monobalón y de doble balón, también existe otra variedad que es con sobretubo en espiral y la meta de todos, es la revisión endoscópica completa del intestino.
Ventajas
Las ventajas de este método son: aplicación terapéutica en sangrados, toma de biopsias, polipectomía, tatuaje de lesiones con tinta china, dilataciones con balón, colocación de prótesis enterales, extracción de cuerpos extraños, realización de colangiopancreatografía retrógrada endoscópica (CPRE), en pacientes con anatomía gastrointestinal modificada y mucosectomía en intestino delgado.
Desventajas
Consume tiempo, es invasiva, existe riesgo de perforación, requiere anestesia, difícil en paciente con adherencias y está limitada por la anatomía del paciente; requiere personal adicional y en la actualidad es mal remunerada, en relación con el tiempo y el esfuerzo.
Utilidad clínica
Al evaluar la utilidad clínica, el autor se plantea los siguientes retos: es difícil definir el rendimiento diagnóstico así como su sensibilidad, no hemos logrado determinar la profundidad que se debe explorar, tanto cuando encontramos la causa del problema como cuando no lo encontramos y se plantea la pregunta sobre si un estudio negativo puede ser 100% confiable o puede ser diagnóstico. Otro punto a discutir sobre la utilidad clínica es que las nuevas tecnologías reproducen estudios limitados, ya que la mayoría de los datos iniciales son de series de casos, existe el sesgo de selección y los resultados verdaderos de los estudios son escasos.
CE Pennanzio presentó en 2004, un estudio que incluyó 100 pacientes consecutivos con HGOO evidente en 26, oculto en 31 y previo en 31, a estos pacientes se les habían realizado antes de la cápsula, 620 pruebas diagnósticas negativas y el rendimiento diagnóstico global fue del 50%.
Enteroscopia con doble balón y su utilidad clínica
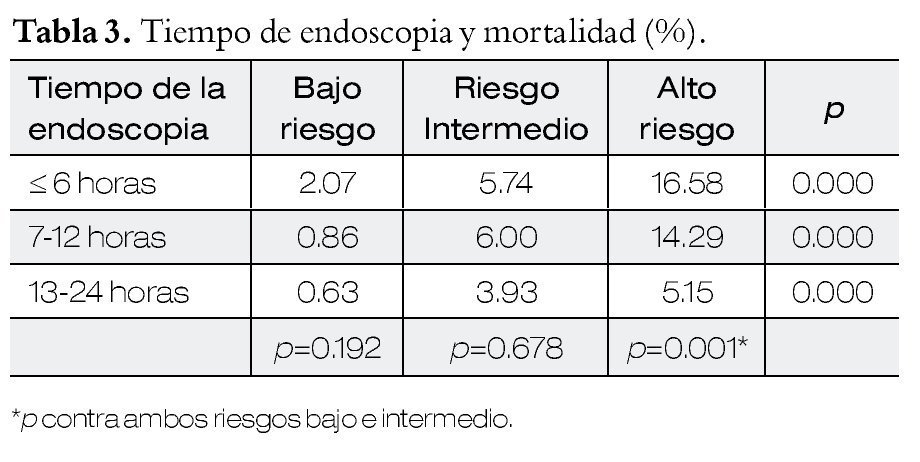
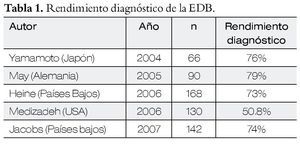
En la Tabla1 se presentan los resultados con el método de doble balón.
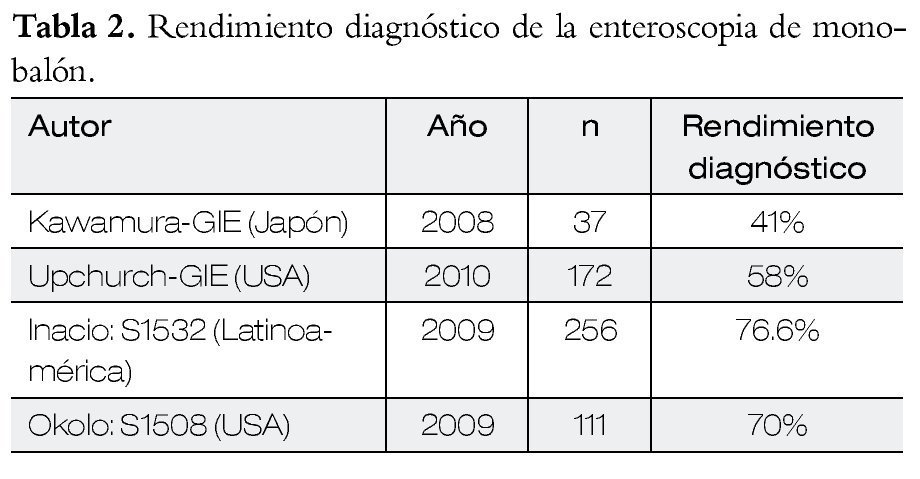
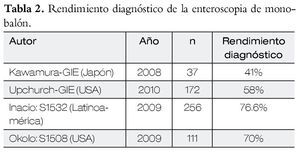
Enteroscopia con monobalón y su utilidad clínica
En la Tabla 2 se presentan los resultados con el método de monobalón.
Una década de la EDB
Lecciones aprendidas de la recopilación de los meta-análisis, de 66 manuscritos en extenso, un periodo de 10 años, en donde se reporta un rendimiento diagnóstico de hemorragia digestiva de intestino medio global del 68% y una tasa de complicaciones en más de 9 000 casos menor al 1%.
Enteroscopia con doble balón y su utilidad clínica
Se presentó este trabajo en donde se incluyeron 98 pacientes tratados de 133 pacientes con lesiones vasculares, el tratamiento se realizó con enteroscopio de doble balón, se realizó seguimiento a 22.6 meses y se encontró una tasa de resangrado del 46% y los factores asociados a este, fueron el número de lesiones y la enfermedad valvular y arritmias cardiacas.
Enteroscopia con doble balón vs. cápsula endoscópica
Medizadeh y colaboradores en este trabajo presentado en el 2006, encontraron una correlación significantemente positiva entre los hallazgos positivos de la EDB y la CE (n=145).
Cápsula dirigida por enteroscopia/eligiendo el planteamiento inicial
En este trabajo reportado por Gay en 2006, se encontró que la EDB tiene un valor predictivo positivo en el 95% de las lesiones identificadas en el 75% del tránsito del intestino delgado en la CE; además que la EDB retrógrada tiene un valor predictivo positivo del 95% para las lesiones identificadas en el último 25% del tránsito intestinal con la CE; y que la revisión de la cápsula es fundamental para esta correlación, encontrando varios errores en el software de la misma, por ejemplo, que no todas las lesiones rojas observadas con la CE son lesiones vasculares y que una vez que se decide realizar la EDB, el tiempo y los gastos son significativos, por lo cual siempre que sea posible se deben revisar los hallazgos de la cápsula personalmente.
¿Qué se recomienda hacer en caso de persistencia de los síntomas cuándo la cápsula y enteroscopia profunda son negativas?, como en los casos de deficiencia de hierro o el sangrado oculto oscuro, se puede repetir la cápsula, realizar una angiotomografía o realizar una enteroscopia transoperatoria, si no se realizó la enteroscopia completa. En los casos de sangrado gastrointestinal oscuro evidente, se recomienda realizar angiografía, angiotomografía o enteroscopia intraoperatoria.
En esta parte, presentaré dos trabajos en relación al tema asignado, el primero es el impacto clínico de la cápsula a largo plazo en los pacientes con hemorragia gastrointestinal, el Dr. Min2 presenta la experiencia de un estudio nacional realizado en Corea y el objetivo del estudio fue evaluar el impacto clínico a largo plazo en 305 pacientes, determinando como desenlace primario el resangrado y como secundario, la necesidad de transfusiones. Se encontraron 187 hombres con una edad promedio de 56.9 años, de los cuales 35 se presentaron en la variedad oculta y 270 en la variedad evidente de la HGOO. Se detectaron las causas de la hemorragia en 131 pacientes (43%), de las cuales el diagnóstico más común fue úlceras activas en 81 casos; se realizó tratamiento en 71 enfermos (23.3%) y la tasa de resangrado fue de un 19% en un seguimiento de 38.7 meses; no hubo una diferencia significativa en las tasas de resangrado de las cápsulas positivas y las negativas (19.1% vs. 19.0%; p=1.00), tampoco el tratamiento específico disminuyó el resangrado, estos mismos datos se observaron para la readmisión y los requerimientos transfusionales. La conclusión del autor es que el resangrado está determinado por la etiología y no está afectado por la aplicación de tratamiento específico, además que los pacientes que más resangraron fueron los que tenían erosiones múltiples y angiodisplasias, por lo que requieren un seguimiento estrecho. Estos fueron los resultados que ellos encontraron, en donde de acuerdo a los mismos el tratamiento no modifica la historia natural de la enfermedad, lo que va en contra de lo reportado en la literatura médica.
En el segundo trabajo, Matsumura3 presenta la utilidad clínica de la enteroscopia con balón realizada después de una CE negativa en pacientes con HGOO, se incluyeron 260 pacientes, de los cuales 203 fueron HGOO evidente y 57 variedad oculta. El objetivo del estudio fue resangrado. El diagnóstico global de la cápsula fue de 40.7% y no se logró establecer la causa de la hemorragia en 154, de este grupo se realizó enteroscopia con balón en 52 pacientes, de los cuales se detectaron erosiones en siete y se realizó tratamiento en dos. El resangrado después de una cápsula negativa en pacientes con enteroscopia y sin enteroscopia fue de 15.3% y 4.9%, respectivamente, por lo que se concluye que realizar la enteroscopia con balón en los pacientes con hemorragia de intestino medio y cápsula negativa, no cambia las tasas de resangrado.
Mensaje para llevar a casa
• La era de la enteroscopia está sobre nosotros.
• La enteroscopia profunda y la CE son complementarias.
• La enteroscopia profunda y la CE no son el "gold standard" para el estudio del sangrado gastrointestinal oscuro.
• Si continúan los síntomas a pesar de CE y enteroscopia profunda negativa, requieren mayor estudio.
Referencias
1. Ross AS. Obscure GIB´ing-Capsule and Ballom Enteroscopy: Hide and Go Seek. ASGE Annual postgraduate course, 2013.
2. Won Min Y, Su Kim J, Seong Woo J, et al. Clinical Impact of Capsule Endoscopy on Long-Term Outcome in Patients With Obscure Gastrointestinal Bleeding: a Multicenter Study in Korea. Gastrointest Endos 2013;77:AB220-AB221.
3. Matsumura T, Arai M, Maruoka D, et al. Clinical Utility of Balloon Enteros-copy Subsequent to Negative Capsule Endoscopy for Obscure Gastrointestinal Bleeding. Gastrointest Endosc 2013;77: AB221.
Manejo de la terapia anticoagulante y antiplaquetaria en endoscopia
Martín Antonio Manrique
Director General, Hospital Juárez de México, SS, México D.F., México
Correspondencia:
Hospital Juárez de México.
Av. Instituto Politécnico Nacional N° 5160, Colonia Magdalena de las Salinas, C.P. 07760, México D.F., México.
Correo electrónico: martinmanriquez@yahoo.com.mx
Resumen
Para los pacientes que requieren endoscopia terapéutica y toman medicamentos del tipo anticoagulantes o antiagregantes plaquetarios, existe una normatividad creada a fin de evitar complicaciones durante el procedimiento endoscópico.
Palabras clave: Terapia anticoagulante, stent coronario, antiplaquetaria, tromboembólico, México.
Abstract
For patients who require therapeutic endoscopy and take anticoagulant or antiplatelet drugs, there a created regulations to avoid complications during endoscopic procedure.
Keywords: Anticoagulant therapy, coronary stent, antiplatelet, thromboembolic, Mexico.
Pacientes en tratamiento con anticoagulantes o antiplaquetarios que requieren endoscopia
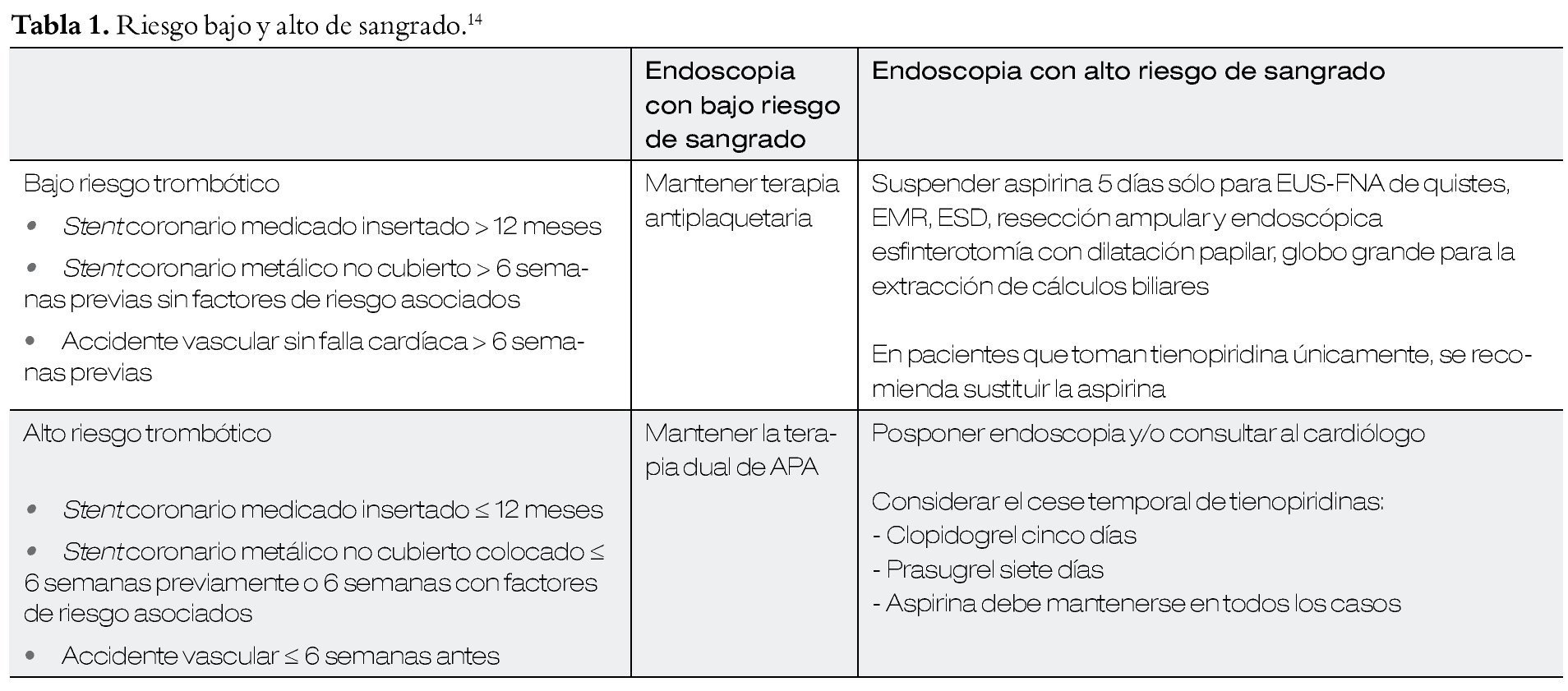
• Pacientes portadores de stent coronario que requieren intervención quirúrgica, se recomienda diferir la cirugía en las primeras seis semanas después de la colocación de un stent metálico y seis meses después de la colocación de un stent medicado (grado 1C), asimismo, se recomienda continuar terapia antiplaquetaria dual (aspirina + clopidogrel) en el periodo perioperatorio (grado 2C).1
• Pacientes con riesgo moderado-alto para desarrollar eventos cerebrovasculares y se encuentren tomando aspirina y necesitan cirugía no cardíaca, se sugiere continuar el medicamento en el periodo perioperatorio (grado 2C).
• Pacientes que usan aspirina perioperatoria, tienen incrementado el riesgo de sangrado (RR=1.5), no así el riesgo de hemorragia clínicamente significativa.
• Aquellos pacientes en quienes se interrumpe la aspirina en el perioperatorio aumentan tres veces el riesgo de desarrollar eventos cerebrovasculares (OR=3.1).1,2,3
No existen datos de las consecuencias de la interrupción o continuación de clopidogrel en el periodo perioperatorio.
La recuperación de la función plaquetaria después de suspender la aspirina y el clopidogrel durante cuatro a cinco días es de 90% y 30% a 40%, respectivamente.4
Pacientes con inicio reciente de anticoagulantes que requieren estudio endoscópico
Estratificación de riesgo tromboembólico
• Riesgo alto: fibrilación auricular (evento cerebrovascular o ataque isquémico transitorio de menos de tres meses; escala CHADS 5-6; fiebre reumática), válvula cardíaca mecánica (válvula mitral, evento cerebrovascular o ataque isquémico transitorio de menos de seis meses); tromboembolismo venoso (menos de tres meses del evento, trombofilia severa, deficiencia de proteína C, S y antitrombina).
• Riesgo moderado: fibrilación auricular (escala de CHADS 3-4), tromboembolismo venoso en los últimos tres a 12 meses o cáncer.
• Riesgo bajo: fibrilación auricular (escala de CHADS 0-2), tromboembolismo de más de 12 meses de evolución.4,5,6
Se recomienda suspender el tratamiento con warfarina, cinco días antes del procedimiento quirúrgico y reiniciar 12-24 horas después de la cirugía, siempre y cuando haya una adecuada hemostasia (grado 1C).
En pacientes que reciben dosis terapéuticas de heparina de bajo peso molecular, se deberá administrar la última dosis de ésta, 24 horas antes de la cirugía y reiniciar 12 horas después (grado 2C). Pacientes que reciben dosis terapéuticas de heparina de bajo peso molecular y presentan sangrado importante durante la cirugía, se recomienda reiniciar el anticoagulante 48-72 horas después del evento quirúrgico. 5,6
Existen pocos datos que sustenten la seguridad de continuar la warfarina durante un procedimiento quirúrgico.7,8
Pacientes con inicio reciente de anticoagulantes quienes presentan hemorragia gastrointestinal aguda
En los pacientes que se encuentran en tratamiento con dabigatrán y tienen alto de riesgo de sangrado, deberán suspenderse el fármaco 2-3 días antes del procedimiento y reiniciarlo un día después.9,10
En pacientes que están recibiendo rivaroxaban y apixaban, y serán sometidos a cirugía mayor se deberán suspender dos dosis antes del procedimiento y reiniciar dos a tres días luego de la intervención. En aquellos que requieran cirugía menor se suspenderá una dosis antes del procedimiento y se reiniciará un día después del mismo.11
Los agentes usados para revertir los efectos de los anticoagulantes tradicionales incluyen: vitamina K, complejo concentrado de protrombina, complejo concentrado de protrombina activado y factor VII activado recombinante.
Ante una hemorragia gastrointestinal aguda en un paciente anticoagulado se requiere manejo interdisciplinario, uso apropiado de agentes prohemostáticos, anestesia general (anestesia espinal contraindicada) y hemostasia mecánica endoscópica (hemoclips).12
Pacientes con trombocitopenia que requieren tratamiento endoscópico
Se recomienda transfusión de plaquetas en pacientes con: recuentos plaquetarios menores de 40 000 y que no cursen de forma concomitante con púrpura trombocitopénica idiopática, y en pacientes con conteo normal de plaquetas que reciban terapia anticoagulante dual (ASA + clopidogrel), quienes sangran durante el procedimiento.13
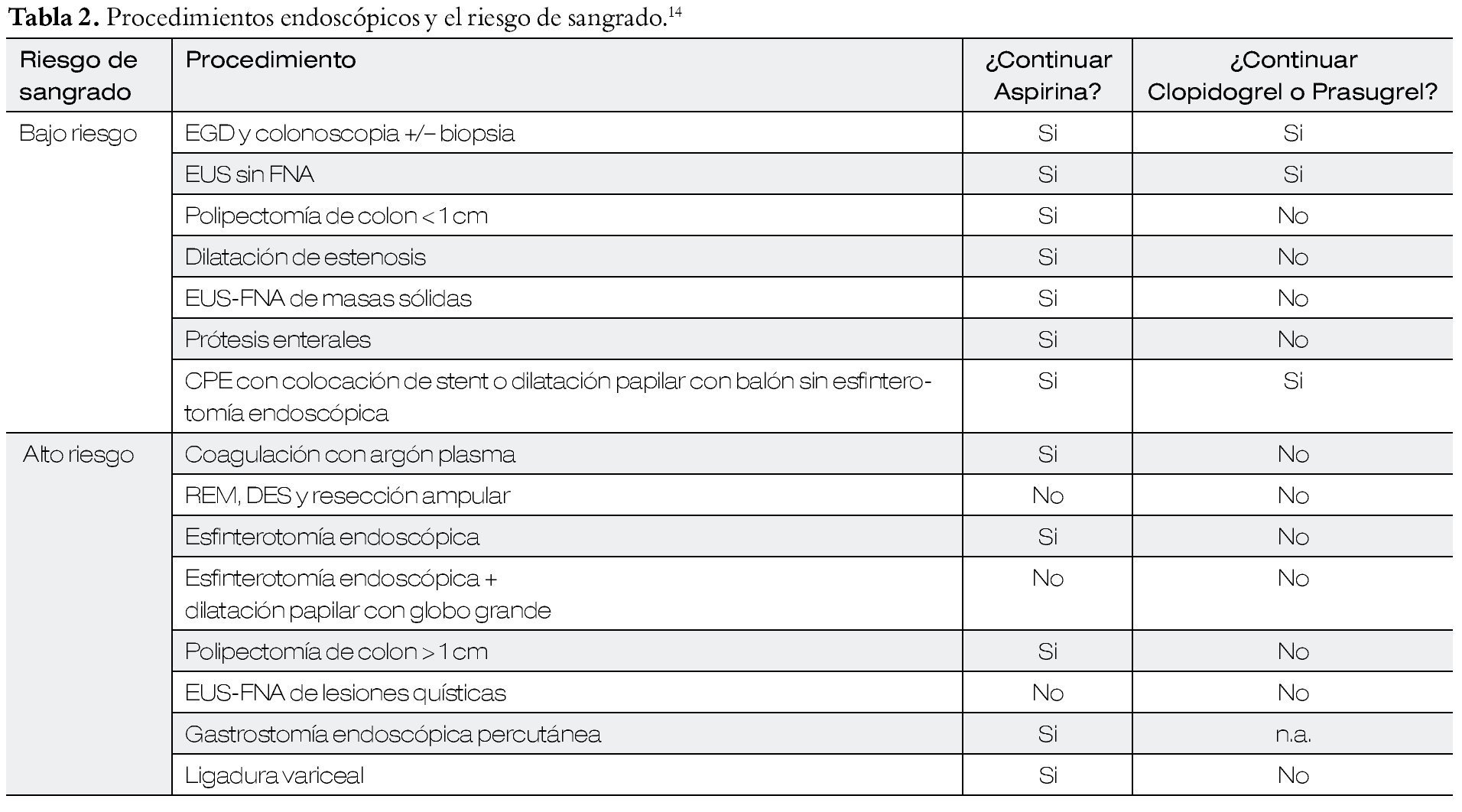
En procedimientos con fines diagnósticos (endoscopia superior, enteroscopia, colonoscopia y ultrasonido endoscópico), se recomienda no suspender los fármacos antiplaquetarios.
Manejo del tratamiento antiagregante plaquetario durante el periodo periendoscópico15 (Tablas 1 y 2).
Referencias
1. Douketis J, et al. Perioperative management of antithrombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141:e326.
2. Blondi-Zoccai GG, et al. A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50 279 patients at risk for coronary artery disease. Eur Heart J 2006;27:2667.
3. Mantz J, et al. Impact of preoperative maintenance or interruption of aspirin on thrombotic and bleeding events after elective non-cardiac surgery: the multi-centre, randomized, blinded, placebo-controlled, STRATAGEM trial. Br J Anaesth 2011;17:899.
4. Price M, et al. Quantification and impact of untreated coronary-artery disease after percutaneous coronary intervention: The residual SYNTAX (SYNergy between PCI with TAXus and cardiac surgery) score. JAAC 2012;59:2338.
5. Gurbel P et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/OFFSET study. Circulation 2009;120:2577.
6. Weitz JL, et al. Periprocedural Management and Approach to Bleeding in Patients Taking Dabigatran. Circulation 2013;126:2428.
7. García D, et al. Laboratory assessment of the anticoagulant effects of the next generation of oral anticoagulants. J ThrombHaemost 2013;11:245.
8. Van Rijnj, et al. Dabigatran etexilate--a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. ThrombHaemost 2010;103:1116.
9. Spyropoulos A. How I treat anticoagulated patients undergoing an elective procedure or surgery. Journal Blood 2012;120:2954.
10. Kubitzan D, et al. Safety, pharmacodynamics and pharmacokinetics of BAY 59- 7939 an oral, direct factor Xa inhibitor after multiple dosing in healthy male subjects. Eur J ClinPharmacol 2005;61:873.
11. Keeling D, et al. Guidelines on oral anticoagulation with warfarin - fourth edition. Br J Haematol 2011;154:311-324.
12. Afdhal Nh, et al. Eltrombopag before Procedures in Patients with Cirrhosis and Thrombocytopenia. N Engl J Med 2012;367:716.
13. Moussa MM, et al. Preoperative use of romiplostim in thrombocytopenic patients with chronic hepatitis C and liver cirrhosis. J GastroHepatol 2013;28:335.
14. Boustière C, et al. Endoscopy and antiplatelet agents. ESGE Guideline 2011;43:445-458.
15. Christopher JL, et al. Current guidelines for endoscopy in patients on antithrombotic medication. Gastrointest Interv 2012;1:58-62.