Lesiones quísticas del páncreas
Félix Ignacio Téllez-Ávila
Departamento de Endoscopia Gastrointestinal, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", México D.F., México
Correspondencia:
Departamento de Endoscopia, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: (+525) 55487 0900, ext. 2150.
Correo electrónico:felixtelleza@gmail.com
Resumen
En el congreso DDW 2013 se revisaron algunos de los datos más recientes en relación con el diagnóstico, seguimiento, evaluación y tratamiento de las lesiones quísticas del páncreas. En el presente trabajo se exponen los que a consideración del autor, son los nuevos avances más significativos para el endoscopista.
Palabras clave: Neoplasia papilar mucinosa intraductal, quiste, seguimiento, ultrasonido endoscópico, México.
Abstract
At DDW 2013 congress reviewed some of the latest data regarding the diagnosis, surveillance, evaluation and treatment of cystic lesions of the pancreas. We included in the present work which, in consideration of the author, are the most significant new developments for the endoscopist.
Keywords: IPMN, Cyst Fluid, Surveillance, EUS, Mexico.
Introducción
Este año en el congreso de la semana de enfermedades digestivas 2013 se comentaron algunos aspectos relevantes en relación al diagnóstico, seguimiento, evaluación y tratamiento de las lesiones quísticas del páncreas. En este trabajo de revisión se presentan los avances/cambios más relevantes al respecto.
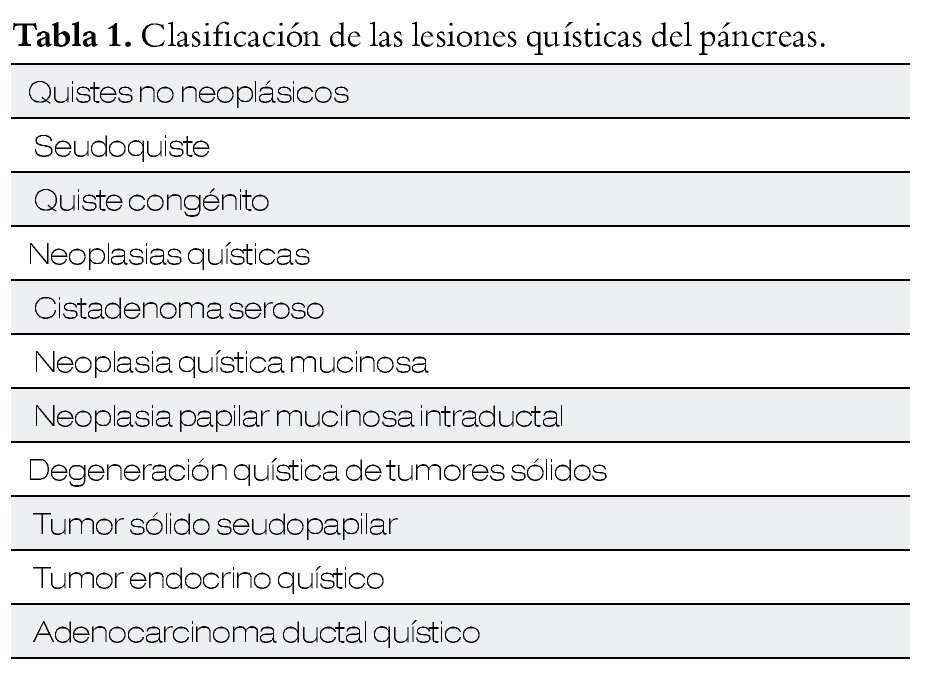
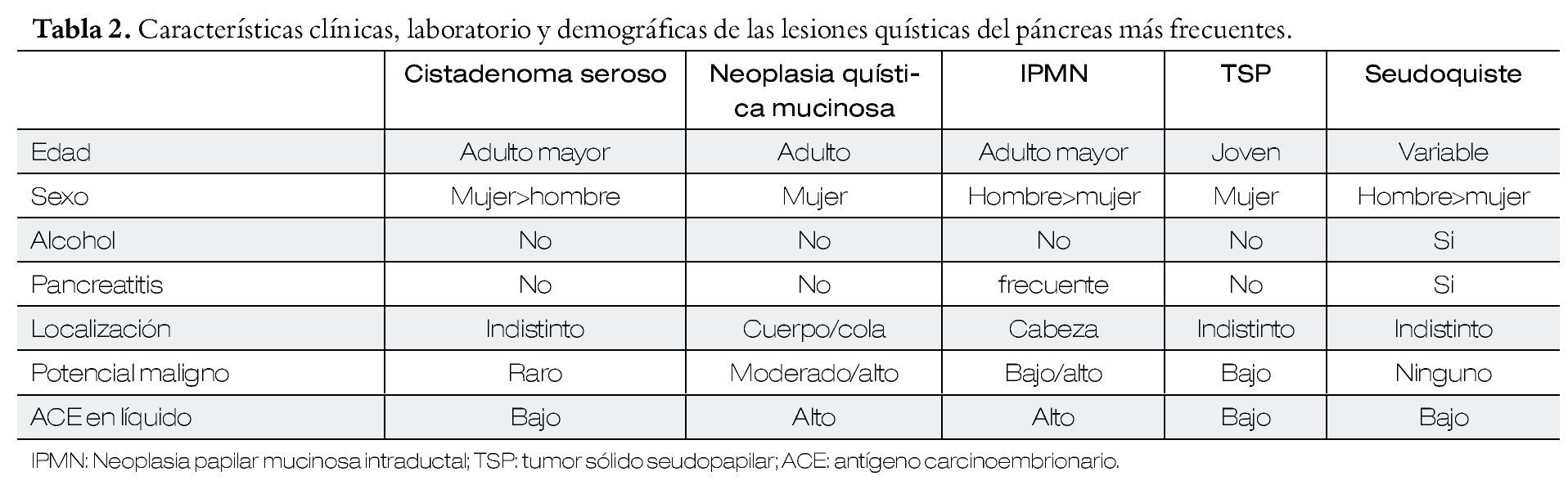
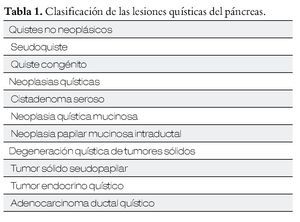
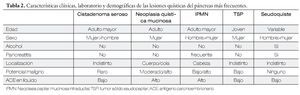
Se sabe que en la población general se encuentra una lesión quística del páncreas hasta en el 2.5% a 10%, si se les realiza una tomografía computada o resonancia magnética. Su incidencia ha ido en aumento debido a la mayor disponibilidad de estas técnicas de imagen. Existen diferentes tipos de lesiones quísticas del páncreas (Tabla 1), y de acuerdo a las características clínicas y demográficas de los pacientes se puede inferir el tipo de lesión de que se trata, en un paciente en particular (Tabla 2).1
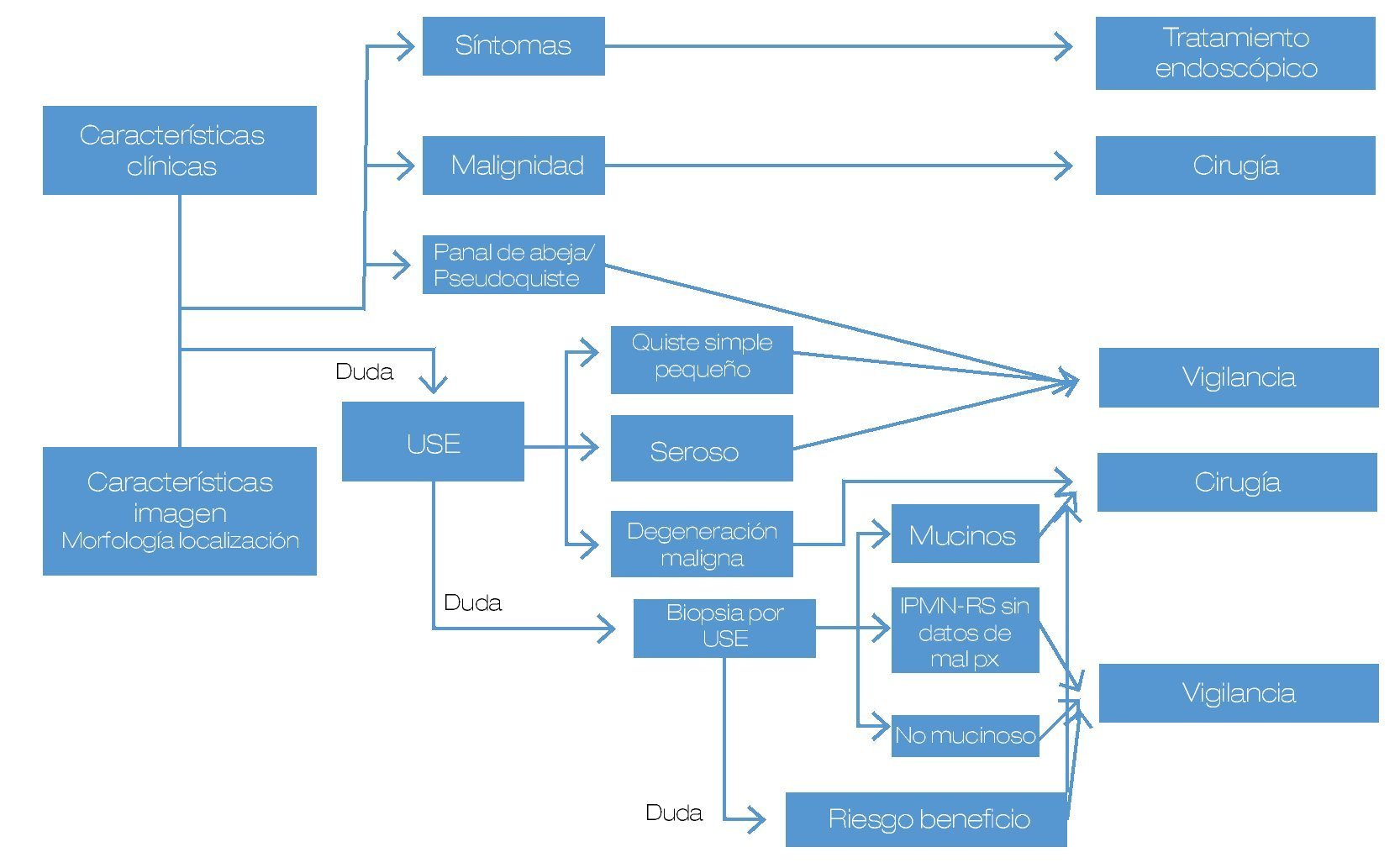
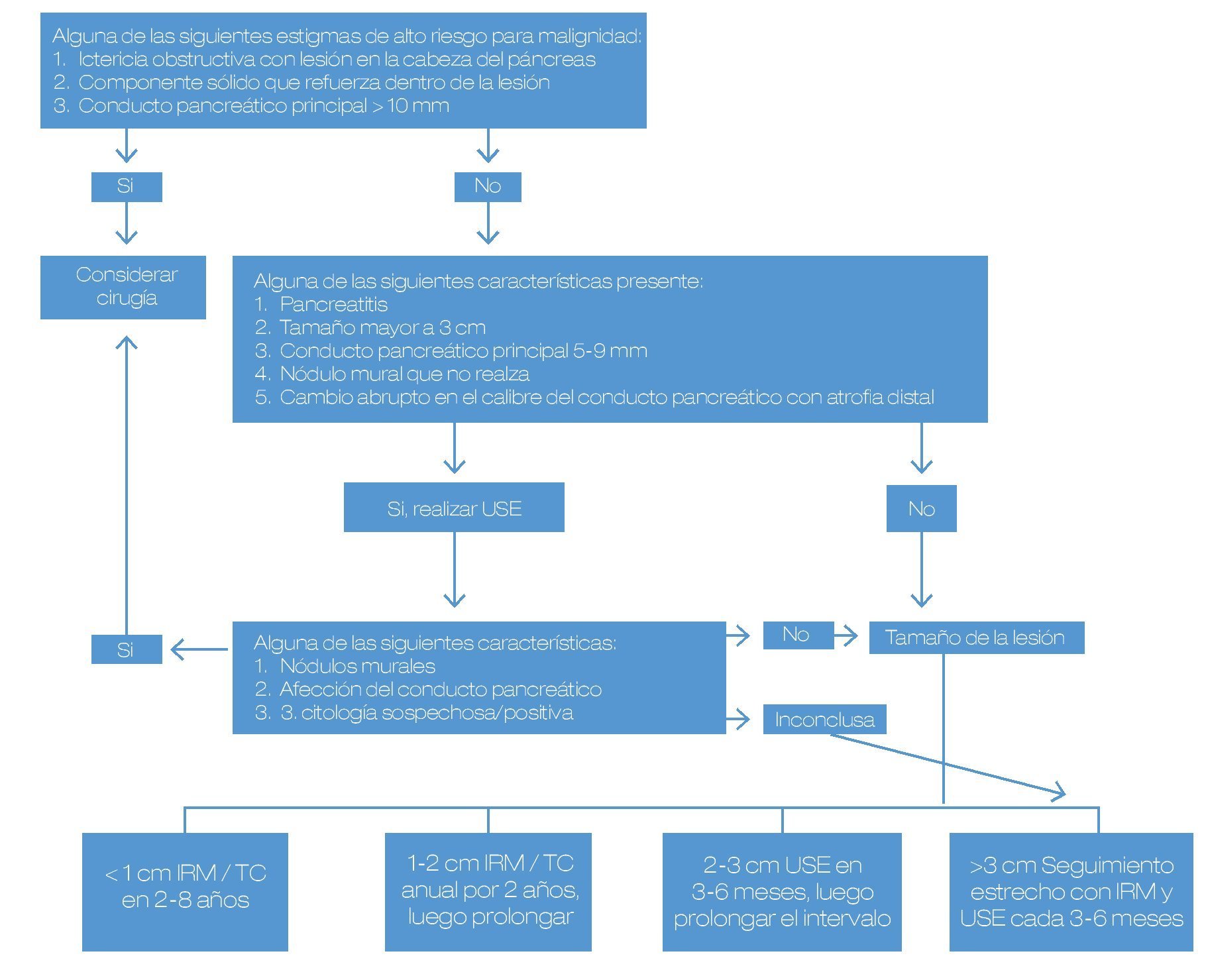
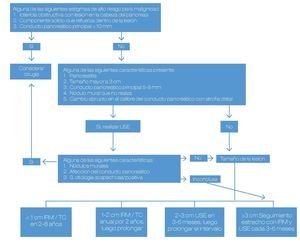
Hasta el momento, el principal punto en este tipo de lesiones continúa siendo lograr la diferenciación entre las lesiones benignas y las lesiones con potencial de malignidad (o bien, ya malignas al momento del diagnóstico), para poder ofrecer la mejor opción a cada paciente (Figura 1). Se expusieron algunos trabajos en este aspecto.
Figura 1. Diagnóstico diferencial y estrategias de manejo para las lesiones quísticas del páncreas.
Utilización de ultrasonido endoscópico con medio de contraste (USE-MC)
El uso de medio de contraste durante el estudio de USE es una técnica novedosa que se ha utilizado con anterioridad en lesiones sólidas. Este año se presentaron algunos resultados de pacientes con lesiones quísticas. En el trabajo de Imada y colaboradores2 se incluyeron 42 pacientes con lesiones quísticas del páncreas, a quienes se les realizó USE-MC. Con este trabajo inicial, los autores pudieron concluir que aquellas lesiones quísticas que durante el USE-MC muestran un componente sólido con reforzamiento, tienen un alto riesgo de que se trate de lesiones malignas.
Modelos predictivos para detectar lesiones quísticas del páncreas con potencial maligno
En un análisis retrospectivo por Krishna y colaboradores,3 se evaluaron múltiples variables clínicas y de laboratorio para identificar algunos de los factores asociados para predecir que una lesión quística del páncreas tenga una naturaleza premaligna (mucinosa). Los factores que evidenciaron un mayor peso fueron antígeno carcinoembrionario (ACE) > 192 ng/mL y presencia de mucina en el estudio citológico.
Mediciones seriadas de ACE en líquido obtenido por USE
Una determinación de ACE por arriba de 192 ng/mL en líquido obtenido de una lesión quística, se utiliza para determinar la naturaleza mucinosa de la misma. En pacientes con una cifra indeterminada de ACE frecuentemente se decide realizar un seguimiento con estudios de imagen, no existen datos claros sobre la necesidad o no de realizar mediciones repetidas de ACE y en su caso, el significado. En un estudio realizado con Nakai Y y colaboradores4 evaluaron la utilidad de las mediciones seriadas de ACE durante el seguimiento de pacientes con lesiones quísticas del páncreas. Los autores pudieron detectar que los niveles de ACE en líquido obtenido de la lesión, son estables en el 80% de los pacientes y que en el resto de los pacientes existen fluctuaciones inexplicables que no tienen un impacto para tomar decisiones en estos pacientes, y que por lo tanto, no está recomendado llevar a cabo mediciones seriadas.
Pacientes con tumores neuroendocrinos quísticos del páncreas
Este tipo de lesiones son raras y representan menos del 5% de las lesiones quísticas del páncreas, por lo cual los datos en relación con USE y BAAF son limitados. En el estudio realizado por Halawi H y colaboradores,5 se incluyeron 36 pacientes enrolados en un periodo de 11 años. Se pudo observar que la mayoría de los pacientes fueron hombres, la lesión se encontraba con mayor frecuencia en el cuerpo del páncreas y que el 63% de los casos se trató de una lesión mixta (sólido-quística). Se pudo observar que la sola imagen de USE con la toma de BAAF con evaluación tradicional con HE, tiene un pobre desempeño (sensibilidad 22%), pero que aumenta significativamente (100%) cuando se utiliza inmunohistoquímica.
Ablación por radiofrecuencia guiada por USE de lesiones quísticas del páncreas6
Se realizó el reporte de ocho pacientes sometidos a este método en lesiones de la cabeza del páncreas. La tolerancia en los ocho pacientes fue buena sin presencia de complicaciones como pancreatitis, perforación o sangrado. La respuesta fue desde resolución total hasta una reducción del 50% de la lesión.
Neoplasia Mucinosa Papilar Intraductal (IPMN)
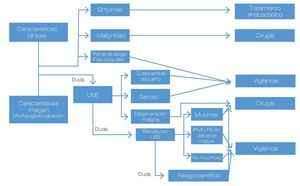
Este año 2013 en la DDW, se habló con amplitud en particular de los IPMN. Algunos datos de estudios recientes fueron comentados ampliamente. La mayoría de estas lesiones son del tipo IPMN de rama secundaria. Se sabe que algunas de las lesiones quísticas del páncreas tienen potencial maligno y que cuando existe desarrollo de cáncer, en pacientes con IPMN, puede ser en la lesión en sí misma o en un sitio diferente del páncreas. Recomendaciones del 2006 (Sendai) mencionaban que lesiones de menos de 3 cm, sin nódulos murales, el seguimiento debía ser cada dos año. A la luz de nuevos estudios que muestran que las lesiones tipo IPMN < 3 cm sin nódulos murales pueden tener presencia de malignidad al momento del diagnóstico y que más que el tamaño inicial, la rapidez de crecimiento (> 2 mm/año) de una lesión es el factor que tiene mayor relación con el desarrollo de malignidad. Por lo cual, se han propuesto algunos cambios a las recomendaciones del 2006, ya que en estudios retrospectivos para evaluar la utilidad de las guías, se pudo observar que el valor predictivo para detectar lesiones premalignas o malignas era alto (no se perdían estas lesiones), pero que su valor predictivo positivo era apenas del 20% (sólo una de cada cinco lesiones resecadas tenía lesiones premalignas/malignas) (Figura 2).7 A diferencia de las neoplasias mucinosas, los IPMN requieren de seguimiento aún después de su resección quirúrgica, ya que pueden desarrollar cáncer pancreático en el páncreas remanente o nuevos IPMN, ya que actualmente se sabe que hasta 21% a 41% de los pacientes con esta patología tiene una enfermedad multifocal.1,8-10
Figura 2. Guías de manejo para los pacientes con IPMN-RS (rama secundaría) y neoplasias quísticas mucinosas.
Referencias
1. Farrell J, Fernández-del Castillo C. Pancreatic cystic neoplasms: management and unanswered questions. Gastroenterology 2013;144:1303-1315.
2. Imada R, Bories E, Caillol F, et al. Prospective Evaluation of Contrast-Enhanced Harmonic Endoscopic Ultrasound (CEH-EUS) in Cystic Lesion of Pancreas. DDW 2013. Mo1506.
3. Krishna S, Bhattacharya A, Ladha H, et al. Endoscopic Ultrasound-Guided Fine Needle Aspiration (EUS-FNA) for Diagnosis of Cystic Pancreatic Lesions (CPL): Comprehensive Evaluation, Multidisciplinary Dialogue and Continued Challenges At a Tertiary Oncology Center. DDW 2013. Mo1505.
4. Nakai Y, Iwashita T, Shinoura S, et al. A Retrospective Analysis of Serial Fluid Analysis of Pancreatic Cystic Neoplasms Under EUS Surveillance: Is There Any Role in Repeat Cyst Fluid CEA Measurement? DDW 2013.Mo1513.
5. Halawi H, DeWitt J, LeBlanc J, et al. The Utility of Endoscopic Ultrasound (EUS)-Fine Needle Aspiration (FNA) for the Diagnosis of Pancreatic Cystic Neuroendocrine Tumors (PCNETs): a Decade of Single Center Experience. DDW 2013. Mo1484.
6. Pai M, Senturk H, Lakhtakia S, et al. Endoscopic Ultrasound Guided Radio-frequency Ablation (EUS-RFA) for Cystic Neoplasms and NeuroendocrineTumors of the Pancreas. DDW 2013. 351.
7. Tanaka M, Fernández-del Castillo C, Adsay V, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology 2012;12:183-197.
8. Schmidt CM, White PB, Waters JA, et al. Intraductal papillary mucinous neoplasms: predictors of malignant and invasive pathology. Ann Surg 2007;246:644-651.
9. Rodriguez JR, Salvia R, Crippa S, et al. Branch-duct intraductal papillary mucinous neoplasms: observations in 145 patients who underwent resection. Gastroenterology 2007;133:72-79.
10. Ohtsuka T, Kono H, Tanabe R, et al. Follow-up study after resection of intraductal papillary mucinous neoplasm of the pancreas; special referencesto the multifocal lesions and development of ductal carcinoma in the remnant pancreas. Am J Surg 2012;204:44-48.
Drenaje biliar y pancreático guiado por ultrasonido endoscópico
José Guillermo de la Mora-Levy
Servicio de Endoscopia, Instituto Nacional de Cancerología, SS, México D.F., México
Correspondencia:
Servicio de Endoscopia, Instituto Nacional de Cancerología,
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Correo electrónico:guillermodelamora@yahoo.com
Resumen
El drenaje pancreatobiliar dirigido por ultrasonido endoscópico (USE) ha cobrado más importancia y las series de pacientes son cada vez más grandes; se pretende refinar este procedimiento con técnicas estandarizadas y resultados reproducibles para su uso clínico cotidiano. La industria se ha interesado en esta área, por lo que se han diseñado, fabricado y usado instrumentos para este fin.
Palabras clave: Endosonografía, drenaje, hepático-gastrostomía, colédoco-duodenostomía, México.
Abstract
Endoscopic Ultrasound (EUS) Pancreato-biliary drainage has gained recognition slowly and recently larger series and even multicentric studies appear; refinement of this procedure, standard techniques and reproducible results are the aim, so that it can become an accepted and gold standard treatment for this group of patients. Industry has also shown interest in this area and new instruments and accessories have been designed and used preliminary in these group of patients.
Keywords: Endosonography, drainage, hepatico-gastrostomy, duodenocoledostomy, Mexico.
En esta revisión se comentarán los trabajos relevantes presentados en la Semana Americana de Enfermedades Digestivas (DDW, por sus siglas en inglés), así como del Simposio Mundial de Ultrasonido Endoscópico, llevado a cabo en Rusia en noviembre de 2012, y también del Congreso Europeo (EuroEUS), del 5 a 6 de mayo de 2012.
Esta técnica fue descrita inicialmente por el Dr. Giovannini, después de que el Dr. Wiersema llevara a cabo la primera colangiografía. Desde entonces se han perfeccionado las técnicas y han aparecido instrumentos especiales para llevarlos a cabo. Existen básicamente dos sitios de abordaje endosonográficos posibles: a través del estómago hacia hígado y desde bulbo duodenal o antro gástrico a duodeno. Por acuerdo internacional de expertos, el término general para estos procedimientos es "colangiografía endoscópica anterógrada o guiada por ultrasonido endoscópico (USE)" (EUCP o ESCP, por sus siglas en inglés). En este año se presentaron varios trabajos sobre esta técnica, los cuales son útiles para determinar el mejor abordaje, instrumentos y técnica.
En la actualidad, cuando no es posible canular la papila por diversos motivos (divertículo periampular, tumor ampular, infiltración del duodeno o cirugía, ya sea gastrectomía o bariátrica), el paciente es enviado a un drenaje percutáneo para resolver la obstrucción biliar en la mayoría de hospitales del mundo, sin embargo en muchos otros centros hospitalarios, esta técnica está empezando a cobrar importancia, siendo aproximadamente entre 1% a 2% de las CPREs.
Los abordajes pueden ser a través del estómago hacia las ramas intrahepáticas izquierdas dilatadas y avanzar la guía hasta el duodeno, atraparla y colocar retrógradamente (Rendez-vous tradicional); si no es posible avanzar la guía, entonces se coloca una prótesis de intrahepáticas izquierdas a estómago (hepático-gastrostomía); para ello se han usado tradicionalmente prótesis plásticas, ya sean rectas o idealmente de doble cola de cochino. A este respecto se describió la primera serie de drenajes utilizando una prótesis metálica autoexpandible especial (Giobor, fabricada por TaeWoong), en cuanto a que ésta sólo está cubierta de un lado y tiene una "copa" más prominente que la mantiene en el estómago, así la parte cubierta impide fugas entre estómago e hígado y la parte distal descubierta permite que se fije al tejido de los conductos intrahepáticos.
El otro abordaje consiste en comunicar el colédoco distal dilatado al bulbo duodenal, en algunos casos por la anatomía, incluso a través del antro. A este procedimiento se le ha llamado colédoco o antrostomía. Más frecuentemente se usa una prótesis plástica, aunque se han usado prótesis metálicas, generalmente parcial o completamente cubiertas; para este fin también se ha fabricado una prótesis especial (Axios) en forma de Yo-Yo en varias medidas, la cual se coloca con un accesorio especial llamado Navix, en su segunda versión, que en lugar de contar con una aguja y un globo "fijador", cuenta con un cistótomo en su extremo distal y varios seguros para impedir que la prótesis se coloque erróneamente. En cuanto a los resultados del procedimiento en sí, en un primer estudio, se comparó el drenaje percutáneo con el guiado por endosonografía en 67 pacientes (edad promedio de 66.3 años, 58% hombres y 57% con cáncer de páncreas, todos tenían una CPRE fallida previa). Finalmente, se incluyeron en este estudio ambispectivo 16 pacientes para el grupo guiado por USE vs. 51 abordajes percutáneos; el éxito técnico fue de 87.5% vs. 100%, sin embargo el éxito clínico se obtuvo en 100% vs. 92.7%. Se presentaron efectos adversos en 25% vs. 41.2% (NS), aunque las complicaciones más graves fueron en el grupo percutáneo. La oclusión del drenaje e intervenciones (como irrigación transonda, infección, hospitalización fueron menores con el método endoscópico y este abordaje también resultó más económico).1 En un estudio comparativo entre hepático-gastrostomía (17 pacientes) y duodenostomía (15 pacientes) guiadas por USE, el éxito fue similar, 93% vs. 88% y 13% vs. 17%, respectivamente,2 utilizando prótesis metálicas parcialmente cubiertas.
En un estudio europeo con seguimiento a largo plazo (hasta 10 años), se practicaron 95 procedimientos, incluyendo Rendezvous (n=11; 13.8%); anterógrado internalizado a duodeno (n=6; 7.5%); colédoco-gastroduodenostomía (n=13; 16.2%); hepáticogastroenterostomía con drenaje retrógrado (n=43; 53.8%) y combinación antero-retrógrada (n=7; 8.8%). La indicación principal fue la incapacidad de llegar a la papila, decisión del paciente o falla en el drenaje percutáneo. El éxito técnico por pase fue: colangiografía (n=93; 97.9%), drenaje (n=80; 85.1%; prótesis metálica n=60; prótesis plástica: n=20). Éxito clínico a largo plazo, media ocho meses (intervalo 3-60), en los malignos. Se presentaron complicaciones en 15.7%, colangitis (n=2), prótesis migrada (n=9), dolor (n=2), bilioma y hemobilia (n=1 cada uno). La reintervención fue necesaria en 5.8%.3
En un estudio pequeño de 16 pacientes, se presentaron complicaciones con dos prótesis metálicas. El éxito técnico fue de 88% (11 metálicas vs. 3 plásticas); el éxito técnico se logró en 14 (88%), mientras que el clínico se presentó en 14 casos; dos pacientes necesitaron recambio de prótesis; no se presentaron fugas biliares, peritonitis ni hemorragia, aunque si un caso de pancreatitis y uno de colecistitis. Seis pacientes han sobrevivido una media de 313 días, ocho han fallecido.4
Un grupo japonés presentó una prótesis metálica autoexpandible de 12 cm de larga, excepto por el primer centímetro proximal, comparadas con una Wallflex totalmente cubierta de 8 cm. La colocación fue posible en 100%; dos prótesis migraron (ambas Wallflex) y se concluyó que es necesario un mínimo de 3 cm de prótesis intrahepática, para evitar la fuga biliar o peritonitis.5
Un estudio muticéntrico internacional que reunió pacientes de India, Estados Unidos, Corea, Francia y México, logró incluir un total de 281 pacientes (n=152; 54% masculinos) con una media de edad de 64.6 +/-14.9. Se logró el drenaje exitoso en 232/281 (86%); 236 (84%) tenían cáncer y 45 (16%) enfermedades benignas. Sólo 54 pacientes presentaban anatomía alterada (19%). La vía intrahepática se usó en 152 pacientes (54%), mientras que la vía extrahepática se usó en 129 casos (46%). Se utilizó Rendezvous en 26 casos (9%). La vía transpapilar se usó en 74 (26%) casos, la vía transentérica/transanastomótica se usó en 114 (41%) pacientes y la hepático-gastrostomía en 89 (32%) casos. Se utilizaron prótesis metálicas en 185 (66%) procedimientos y plásticas en 63 (22%); 97/281 (34.5%) presentaron alguna complicación, tal como pancreatitis aguda (n=1), neumonía por aspiración (n=1), bacteremia (n=1), fuga biliar (n=16), peritonitis biliar (n=3), hemorragia (n=27), colangitis (n=18), ictericia (n=1), fiebre (n=2), migración de la prótesis (n=8), dolor (n=4), pancreatitis post-CPRE (n=1), neumoperitoneo (n=7), broncoaspiración (n=2) y obstrucción (n=5). Setenta y nueve (81%) de las complicaciones ocurrieron en pacientes con cáncer; 56 (57%) complicaciones sucedieron con prótesis metálicas vs. 26 (27%) con prótesis de plástico, en 15% sin usar prótesis. El análisis de regresión logística múltiple no encontró ningún factor predictor de éxito. Los autores concluyeron por tanto, que la vía y tipo de prótesis no determinan el éxito y cada caso debe individualizarse.5
Otra prótesis de diseño ya conocido y previamente utilizado en seudoquistes y colédoco-duodenostomías, se utilizó para la creación de colédoco-duodenostomías en ocho pacientes, siendo exitosa en todos, incluso a largo plazo, sin bilioperitoneo, ni hemorragia, sólo leve dolor transitorio en el 50% de los pacientes.6
Otro estudio multicéntrico, primordialmente de la India, incluyó 68 pacientes (34 masculinos). Sesenta y cuatro pacientes tenían una CPRE previa fallida; el procedimiento fue exitoso en 65 pacientes (95.6%). Se presentaron las siguientes complicaciones en 14 pacientes (20.6%): colangitis (n=5), fuga biliar (n=4), perforaciones (n=2), neumobilia (n=2) y hemorragia (n=1). Tres pacientes fallecieron (4.4%, colangitis 2, perforación 1). El análisis de regresión logística encontró solamente al acceso por vía transhepática como factor de riesgo para complicaciones (p=0.031; t=2.2). Los autores concluyen que es mejor intentar el abordaje extrahepático.7
Con el fin de comparar tres abordajes distintos: transduodenal, transgástrico y colocación anterógrada de prótesis (por cualquiera de estas rutas), se incluyeron 31 pacientes, de los cuales en 13 se utilizó la vía transduodenal y en nueve, cada uno de los otros dos métodos. Por vía duodenal el éxito fue de 90%, 77% para abordaje transhepático y 84% para drenaje a estómago. Los autores consideraron siempre más sencillo el abordaje transduodenal, aunque se presentaron cuatro complicaciones menores; la vía transhepática fue considerada como más difícil y se presentaron dos complicaciones (una severa), así como en el grupo de hepático-gastrostomía sin Rendez-vouz. Estos autores concluyeron también que el abordaje transduodenal es más sencillo.
Finalmente, los abordajes guiados por USE en pacientes poscirugía bariátrica, son una opción para la enteroscopía. En un grupo de siete pacientes, el éxito se consiguió en seis pacientes, logrando dilatar el esfínter de Oddi de manera anterógrada, para empujar los litos hacia el duodeno o dejar una prótesis en el único caso fallido.
De la Clínica Mayo, se reportan 51 casos de pancreatografía guiada por USE. Las razones fueron por CPRE fallida en 75% (n=38) y/o anatomía alterada (n=36), páncreas divisum (n=4), estenosis duodenal (n=1) y perforación por CPRE (n=1). La media de diámetro del conducto pancreático fue de 5 mm (0.8-8.5 mm). Se logró extraer 50% de prótesis migradas y en los 32 pacientes restantes se obtuvo un éxito técnico de 76%, sin diferencia entre abordaje ante o retrógrado. El éxito clínico fue de 55% y hubo cuatro complicaciones, una grave.
Referencias
1. Valeshabad AK, Afghani E, Singh VK, et al. EUS-Guided Biliary Drainage Is Effective, Safe, and Less Costly Than Percutaneous Transhepatic Biliary Drainage in Patients With Distal Malignant Biliary Obstruction and Failed ERCP. Su1567.
2. Marson F, Sakai P, Hashiba K, et al. EUS-Guided Choledochoduodenostomy or Hepaticogastrostomy to Malignant Distal Biliary Obstruction: a Prospective Comparative Trial. Su1565.
3. Will U, Fueldner F, Meyer F. EUS-Guided Translumenal Bile Duct Drainage (Eubd) - Spectrum of Indications, Various Access Sites, Technicaland Clinical Success and Long-Term Follow-up in a Large Systematic Clinical Prospective Observational Study (N=95) Reflecting Daily Practice of a High-Volume Centre. Su1563.
4. Khashab M, Valeshabad AK, Idrees M, et al. Single-Center Experience With EUS-Guided Biliary Drainage Using a Standardized Algorithm for Malignant. Biliary Obstruction: Rendezvous vs. Direct Transluminal Techniques. 76.
5. Kahaleh M, Perez-Miranda M, Artifon EL, et al. Endoscopic Ultrasound (EUS) Guided Biliary Drainage: What Have We Learned? 140.
6. Isayama H, Nakai Y, Kawakubo K, et al. Feasibility and Efficacy of a 12-CM Long Covered Metallic Stent for EUS-Guided Hepaticogastrostomy (EUSHGS9 for Unresectable Malignant Biliary Obstruction. Mo1552.
7. Itoi T, Binmoeller K, Itokawa F, et al. Creation of a Choledochoduodenostomy Using a Novel Lumenal Apposition Device: First Clinical Experience. 66.
8. Dhir VK, Artifon EL, Gupta K, et al. A Multicenter Study on EUS- Guided Expandable Biliary Metal Stent Placement: Choice of Access Route, Direction of Stent Insertion, and Drainage Route. Su1587.
9. Isayama H, Kawakubo K, Kato H, et al. A Multicenter Retrospective Study of Endoscopic Ultrasound-Guided Biliary Drainage (EUS-BD) for Malignant Biliary Obstruction in Japan. Mo1532.
10. Iwashita T, Yasuda I, Doi S, et al. Endoscopic Ultrasound-Guided Antegrade Treatments for Biliary Disorders in Patients With Surgically Altered Anatomy. Su1566.
11. Fujii L, Lenz C, Abu Dayyeh BK, et al. Endoscopic Ultrasound (EUS) Guided Pancreatic Duct Intervention: Outcomes of a Single Tertiary Referral Center Experience. Mo1536.
Drenaje endoscópico de la pancreatitis necrosante
Miguel Ángel Ramírez-Luna
Departamento de Endoscopia Gastrointestinal, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", México D.F., México
Correspondencia:
Departamento de Endoscopia Gastrointestinal, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán",
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, México D.F., México.
Teléfono: 5487 0900, ext. 2150.
Correo electrónico: mangelramirez@ yahoo.com
Resumen
En la pasada semana de enfermedades digestivas realizada en la ciudad de Orlando, Florida en los Estados Unidos, se presentaron varios trabajos en resumen acerca del drenaje endoscópico de la necrosis pancreática y de las colecciones líquidas pancreáticas. La tendencia en los estudios es evaluar y comparar los factores técnicos de los drenajes endoscópicos, así como establecer las variables que predicen recurrencia o resolución a largo plazo de las colecciones líquidas peripancreáticas, a continuación comentamos cuatro trabajos en esta área.
Palabras clave: Necrosis pancreática, drenaje endoscópico, colecciones peripancreáticas, México.
Abstract
In the last Digestive Disease Week held in the city of Orlando, Florida in the United States, several papers were presented in summary about endoscopic drainage of pancreatic necrosis and pancreatic fluid collections. The trend in the studies is to evaluate and compare the technical factors of endoscopic drainage and establish the variables that predict recurrence or long-term resolution of peripancreatic fluid collections, then we will discuss four papers in this area.
Keywords: Pancreatic necrosis, endoscopic drainage, pancreatic fluid collections, Mexico.
Navin Paul y colaboradores presentaron su trabajo en resumen titulado "el drenaje de seudoquistes pancreáticos y necrosis pancreática licuada guiada por ultrasonido endoscópico (USE): prótesis metálicas autoexpandibles totalmente cubiertas (PMTC) contra prótesis plásticas (PP) doble cola de cochino mediante cistogastrostomía".1 El diseño del estudio fue una comparación retrospectiva. Las variables relacionadas al procedimiento y los resultados del mismo fueron analizados 24 horas y 30 días posteriores a la realización de la cistogastrostomía. El éxito técnico con PMTC fue de 100% (12/12 enfermos), en tanto de 91% para PP (11/12). No hubo diferencias significativas en la edad, género ni diámetro de la colección líquida entre ambos grupos de tratamiento. Se observó una diferencia significativa en el diámetro de la dilatación requerida de la fistula cistogástrica, entre el grupo de PMTC contra PP (3 mm contra 7.4 mm; p=0.001). El tiempo total del procedimiento fue mayor para el grupo de PP (22.8 minutos contra 68.8 minutos; p=0.006). En todos los enfermos del grupo de PMTC se colocó una prótesis de 10 mm de diámetro, en tanto en el grupo de PP se colocó un promedio de 2.54 prótesis con un diámetro promedio de 9.54 F. En 1/12 (8%) enfermos de PMTC y en 3/12 (25%) de PP se observó migración al estómago de la prótesis, no se presentó ningún caso de migración al interior de la colección. Se observó un decremento significativo del diámetro de la colección posterior al drenaje en ambos grupos de tratamiento, sin embargo este se presentó en promedio 4.7 días en el grupo de PMTC y a los 61 días en PP. No se identificó ninguna recurrencia de la colección en el grupo de PMTC, en tanto esto se observó en 3/12 (25%) en PP, los cuales necesitaron nuevo drenaje endoscópico en uno y drenaje quirúrgico en dos enfermos. No se observaron complicaciones inmediatas o tardías en el grupo de PMTC, en tanto en 1/12 (8%) del grupo de PP presentó neumoperitoneo y requirió cirugía.
Este trabajo comparativo por supuesto adolece de los problemas de una evaluación retrospectiva, sin embargo pone de manifiesto la ventaja teórica de que las prótesis metálicas aunque inicialmente aparentemente más caras permiten un mejor y más rápido drenaje de la colección, menos riesgo de oclusión y menor tiempo del procedimiento. El trabajo de Navin y colaboradores no evalúa los costos de ambos grupos de tratamiento, sin embargo por supuesto se esperan trabajos comparativos prospectivos que muestren el mayor costo-beneficio de las prótesis metálicas en el drenaje de colecciones líquidas peripancreáticas. Un punto especial a evaluar en futuros estudios es la utilidad de las prótesis metálicas con diseño de "doble campana" que disminuye en teoría el riesgo de migración, manteniendo la posibilidad de un diámetro amplio de 10 mm que incluso permite la posibilidad de necrosectomía transluminal.
Alireza Sedarat y colaboradores presentaron un trabajo en resumen titulado "técnica para drenaje endoscópico de colecciones líquidas pancreáticas organizadas". Un estudio de patrones de práctica entre expertos.2 El objetivo del estudio fue evaluar en la práctica de los expertos los patrones preferidos de preparación del enfermo, posición para el drenaje así como instrumentación para realizar la cistogastrostomía. Los autores enviaron por internet un cuestionario de 10 preguntas a un grupo de 60 expertos, 33 (55%) contestaron y completaron dicho cuestionario. El 75% de los endoscopistas realizan el procedimiento con intubación endotraqueal electiva y el 52% prefieren la posición del enfermo en decúbito lateral izquierdo, sin embargo el 89% consideran que la posición no afecta el éxito del procedimiento. La mayoría usan el ecoendoscopio para realizar la punción inicial y hasta completar el procedimiento sin cambiar de endoscopio. El 64% de los endoscopistas realizan una dilatación de la cistogastrostomía entre 8 y 12 mm, 15% entre 12 y 18 mm, y 21% a menos de 8 mm; ninguno dilata a más de 18 mm. No existen estudios prospectivos en la literatura que hayan comparado la posición y preparación del enfermo, ni las distintas modalidades técnicas y diversos accesorios disponibles para realizar una cistogastrostomía endoscópica. Es clara la imposibilidad y no necesidad de hacer un estudio comparativo entre intubar y no hacerlo en un enfermo que va a ser sometido a un drenaje transluminal, con posibilidad alta de broncoaspiración. Sin embargo, ya existen estudios comparativos que destacan la no necesidad de un drenaje guiado por endosonografía, cuando existe una compresión clara de la pared del duodeno o estómago y si en cambio su gran utilidad en ausencia de compresión o várices en la pared del trayecto de punción. Este trabajo significa un guía en opinión de expertos de la técnica y preparación del enfermo para realizar una derivación cistogástrica, pero por supuesto susceptible de modificarse en el contexto de recursos humanos y materiales disponibles en cada centro hospitalario.
Un trabajo de interés fue realizado por Ji Young Bang y colaboradores, presentado en resumen se titula "evolución de las estrategias de tratamiento en el manejo endoscópico de la necrosis pancreática".3 El objetivo del estudio fue identificar los factores que mejoran los resultados del drenaje endoscópico en enfermos con necrosis pancreática. Este fue un estudio retrospectivo de enfermos tratados durante un periodo de nueve años. A todos los drenajes se les colocó prótesis doble cola de cochino aunado a un drenaje nasoquístico, para lavado de la cavidad. En enfermos seleccionados se les realizó la técnica de drenaje transluminal múltiple. En enfermos con síndrome de conducto pancreático desconectado, las prótesis transmurales se dejaron en posición de manera indefinida a fin de evitar la recurrencia de la colección. En el periodo de estudio 79 enfermos fueron tratados, el drenaje fue exitoso en 51 enfermos (68.9%). Los enfermos a los cuales se les realizó la técnica de drenaje transmural múltiple (n=16) tenían mayor éxito del tratamiento, que con la técnica de drenaje convencional (n=58), 93.8% contra 62.1% (p=0.02). En el análisis multivariado sólo la técnica de drenaje transmural múltiple (p=0.02) y la carencia de necesidad de intervenciones endoscópicas múltiples (p=0.03) fueron predictivos del éxito del tratamiento. De los 51 enfermos con éxito del tratamiento a largo plazo, la recurrencia de la colección se presentó en 0 de 27 enfermos con prótesis permanentes transmurales en comparación a cinco recurrencias en los 24 enfermos en los que se retiró las prótesis (0% contra 20.8%, p=0.02). En una media de seguimiento de 314 días, se encontraron complicaciones en cinco de 40 (12.5%) enfermos con síndrome de conducto pancreático desconectado, uno requirió pancreatectomía distal y otro pancreatectomía total por recurrencia de la colección o persistencia de síntomas, en los otros tres enfermos se presentó migración de las prótesis. Las conclusiones y mensaje trascendente de este trabajo son que el drenaje de la necrosis pancreática se acompaña de un mayor éxito cuando se realiza la técnica de drenaje transmural múltiple, y que la permanencia de las prótesis transmurales disminuye significativamente la recurrencia de la colección. Estos conceptos se pueden llevar a la práctica teniendo en mente y particularmente en las colecciones grandes con necrosis, la ventaja de realizar fistulas múltiples transgástricas y transduodenales en el mismo enfermo a fin de permitir un drenaje lo más óptimo posible, incluso un punto a investigar en el futuro es la ventaja de mantener dichas fistulas permeables con la colocación de prótesis metálicas autoexpandibles múltiples transgástricas y transduodenales. El concepto del síndrome del conducto pancreático desconectado es un problema hoy día incompletamente resuelto con tratamiento endoscópico, y que en la mayoría de los casos requiere prótesis transmurales por tiempo indefinido o bien, tratamiento quirúrgico que hoy día con técnicas de resección o de drenaje constituyen una alternativa muy eficaz en la resolución del problema.
Surinder S. Rana y colaboradores presentaron un trabajo muy interesante titulado "consecuencias a largo plazo de prótesis transmurales permanentes en enfermos con colecciones asociadas a necrosis pancreática y síndrome del conducto pancreático desconectado".4 El estudio fue una evaluación retrospectiva de enfermos sometidos a tratamiento en los últimos tres años. Se incluyeron en el estudio 25 enfermos que fueron seguidos por un promedio de 19.1 ± 10.9 meses (rango dos a 34 meses). En todos los enfermos se colocaron de manera permanente y por vía transgástrica dos o tres prótesis plásticas doble cola de cochino de 7 F (16 enfermos) o 10 F (nueve enfermos) y de 5 cm de longitud. La pancreatografía endoscópica reveló el conducto pancreático desconectado en la cabeza, cuerpo y cola en 18, seis y un enfermo, respectivamente. Cuatro enfermos (16%) presentaron migración espontánea de las prótesis transmurales. La migración de las prótesis no causó ningún síntoma. Ninguno de los 25 enfermos incluidos en el estudio presentó recurrencia de la colección. Los autores concluyen que la permanencia de las prótesis transmurales en enfermos con colecciones asociadas a necrosis pancreática y síndrome de conducto pancreático desconectado, es seguro y parece disminuir el riesgo de recurrencia de la colección. Es bien sabido que en necrosis pancreática posterior a una pancreatitis aguda, se puede presentar el síndrome de conducto pancreático desconectado hasta en el 50% de los enfermos. El tratamiento endoscópico de esta condición entraña el drenaje transmural de la colección al estómago o duodeno, con la permanencia indefinida de las prótesis que ferulizan dichas fístulas, a fin de producir un drenaje interno del segmento proximal del conducto pancreático excluido. Retirar estas prótesis condiciona el riesgo de recurrencia de la colección alimentada por el segmento pancreático desconectado. El estudio de Surinder y colaboradores destaca el riesgo de migración de las prótesis transmurales de un 16%, sin embargo llama la atención que en el seguimiento ninguna de las colecciones recurrió, lo cual en mi opinión puede tener dos explicaciones, primero que a pesar de migración de las prótesis persiste permeable la fístula interna creada por endoscopia, lo cual drena el segmento pancreático excluido. La segunda explicación es que el seguimiento es corto y que prolongarlo puede hacer más evidente el incremento en la recurrencia de la colección, pues es posible que con mayor seguimiento la fístula interna que persiste aún en ausencia de prótesis cierre totalmente, y con ello el jugo pancreático del segmento excluido alimente y reforme la colección.
Referencias
1. Paul N, Abboud G, Jamil LH, et al. EUS Guided Drainage of Pancreatic Pseudo-cyst and Walled off Liquefied Pancreatic Necrosis- Fully Covered Self-Expanding Metal Stent (FCSEMS) vs. Double Pigtail Plastic Stent for Cyst Gastrostomy. Su1578
2. Sedarat A, Raina A, Chandrasekhara T, et al. Techniques for Endoscopic Drainage of Organized Pancreatic Fluid Collections: a Survey of Practice Patterns Amongst Experts. Mo1441
3. Bang JY, Hasan M, Ramesh R, et al. Evolving Treatment Strategies in the Endoscopic Management of Walled-off Pancreatic Necrosis (WOPN). Mo1443
4. Rana SS, Bhasin DK, Chalapathi R, et al. Long Term Consequences of Permanent Indwelling Transmural Stents in Patients With Walled off Pancreatic Necrosis & Disconnected Pancreatic Duct Syndrome. 765