Introducción: El tratamiento de primera línea para la erradicación de Helicobacter pylori (H. pylori) incluye un inhibidor de bomba de protones, claritromicina y amoxicilina (IBP-CA). En Guatemala, la resistencia de H. pylori a claritromicina es elevada y representa un problema importante de salud pública.
Objetivo: Determinar la efectividad del tratamiento con IBP, levofloxacina y amoxicilina (IBP-LA) y compararla con la de IBP-CA.
Material y métodos: Estudio de cohortes no concurrentes, en donde se analizaron prospectivamente 60 pacientes consecutivos con dispepsia y confirmación histológica de infección por H. pylori, a quienes se administró pantoprazol 40 mg b.i.d, levofloxacina 500 mg diario y amoxicilina 1 g b.i.d. vía oral por 10 días (junio de 2009 a mayo de 2010). La curación se verificó con prueba de aliento Urea-C13. La efectividad del tratamiento se comparó con un grupo control retrospectivo de 84 pacientes consecutivos, que recibieron tratamiento con pantoprazol 40 mg b.i.d. (o dosis equivalente de otro IBP), claritromicina 500 mg b.i.d. y amoxicilina 1 g b.i.d. por 10 a 14 días (años 2005 a 2009).
Resultados: La efectividad del tratamiento IBP-LA fue de 85% y 93%, en el análisis por intensión de tratamiento y en el análisis por protocolo, respectivamente. La efectividad para el grupo control fue de 42% (p=0.02).
Conclusión: La efectividad del tratamiento de primera línea con IBP-LA es elevada y superior a IBPCA. Se requieren más estudios para confirmar estos resultados y determinar si el tratamiento IBP-LA debe considerarse como tratamiento de primera línea, en países en vía de desarrollo.
Background: First-line treatment for Helicobacter pylori (H. pylori) infection includes a proton-pump inhibitor, clarithromycin and amoxicillin (PPI-CA). In Guatemala, the rate of resistance of H. pylori to clarithromycin is high and represents an important public health problem.
Aims: To determine the efficacy of a IBP, levofloxacin and amoxicillin (PPI-LA) and compare with PPI-CA.
Patients and methods: cohort´s study in which we prospectively analyzed a group of 60 consecutive dyspeptic patients with histopathologically proven H. pylori infection that received a ten-day oral treatment with pantoprazole 40 mg b.i.d., levofloxacin 500 mg daily, and amoxicillin 1 g b.i.d. from June 2009 to May 2010. Post-treatment H. pylori status was assessed with 13C-urea breath test. The efficacy of treatment was compared with a retrospective and consecutive control group of 84 patients that received pantoprazole 40 mg b.i.d. (or equivalent dose of any other PPI), clarithromycin 500 mg b.i.d. and amoxicillin 1 g b.i.d. for 10 to 14 days during years 2005 to 2009.
Results: PPI-LA treatment eradication rates were 85% and 93% for the intention-to-treat analysis and the per-protocol analysis, respectively. Eradication rate for the control group was 42% (p=0.02).
Conclusion: The efficacy of the first-line treatment with PPI-LA for H. pylori infection is high and superior to the observed with IBP-CA. More studies are required to confirm our results and to determine if PPI-LA treatment should be considered as first-line treatment in developing countries.
Introducción
El bacilo Helicobacter pylori (H. pylori) es una bacteria gram negativa, en forma de espiral, microaerofílica, que desde 1982 fue reconocida por Robin Warren y Barry Marshall como un agente causante de gastritis y úlcera péptica.1,2 Hoy en día, es la causa más frecuente de gastritis y sus complicaciones.3 El H. pylori es uno de los agentes infecciosos más comunes y habita en el estómago de más de la mitad de la población mundial;4 su prevalencia difiere de un país a otro, así como entre grupos étnicos, sociales y etarios, incluso en un mismo país. La prevalencia de H. pylori es mayor en países en vía de desarrollo que en países desarrollados, llegando a ser cercana al 90% en la edad adulta en los países más pobres.3,5 En Guatemala se ha reportado una seroprevalencia de 58% entre pobladores indígenas,6 mientras que en Panamá es de 54%,7 en México de 66%8 y en Colombia de 69%.9
El tratamiento de primera línea para la erradicación del H. pylori sigue siendo la combinación de un inhibidor de bomba de protones, claritromicina y amoxicilina (IBP-CA). El tratamiento con IBP-CA en países desarrollados aún tiene una efectividad relativamente elevada, incluso podría ser superior a la observada con IBP-LA.10 En regiones en donde la resistencia a claritromicina es alta, como es el caso de los países en vía de desarrollo, se han propuesto otras alternativas de tratamiento de primera línea, como la utilización de levofloxacina en sustitución de claritromicina.11 La única serie de casos descrita en Guatemala en relación a la susceptibilidad in vitro del H. pylori consta de 26 cepas de pacientes consecutivos con dispepsia, incluidos 10 pacientes con fallo al tratamiento IBP-CA, en donde se reportó que el 69% fue sensible a amoxicilina, 15% a claritromicina, 96% a levofloxacina, 0% a metronidazol, 88% a tetracilina y 28% a nitrofurantoína.12 En contraste, en Perú, otro país latinoamericano, la prevalencia de resistencia in vitro a levofloxacina se reportó en 36.9%.13 La levofloxacina es una fluoroquinolona con un amplio espectro de acción contra bacterias gram positivas y negativas, entre ellas contra el H. pylori. En regiones de países desarrollados en donde la tasa de resistencia a claritromicina es alta, la efectividad del tratamiento de primera línea IBP-LA es superior a IBP-CA.14 El tratamiento de primera línea con ofloxacina y amoxicilina, y la combinación de levofloxacina y furazolidona como tratamiento de rescate, demostraron ser altamente efectivos en México y Brasil, respectivamente.15,16 La combinación de levofloxacina y amoxicilina no ha sido estudiada en estudiada en América Latina.
El objetivo del presente estudio fue determinar la efectividad del tratamiento con IBP-LA para la erradicación de infección por H. pylori, y compararla con la efectividad del tratamiento con IBP-CA.
Material y métodos
Grupo de estudio
Se identificaron todos los pacientes candidatos a recibir tratamiento de primera línea con IBP-LA durante los meses de junio de 2009 a mayo de 2010, y que acudieron a evaluación basal y de seguimiento en la clínica de consulta externa de la especialidad de Gastroenterología, del Hospital Las Américas y del Hospital General San Juan de Dios. Se incluyeron de forma prospectiva a pacientes consecutivos mayores de 18 años de edad con síntomas dispépticos (dolor epigástrico, distensión abdominal, náusea, vómitos, saciedad precoz, etc.), y diagnóstico de infección por H. pylori, que no han recibido tratamiento previo y que aceptaran participar en el estudio. Se definió como infección por H. pylori la presencia de esta bacteria en el análisis histopatológico con tinción Giemsa de las biopsias del antro y cuerpo gástrico, obtenidas por endoscopia (seis biopsias). El tratamiento administrado fue pantoprazol 40 mg (Altana Pharma, Konstanz, Alemania) dos veces al día, levofloxacina 500 mg (Monte Verde S.A., Argentina) una vez al día y amoxicilina 1 g (Sandoz GmbH, Kundl, Austria) dos veces al día durante 10 días (IBP-LA). En la semana subsecuente al término o suspensión del tratamiento, los pacientes fueron entrevistados para obtener información de eventos adversos. Para evaluar el apego al tratamiento se solicitó a los pacientes que presentaran las cajas de los medicamentos administrados. Para valorar la erradicación del H. pylori a todos los pacientes incluidos en el estudio, se les realizó una prueba de aliento con urea-C13 cuatro a ocho semanas después de finalizado o suspendido el tratamiento. La erradicación del H. pylori se definió como la prueba de aliento con resultado negativo. No fueron incluidos aquellos con antecedente de cirugía gástrica, cáncer gástrico, tratamiento previo para H. pylori, intolerancia o alergia a alguno de los medicamentos incluidos en el estudio, y pacientes con historia de uso de antibióticos o antiinflamatorios durante las cuatro semanas previas. Las variables analizadas fueron la efectividad del tratamiento, eventos adversos y adherencia al tratamiento.
Grupo control
Este grupo de pacientes se analizó de forma retrospectiva debido a que el protocolo no fue avalado por las autoridades hospitalarias para realizarse de manera prospectiva, por la elevada tasa de resistencia a claritromicina en Guatemala (85%).12 En este grupo se incluyó a todos los pacientes que en el periodo de 2005 a 2009 recibieron tratamiento de primera línea para erradicación de H. pylori, con la combinación de pantoprazol 40 mg dos veces al día (o dosis equivalente de cualquier otro IBP), claritromicina 500 mg dos veces al día y amoxicilina 1 g dos veces al día por 10 a 14 días (IBP-CA), en la Unidad de Gastroenterología y Endoscopia Digestiva del Hospital Las Américas y del Hospital General San Juan de Dios.
El diagnóstico de infección por H. pylori en el grupo control también se realizó en biopsias obtenidas por medio de endoscopia, mientras que la erradicación de la infección fue confirmada con biopsia o prueba de aliento urea-C13 entre la cuarta y octava semanas posterior al tratamiento. Los criterios de exclusión fueron los mismos que para el grupo de estudio. Por la naturaleza retrospectiva del análisis de este grupo, no existió control sobre el número exacto de dosis tomadas; sin embargo, sólo se incluyeron para el presente estudio aquellos pacientes en los cuales en el expediente estaba descrito que el tratamiento fue tomado de manera completa. En este grupo, los eventos adversos y complicaciones, tanto del método diagnóstico como del tratamiento, no fueron analizados.
Los procedimientos endoscópicos en ambos grupos fueron realizados por gastroenterólogos endoscopistas expertos. Se utilizaron equipos de endoscopia estándar (GIF Q100-160®, Olympus Corporation, Tokyo, Japón). El criterio para administración de sedantes intravenosos (propofol y/o midazolam) o únicamente anestesia tópica (dos a cuatro aplicaciones de atomizador de lidocaína al 10%, Laboratorios Farma, Caracas, Venezuela) en orofaringe para la endoscopia quedó a discreción del endoscopista y del anestesiólogo, en conjunto con la preferencia del paciente. En todos los pacientes se tomaron por lo menos cuatro biopsias del antro y dos del cuerpo gástrico, las cuales fueron conservadas en formalina, incluidas en parafina, cortadas y teñidas (tinciones de hematoxilina & eosina y giemsa). Las biopsias fueron obtenidas con el uso de una pinza estándar (Radial Jaw® 3 o 4, Boston Scientific Corporation, Natick, MA, EUA). El análisis microscópico fue realizado por patólogos expertos que utilizaron microscopio de luz (CX 31®, Olympus Corporation, Tokyo, Japón).
El protocolo fue evaluado y autorizado por las autoridades correspondientes de las instituciones participantes.
Análisis estadístico
Los datos de los pacientes son expresados en frecuencias absolutas y relativas, medianas e intervalos mínimo y máximo. Para la comparación de las posibles diferencias de las variables dicotómicas entre los grupos de acuerdo al tratamiento recibido, se utilizó prueba de ji cuadrada o prueba exacta de Fisher conforme al número de eventos esperados en cada celdilla. Para las variables continuas se utilizó prueba t de student o la prueba U de Mann-Whitney, de acuerdo a la distribución de la variable. El análisis de resultados se realizó por intención de tratar (IT) y por protocolo (PP). En el análisis por IT se incluyó a todos los pacientes que iniciaron el tratamiento, mientras que en el análisis PP se incluyó a pacientes que reportaron haber completado al menos 90% de las dosis del tratamiento. La efectividad del tratamiento PP se comparó con la efectividad del tratamiento en el grupo control. Los valores de p≤0.05 fueron considerados estadísticamente significativos. Para el análisis estadístico se utilizó el programa SPSS/PC versión 13.0 (SPSS, Chicago, IL).
Resultados
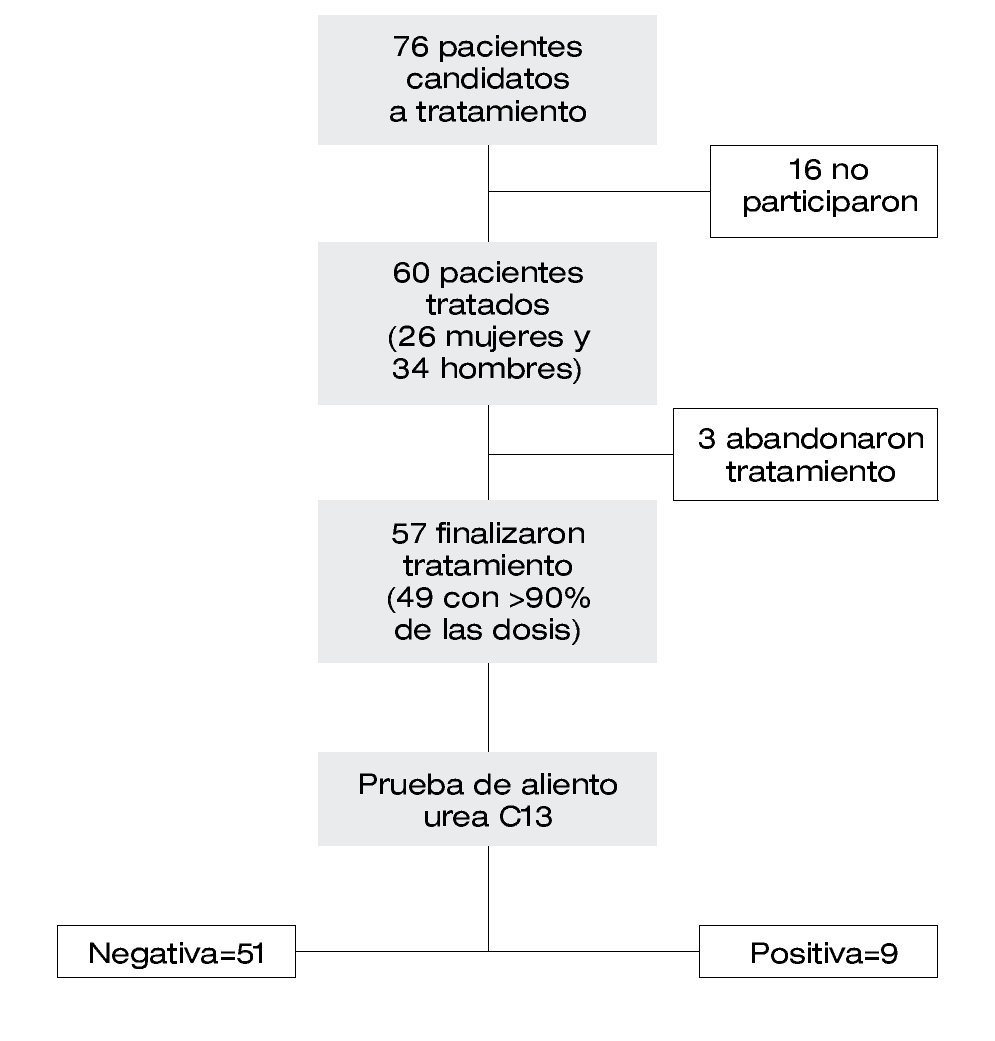
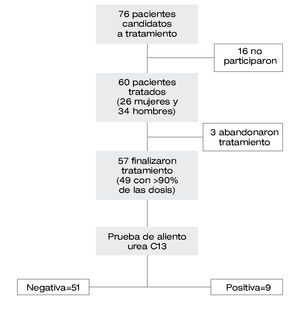
Se identificaron 76 pacientes candidatos al tratamiento IBP-LA; 16 de ellos no aceptaron participar en el estudio. En éste se analizaron 60 pacientes (mujeres=26, 43%) de 40.7 ± 13.6 años de edad (mediana=40.5, intervalo=18-72) (Figura 1). En el grupo control se analizaron 84 pacientes (mujeres=37, 44%) de 38.2 ± 11.9 años de edad (mediana=36.5, intervalo=19-66). No se observó diferencia significativa en relación al género y edad entre ambos grupos (p>0.05).
| Figura 1. Grupo de pacientes identificados y tratados con pantoprazol, levofloxacina y amoxicilina.
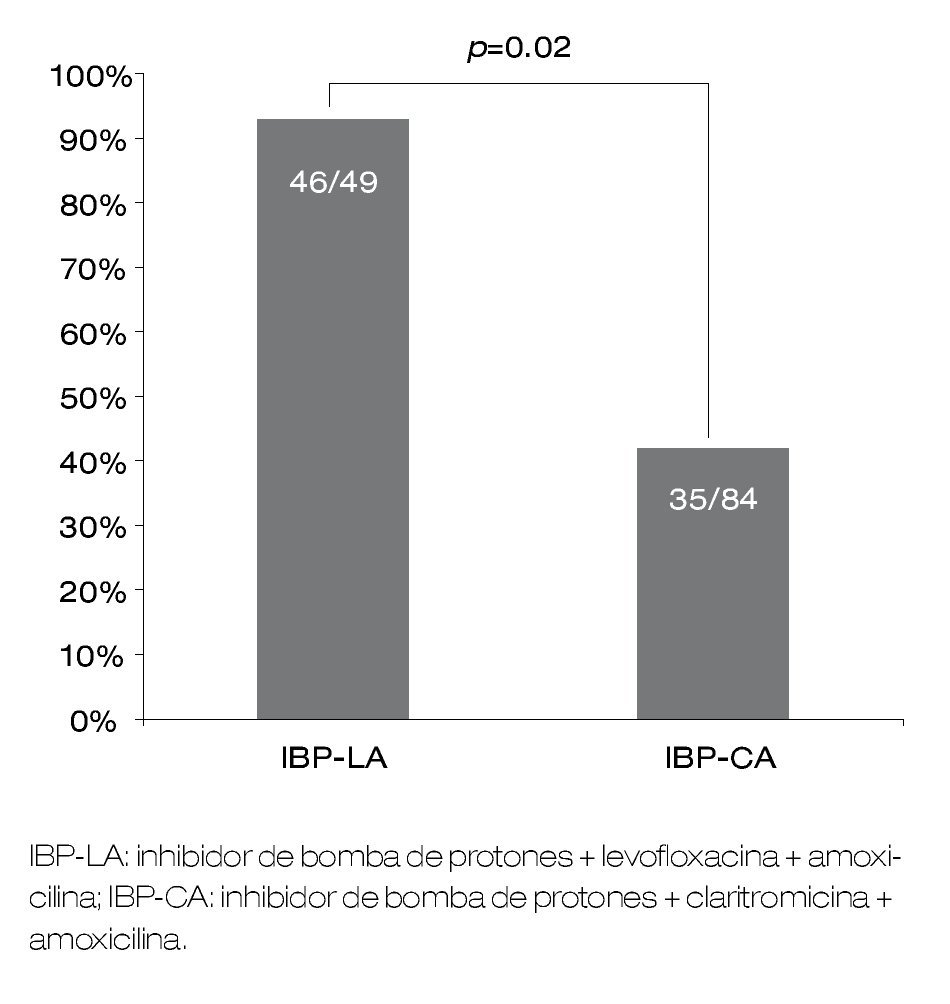
La prueba de aliento al final del tratamiento con IBP-LA fue negativa en 51 de 60 pacientes (efectividad del tratamiento en análisis por IT=85%). Cuarenta y nueve pacientes reportaron haber tomado más del 90% de las dosis, de los cuales 46 tuvieron negativa la prueba de aliento (efectividad del tratamiento en el análisis PP=93%). En el grupo control se confirmó erradicación del H. pylori en 35 de 84 pacientes (42%). La efectividad en el análisis PP del tratamiento con IBP-LA fue significativamente mayor a la efectividad del tratamiento IBP-CA (p=0.02, OR=21.4, IC 95%=6.1-74, NNT=4.4, RA=22.4%) (Figura 2).
| Figura 2. Efectividad del tratamiento con IBP-LA (análisis por protocolo) y del tratamiento con IBP-CA (análisis retrospectivo).
De los pacientes que iniciaron el tratamiento con IBP-LA, tres (5%) lo suspendieron al tercer día a causa de eventos adversos (Figura 1): vómitos (dos pacientes), dolor abdominal (un paciente). Catorce pacientes reportaron haber tenido un total de 25 episodios de eventos adversos durante el tratamiento (proporción de pacientes con algún evento adverso = 23%), los cuales fueron: náusea en siete (12%), vómitos en cinco (8%), dolor abdominal en tres (5%), cefalea en dos (3%), diarrea en dos (3%), malestar general inespecífico en dos (3%), y otros eventos adversos en cuatro (7%) pacientes. No se observaron complicaciones asociadas a los procedimientos endoscópicos.
Los hallazgos endoscópicos más frecuentes para el grupo de tratamiento con IBP-LA fueron: gastritis folicular en 47 (78%) pacientes, esofagitis erosiva en 19 (31%), gastritis erosiva en 10 (16%), úlcera gástrica en siete (12%) y úlcera duodenal en uno (2%); mientras que para el grupo control los hallazgos fueron: gastritis folicular en 61 (72%) pacientes, esofagitis erosiva en 34 (40%), gastritis erosiva en 12 (14%), úlcera gástrica en 10 (12%) y úlcera duodenal en dos (2%) pacientes. Todas las úlceras identificadas tuvieron una clasificación endoscópica Forrest III. No se observó diferencia estadística en los hallazgos endoscópicos entre ambos grupos (p>0.05). El análisis histopatológico reveló gastritis asociada a la presencia de H. pylori en todos los pacientes, metaplasia intestinal en cinco (8%) pacientes del grupo IBP-LA y en ocho (9%) del grupo control (p>0.05), mientras que atrofia del epitelio gástrico fue reportada en cuatro pacientes por grupo (p>0.05) y displasia en ninguno. Adicionalmente, se encontró esófago de Barrett en dos pacientes por grupo (p>0.05).
Discusión
El tratamiento de primera línea para la erradicación de H. pylori recomendado hasta ahora en los consensos de Maastricht, Asia, América Latina, México, así como en las Guías Prácticas de la Organización Mundial de Gastroenterología, sigue siendo la combinación de un inhibidor de bomba con claritromicina y amoxicilina,17-23 del cual recientemente se han observado tasas de efectividad menores a las reportadas inicialmente.24 Asimismo, se conoce que la prevalencia de cepas de H. pylori resistentes a claritromicina y otros antibióticos está aumentando, por lo que se ha requerido de nuevos esquemas terapéuticos.25
Según recomendaciones de expertos y de la Primera Conferencia de Consenso en Maastricht en el año 1997, los tratamientos recomendados para la erradicación del H. pylori deben tener una efectividad por IT mayor del 80% e idealmente mayor al 90%.17,25 En población guatemalteca observamos que la respuesta a tratamiento de primera línea con IBP-AC es baja (42%), por lo que no es una alternativa apropiada. Parece ser que la efectividad en Guatemala es menor que en países más desarrollados.10 La tasa de erradicación del H. pylori con el esquema IBP-LA, tanto en el análisis por IT como PP es de alrededor del 90%, que lo convierte en una adecuada alternativa de tratamiento. Estos resultados contrastan con los reportados recientemente en España, Turquía y Taiwán, países en donde la tasa de resistencia a claritromicina también es alta y la respuesta al tratamiento con levofloxacina es menor al 80%.10,11,26 Recientemente, se publicó un estudio realizado en Taiwán en donde se observó que la tasa de resistencia in vitro del H. pylori a levofloxacina y ciprofloxacina se incrementó de 2.8% en los años 1998-2003 a 11.8% en los años 2004-2007,27 por lo que podría esperarse que también en América Latina se observe una tasa de resistencia con el mismo comportamiento.
Además de su alta efectividad, la tasa de abandono de tratamiento fue baja (5%). Gispert y colaboradores reportaron en el año 2006 en una revisión sistemática, que el tratamiento de rescate con IBP-LA además de tener una alta efectividad, es bien tolerado, lo cual lo ha llevado a estudiarse primordialmente como tratamiento de segunda línea.28-31 La evidencia de la efectividad del IBP-LA como tratamiento de primera línea aún es escasa y proviene mayormente de países desarrollados; este trabajo es el primero destinado a conocer su efectividad en un país de América Latina. La tasa de eventos adversos con el esquema tradicional IBP-CA es baja pero su efectividad también, lo que lo convierte en un problema de salud importante en Guatemala y probablemente en otros países en vía de desarrollo. Por tanto, el esquema de tratamiento IBP-LA debe estudiarse de forma más amplia para determinar si debe sustituir al tradicional esquema de primera línea. La limitación más importante de este estudio es la naturaleza retrospectiva del grupo control, que impide el análisis de algunas variables importantes como los eventos adversos. La baja efectividad en el grupo control podría estar influenciada por su carácter retrospectivo, lo que hace imposible determinar el apego al tratamiento. Aunque no fue objetivo de este estudio, podría ser otra limitación el hecho que no se comparó si la duración de 10 o 14 días de tratamiento tuvo algún impacto en los resultados del grupo control; sin embargo, ambas duraciones son ampliamente recomendadas.19
En conclusión, en Guatemala el tratamiento de primera línea con IBP-LA para la erradicación del H. pylori es altamente efectivo, bien tolerado y alcanza una efectividad significativamente superior a la observada con el esquema IBP-CA. Se requiere de más estudios para establecer si el tratamiento IBP-LA debe sustituir al esquema tradicional.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este estudio.
Agradecimientos
Los autores agradecen la colaboración del Dr. Nery F. Quiñónez.
Correspondencia: Dr. Josué Barahona Garrido.
Unidad de Gastroenterología y Endoscopia Digestiva, Hospital Las Américas, 10 calle 2-45 zona 14, oficina 204, C.P. 01014.
Ciudad de Guatemala, Guatemala.
Teléfonos: (502) 57064084, (502) 23854915. Fax: (502) 23854913.
Correo electrónico: gastromedic@gmail.com