Las lesiones subepiteliales (LSE) constituyen un hallazgo incidental en la mayoría de los casos. Algunas de estas lesiones tienen potencial maligno, por lo que es importante identificarlas para su manejo. El ultrasonido endoscópico (USE) es el mejor método de imagen para caracterizar a este tipo de lesiones, ya que puede establecer su localización precisa dentro de la pared gastrointestinal, y proporcionar información sobre sus características ultrasonográficas, que pueden orientar el diagnóstico diferencial de una LSE. Además, si es necesario permite la obtención de tejido para su análisis citológico, por lo que basado en los hallazgos de la endosonografía, el médico puede decidir entre la vigilancia y la resección de las LSE.
The subepithelial lesion is usually found incidentally during gastrointestinal (GI) endoscopy. Because of some of subepithelial lesions have a malignant potential is important to recognize these lesions for management. The endoscopic ultrasound (EUS) is the best imaging method for the characterization of these lesions, because only EUS can establish the precise location of the lesion within the GI wall and provide information on the sonographic characteristics to narrow differential diagnosis of the subepithelial lesion. In addition when is necessary, enable the procurement of tissue for cytologic evaluation. Based on EUS result the clinician can decide between the surveillance and the resection of subepithelial lesion.
Pagina nueva 1
Introducción
Aunque se les llega a denominar lesiones submucosas, su nombre correcto es lesiones subepiteliales (LSE) ya que pueden originarse en cualquier capa de la pared gastrointestinal o fuera de la misma.1 Su prevalencia en endoscopias de rutina es desconocido. En un estudio retrospectivo reportan que las LSE gástricas fueron identificadas en 0.36% de estudios endoscópicos, realizados entre 1976 y 1984.1 En otro estudio más reciente, en el cual se revisaron los expedientes clínicos de 104 159 pacientes, quienes fueron sometidos a endoscopia superior, el 0.76% resultaron con una LSE.2 La localización más frecuente de este tipo de lesiones es el estómago (60%), seguida del esófago (30%) y el duodeno (10%).3 La mayoría de LSE son asintomáticas, de tamaño pequeño y cubiertas por mucosa normal.4 En un estudio por Jenssen y colaboradores, en el 87% de los casos de LSE, los síntomas presentes no correspondían con la LSE.5
La determinación del tipo de LSE es crucial debido a que se ha demostrado que por cada cinco LSE, al menos una puede ser maligna.4
Valoración inicial de las LSE
La endoscopia estándar puede evaluar su tamaño, forma, movilidad, consistencia, pulsación, color y apariencia de la mucosa. Sin embargo, puede ser difícil diferenciar una lesión intramural de una compresión extramural únicamente con endoscopia.
Dos estudios prospectivos han demostrado que la endoscopia tiene una sensibilidad de 89%-98%, con una especificidad entre 29%-64%.6,7 La valoración endoscópica de una LSE con respecto a su tamaño es útil, si se utiliza como referencia la pinza de biopsia abierta. Además, se sugiere que la endoscopia podría ser suficiente para caracterizar y diagnosticar los lipomas, basado en la presencia o ausencia del signo de la almohada (especificidad del 99%/ sensibilidad del 40%). Es importante mencionar que, la endoscopia no ha demostrado ser útil en el diagnóstico de otro tipo de LSE.1,6
Con respecto a las técnicas de imagen de corte transversal como el ultrasonido transabdominal, la tomografía computarizada (TC) y la resonancia magnética (RM), resultan ser adecuadas para detectar la presencia de estructuras normales o anormales fuera de la pared del tracto gastrointestinal como causas de compresiones extrínsecas, pero no son capaces de distinguir entre las diferentes LSE intramurales.7
El ultrasonido endoscópico (USE) puede caracterizar de manera más completa las LSE, demostrando su localización (intramural o extramural), el tamaño, la ecogenicidad, la vascularidad y la presencia o no de adenopatías asociadas.3 El USE puede evidenciar la capa histológica de origen de la lesión dentro de la pared gastrointestinal.1
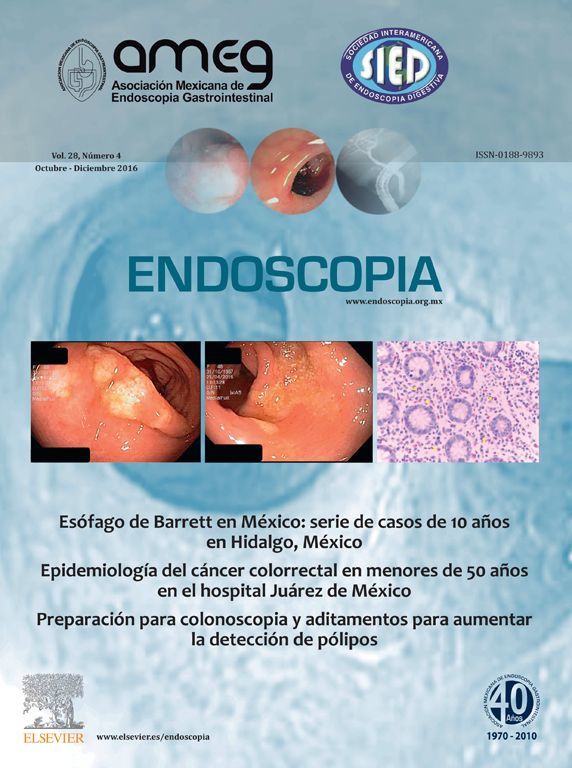
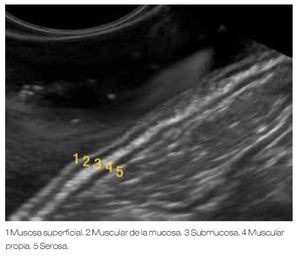
La imagen endosonográfica de la pared del tracto gastrointestinal típicamente exhibe cinco diferentes capas (Figura 1), pero es posible visualizar hasta siete a nueve capas, dependiendo de la región del tracto gastrointestinal que es examinado y de la frecuencia del transductor.3,6,8 A mayor frecuencia del transductor del ultrasonido utilizado, existe mayor definición de las capas de la pared del tracto gastrointestinal valorado, pero menor capacidad de profundidad de la imagen obtenida.9
Figura 1. Representación de las cinco capas apreciadas con la evaluación del USE, en relación a las estructuras histológicas de la pared gastrointestinal.
Papel del USE para evaluación de las LSE
El USE constituye el mejor método para diferenciar entre las LSE intramurales y extramurales.3,4,6 La mayoría de las LSE en el tracto gastrointestinal superior son identificadas en la mucosa profunda, submucosa y muscular propia. En un estudio que incluyó pacientes a quienes se le realizó USE para la valoración de LSE, el 17.6% de las lesiones correspondieron a compresiones extrínsecas.5
LSE intramurales
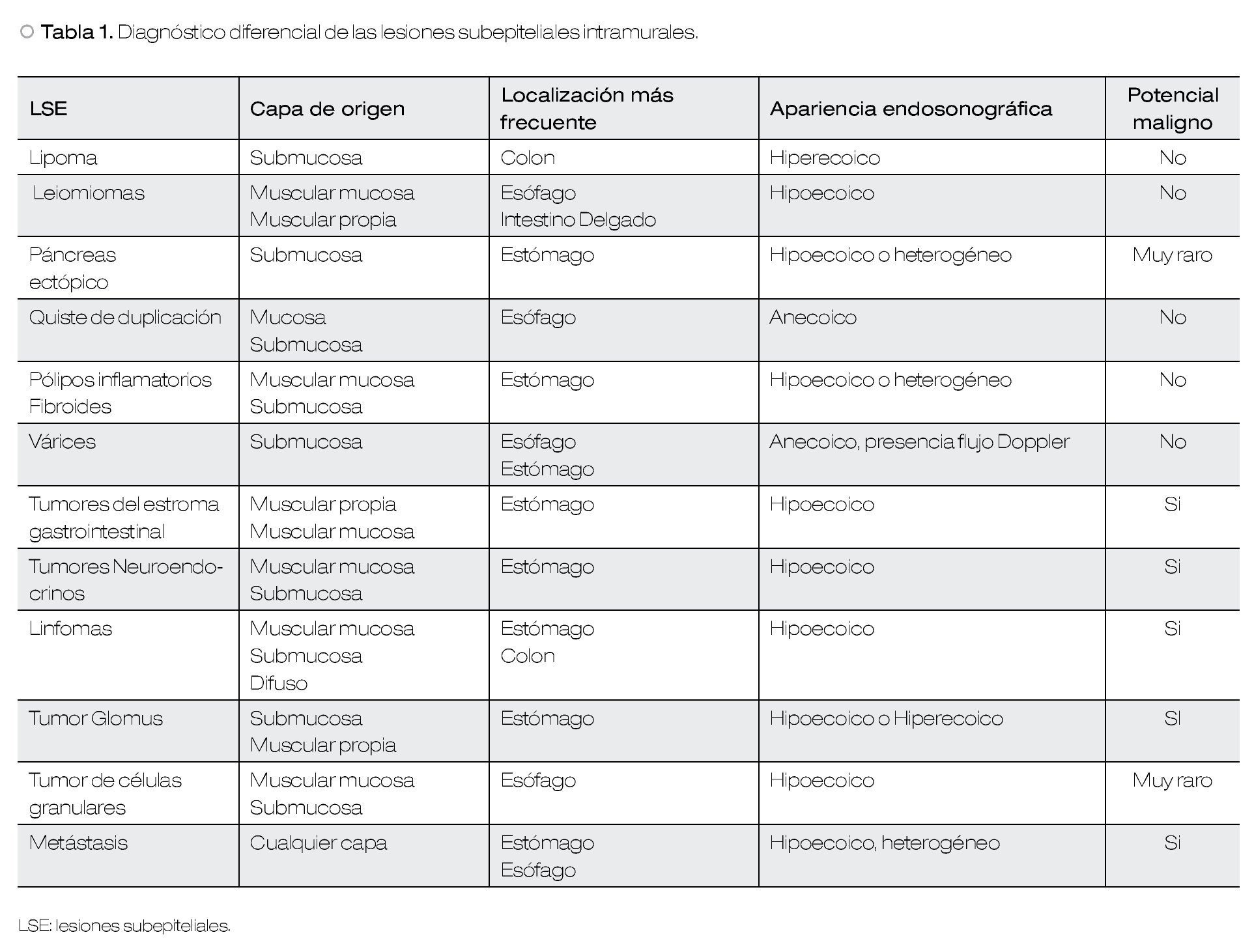
Su localización en determinada capa histológica, el tamaño y la ecotextura determinada por medio del USE pueden orientar el diagnóstico diferencial (Tabla1), y puede ser diagnóstico en algunos casos.1,7,8
La imagen ultrasonográfica de una LSE puede ser homogénea o heterogénea, hiperecoica, hipoecoica, isoecoica o anecoica. La definición de la ecogenicidad de una lesión se logra al compararla con las ecocapas normales de la pared, por ejemplo, con la muscular propia de la pared gastrointestinal (baja ecogenicidad), capa submucosa (alta ecogenicidad) y con el lumen del órgano examinado, el cual debe ser anecoico por la presencia de agua o balón lleno de agua. Además, las LSE anecoicas se pueden evaluar con modo Doppler para investigar su vascularidad.10
El USE puede sugerir también si se trata de una lesión benigna o maligna (Tabla 2). Por lo general, una lesión pequeña bien circunscrita sugiere benignidad, mientras que una LSE ≥ 30 mm, con bordes irregulares, que invade otras capas dentro de la pared o estructuras vecinas, ecogenicidad heterogénea, con presencia de adenopatías regionales, lesiones hepáticas asociadas o líquido libre tienen más posibilidad de sugerir un proceso maligno.5-7 Sin embargo, los estudios que definen estos criterios son escasos y limitados por el número de pacientes, diseño retrospectivo e inadecuada comparación con el estándar de oro.9
Sumado a lo anterior, la interpretación de las imágenes obtenidas por medio del USE es operador dependiente. En un estudio, en el cual se valoró la concordancia interobservador para la evaluación de LSE, se obtuvo una kappa de 0.63. Sin embargo, el acuerdo entre observadores varía de acuerdo al tipo de lesión, siendo muy alto para lesiones anecoicas como las lesiones quísticas y en compresiones extrínsecas (κ=0.8), bueno para los lipomas (κ=0.65), regular para leiomiomas y lesiones vasculares (κ=0.53 y κ=0.54, respectivamente), y pobre para otras LSE (κ=0.34). Adicionalmente, se determinó que existe una relación significativa entre los años de experiencia del operador y su habilidad para lograr diagnósticos precisos usando USE.3
La imagen de la LSE por USE podría ayudar a identificar lesiones cuyo diagnóstico histológico suele ser necesario. Por ejemplo, la localización anatómica de las lesiones hipoecoicas es una clave para poder diferenciarlas, como se determinó en varios estudios, en donde se observó que el 74% a 83% de los tumores con estas características endosonográficas en el esófago, correspondieron a tumores de origen muscular pequeños (leiomiomas o leiomiosarcomas), mientras que en el estómago, un tumor idéntico tiene una probabilidad del 69% a 94% de ser diagnosticado como tumor del estroma gastrointestinal (GIST, por sus siglas en inglés) al examen histológico.5
Según un estudio por Moon y colaboradores, en que se evaluó la concordancia del diagnóstico presuntivo por USE en 205 LSE, fue correcta en solamente 53.7% de los casos. El diagnóstico incorrecto abarcó lesiones hipoecoicas de la tercera o cuarta ecocapa.11 En otro estudio, la mayoría de las lesiones mal diagnosticadas por USE fueron neoplásicas, especialmente GIST y tumores neuroendocrinos. Por lo tanto, el USE puede diagnosticar LSE malignas con una sensibilidad de 64% y con una especificidad del 80%.12
LSE extramurales
La causa más común de LSE extramural observada en el estómago, proviene del bazo o los vasos esplénicos. Otras causas de LSE extramurales incluyen estructuras normales del abdomen como: el lóbulo hepático izquierdo, la vesícula biliar, el colon y el páncreas. Además las lesiones patológicas como tumores, abscesos, seudoquistes pancreáticos, quiste renal, leiomiomas uterinos, aneurismas y adenopatías pueden algunas veces ser identificadas como compresiones extrínsecas en el estómago.6,8
Muestras citológicas e histopatológica en las LSE
Existen varios métodos endoscópicos para obtener una biopsia de una LSE: por medio de pinza endoscópica, biopsia por aspiración con aguja fina (BAAF) y aguja gruesa (trucut) guiada por USE y resección endoscópica submucosa.
La técnica de biopsia sobre biopsia al tomar múltiples muestras en el mismo sitio usando una pinza Jumbo, puede potencialmente obtener tejido de las capas más profundas de la pared gástrica. En una revisión de la Asociación Americana de Gastroenterología, el rendimiento diagnóstico de esta técnica fue del 42% y la frecuencia de complicaciones fue del 2.8%, principalmente sangrado.7 En otro estudio, el rendimiento de la técnica biopsia sobre biopsia en la evaluación de LSE limitadas a la submucosa fue de solamente un 17%.6 En otro estudio por Keswani y colaboradores, con una población de estudio de apenas 20 pacientes, se reportó que en el 81.8% de los casos se alcanzó un diagnóstico definitivo de la LSE por esta técnica.13 Recientemente, Buscaglia y colaboradores realizaron un análisis retrospectivo en 129 pacientes, en los cuales se valoró el rendimiento diagnóstico de la misma técnica con pinza Jumbo para obtener biopsia en las LSE. Los resultados demostraron un diagnóstico definitivo en 65.1% de los casos, en lesiones originadas en la tercera ecocapa de la pared, mientras que aquellas lesiones originadas en la cuarta ecocapa, este método obtuvo apenas el 40% en su diagnóstico definitivo. Con respecto a complicaciones por esta técnica, el 34.9% de los pacientes evaluados presentaron sangrado significativo que requirió algún tipo de terapia endoscópica. Por lo tanto, la pinza Jumbo parece ser una herramienta útil en el diagnóstico de la LSE, principalmente en aquellas lesiones originadas en la tercera ecocapa, pero hay que tener en cuenta el riesgo significativo de sangrado.14
En segundo lugar, la obtención de muestras histológicas de las LSE en el tracto gastrointestinal superior por medio de USE, tiene un rendimiento diagnóstico global bueno. En la mayoría de los pacientes, la BAAF guiada por USE (BAAF-USE) establece un probable o definitivo diagnóstico.15 La BAAF-USE proporciona una muestra citológica que puede distinguir entre benigno y maligno, pero es menos útil para determinar el tipo de lesión presente.
La sensibilidad, la especificidad y la precisión de la evaluación citológica para LSE intramurales fue reportada como baja en los primeros estudios. Pero actualmente, se reporta con alto rendimiento diagnóstico entre 75% a 100%. La sensibilidad para los GIST ha sido estimada en 84% a 89%. Se ha observado que existe mayor rendimiento diagnóstico de este método cuando se trata de lesiones grandes, con localización gástrica y con la presencia de un citopatólogo durante el procedimiento.3 El papel de la BAAF-USE en el diagnóstico de LSE hipoecoicas localizadas en la cuarta capa como los GIST, puede ser mejorada con la aplicación de inmunohistoquímica cuando se obtiene suficiente tejido.6,7,11 En dos estudios que utilizaron inmunohistoquímica, determinaron que un índice de Ki-67 mayor al 5% fue altamente preciso para el diagnóstico de un GIST maligno.5,7 Sin embargo, no está claro si la inmunohistoquímica mejora la habilidad para predecir el comportamiento de los GIST. En cuanto a la histología, uno de los dos principales criterios para valorar el comportamiento biológico de los GIST es el índice mitótico (número de mitosis por 50 campos de alto poder). Las partículas obtenidas de una BAAF e inclusive con aguja trucut, son demasiado pequeñas para ser utilizadas para valorar este índice. Sin embargo, la presencia de cualquier mitosis en las muestras obtenidas en la BAAF-USE, es altamente sugestiva de alto riesgo de malignidad.5
Con respecto al tamaño de la aguja utilizada, se espera que agujas de mayor calibre mejoren la precisión diagnóstica en comparación con agujas de menor calibre. Por tal motivo, en un estudio se comparó la precisión diagnóstica de la BAAF usando agujas 22G y 25G en el mismo paciente, encontrándose que la frecuencia de muestreo tisular y la precisión diagnóstica fueron similares entre ambas. Sin embargo, las agujas 25G fueron superiores a las agujas 22G, en la punción de lesiones pequeñas y móviles.11 En cuanto al número de pases realizados para obtener tejido, se ha observado que el rendimiento se incrementa gradualmente con cada punción subsecuente para alcanzar una meseta después de la cuarta punción. En un estudio japonés, la muestra adecuada fue lograda en un 83% de los casos con 2.5 ± 0.7 punciones.11 Además, la aplicación continua de succión con la jeringa durante la BAAF, mejora la sensibilidad del diagnóstico de malignidad en pacientes con lesiones sólidas. 11
En tercer lugar, la biopsia con aguja trucut guiada por USE puede obtener suficiente tejido para la evaluación histológica, permitiendo evaluar cambios en la arquitectura tisular sumado a la morfología celular.6 La experiencia inicial de la aguja para biopsia por trucut en LSE intramurales, llevó al diagnóstico correcto en cuatro de cinco casos comparado con uno de cinco casos usando BAAF.6 La gran ventaja de la utilización de esta técnica es la cantidad de tejido para realizar la técnica de inmunohistoquímica, el cual se reporta en 89% aproximadamente.16 Sin embargo, hay resultados discordantes sobre si la biopsia con aguja trucut realmente disminuye el número de punciones requeridas para establecer un diagnóstico histológico.5 En la mayoría de las instancias, la biopsia con aguja trucut no ofrece beneficios adicionales que la BAAF, pero esta técnica debe ser considerada para valorar el detalle de la arquitectura celular y la inmunohistoquímica.11 Sumado a lo anterior, la utilización de la aguja trucut guiada por USE es técnicamente difícil, debido a la angulación causada por la rigidez de la punta de la aguja e inclusive no se recomienda el uso del dispositivo más allá del bulbo duodenal.3,17 En un estudio en nueve de 65 pacientes (13.8%), las LSE no fueron accesibles con la aguja trucut, por lo que fueron puncionadas exitosamente con técnica de aguja fina.16
Una nueva aguja para biopsia con una trampa para tejido ha sido desarrollada, (ProCore®; Cook Endoscopy, Winston-Salem, NC, USA), la cual se encuentra disponible en 19G y 22G, fue diseñada para aumentar el rendimiento diagnóstico al permitir la adquisición de muestras de tejido para análisis histológico.3,11 Pero si realmente logra mejorar el muestreo de las LSE es desconocido.3 En un estudio europeo, las muestras histológicas que fueron obtenidas con la aguja ProCore® 19G mostraron una precisión diagnóstica mayor al 90%.11
Las complicaciones de la BAAF o trucut guiadas por USE incluyen infección, sangrado y perforación, pero son muy raros, ocurriendo en aproximadamente el 2% de los casos.7,18 En cuanto si hay riesgo de diseminación de las lesiones malignas, no hay reportes de siembra tumoral después de una BAAF por USE, pero una siembra peritoneal puede desarrollarse si la aguja de aspiración penetra toda la pared gástrica y alcanza el lado del peritoneo.11
Con respecto a la resección endoscópica submucosa y disección, es otra técnica para obtener muestra tisular para un preciso diagnóstico histológico. La evaluación con USE previo a la realización de la resección endoscópica es esencial, debido a que estas técnicas endoscópicas son usualmente reservadas para lesiones confinadas a la submucosa o mucosa profunda, por el gran riesgo de perforación asociado a la resección de lesiones localizadas en la muscular propia.6
La resección y la disección submucosa endoscópica ofrecen mayor diagnóstico que las técnica de biopsia con pinza en las LSE, pero no ha sido comparado con la BAAF o trucut guiado por USE.7
Por último, se ha descrito recientemente un nuevo método para la obtención de histología en las LSE, que consiste en una simple incisión con dispositivo aguja cuchillo guiado por USE sobre la zona convexa más alta de la lesión, y la posterior introducción profunda de una pinza convencional de biopsia para obtener muestras de tejido. Este método tuvo una precisión diagnóstica global del 92.8%, por lo que podría representar una técnica nueva en la obtención de histología en las LSE cuando sea necesario.17
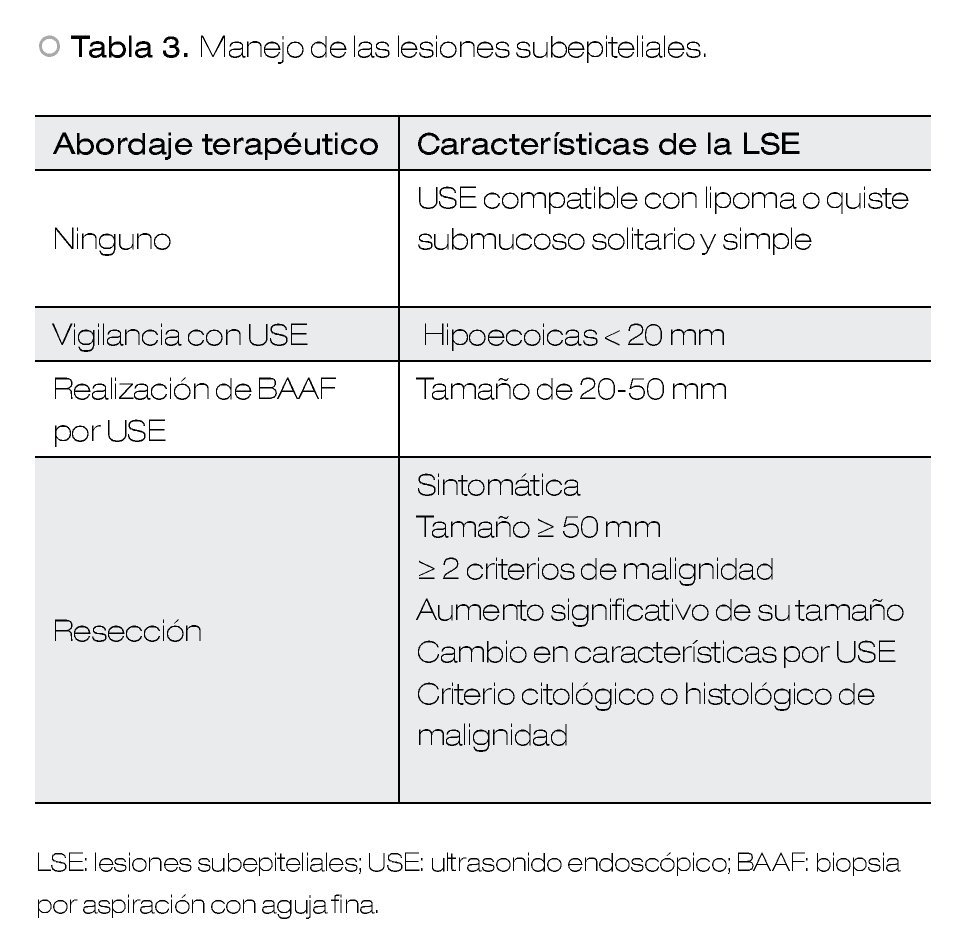
La obtención de histología en las LSE es necesaria para guiar el tratamiento en aquellas lesiones asintomáticas, que midan entre 20-50 mm, no clasificables endosonográficamente como lipomas o quistes y/o sin criterios de malignidad por USE. Esto debido a que las LSE con las características anteriormente mencionadas si son resecadas, el porcentaje de lesiones benignas es inaceptablemente alto. Por otro lado, la mayoría de las LSE pequeñas especialmente < 10 mm no sufren cambios a través del tiempo, por lo que la endoscopia representa el método de vigilancia en esta clase de lesiones, sin ser necesario mayor evaluación diagnóstica.2,5,7
Otras herramientas del USE para la valoración de las LSE
Las herramientas diagnósticas que permitan estimar realmente el riesgo de malignidad de algunas LSE como los GIST de manera preoperatoria, actualmente son escasas.
El ultrasonido transabdominal que cuenta con Doppler mejorado con agentes de contraste y el ultrasonido harmónico mejorado con contraste, han sido utilizados recientemente, para valorar preoperatoriamente la vascularidad de los GIST, lo cual parece ser un predictor de malignidad de este tipo de lesiones.19
La mayoría de los ecoendoscopios tienen una banda de frecuencia limitada que produce una señal acústica insuficiente para imágenes harmónico con contraste, usando agentes de primera línea como Levovist® (Bayer, Pymble, Australia). Sin embargo, agentes de contraste de segunda generación, tales como SonoVue® (Bracco International, Amsterdam, Países Bajos) y Sonazoid® (Daiichi Pharmaceutical Co, Tokyo, Japon) producen señales harmónicas a señales acústicas bajas, adecuadas para la imagen con USE. Recientemente, la tecnología de USE harmónica también ha mejorado, con el desarrollo de transductores de banda ancha.19
En un estudio por Sakamoto y colaboradores, se evaluó la imagen de los vasos dentro de LSE por medio del USE harmónico mejorado con contraste. Las imágenes de los vasos fueron clasificados de acuerdo al patrón de los vasos en regular (vasos finos en el tumor), irregular (vasos grandes e irregulares que fluyen desde la periferia al centro de la lesión) y con ausencia de vasos. Estas mismas imágenes obtenidas fueron categorizadas en tipo I: vasos regulares con reforzamiento homogéneo de la imagen de la lesión, y tipo II: vasos irregulares con reforzamiento heterogéneo en la imagen de la lesión. El USE harmónico mejorado con medio de contraste clasificó a todos los GIST con alto grado de malignidad como tipo II, con una sensibilidad, especificidad y precisión de 100%, 63% y 83%, respectivamente. Por lo tanto, los autores concluyen que el USE harmónico mejorado con contraste podría ser usado exitosamente para visualizar la microvasculatura intratumoral, la cual es un importante factor para determinar el riesgo de malignidad de los GIST, especialmente para lesiones pequeñas.19
Otra herramienta del USE es la elastografía. Esta es una técnica para valorar la elasticidad de los tejidos, al comparar las imágenes obtenidas antes y después de la aplicación de una ligera compresión. Como es conocido algunas enfermedades, por ejemplo el cáncer, produce cambios en la elasticidad de los tejidos, por lo que la elastografía puede ayudar a diferenciar entre lesiones benignas y malignas en el tracto gastrointestinal. Con el objetivo de realizar diferencias claras en la determinación de la elasticidad de los tejidos, la imagen endosonográfica se ha codificado con diferentes colores: azul, para el tejido menos elástico; verde, para el tejido más duro (fibrosis); rojo, para la grasa y amarillo, para tejido normal. La mayoría de estudios que reportan esta técnica ha sido en la valoración de masas pancreáticas y adenopatías.20 Sin embargo, existen resultados preliminares de un estudio que sugiere que la elastografía por USE puede proveer información importante y tener la posibilidad de diferenciar lesiones benignas y malignas, entre lesiones sólidas gastrointestinales como lo son algunas LSE.10
LSE del tracto gastrointestinal inferior
El USE no ha sido utilizado ampliamente en las neoplasias localizadas en colon, debido a que la endosonografía colonoscópica incluye un instrumento rígido e inflexible con diámetros grandes en su punta, por lo que existe gran dificultad para su manipulación en las lesiones estenóticas o proximales en el colon. La introducción de los minisondas de USE con alta frecuencia ha sobrepasado la mayoría de estos problemas, ya que pueden ser introducidas a través del canal de trabajo del colonoscopio y proporcionar imágenes de alta resolución durante la misma sesión. Sin embargo, la mayoría de los estudios utilizando las minisondas de USE son limitados a la región recto sigmoidea, debido a que los instrumentos son muy costosos y propensos a su ruptura.21
Las LSE de colon y recto son muy infrecuentes, y ocasionalmente identificadas durante la colonoscopia realizada debido a síntomas gastrointestinales bajos o para la detección de cáncer. Por lo tanto, la estrategias de tratamiento de este tipo de lesiones incluyen: la evaluación por medio de métodos de imagen de corte axial, la resección endoscópica o quirúrgica y el seguimiento clínico.21
En un estudio por Tsung-Hsing y colaboradores realizado durante ocho años, se evaluaron a 40 pacientes con LSE en tracto gastrointestinal bajo. El examen endosonográfico se enfocó en las siguientes localizaciones: colon ascendente y ciego en 23% de los casos, colon transverso y descendente en 7% de los casos y en la región recto sigmoides en 70% de los casos.21
Con respecto al tipo de lesiones valoradas se diagnosticaron 16 pacientes con tumor neuroendocrino de recto, de los cuales al ser sometidos al examen histológico posterior a la resección, uno resultó ser un pólipo hiperplásico. En 10 pacientes, las minisondas de USE detectaron lipomas, dos de estos pacientes fueron sometidos a resección endoscópica, uno de los cuales estaba ocasionando obstrucción a nivel de colon transverso. Y por último, cinco pacientes fueron diagnosticados con tumores a nivel de la muscular propia en recto, tres de estos pacientes fueron sometidos a resección, de los cuales la histología correspondió con miomas uterinos en dos casos y un adenocarcinoma mucinoso de apéndice con metástasis rectales.21
Teniendo en cuenta estos hallazgos, existen ciertas limitaciones del uso de minisondas por la calidad subóptima del escaneo endosonográfico en las LSE colónicas > 2 cm, lo que podría explicarse por la limitada profundidad en la imagen del rastreo endosonográfico de las minisondas de alta frecuencia, pérdida de la serosa del recto, angulación de la porción del colon y la poca experiencia del operador. A pesar de lo anterior, la minisonda ultrasonográfica puede ser útil como estudio complementario a la colonoscopia de rutina y puede ser usada como guía en el tratamiento de las LSE de colon y recto.21,22
Manejo de las LSE basado en los hallazgos del USE
El USE juega un rol importante en las decisiones de manejo de este tipo de lesiones. Este método diagnóstico debe ser utilizado para excluir la presencia de compresiones extramurales y várices como causa de LSE.5,23
El manejo de las LSE depende de su etiología, localización, tamaño, de la presencia de síntomas asociados y de las características del paciente.
El objetivo del USE es identificar las lesiones benignas que requieren manejo conservador, las lesiones probablemente benignas que pueden ser tratadas por métodos endoscópicos o vigiladas por intervalos regulares, las lesiones potencialmente malignas que requieren estudio con biopsia o resección quirúrgica y las lesiones definitivamente malignas, las cuales requieren resección quirúrgica completa.23
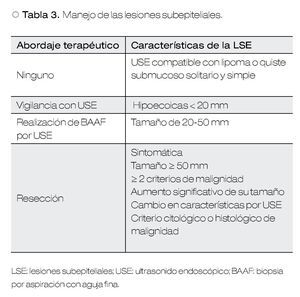
La única lesión benigna que no requiere ningún tratamiento ni seguimiento son los lipomas. Dentro de este grupo se pueden incluir también los quistes submucosos, en el caso de lesiones simples y solitarias.
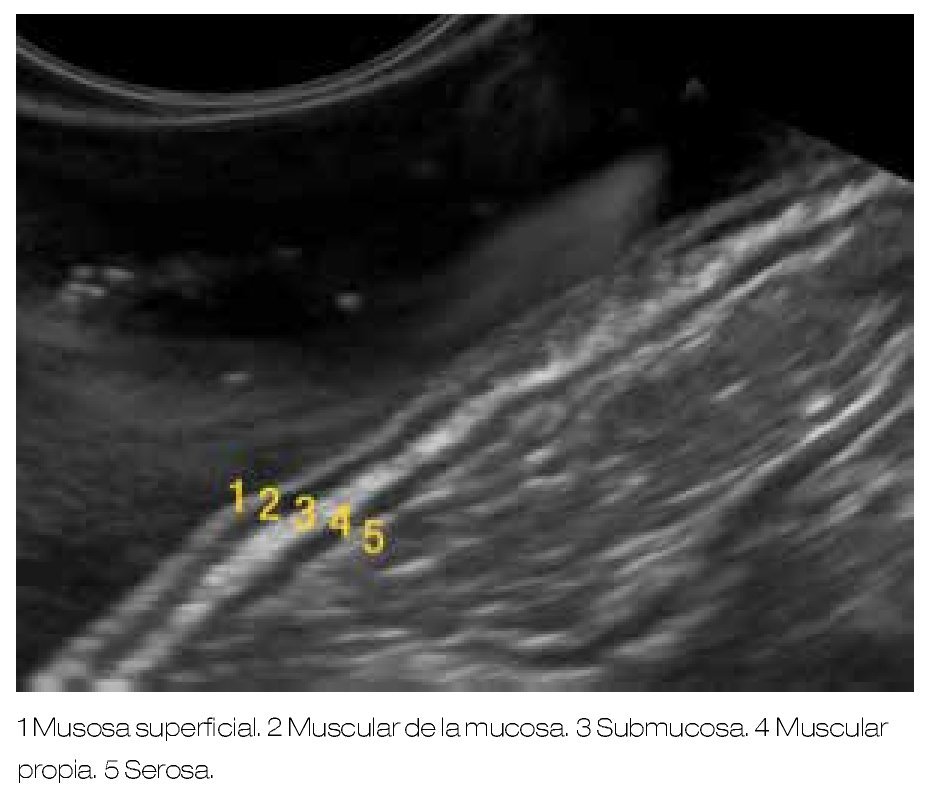
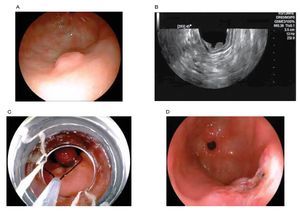
En aquellas LSE originadas en la segunda o tercera ecocapa, que miden más de 20 mm y que no pueden ser clasificados como lipomas o quistes, se debe considerar llevar a cabo una resección endoscópica y el seguimiento ultrasonográfico debe ser una alternativa (Figura 2).
Figura 2. A) Lesión subepitelial en antro gástrico. B) Endosonográficamente la lesión se localiza intramural, con origen en la segunda ecocapa correspondiente a la muscular de la mucosa. C) Resección endoscópica de la lesión asistida por capuchón y asa electroquirúrgica. D) Resección completa de LSE, cuya histología final fue de un fibroma.
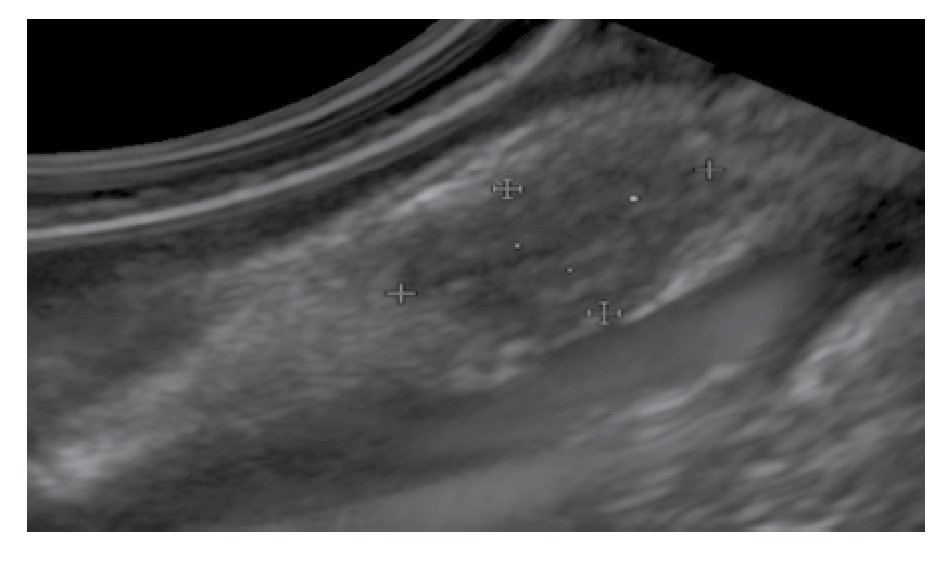
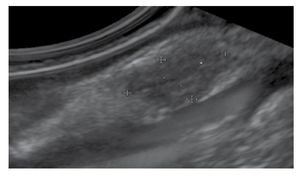
El seguimiento endosonográfico parece ser una opción razonable en el subgrupo de pacientes con LSE hipoecoicas pequeñas < 20 mm. El riesgo de malignidad de estas lesiones es muy bajo si son: hipoecoicas, con márgenes bien definidos, homogéneas y si su capa de origen puede ser fácilmente visualizada sin ningún signo de infiltración (Figura 3). En este mismo grupo, se recomienda incluir para seguimiento endosonográfico a las lesiones quísticas complejas o quísticas con contenido sólido, que no son referidas para histología o resección endoscópica.
Figura 3. Lesión hipoecogénica de la tercera ecocapa de la pared gastrointestinal.
Se debe tomar en cuenta ciertos problemas existentes con las estrategias de vigilancia. En primer lugar, no existe una definición establecida de lo que corresponde al aumento de tamaño significativo o rápido crecimiento de una LSE. El aumento mayor del 25% de un diámetro sin tener en cuenta el intervalo de tiempo o el incremento de la lesión > 1 mm/mes; parecen ser criterios razonables. Además, se debe considerar que tanto tumores malignos como benignos pueden crecer significativamente. Por otro lado, no hay evidencia definitiva, de que los tumores de crecimiento lento no son potencialmente malignos. En segundo lugar, el tiempo óptimo de seguimiento con USE sigue siendo materia de debate. Un intervalo de 12 meses parece ser adecuado, y es utilizado por el 70% de los endosonografistas en los Estados Unidos.24 Por último, el problema tal vez más serio con el seguimiento de las LSE es claramente el limitado intervalo de tiempo, con el cual los pacientes cumplen con los estudios de vigilancia.3,5 En un estudio por Lok K y colaboradores, solamente 23 de 49 pacientes (46.9%) con LSE pequeñas originadas en la muscular propia, estuvieron de acuerdo en participar en un programa de vigilancia.25
Cuando hay un significativo aumento del diámetro o cambios en la estructura ecográfica de la lesión durante el seguimiento, la LSE debe ser resecada.
En aquellas LSE asintomáticas con diámetro entre 20 y 50 mm, no clasificadas como lipomas o quistes, sin características endosonográficas de malignidad, la decisión de terapéutica debe ser basada en los resultados de exámenes citológicos o histológicos.5,7 Esto debido a que si todas las LSE que no cumplen con los criterios de malignidad fueron resecadas, la prevalencia de tumores benignos encontrados podría ser inaceptablemente alto, como fue demostrado en un estudio, hasta un 65% de los casos.26 Esto es todavía más importante, considerando si el riesgo quirúrgico del paciente es alto o si el paciente no desea la cirugía.5
Por último, las LSE asintomáticas que cumplan con cualquiera de los siguientes criterios, definitivamente requieren resección: tamaño > 50 mm, aumento significativo en el tamaño, cambios en la estructura endosonográfica durante el periodo de seguimiento, desarrollo de síntomas durante la vigilancia, dos o más características endosonográficas sugerentes de malignidad (Tabla 2) y criterios citológicos, histológicos e inmunohistoquímicos de neoplasia maligna.3,5 Con respecto a los GIST, las guías de la Asociación Americana de Gastroenterología recomiendan su resección cuando éstos son ≥ 20 mm.7
En un estudio con 252 pacientes con alguna LSE fueron vigilados por medio de endoscopia por un tiempo promedio de 82.5 meses. El 96.8% de las LSE no sufrieron cambios en su tamaño, y apenas 3.2% de estas aumentaron considerablemente su tamaño después de un intervalo promedio de 59.1 meses. Los autores concluyen que la mayoría de las LSE pequeñas no sufren cambios y que un seguimiento regular con endoscopia puede ser considerado suficiente en lesiones pequeñas, especialmente en < 1 cm.2
Con respecto, a los pacientes con síntomas atribuidos a la LSE deben ser sometidos a la resección endoscópica o quirúrgica de la lesión. La biopsia guiada por USE de LSE sintomáticas previo a su resección, solamente está recomendada si existen criterios de tumor primario irresecable, presencia metástasis y que un tratamiento neoadyuvante sea considerado al obtener el diagnóstico histológico como es el caso de los GIST, con el uso de terapia de Imatinib, la cual puede reducir el tumor lo suficiente para permitir su resección.5,27
Adicionalmente, el USE puede ser útil para valorar cuáles tumores pueden ser resecados endoscópicamente o el tipo de cirugía recomendada. Usualmente es posible la resección endoscópica en LSE < 20 mm, en tumores de 30 mm si la localización es la adecuada, o si la lesión es separada fácilmente de la cuarta capa por medio de la inyección de solución salina por debajo del tumor. Si la LSE se extiende a la cuarta capa o más profunda, la probabilidad de riesgo de perforación endoscópica aumenta.3
La resección endoscópica submucosa adapta una variedad de técnicas de resección de lesiones en la tercera ecocapa. Esta comprende el levantamiento de la lesión sobre la muscular propia por medio de la inyección de solución salina, o a través de succión de la lesión dentro de un capuchón fijado al endoscopio, seguido de resección electroquirúrgica con asa. La principal complicación de la resección endoscópica submucosa es el sangrado, el cual es reportado en el 13% de los pacientes, pero usualmente manejado exitosamente de forma endoscópica. También la perforación como complicación está reportada en más del 5% de los casos.5
Los hallazgos del USE también pueden predecir la resección endoscópica completa de los tumores. En un estudio se valoró la conexión de las LSE con la muscular propia, dividiendo a estas lesiones sin conexión alguna, con una conexión estrecha (menos del 50% del máximo diámetro del tumor y < 15 mm de ancho) y aquellos con una conexión amplia (más del 50% del diámetro del tumor o > 15 mm de ancho). Sólo las LSE sin conexión o con conexión estrecha con la muscular propia fueron de manera significativa asociadas con resección completa.28
Además en el momento de la resección endoscópica, el USE puede guiar la inyección de solución salina lo suficientemente cerca de la muscular propia, y por debajo del tumor. Ya que esto resulta útil al crear un depósito de solución salina entre la muscular propia y el tumor, con el objetivo de minimizar el trauma causado por la coagulación y el riesgo de perforación.5
Además, en casos seleccionados, el USE ha sido utilizado para asistir en la obliteración de las LSE vasculares y en la inyección guiada de etanol o cianocrilato para el tratamiento del sangrado por GIST.
La resección quirúrgica es el tratamiento de elección para tumores originados en la cuarta ecocapa de la pared gastrointestinal. El USE proporciona información preoperatoria de la LSE acerca de su tamaño, localización intramural, profundidad de infiltración y la posible presencia de adenopatías asociadas. Esta información es útil para la decisión del tipo de cirugía requerida.5
En el caso de GIST < 50 mm de diámetro, una resección en cuña guiada por laparoscopía con o sin asistencia endoscópica es el tratamiento de elección en la mayoría de los casos. En cambio, tumores muy grandes o en localizaciones no favorables, la cirugía más extensa como gastrectomías parcial o total puede ser necesaria (Tabla 3).5
Conclusión
El USE es el mejor método para caracterizar a las LSE del tracto gastrointestinal. Proporciona información útil en el diagnóstico diferencial y el manejo. Nuevas herramientas adicionales como el USE con medio de contraste y la elastografía, podrían incrementar la utilidad de la endosonografía en las LSE.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Félix Ignacio Téllez Ávila.
Departamento de Endoscopia
Gastrointestinal, Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Vasco de Quiroga N° 15, Colonia Sección XVI, Tlalpan, México
D.F., México.
Correo electrónico: felixtelleza@gmail.com