Las neoplasias del tracto gastrointestinal superior y medio pueden desarrollarse en asociación con varias enfermedades subyacentes, conocidas como lesiones premalignas. Sin embargo, no existen recomendaciones homogéneas para la prevención, detección y vigilancia de estas enfermedades. La vigilancia de las lesiones premalignas se refiere al seguimiento endoscópico de los individuos que están en mayor riesgo de malignidad o en los que una lesión neoplásica ha sido identificada y removida. Con el tiempo hemos conocido un poco más sobre la historia natural de muchas de estas condiciones. En este artículo se abordará la detección y vigilancia endoscópica de las siguientes lesiones premalignas: acalasia, ingestión cáustica, tilosis, esófago de Barrett, pólipos gástricos, atrofia gástrica, anemia perniciosa, metaplasia intestinal y los síndromes hereditarios de cáncer gastrointestinal.
Cancer of the upper and middle gastrointestinal tract may develop in association with several underlying diseases, known as pre-malignant lesions. However, there are no homogeneous recommendations for prevention and follow-up of these conditions. The monitoring of pre-malignant lesions involves the endoscopic follow-up of individuals who are at increased risk for malignancy, or in whom a neoplastic lesion has been identified and removed. Over time, a little more is known about the natural history of many of these conditions. In this article, the screening and endoscopic monitoring of the following premalignant lesions will be presented: achalasia, caustic ingestion, tylosis, Barrett's oesophagus, gastric polyps, gastric atrophy, pernicious anaemia, intestinal metaplasia, and hereditary gastrointestinal cancer syndromes.
La información recientemente publicada en México estima que durante el periodo 1976-2012, en 4 instituciones de la ciudad de México, el cáncer gástrico, el cáncer de esófago y el de intestino delgado ocuparon el 2.o, 5.o y 6.o lugar en neoplasias de tubo digestivo, respectivamente1. A nivel nacional, el cáncer colorrectal y gástrico representaron durante el periodo 1993-2002 el 5.o y 6.o lugar de los tumores más frecuentes2; sin embargo, el cáncer gástrico es la tercera causa de muerte por neoplasia en México ya que más del 75% se diagnostica en etapas avanzadas2,3.
Para las neoplasias malignas del tubo digestivo superior y medio, a diferencia del carcinoma colorrectal, no hay recomendaciones homogéneas por las distintas sociedades de gastroenterología y endoscopia en relación con su detección y seguimiento4. Las neoplasias del tubo digestivo superior y medio pueden desarrollarse en asociación con múltiples lesiones premalignas, por lo cual es importante conocer su prevalencia e historia natural para determinar su seguimiento endoscópico.
AcalasiaLa acalasia consiste en la aperistalsis del cuerpo esofágico combinada con la falla para la relajación del esfínter esofágico inferior, cuya prevalencia es de 10 en 100,000 personas y su incidencia pico ocurre en la séptima década de la vida5,6. El cáncer esofágico más frecuentemente asociado a esta enfermedad es el carcinoma escamoso, cuyo riesgo se incrementa 16 a 33 veces más respecto a la población general y la incidencia en esta población es de 1 en 300 casos/paciente/año de seguimiento6.
Aunque la etiología no es del todo clara, se cree que la estasis alimentaria secundaria a esta enfermedad produce inflamación crónica de la mucosa esofágica, lo cual incrementa el riesgo de desarrollar la secuencia hiperplasia, displasia y carcinoma de células escamosas. Sin embargo, la incidencia de adenocarcinoma esofágico también se encuentra aumentada y parece que esto es secundario a la disminución en la presión del esfínter esofágico inferior consecuencia del tratamiento quirúrgico, lo cual aumentaría el reflujo gastroesofágico y podría causar esófago de Barrett (EB) y adenocarcinoma4.
Desafortunadamente muchos de los cánceres esofágicos son detectados en etapa avanzada y la endoscopia con luz blanca no es sensible para detectar displasia. Se ha visto que se requiere realizar al menos 400 panendoscopias en pacientes con acalasia para detectar un caso de cáncer5 y muchas veces los síntomas de carcinoma esofágico se confunden con los de esta enfermedad. Por ello las guías recientes del Colegio Americano de Gastroenterología (ACG por sus siglas en inglés) y de la Sociedad Americana de Endoscopia Gastrointestinal (ASGE por sus siglas en inglés) ya no recomiendan de rutina el escrutinio y vigilancia endoscópica de cáncer en pacientes con acalasia5,6. Según la opinión de expertos podría sugerirse, según el caso, realizar panendoscopia 10 a 15 años después del inicio de los síntomas con intervalos cada 3 años5.
Lesión por cáusticosLa ingesta de cáusticos incrementa la posibilidad de desarrollar cáncer esofágico de 1,000 a 3,000 veces respecto a la población general, con un ligero predominio del carcinoma epidermoide sobre el adenocarcinoma7. La incidencia de cáncer secundaria a la ingesta de cáusticos oscila entre el 2 y 30%, estando presente la historia de ingestión de dichas sustancias en el 1-4% de los pacientes con cáncer esofágico6.
El periodo de tiempo entre la lesión inicial y el desarrollo de carcinoma esofágico se ha descrito tan amplio como de 10 hasta 71 años. Las características clínicas de estos pacientes suelen ser edad promedio entre 35 y 51 años, intervalo promedio de 40 años entre la ingesta y la aparición de cáncer y la localización de este en esófago medio y en zonas de estenosis4. Las recomendaciones actuales de la ASGE sugieren iniciar la vigilancia endoscópica 10-20 años después de la ingestión del cáustico y continuar el seguimiento a intervalos de 2-3 años. Esto ya no incluye a los pacientes con esófago excluido6.
TilosisLa tilosis es un trastorno autosómico dominante poco frecuente, que se caracteriza por hiperqueratosis de palmas y plantas y se debe a la regulación a la baja del gen de la citoglobina localizada en el cromosoma 17q25. Existen 2 tipos de tilosis: la tipo A o de inicio tardío (5 y 15 años) y la tipo B o de inicio temprano (al año de edad).
El riesgo de desarrollar carcinoma epidermoide de esófago a lo largo de la vida en esta enfermedad es del 40% y, a los 65 años, aproximadamente del 95% de estos pacientes son diagnosticados con esta neoplasia. Por ello las recomendaciones actuales de la ASGE sugieren iniciar la vigilancia endoscópica a partir de los 30 años de edad en sujetos con tilosis tipo A (la tipo B no se asocia a neoplasia) y continuar el seguimiento a intervalos de 1-3 años6.
Esófago de BarrettEl consenso internacional más reciente define el EB como la presencia de mucosa columnar en esófago y debe establecerse si hay metaplasia intestinal (MI) presente por arriba de la unión esofagogástrica8. Histológicamente se define como MI con células caliciformes que reemplaza al epitelio plano estratificado normal del esófago9; el EB incrementa de forma relativa 11.3 veces el riesgo de padecer adenocarcinoma esofágico respecto a la población general6,9.
Aún existe controversia sobre el beneficio clínico del tamizaje y seguimiento endoscópico del EB ya que la incidencia de adenocarcinoma esofágico se ha incrementado en los últimos 10 años a pesar de la vigilancia endoscópica; el 95% de los casos no tienen panendoscopia previa y una vez que se diagnostica esta neoplasia la supervivencia a 5 años es del 13%9.
No se recomienda el tamizaje para la población general y, de acuerdo a las distintas sociedades6,10,11, este debe realizarse en poblaciones con múltiples factores de riesgo como edad>50 años, hombres, raza blanca, obesidad central (IMC>30), enfermedad por reflujo gastroesofágico (ERGE) crónico, historia familiar de EB o adenocarcinoma y tabaquismo. La Sociedad Británica de Gastroenterología recomienda que el tamizaje debe iniciarse en sujetos con 3 o más factores previos o con la presencia de historia familiar de EB o adenocarcinoma más uno o más de estos factores11. Sin embargo el grupo de consenso internacional Benign Barrett's and CAncer Taskforce (BOB-CAT) recientemente determinó que el escrutinio de Barrett y, también para investigar dispepsia, debe ofrecerse a hombres mayores de 60 años con más de 10 años de síntomas de ERGE8.
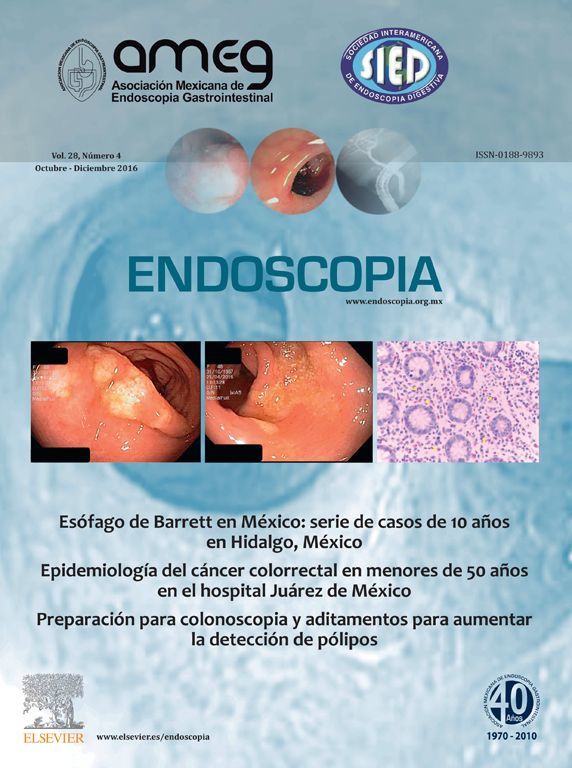
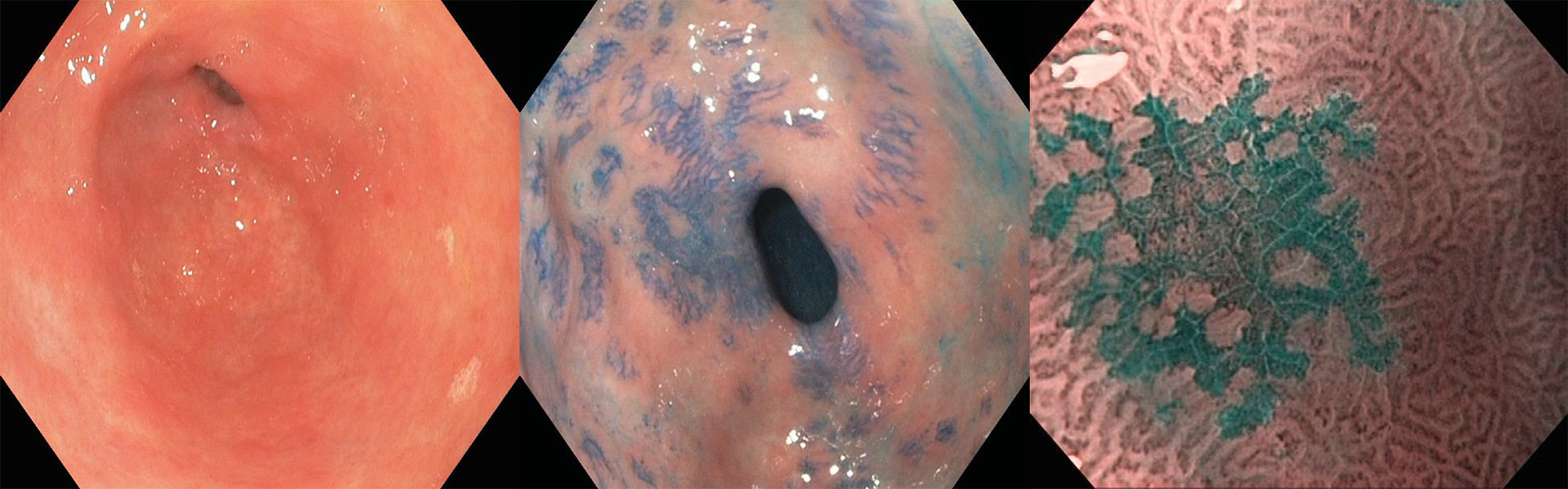
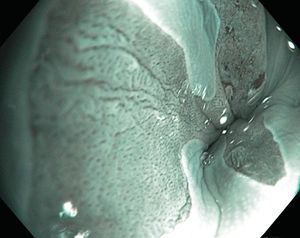
El EB debe examinarse mediante endoscopia de alta definición con luz blanca, ya que esta tiene una sensibilidad (S) del 80-90% para detectarla por lo cual es el estándar diagnóstico en la actualidad6,8. Endoscópicamente se aprecia como una mucosa asalmonada de extensión proximal a partir de los pliegues gástricos que definen la unión esofagogástrica y su extensión se determina utilizando la Clasificación de Praga que considera la afección circunferencial y la extensión máxima longitudinal, mediante las letras C y M6,8,10 (fig. 1).
Aunque no existe un protocolo de biopsias que realmente haya demostrado ser el más exacto, actualmente se sigue el protocolo de Seattle que consiste en tomar biopsias de zonas irregulares de la mucosa esofágica como nódulos, placas o úlceras y, en ausencia de lesión evidente, tomar biopsias en los 4 cuadrantes cada 2cm, o en pacientes con displasia ya conocida, tomar biopsias cada centímetro8,10.
Si se tienen disponibles las técnicas de cromoendoscopia digital, vital y magnificación se recomienda utilizarlas ya que, aunque no mejoran el rendimiento diagnóstico respecto a la luz blanca, sí mejoran la detección de lesiones sospechosas y ayudan a dirigir y reducir el número de biopsias6,8,10,11. En la cromoendoscopia vital deben utilizarse el índigo carmín (IC) y el ácido acético12–15 combinados con magnificación para detectar patrones mucosos en el epitelio columnar del EB; de esta manera, Sharma et al. hallaron que el patrón velloso detectado con IC16 y los patrones velloso, cerebroide, foveolar y lineal profundo descritos por Gueruld et al. usando ácido acético se asocian a MI. Los resultados con azul de metileno han sido variables y no ha demostrado incrementar el rendimiento diagnóstico de displasia respecto al protocolo de Seattle aunque sí reduce el número de biopsias17; sin embargo puede tener un potencial carcinogénico por lo cual ya no se recomienda su uso10.
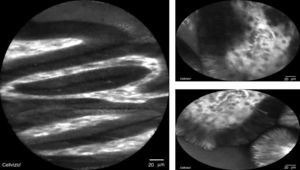
En cuanto a las técnicas de cromoendoscopia digital, las que hasta el momento han demostrado mayor utilidad son la imagen de banda estrecha (NBI por sus siglas en inglés) y microendoscopia confocal. La NBI tiene una S del 97%, una especificidad (E) del 94% y una exactitud global del 96% para distinguir displasia y no displasia (fig. 2); esto significa que detecta a más pacientes con displasia incluyendo alto grado, con menor número de biopsias, respecto a la luz blanca de resolución estándar18–20.
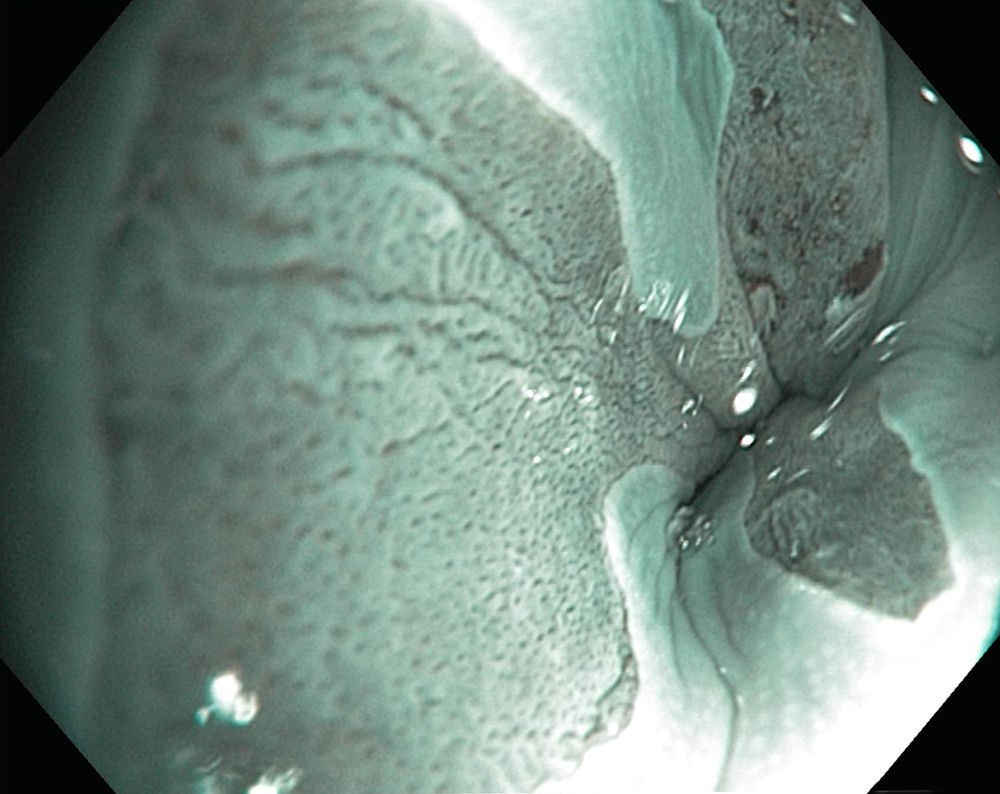
La microscopia confocal consiste en la observación microscópica de la mucosa gastrointestinal en tiempo real con una sonda que, mediante el uso de láser y fluoresceína intravenosa, evalúa el patrón glandular y vascular en la mucosa esofágica y gástrica18 (fig. 3). En cuanto a la NBI combinada con microscopia confocal, tiene S del 92% y E del 76-86% para detección de displasia y, para excluir neoplasia, la microscopia confocal tiene una E del 95-97% y un VPN del 93-97%20,21.
Por otro lado, el seguimiento endoscópico de estos pacientes depende de la presencia y el grado de displasia10. Así sabemos que el riesgo anual de progresión a cáncer en pacientes con Barrett sin displasia es del 0.12-0.33%10,22, en displasia indeterminada del 0.9% por año, en displasia de bajo grado del 0.77-9.1% por año6,23 y en displasia de alto grado del 6-19% por año24. Los factores de progresión a adenocarcinoma incluyen longitud del EB>8cm, hombres, alteraciones cromosómicas de p16 y p53, tabaquismo y obesidad central8,11.
En pacientes con EB sin displasia en la endoscopia inicial algunas sociedades recomiendan repetir una nueva endoscopia un año después y, de persistir sin displasia, recomiendan vigilancia endoscópica adicional en intervalos de 3-5 cinco años por el bajo riesgo de progresión a adenocarcinoma. Sin embargo, la ASGE y el grupo BOB-CAT recomiendan no considerar vigilancia en este grupo de pacientes y realizarla solo en aquellos con factores de progresión hasta 3-5 años después del estudio inicial6,8; el grupo BOB-CAT considera suspenderla si la esperanza de vida es<5 años8.
En caso de displasia indeterminada en la endoscopia inicial pero con signos de inflamación aguda por reflujo gastroesofágico se da dosis doble de inhibidor de bomba de protones durante 8 semanas y se repite la endoscopia. Si persiste la displasia indeterminada se ajusta el tratamiento con inhibidor de bomba de protones y se realiza nueva endoscopia con toma de biopsia en un año8. En displasia de bajo grado se recomienda realizar endoscopia con toma de biopsia cada 6 meses, además de ajustar el tratamiento con inhibidor de bomba de protones6,8,10; si la displasia de bajo grado es multifocal, persistente (presente en al menos 2 endoscopias) y de segmento largo, se recomienda tratamiento mediante ablación con radiofrecuencia8. Si ya no hay displasia de bajo grado en 2 endoscopias consecutivas se pasa al seguimiento de no displasia6.
En la displasia de alto grado debe realizarse ultrasonido endoscópico para estadificar y evaluar linfadenopatías. El tratamiento endoscópico mediante resección de la mucosa (REM) y/o ablación con radiofrecuencia es el de elección y en segundo lugar la cirugía en centros expertos25; sin embargo, en pacientes no candidatos o que no desean tratamiento, la vigilancia endoscópica con toma de biopsias se realiza cada 3 meses mediantes biopsias cada centímetro de los 4 cuadrantes6,8.
En un estudio reciente con seguimiento a 5 años después de aplicar ablación con radiofrecuencia se encontró recurrencia del EB en el 32% de los pacientes, que fue más común en o cercano a la unión esofagogástrica y casi siempre como lesión invisible. Por ello se recomienda que, además de tomar biopsias en sitios previos de REM y en lesiones visibles, también debe tomarse biopsias en los 4 cuadrantes cada centímetro respecto a la estadificación inicial del Barrett incluyendo un centímetro por abajo y un centímetro por arriba de la unión esofagogástrica26. El grupo de consenso BArrett's Dysplasia and CAncer Taskforce (BAD-CAT) establece que el seguimiento endoscópico debe realizarse cada 2.5 años durante al menos 5 años después del tratamiento y, en casos de pacientes con esofagectomía, realizar endoscopia a los 2, 5 y 10 años después de la misma24. Las tablas 1a y 1b resumen las recomendaciones de las distintas sociedades para el escrutinio y vigilancia endoscópica del EB.
Recomendaciones para vigilancia y seguimiento de esófago de Barrett
| ASGE 2012 | ACG 2008 | AGA 2011 | |
|---|---|---|---|
| Escrutinio | Múltiples factores de riesgo. No en población general | Hombres blancos>50 años con ERGE crónico | Múltiples factores de riesgo. No en población general. |
| Sin displasia | Considerar no seguimiento.EGD cada 3-5 años con biopsias c/2cm en 4 cuadrantesConsiderar ARF en algunos casos | Repetir EGD al año y después cada 3 años | EGD cada 3-5 años |
| Displasia indeterminada | Reevaluar por patólogo experto.Ajustar IBPRepetir EGD con biopsias | ||
| Displasia de bajo grado | EGD con toma de biopsias c/1-2cm en 4 cuadrantes cada 6 meses. Considerar resección o ARF | Repetir a los 6 meses. Después cada año hasta 2 EGD sin displasia | EGD con toma de biopsias cada 1cm en 4 cuadrantes cada 6-12 meses |
| Displasia de alto grado | Repetir EGD y descartar cáncerConsiderar USE, tx endoscópico y valorar cirugíaEGD cada 3 meses con biopsia cada 1cm en 4 cuadrantes si no es candidato o rechaza Tx | Repetir EGD y descartar cáncerFocal: <5 glándulas por Bx EGD cada 3 mesesMultifocal: Tx endoscópico o Qx | Repetir EGD y descartar cáncer.Evaluar tipo de paciente, experiencia, focalidad, vigilancia intensiva, REM, tx ablativo, fotodinámico o cirugíaEGD cada 3 meses con biopsia cada 1cm en 4 cuadrantes si no es candidato o rechaza Tx |
Recomendaciones para vigilancia y seguimiento de Esófago de Barrett
| AMEG 2013 | BSG 2014 | BOB-CAT 2015/BAD CAT 2012 | |
|---|---|---|---|
| Escrutinio | Múltiples factores de riesgo. No en población general | Tres factores de riesgo o antecedente familiar más un factor de riesgo | Hombres> 60 años con ERGE crónico >10 años descontrolados |
| Sin displasia | Realizar EGD con biopsia cada 6meses el primer añoSi persiste sin displasia se debe realizar EGD y biopsia cada 3 años | Si longitud de EB<3cm EGD cada 3-5 años; si longitud>3cm EGD cada 2-3 años | No recomendadoRealizar solo en aquellos con factores de riesgo: hombres, blancos, >50 años, obesidad central y síntomas |
| Displasia indeterminada | Optimizar IBP y repetir EGD con biopsias en 6 mesesSi no hay displasia en EGD subsecuentes cambiar a seguimiento de no displasia | Diagnóstico interinoOptimizar IBP y repetir EGD al año | |
| Displasia de bajo grado | EGD con biopsias particularmentedirigidas al sitio de displasia cada 6 mesesSi persiste con displasia de bajo grado, vigilar con EGD cada año | Repetir EGD a los 6 meses hasta que 2 EGD sean negativas | EGD con toma de biopsias cada 6-12 meses; si 2 EGD son negativas pasar a seguimiento de no displasiaPacientes con DBG persistente, multifocal, con lesión visible o con EB largo deben someterse a ARF y/o REM |
| Displasia de alto grado | Resección endoscópica o quirúrgicaSi no es candidato o no elige resección, EGD con biopsia cada 3 meses | Referir a EAETx endoscópico y valorar Tx quirúrgico | Tx endoscópico con ARF y/o REMValorar Tx quirúrgicoEn pacientes postesofagectomía realizar EGD a los 2, 5 y 10 añosEn pacientes post-ARF EGD cada 2.5 años durante 5 años |
Los pólipos gástricos son lesiones luminales que protruyen de la mucosa y se descubren de modo incidental en el 2-7%% de las panendoscopias (EGD), cuya secuencia de caracterización por el endoscopista debe incluir el contexto clínico del paciente, la indicación de la EGD, la caracterización endoscópica adecuada y, por ende, el seguimiento que debemos dar a este tipo de lesiones. De acuerdo a su potencial de transformación se clasifican en pólipos benignos y malignos. Los benignos incluyen los hiperplásicos, de glándulas fúndicas, fibroides, hamartomatosos y otros. Y los malignos incluyen los pólipos neoplásicos (adenomatosos y neuroendocrinos) así como los pólipos con algún grado de displasia27. En esta revisión solo hablaremos de los pólipos hiperplásicos, fúndicos y adenomatosos (tabla 2).
Manejo de pólipos gástricos (guías BSG 2010, ACG y ASGE 2015)
| Tipo de pólipo | Sitio y número | Potencial maligno | Potencial maligno de la mucosa circundante | Manejo y seguimiento |
|---|---|---|---|---|
| PGF esporádicos | Múltiples de 1-5mm; fondo y cuerpo | Muy bajo | Muy bajo | Biopsia para confirmar tipoResecar si>1 cmSin seguimiento |
| PGF asociados a PAF | Múltiples<1cm | Bajo | Bajo | Biopsia para confirmar tipoEGD cada 6 meses a 4 años |
| Hiperplásicos | Único 1-2cm; antro | Bajo pero significativo | Bajo | Resecar si displasia o> 0.5cm, erradicar H. pylori, EGD en un año |
| Múltiples<1cm; cuerpo bajo | Bajo pero significativo | Bajo | Erradicar H. pylori, EGD en un año | |
| Adenomatosos | Único 1-2cm; antro | Alto | Significativo | Resecar, biopsias del resto mucosa gástrica y EGD en un año, con seguimiento cada 3-5 años |
| Fibroide inflamatorio | Único 1-5cm; antro | Muy bajo | Muy bajo | Biopsia, resecar si obstruyeSin seguimiento |
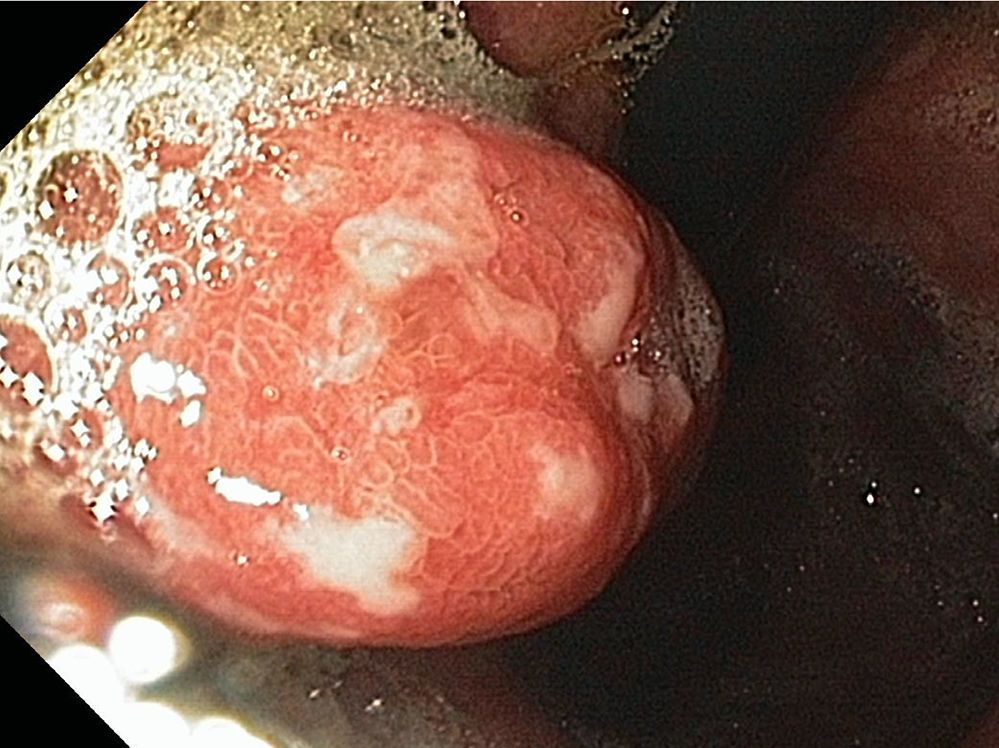
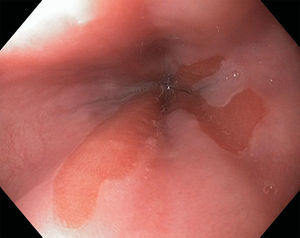
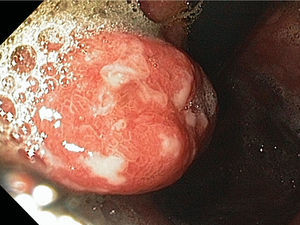
Los pólipos hiperplásicos representan el 30-93% de todos los pólipos gástricos28,29, la edad de presentación más común es entre los 65 y 75 años de edad y, aunque su etiología es desconocida, se han asociado a inflamación y atrofia de la mucosa gástrica27. El 25% de los pacientes con pólipos hiperplásicos tienen infección por Helicobacter pylori (H. pylori) (hasta el 70% revierten después de erradicar dicha infección) y también se han asociado a anemia perniciosa y se pueden encontrar adyacentes a úlceras, erosiones o en el sitio de la gastroenteroanastomosis28. La mayoría de estos pólipos se encuentran en el antro y en segundo lugar en cuerpo gástrico, son de superficie lisa y eritematosa con una pequeña zona de erosión, úlcera o placa (fig. 4). La mayoría suelen ser asintomáticos pero cuando producen síntomas estos suelen ser secundarios a anemia, hemorragia u obstrucción27,28.
El 5-19% de estas lesiones pueden tener focos de displasia30 y la incidencia de malignidad descrita para estas lesiones oscila entre 1 y 3%; los factores de riesgo descritos para dicha progresión son tamaño>1cm, pedunculados, posgastrectomía y lesiones sincrónicas en mucosa circundante30,31. Sin embargo en las últimas recomendaciones de la ASGE publicadas este año se recomienda realizar polipectomía de estas lesiones si son>0.5cm30 y algunos autores recomiendan hacerlo si causan hemorragia28; además ante múltiples lesiones deben tomarse biopsia o resecarse las más representativas y tomar 3 biopsias de antro y 2-4 del cuerpo gástrico en búsqueda de infección por H. pylori y gastritis atrófica metaplásica27,30. En caso de erradicar H. pylori debe realizarse nueva endoscopia 3-6 meses después28 y si no se retiraran estas lesiones deberá repetirse nueva endoscopia en un año4; algunos autores recomiendan continuar seguimiento endoscópico a largo plazo si histológicamente resultan ser Operative Link for Gastritis Assessment (OLGA) 3 o 428.
Los pólipos fúndicos representan el 16-51% de los pólipos gástricos y se observan en el 0.8-23% de las panendoscopias27,29, aunque algunos reportes señalan que son los pólipos gástricos más frecuentes en occidente28. No se asocian a la infección por H. pylori y surgen en 2 contextos: esporádicos y asociados a síndromes genéticos27. Dentro de los esporádicos, el factor de riesgo más frecuente que incrementa 4 veces su riesgo de aparición es la ingesta de inhibidores de bomba de protones durante más de un año28. En el contexto de síndromes genéticos se ha asociado a poliposis adenomatosa familiar (PAF) o síndrome de Peutz-Jeghers27. En pacientes con más de 10 pólipos fúndicos, menores de 40 años, lesiones duodenales simultáneas o displasia en alguno de ellos se sugiere realizar colonoscopia para excluir PAF30,32. Endoscópicamente estas lesiones suelen tener una mucosa del mismo color que la gástrica y en aspecto de vidrio deslustrado o en panal de abeja por NBI, además de localizarse más frecuentemente en fondo o cuerpo27. Las recomendaciones actuales de la ASGE aconsejan realizar biopsia o resección de estas lesiones cuando sea posible y polipectomía si son>1cm30. Además si los pólipos son>1cm, más de 20 o existe supresión profunda definida por niveles de gastrina>400ng/ml de gastrina sérica debe considerarse suspender los inhibidores de bomba de protones y reemplazarlos por antagonistas H228.
Los pólipos adenomatosos son lesiones asociadas a un alto potencial de malignidad, representan el 7-10% de los pólipos gástricos y casi siempre surgen en el contexto de gastritis crónica con MI30, aunque algunos se asocian a PAF27. Cuando se identifican estas lesiones siempre deben resecarse, aun cuando recurren hasta en el 2.6% de los casos tras la escisión completa y en el 1.3% de los pacientes bajo seguimiento se encuentra cáncer gástrico30. Los factores de riesgo para progresión maligna son lesiones>2cm, con depresión central, úlceras y patrón velloso28. Siempre debe resecarse toda la lesión y evaluar sistemáticamente la mucosa gástrica; si no se logra la resección completa debe realizarse nueva endoscopia en 6 meses29 y si se reseca toda la lesión la endoscopia se repite un año después29,30; si esta última endoscopia es negativa se continúa la vigilancia endoscópica cada 3-5 años30.
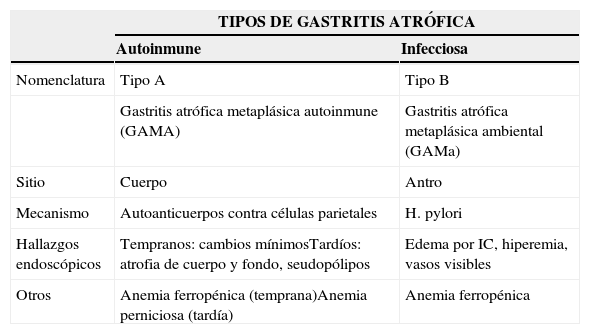
Atrofia y metaplasia gástricaMediante cromoendoscopia digital con NBI y magnificación se ha demostrado que la mucosa normal del cuerpo gástrico consiste en un patrón en pozos redondos, una red capilar subepitelial en panal de abeja y vénulas colectoras; en el antro la red capilar es en pila de monedas. La infección por H. pylori produce pérdida de las vénulas colectoras e irregularidad de la red capilar subepitelial, mientras que la atrofia gástrica se asocia a un patrón desarreglado e irregular de estas estructuras13. Por otro lado, un estudio reciente realizado por Nomura et al. corroboró que los hallazgos endoscópicos mediante luz blanca de gastropatía crónica pueden pasar desapercibidos al endoscopista, por lo cual mediante la aplicación de IC buscaron qué hallazgos endoscópicos podrían predecir la actividad inflamatoria a nivel gástrico. Así demostraron que la combinación de edema demostrado con IC y la ausencia de la disposición regular de vénulas así como la combinación de edema demostrado con IC e hiperemia difusa podrían predecir la infiltración por células mononucleares y polimorfonucleares, respectivamente, en mucosa del cuerpo. En el antro, la combinación de hiperemia difusa y vasos visibles así como la combinación de edema demostrado con IC y vasos visibles pueden predecir la infiltración por células mononucleares y polimorfonucleares, respectivamente, en mucosa de antro33. La tabla 3 resume las diferencias entre los 2 tipos de gastritis atrófica.
Diferencias y manejo de gastritis atrófica
| TIPOS DE GASTRITIS ATRÓFICA | ||
|---|---|---|
| Autoinmune | Infecciosa | |
| Nomenclatura | Tipo A | Tipo B |
| Gastritis atrófica metaplásica autoinmune (GAMA) | Gastritis atrófica metaplásica ambiental (GAMa) | |
| Sitio | Cuerpo | Antro |
| Mecanismo | Autoanticuerpos contra células parietales | H. pylori |
| Hallazgos endoscópicos | Tempranos: cambios mínimosTardíos: atrofia de cuerpo y fondo, seudopólipos | Edema por IC, hiperemia, vasos visibles |
| Otros | Anemia ferropénica (temprana)Anemia perniciosa (tardía) | Anemia ferropénica |
Modificada de Park et al.34.
En cuanto a la gastropatía atrófica tipo A o anemia perniciosa, se ha descrito que la prevalencia de cáncer gástrico en esta enfermedad es del 1-3% y estos pacientes tienen 2-3 veces más riesgo de padecer dicha neoplasia así como 13 veces más riesgo de desarrollar tumores neuroendocrinos tipo i30,34. El riesgo más alto parece ser en el primer año de realizado el diagnóstico30 y dentro de los factores de progresión a malignidad se encuentran la gravedad de la atrofia, MI, tiempo de evolución y edad>50años34. Por ello las guías actuales de la ASGE recomiendan realizar una endoscopia en los primeros 6 meses del diagnóstico y ante la aparición de nuevos síntomas del tubo digestivo superior en este tipo de pacientes30.
La MI es una lesión premaligna caracterizada por pérdida del epitelio gástrico que es reemplazado por epitelio intestinal y se debe a la presencia de la infección por H. pylori, el tabaquismo y el alto consumo de sal principalmente30,35. Su prevalencia global es del 7% y afecta por igual a hombres y mujeres, incrementándose con la edad. La progresión global a cáncer gástrico oscila entre 1.8--6.4% y esto varía en distintos escenarios: progresión de MI tipo iii hasta el 10%, progresión con displasia hasta el 79% y la prevalencia de cáncer en MI es del 11%35.
De acuerdo a la clasificación histológica de Jass y Filipe la MI gástrica se divide en completa (tipo i o intestino delgado) e incompleta (tipo IIA/II o enterocólica y tipo IIB/III o colónica). Además la MI también puede clasificarse por extensión en focal (un área afectada) y difusa (2 o más áreas afectadas) que es lo que más concierne al endoscopista ya que este debe determinarlo durante el mismo procedimiento30,36,37. Esto es importante ya que la MI incompleta y la afección difusa se relacionan ambas con mayor riesgo de progresión neoplásica36.
La endoscopia convencional con luz blanca no permite diferenciar ni diagnosticar de manera confiable la MI y esta puede mostrarse como depósitos mucosos blanquecinos y delgados. Areia et al. propusieron una clasificación para el diagnóstico de MI utilizando azul de metileno y obteniendo 4 patrones mucosos sugerentes de la misma y otros 2 patrones sugerentes de displasia38; sin embargo esto incrementa el tiempo endoscópico y puede disminuir la tolerancia del paciente al estudio.
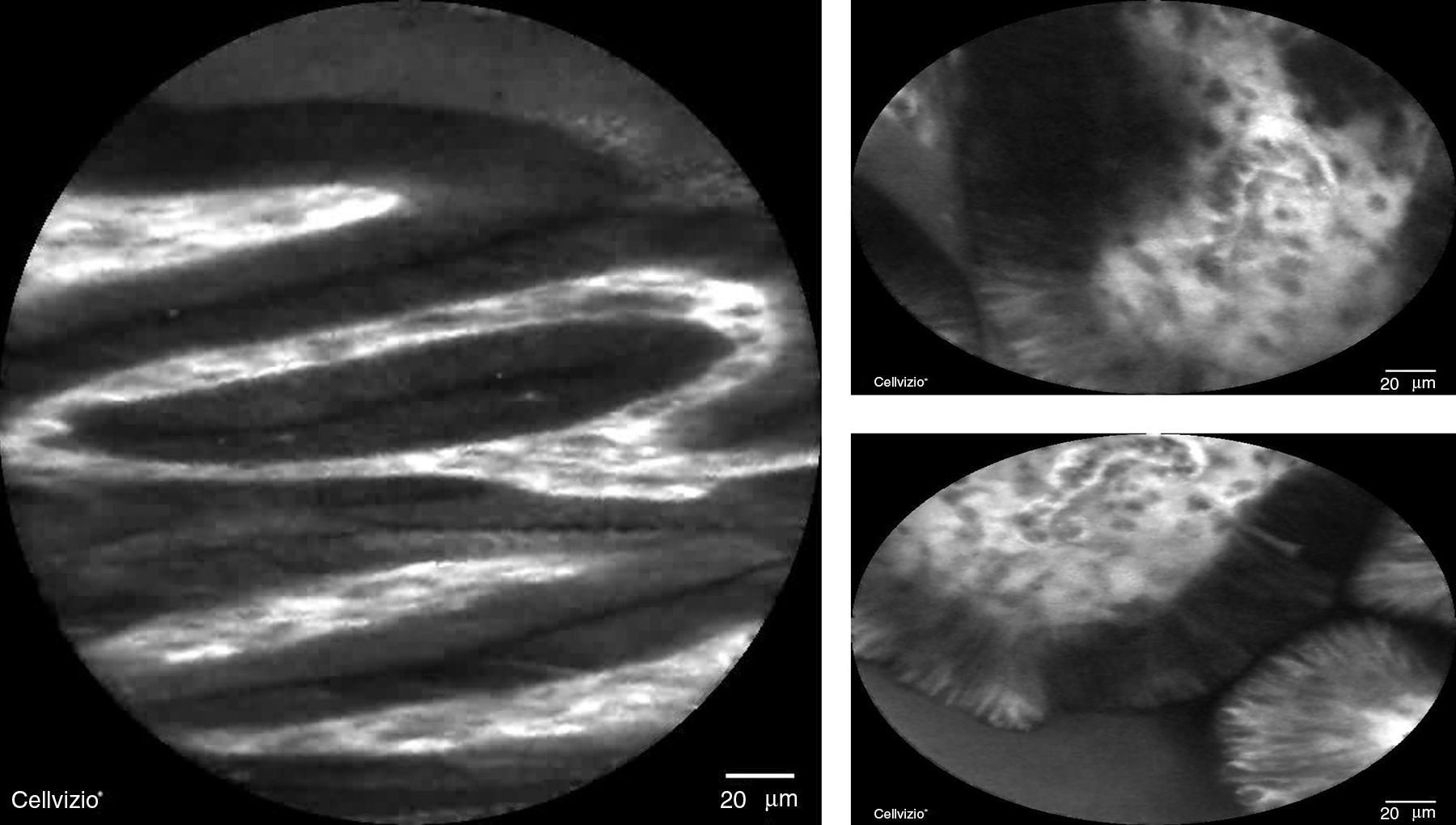
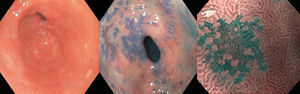
Por ello se ha propuesto que además de la cromoendoscopia con magnificación, el uso de NBI con o sin magnificación puede ser una herramienta útil en la evaluación endoscópica de estos pacientes (fig. 5). La NBI con magnificación tiene una S del 76-84% y E del 89-93% para distinguir MI gástrica39; mientras que un signo específico, la cresta azul claro, tiene S del 80%, E del 93% y rendimiento del 91% para detectar MI13. Tomando en cuenta el NBI y el signo de la cresta azul claro se elaboró una herramienta sencilla, la Clasificación de Pimentel-Nunes, que detecta 3 patrones: patrón mucoso circular y regular con patrón vascular regular (normal o tipo A); patrón regular, en crestas o tubulovelloso con patrón vascular normal (metaplasia o tipo B) y patrón mucoso ausente o irregular con patrón vascular irregular (displasia o tipo C). Esta clasificación es fácil de aprender y después de 200 evaluaciones con NBI se logra una S y E del 80% para detectar MI y una E del 95% para displasia40.
En cuanto a las nuevas técnicas endoscópicas para evaluación de la metaplasia y displasia gástrica vale la pena mencionar 2: la microendoscopia confocal y la endocitoscopia. Con la primera se han descrito 4 patrones20,36: tipo A que consiste en criptas redondas regulares y glándulas en empedrado (normal), tipo B que consiste en un aumento de la fluorescencia e infiltrado entre criptas (asociado a gastritis), tipo C que consiste en criptas irregulares y epitelio irregular y engrosado (asociado a displasia) y tipo D que consiste en desorganización y fuga de fluoresceína (asociado a adenocarcinoma). Estos hallazgos se han resumido en la Clasificación de Miami descrita mediante esta técnica para diversas enfermedades del tubo digestivo41 la cual tiene una S del 98%, una E del 95% y rendimiento del 91.7% para diagnosticar MI gástrica36.
Con la endocitoscopia o ultramagnificación42, descrita por Sato, Kudo et al. se intentó encontrar la relación entre cambios hallados mediante endoscopio Olympus con magnificación hasta 380 veces y luego correlacionarlo con la enfermedad. Estos patrones son tipo i: criptas y papilas normales lo cual excluye infección por H. pylori; tipo ii: apariencia dentadas y algunos detritus y células inflamatorias el cual se asocia a gastritis crónica; tipo iii: criptas lobuladas y disminuye la infiltración, el cual se asocia a gastropatía atrófica; y tipo iv: aparecen células caliciformes (S del 58.5% para infección por H. pylori). Sin embargo estas técnicas aún no están estandarizadas por lo cual requieren mayor validación.
Según el último consenso europeo37 para el diagnóstico de atrofia y metaplasia gástrica deben tomarse al menos 4 biopsias de estómago proximal y distal (2 de curvatura mayor y 2 de curvatura menor) y al parecer no es necesaria una biopsia de la incisura angularis porque no parece aportar mayor información. La vigilancia endoscópica, en cambio, dependerá del grado y extensión de la displasia encontrada30,37 por lo cual se sugiere el siguiente seguimiento:
- •
MI extensa (compromiso de antro y cuerpo): EGD cada 3 años.
- •
MI solo leve-moderada en antro: no requiere seguimiento pero, si existe, hay que erradicar H. pylori.
- •
Displasia de bajo grado sin lesión visible: revisión dentro de 12 meses.
- •
Displasia de alto grado sin lesión visible: revisión inmediata y en 6-12 meses.
- •
Displasia con lesión endoscópica visible: resección y nueva estadificación.
En casos de MI gástrica ya diagnosticada, si hay antecedentes familiares o el paciente es de raza de alto riesgo para cáncer gástrico, la ASGE sí sugiere realizar seguimiento endoscópico y continuarlo a intervalos establecidos según el riesgo individual30.
Adenomas ampulares y no ampularesLas guías de la ASGE43 establecen que en pacientes en quienes se resecó completamente un adenoma de ámpula debe realizarse nueva duodenoscopia de seguimiento entre 1 y 6 meses después de la endoscopia inicial, seguido de duodenoscopia cada 6 a 12 meses durante 2 años. Posteriormente recomiendan vigilancia periódica; algunos autores sugieren realizarla cada 3 años44.
Los adenomas ampulares pueden ocurrir esporádicamente o asociados a síndromes genéticos como PAF y no siempre pueden distinguirse de carcinomas o pólipos no adenomatosos. Por ello, las guías recientemente publicadas de la ASGE sugieren tomar al menos 6 biopsias al momento del estudio, cuidando de orientar la pinza de biopsia paralelamente a los pliegues para disminuir el riesgo de fibrosis subsecuente y biopsias fuera del orificio del conducto pancreático para reducir el riesgo de pancreatitis. Otra alternativa es esperar 10 días después de una esfinterotomía para la toma de biopsias43.
Los adenomas ampulares mayores a 1 cm o con signos de malignidad (úlcera, induración o sangrado) deben ser evaluados con ultrasonido endoscópico (USE). Por otro lado las lesiones menores de 4 cm, sin displasia o con displasia de alto grado sin evidencia de cáncer invasor y sin características endoscópicas como induración, úlceras, friabilidad o que el componente periampular no levante tras la inyección submucosa, son candidatas a resección endoscópica; en cambio, si presentan alguna de estas características deben ser resecadas quirúrgicamente. Al momento de la papilectomía endoscópica debe realizarse colangiopancreatografía retrógrada endoscópica o CPRE con evaluación de la vía biliar y pancreática para excluir extensión al sistema ductal y, si esta es menor de 1 cm, no precluye la resección endoscópica.
En pacientes en quienes se resecó completamente un adenoma de ámpula debe realizarse nueva duodenoscopia de seguimiento entre 1 y 6 meses después del procedimiento inicial, seguido de duodenoscopia cada 3 a 12 meses durante 2 años43. Posteriormente se recomienda vigilancia periódica; algunos autores sugieren realizarla cada 3 años44.
Por otro lado, los adenomas duodenales no ampulares deben ser evaluados mediante duodenoscopia o USE para descartar afección a la paila mayor y extensión intraductal o metastásis. Aquellas lesiones menores de 3 cm o que afectan menos del 33% de la circunferencia duodenal pueden ser sometidas a resección endoscópica. En los adenomas no ampulares esporádicos la vigilancia endoscópica no está bien establecida y debe individualizarse de acuerdo con si la resección fue o no completa, el grado de displasia y las comorbilidades del paciente43,44. Acorde a un artículo de revisión realizado hace tres años, muchos autores sugieren realizar una endoscopia de seguimiento 3 a 6 meses después de la resección y continuar con vigilancia cada 6 a 12 meses45. Además, la ASGE recomienda que, en pacientes con adenomas duodenales y ampulares esporádicos, debe realizarse una colonoscopia de tamizaje43.
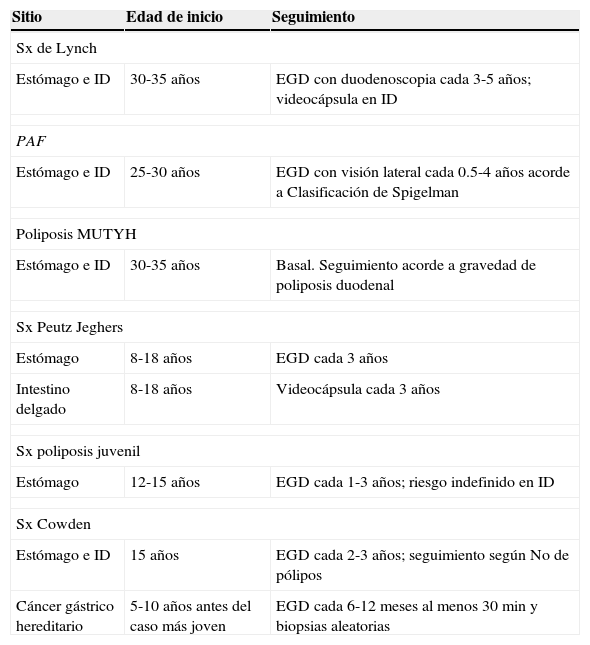
Síndromes gastrointestinales hereditariosSe han publicado recientemente guías para el manejo de los síndromes gastrointestinales hereditarios y, en las tablas 4 y 5, mostramos las recomendaciones relevantes en cuanto al seguimiento y vigilancia endoscópica en tubo digestivo superior y medio.
Guías ACG 2015 de síndromes gastrointestinales hereditarios
| Sitio | Edad de inicio | Seguimiento |
|---|---|---|
| Sx de Lynch | ||
| Estómago e ID | 30-35 años | EGD con duodenoscopia cada 3-5 años; videocápsula en ID |
| PAF | ||
| Estómago e ID | 25-30 años | EGD con visión lateral cada 0.5-4 años acorde a Clasificación de Spigelman |
| Poliposis MUTYH | ||
| Estómago e ID | 30-35 años | Basal. Seguimiento acorde a gravedad de poliposis duodenal |
| Sx Peutz Jeghers | ||
| Estómago | 8-18 años | EGD cada 3 años |
| Intestino delgado | 8-18 años | Videocápsula cada 3 años |
| Sx poliposis juvenil | ||
| Estómago | 12-15 años | EGD cada 1-3 años; riesgo indefinido en ID |
| Sx Cowden | ||
| Estómago e ID | 15 años | EGD cada 2-3 años; seguimiento según No de pólipos |
| Cáncer gástrico hereditario | 5-10 años antes del caso más joven | EGD cada 6-12 meses al menos 30min y biopsias aleatorias |
Modificada de Syngal et al.32.
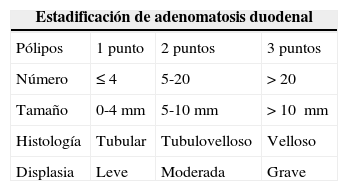
Clasificación de Spigelman para poliposis adenomatosa familiar (PAF)
| Estadificación de adenomatosis duodenal | |||
|---|---|---|---|
| Pólipos | 1 punto | 2 puntos | 3 puntos |
| Número | ≤4 | 5-20 | >20 |
| Tamaño | 0-4mm | 5-10mm | >10 mm |
| Histología | Tubular | Tubulovelloso | Velloso |
| Displasia | Leve | Moderada | Grave |
| Estadio de Spigelman | Puntaje | Seguimiento |
|---|---|---|
| 0 | 0 | Cada 4 años |
| I | ≤4 | Cada 2-3 años |
| II | 5–6 | Cada 1-3 años |
| III | 7–8 | Cada 6-12 meses |
| IV | 9–12 | Seguimiento por experto cada 3-6 meses, evaluación quirúrgica, mucosectomía/duodenectomía o Whipple |
Modificada de Syngal et al.32.
La mayoría de los pacientes con síndromes de poliposis actualmente ya pueden ser manejados mediante enteroscopia profunda46,47, ya que esta modalidad permite la resección endoscópica de pólipos mayores de 1 cm en poliposis adenomatosa familiar29,47. Además, en pacientes con síndrome de Peutz-Jeghers la presencia de pólipos ≥ 1.5 cm es el principal factor de riesgo para intususcepción y obstrucción de intestino delgado; por ello es que actualmente en estos pacientes los pólipos de 1 a 1.5 cm, sintomáticos o de rápido crecimiento deben ser resecados endoscópicamente47.
En los pacientes con un intestino delgado fijo debido a resecciones quirúrgicas previas y en los que tienen grandes pólipos, la enteroscopia de doble balón asistida por laparoscopia permite la resección de múltiples pólipos en una sola sesión, lo que disminuye la necesidad de múltiples resecciones de intestino delgado y el riesgo de desarrollar síndrome de intestino corto a largo plazo. La enteroscopia intraoperatoria puede ser necesaria para la evaluación y manejo de pacientes con tumores del intestino delgado que están más allá de la profundidad de inserción máxima de la enteroscopia profunda46.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses. No se recibió ningún patrocinio para realizar este artículo.