La anemia constituye la complicación extraintestinal más común en pacientes con enfermedad inflamatoria intestinal. Es tan frecuente que resulta imprescindible realizar controles analíticos periódicos para detectarla y tratarla precozmente. Los mecanismos que la generan puede ser diversos, siendo el más habitual la ferropenia (verdadera o solo funcional) seguido, y asociado en muchos casos, de la inflamación crónica. Evaluamos estos mecanismos esencialmente mediante la ferritina, saturación de transferrina y la estimación de la inflamación. Una saturación de la transferrina disminuida indica ferropenia, bien «verdadera» si los depósitos férricos están también disminuidos, bien «funcional» si son normales o incluso elevados. Los depósitos de hierro no se estiman fácilmente porque su marcador habitual, la ferritina, se ve muy influido por la existencia de inflamación. Esta tampoco es siempre fácil de valorar y suele hacerse a través de la PCR. Consideramos que los depósitos de hierro están disminuidos si la ferritina es<30μg/l en ausencia de inflamación y<100μg/l cuando sí la hay. Otros parámetros menos influidos por la inflamación pueden ser útiles en diferenciar ambos mecanismos de anemia. El hierro intravenoso, imprescindible en algunas situaciones, se recomienda cada vez más frente a la vía oral, porque evita sus efectos adversos gastrointestinales, es muy seguro, eficaz y más rápido. Es además muy cómodo para el paciente si se usan las nuevas formulaciones, porque permiten administrar todo el hierro necesario en solo una o 2 dosis. El objetivo del tratamiento es normalizar la hemoglobina e idealmente alcanzar una ferritina>400μg/l, lo que disminuye el elevado riesgo de reaparición de la anemia. Una vez corregida debemos realizar controles periódicos, cada 3 meses el primer año.
Anemia is the most common extraintestinal complication in patients with inflammatory bowel disease. It is so frequent that it is indispensable to perform periodic analytical controls for early detection and treatment. The mechanisms that generate it could be diverse, being iron deficiency (genuine or functional) the most common, followed by and usually associated with chronic inflammation. We evaluated these mechanisms, esentially with ferritin, transferrin saturation and inflammatory markers. A low transferrin saturation indicated iron deficiency, “genuine” if ferric deposits are also low, or “functional” if they are normal or even high. Iron deposits are not easily assessed because their usual marker, ferritin, is substantially influenced by the existence of an inflammation. This is not always easy to estimate either, usually it is evaluated with the CRP. We consider iron deposits are diminished if ferritin is <30μg/l without inflammation, and <100μg/l when inflammation is present. Other parameters less influenced by inflammation could be useful to discriminate between both types of anemia. Endovenous iron, essential in some situations, is increasingly recommended versus the oral treatment because it avoids the adverse gastrointestinal effects, it is safe, efficient and faster. It is also very convenient for the patient if new formulas are being used, since they can administer all necessary iron in only 1 or 2 doses. The goal of this treatment is to bring hemoglobin back to normal levels, and ideally reach a ferritin of >400μg/l, thus reducing the elevated risk of recurrence of anemia. Once corrected, periodic controls must be conducted, at least quarterly during the first year.
La anemia en la enfermedad inflamatoria intestinal (EII) se define de acuerdo a los criterios clásicos de la Organización Mundial de la Salud como una hemoglobina (Hb) <13g/dl en los varones y <12g/dl en las mujeres. Además, se discute la relevancia real de un descenso importante respecto a la Hb habitual de un paciente concreto, aunque se encuentre en valores normales. En cualquier caso, si la consideramos como tal, la anemia es la complicación extraintestinal más común en la EII1. No obstante, su prevalencia es muy variable en diferentes estudios, en función de los controles y criterios para su evaluación y el tipo de pacientes incluidos2. Una revisión sistemática de la literatura describe una prevalencia de anemia en la EII del 16% en pacientes ambulatorios con EII y de hasta el 70% en pacientes hospitalizados3. Por otra parte, la anemia aparece con mayor frecuencia en la enfermedad de Crohn (EC) que en la colitis ulcerosa (CU)4,5. Con respecto a la anemia ferropénica (AF), etiología más común de la anemia en la EII y de la que vamos a tratar esencialmente, sucede algo similar, con cifras de prevalencia en torno al 45%6.
La ferropenia, con o sin anemia, es aún más frecuente. Además de ser muy frecuente, la importancia de la anemia (incluso la ferropenia sin anemia), estriba en su impacto negativo en la calidad de vida de quien la sufre, que puede ser tan deficiente como en pacientes anémicos con cáncer avanzado7.
Teniendo presentes estos datos resulta obvio que los gastroenterólogos dedicados a la atención de pacientes con EII deben preocuparse por controlar sus niveles de Hb y normalizarlos cuando se vean disminuidos. En este artículo nos centramos en la AF, anemia de proceso crónico (APC) o mixta, por su especial importancia. Existen revisiones más extensas sobre la anemia en general en la EII8,9.
Anemia en la enfermedad inflamatoria intestinal: mecanismos patogénicos y definicionesLa anemia en la EII puede tener múltiples causas, que además pueden coexistir en el mismo paciente. En ocasiones la etiología puede ser un déficit de vitamina B12 (por causas secundarias a la EC, como la resección o inflamación crónica ileal, o ajenas a la misma como la toma crónica de inhibidores de la bomba de protones, la gastritis atrófica, la infección por Helicobacter pylori o la dieta vegana), o de folatos (por dieta inadecuada, actividad de la EII o fármacos como metotrexato o sulfasalazina)10, la mielotoxicidad por tiopurínicos (azatioprina o mercaptopurina)11 u otras causas poco frecuentes como la anemia hemolítica autoinmune12 o secundaria. Sin embargo, la causa más habitual es la ferropenia seguida de la APC, mecanismos patogénicos que muy probablemente coexisten, en mayor o menor medida en muchos casos.
La ferropenia y la AF en pacientes con EII tienen como causas principales las pérdidas hemáticas crónicas, manifiestas o no, y la hemorragia aguda. En otras ocasiones, aunque es poco habitual, puede existir un defecto en la absorción de hierro, en especial en la EC, secundario a afectación duodenal o a cirugías previas sobre esta zona, como las gastrectomías Billroth II o debido a causas ajenas a la EC, ya descritas previamente para el déficit de vitamina B12. Finalmente, algunas restricciones dietéticas pueden disminuir el aporte de hierro o de otros micronutrientes que mejoren su absorción.
Los procesos inflamatorios crónicos, como la EII, producen una disminución de la vida media de los hematíes y de su producción por diferentes mecanismos: menor producción de eritropoyetina (EPO), disminución de la respuesta del progenitor eritroide de los hematíes a la EPO y disminución de la movilización del hierro desde el sistema retículo endotelial. Este último punto, llamado déficit funcional de hierro, puede ser cuantitativamente más o menos importante en la génesis de la APC y también viene mediado por citoquinas proinflamatorias y por la hepcidina13. Esta es un péptido producido en el hígado, que aumenta en situaciones de sobrecarga férrica y de inflamación (como la EII), probablemente inducida por la IL-6, mientras que disminuye en caso de ferropenia. Su acción biológica es disminuir, a través de diversos mecanismos, la absorción de hierro en el duodeno y su liberación desde los macrófagos del sistema reticuloendotelial.
Esta diferenciación «clásica» de los tipos de anemia más frecuente en la EII, entre AF y APC no es tan nítida ni real en la práctica, y en realidad en muchos pacientes coexisten ambos mecanismos. Además, ambas pueden compartir como mecanismo generador común de anemia la falta de hierro disponible para la eritropoyesis, consecuencia de un déficit «verdadero» o «funcional». Por ello existe un término de uso más reciente, «anemia restringida por hierro», que define esta situación y enfatiza la importancia del hierro en el tratamiento de la EII, como veremos posteriormente. Desafortunadamente, aunque teóricamente sería muy relevante de cara al tratamiento, de momento no somos capaces de cuantificar adecuadamente la implicación de estos aspectos. Lo que sí podemos intuir es la dificultad (y en cierta medida inexactitud) de la valoración diagnóstica que veremos a continuación, reflejo una vez más de la complejidad que define a la EII en la mayoría de sus facetas.
Diagnóstico de la anemia en la enfermedad inflamatoria intestinal: hallazgos de laboratorio y algunos conceptos importantesDada su elevada frecuencia, en los pacientes con EII es imprescindible la realización periódica de analíticas con hemograma y «metabolismo férrico», con el fin de detectar la presencia de anemia y ferropenia, para poder tratarla de forma precoz y eficaz.
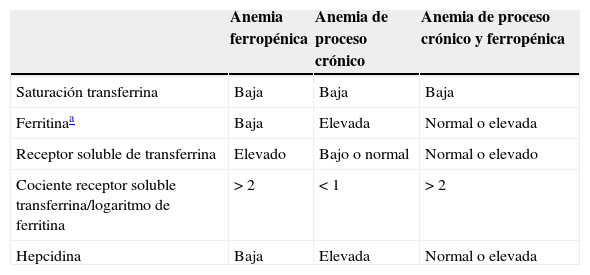
Ante la aparición de anemia consideraremos siempre las múltiples causas posibles y entre ellas las más habituales, AF y APC. Diferenciarlas o constatar su coexistencia y en qué medida resulta complejo, no deja de ser una estimación e incluso es imposible, en algunos casos. No obstante, las diferencias clásicas entre ellas en los valores de los parámetros férricos se muestran en la tabla 1. Uno de los parámetros que se ha puesto en valor más recientemente es la saturación de la transferrina; cifras inferiores al 20% implicarían ferropenia, verdadera si los depósitos férricos están disminuidos y funcional si son normales.
Anemia ferropénica, de proceso crónico y de origen mixto; diferencias en los valores del metabolismo férrico
| Anemia ferropénica | Anemia de proceso crónico | Anemia de proceso crónico y ferropénica | |
|---|---|---|---|
| Saturación transferrina | Baja | Baja | Baja |
| Ferritinaa | Baja | Elevada | Normal o elevada |
| Receptor soluble de transferrina | Elevado | Bajo o normal | Normal o elevado |
| Cociente receptor soluble transferrina/logaritmo de ferritina | >2 | <1 | >2 |
| Hepcidina | Baja | Elevada | Normal o elevada |
Para el diagnóstico de ferropenia clásicamente se utiliza la determinación de ferritina, marcador de los depósitos férricos del organismo, cuyo dintel de normalidad varía según la existencia o no de inflamación. Evidentemente determinar si existe o no inflamación no es siempre sencillo; tampoco podemos afirmar con seguridad que aunque la haya sistémica sea suficiente y responsable de una APC mediada por citoquinas. En cualquier caso, aceptamos que cuando no hay inflamación existe ferropenia si la ferritina está por debajo de 30microgramos/litro (μg/l), mientras que si la hay, una ferritina<100μg/l indica ferropenia. Como la ferritina está muy modificada por la inflamación, se han buscado otros parámetros que puedan estarlo menos. Nos ayudarían a confirmar ferropenia parámetros baratos y accesibles, como el porcentaje de hematíes hipocrómicos, Hb reticulocitaria media o volumen reticulocitario medio. Aunque no disponible de forma general, el receptor soluble de la transferrina (y el cociente entre el receptor soluble y el logaritmo de la ferritina sérica) permite detectar ferropenia incluso con APC coexistente14–16. Cuando este receptor está elevado existe «ferropenia intracelular», ya que se correlaciona bien con la cantidad de receptor de transferrina expresado en la membrana plasmática de las células sanguíneas17. Otro parámetro poco disponible, pero muy interesante como ya hemos visto, es la determinación de hepcidina. Así, en un reciente trabajo se demuestra que independientemente de la actividad inflamatoria todos los pacientes con disminución de la ferritina (<30μg/l) tienen niveles de hepcidina significativamente más bajos en comparación con los pacientes que tienen ferritina normal (>30μg/l) y los controles sanos18. Finalmente, el valor de la saturación de la transferrina parece especialmente importante. Una cifra inferior a 20% supondría ferropenia, que sería verdadera si los depósitos férricos están disminuidos y funcional si son normales.
La anemia de proceso crónico indica intrínsecamente actividad de la EII subyacente. Típicamente es normocrómica, con reticulocitos normales o bajos y se diagnostica nuevamente en función de la existencia de inflamación y nivel de ferritina, apoyada por otros parámetros. Así, cuando hay inflamación y anemia, esta probablemente será de proceso crónico si la ferritina es >100μg/l. Incluso en esta situación lo habitual es que la saturación de la transferrina sea <20%, expresión en este caso de un déficit funcional de hierro, consecuencia del proceso inflamatorio19. Incluso con una ferritina 100μg/l podría existir ferropenia verdadera asociada y la determinación del receptor soluble de la transferrina y su cociente con el logaritmo de la ferritina sérica nuevamente ayudaría a detectarla20.
La combinación de ambos mecanismos (AF y APC) es muy habitual, en especial cuando hay una ferritina entre 30 y 100μg/l y una saturación de transferrina <20% e inflamación, expresada esencialmente como proteína C reactiva (PCR) elevada. Este descenso de la transferrina es probablemente un marcador de un posible denominador común en estas 3 situaciones posibles (AF, APC, combinación): la anemia restringida por hierro.
Consecuencias clínicas de la anemiaEl cuadro clínico varía mucho de unos casos a otros, en dependencia de la velocidad de instauración de la anemia, de su gravedad y de las características del paciente que la padece. Así, la AF o la ferropenia puede detectarse en un individuo asintomático o con sintomatología general, más o menos importante, como debilidad, cansancio, irritabilidad, falta de concentración, cefalea, intolerancia al ejercicio o incluso clínica de insuficiencia cardiaca en los casos más graves. Todo ello conlleva una significativa afectación en la condición física, las funciones cognitivas y la calidad de vida del individuo21. La exploración física puede ser normal o demostrar palidez de diversa intensidad. Puede existir un soplo sistólico en la auscultación cardiaca. Durante mucho tiempo se pensó que los síntomas clínicos de la anemia ocurrían solo cuando el nivel de Hb caía abruptamente. Se ha sugerido que los pacientes se adaptarían a los niveles bajos de Hb si la anemia se desarrollaba lentamente. Esto ha llevado al concepto de la «anemia asintomática», concepto que realmente refleja el hecho de que las alteraciones en el estado físico, la calidad de vida y la función cognitiva pueden no ser reconocidas por los pacientes y sus médicos.
Tratamiento de la anemia ferropénica/de proceso crónico en la enfermedad inflamatoria intestinalPremisas generalesEl reciente consenso ECCO sobre anemia en EII recomienda realizar controles analíticos que incluyan al menos hemograma, ferritina sérica y PCR cada 6-12 meses en sujetos en remisión y cada 3 meses en pacientes ambulantes con enfermedad activa. Aquellos casos con riesgo de déficit de vitamina B12 o ácido fólico también deben ser específicamente controlados, midiendo sus niveles al menos anualmente y si aparece macrocitosis en ausencia de tratamiento con tiopurinas. Estas recomendaciones están basadas en opiniones de expertos y reflejan la práctica clínica general. En sujetos con resección extensa del intestino delgado, EC ileal amplia, portadores de reservorios o con evidencia previa de déficit de vitamina B12 o ácido fólico, el control debe ser más frecuente que anual22.
Tan pronto como se detecte anemia en un paciente debe iniciarse el proceso diagnóstico, y en cuanto lo obtengamos debemos iniciar un tratamiento. Como hemos visto, la restricción de hierro está presente en la mayoría de los casos, y por ello suele ser el tratamiento inicial, siempre asociado al control de la inflamación debida a la EII. De hecho, optimizar el tratamiento de la EII es necesario casi siempre y una terapia muy eficaz de la anemia, a veces la única que consigue su control23. Obviamente, el problema es que en muchas ocasiones esto es muy complicado o incluso no es posible. Solo en algunos pacientes, en los que la alteración de la eritropoyesis sea esencialmente debida a la alteración de citoquinas, con el déficit relativo de EPO, será necesario el uso de agentes estimulantes de la eritropoyesis (AEE).
El objetivo del tratamiento es normalizar la Hb y los depósitos de hierro22. Se ha demostrado que conseguir unas cifras altas de ferritina tras tratamiento con hierro intravenoso (iv) (>400μg/l) mejora la evolución y minimiza el riesgo de recurrencia de la anemia, que en caso contrario es la norma22,24.
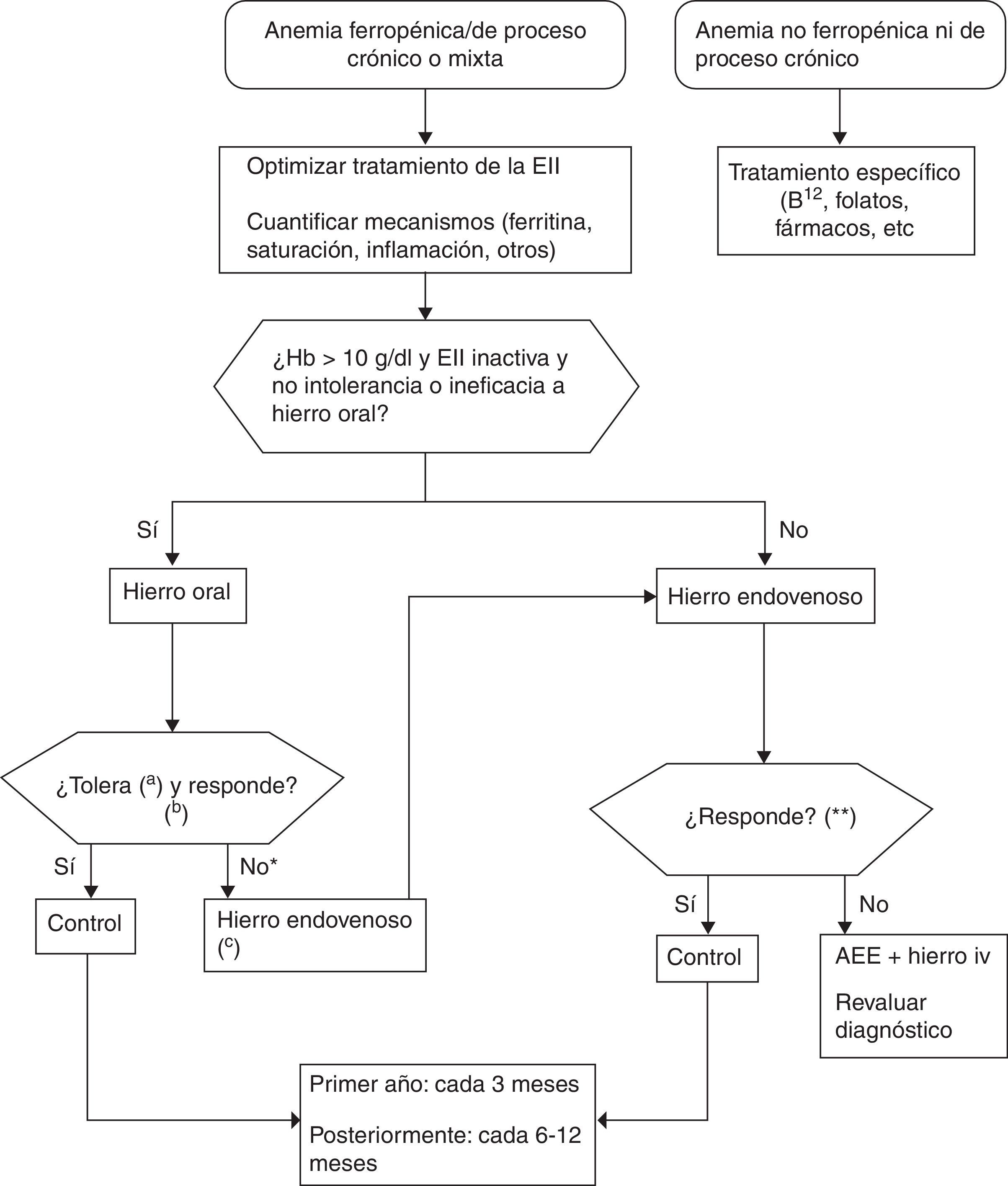
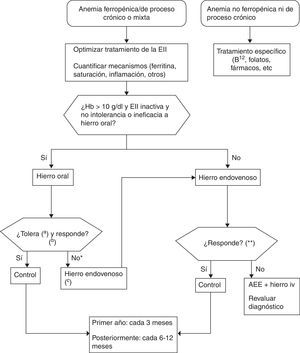
Tratamiento con hierroDisponemos de hierro oral y de hierro iv, y optaremos por uno u otro en función de las particularidades del caso concreto. Aunque cada día se recomienda más el uso de hierro iv, el hierro oral sigue teniendo indudablemente sus indicaciones. En la figura 1 se describe el algoritmo recomendado en la actualidad para el tratamiento de la anemia en la EII.
Recomendaciones básicas para el tratamiento de la anemia en los pacientes con enfermedad inflamatoria intestinal.
a Considerar cambio de preparado de hierro oral si existe intolerancia.
b Hb normal e idealmente ferritina>400μg/l; hierro oral en 3 meses; hierro iv 1-2 meses tras administrar toda la dosis programada (ver texto).
c Utilizar dosis correcta siempre «fórmula simplificada» (ver texto).
Es un tratamiento sencillo, barato y seguro. Su eficacia y tolerancia varía entre estudios. En algunos de ellos, realizados en nuestro país y muy adecuadamente, el hierro oral ha demostrado su eficacia, llegando a alcanzar la normalización de la Hb en más del 85% de los casos, sin apreciar incremento de la actividad de la EII y con tan solo un 5% de discontinuación terapéutica por intolerancia. Los pacientes que no toleraron o no corrigieron su Hb con hierro oral recibieron hierro iv con excelente resultado25. Sin embargo, estos excelentes resultados no se reproducen en todos los estudios e indudablemente el hierro oral presenta limitaciones obvias e importantes26. En muchas ocasiones se tolera mal o muy mal, pudiendo producir diarrea, estreñimiento o dolor abdominal, por una parte dificultando el cumplimiento (y con ello la eficacia real) y por otra puede confundirnos con un brote. Así, en una revisión sistemática se describe que la aparición de efectos secundarios llevó a la suspensión del hierro oral hasta en el 21% de pacientes con EC2. Lugg et al. describen el fracaso del hierro oral en controlar la anemia en 2 de cada 3 individuos con EII, debido en parte a los efectos secundarios, que aparecen en más de la mitad de sus pacientes27. Además, datos experimentales sugieren que el hierro no absorbido podría ser tóxico para la mucosa intestinal28,29, y quizá incluso precipitar brotes de la EII30. La clave en la tolerancia del hierro oral no se sabe con certeza, y mucho se ha escrito y asumido como dogma, sin base real. Los datos más recientes sugieren que es la dosis de hierro el aspecto más importante en la tolerancia, más que la formulación empleada u otros factores. Los efectos secundarios son dosis dependientes. Por otra parte, su potencia es escasa, ya que se absorbe en pequeñas cantidades, que incluso en condiciones de ferropenia e intestino sano no parecen superar los 20mg/día. Esta cifra muy probablemente no se alcanza en la EII, al menos si existen resecciones intestinales amplias o que incluyan duodeno, o la enfermedad está activa (coexiste APC). En estos casos la absorción oral es limitada por el proceso inflamatorio sistémico y quizá también por las lesiones locales31.
Indicaciones del hierro oral en la enfermedad inflamatoria intestinalAF leve, con Hb >10-10,5g/dl, o ferropenia sin anemia, en pacientes sin intolerancia previa al hierro oral y con EII no activa.
Uso prácticoEn cuanto a qué hierro oral utilizar y cómo hacerlo, la recomendación más firme es sobre la dosis: no se deben emplear más de 100mg/día de hierro elemental32–34. Acerca de la preparación a utilizar, las recomendaciones son menos claras. Las formulaciones clásicas contienen sales ferrosas (sulfato ferroso, gluconato ferroso, fumarato ferroso y lactato ferroso). Existen otros preparados como ferrimanitol, succenilcaseína férrica y ferrocolinato, supuestamente con algunas ventajas, no claramente demostradas, al menos de momento, ya que carecemos de estudios comparativos entre ellas, al menos en ensayos clínicos. Un reciente trabajo describe que un complejo de hierro con maltol es eficaz y muestra un perfil de seguridad favorable en pacientes con EII35. Otra formulación reciente, el hierro liposomal, podría tener algunas ventajas, de momento solo teóricas. Se trata de un pirofosfato férrico en liposomas que permite que sea absorbido directamente por vía linfática. Resultados preliminares muestran su excelente tolerancia en otras situaciones clínicas y han despertado el interés por su utilización en la EII, donde los datos son aún escasos36. En el momento actual probablemente debemos usar sales ferrosas como hierro oral inicial, en espera de nuevos datos. Una correcta utilización del hierro oral parece esencial para optimizar su eficacia. Nuestras recomendaciones (tabla 2) no coinciden con las que podríamos llamar «clásicas», basadas en general en la «costumbre», que no parecen tener más valor que las nuestras, basadas en la experiencia de muchos autores. Con el hierro oral solemos conseguir un ascenso de la Hb entre 1-2g/dl por semana, y es clave la constancia hasta normalizar también los depósitos de hierro, lo que suele suceder en 3 o 4 meses.
Recomendaciones de uso del hierro oral
| Comenzar por sulfato ferroso un comprimido al día (si intolerancia: probar otros preparados) |
| Utilizar dosis bajas, de un solo comprimido de los preparados habituales de sulfato ferroso (menos de 100mg/día de hierro elemental) |
| Administración tras la comida principal o tras la cena. No en ayunas. Puede administrarse con zumo rico en vitamina C. Evitar toma cercana de café o té |
| Constancia hasta la reposición completa de depósitos; puede requerir en torno a 3 meses |
Los preparados de hierro iv tienen una estructura formada por un núcleo de hierro elemental y una capa o cubierta glucídica, con un peso molecular y estabilidad determinados, así como una velocidad de liberación del hierro y de degradación del compuesto. Todo ello determina la dosis máxima a administrar, la necesidad de dosis de prueba y el ritmo de infusión. El hierro liberado es captado por los macrófagos del sistema retículo-endotelial y desde ellos se transfiere a los depósitos intracelulares (ferritina) y al plasma (transferrina).
Preparados de hierro intravenoso: perspectiva histórica y sus datos esencialesPara abordar el uso del hierro parenteral es esencial hacerlo con perspectiva histórica. Así, con los preparados iniciales se produjeron casos de reacciones anafilactoides graves, algunas con resultado de muerte, lo que explica que muchos clínicos «tengan miedo» a utilizar la vía parenteral. Sin embargo, las nuevas formulaciones desarrolladas posteriormente son muy seguras, no solo en los ensayos clínicos, sino en su amplísimo uso en la clínica habitual. En ellas, la fuerte unión entre el núcleo de hierro y el componente glucídico minimiza el hierro libre en plasma, lo que mejora su seguridad. Con los «nuevos» hierros iv los efectos secundarios son muy poco frecuentes, y casi siempre leves (quemazón en el lugar de venopunción, sabor amargo o metálico, cefalea, náuseas, vómitos, palpitaciones o, más raramente, hipotensión leve, rubor o erupción cutánea, fiebre y dolores musculares). Los efectos adversos graves, las reacciones anafilactoides (seudoalérgicas), son extremadamente infrecuentes, tanto con el clásico hierro sacarosa como con las nuevas formulaciones. El hierro carboximaltosa parece, cuando menos, tan seguro como el sacarosa. Con el hierro dextrano se han descrito efectos adversos graves con una frecuencia de 11,3/106 dosis y de<1/106 dosis con el resto de formulaciones. Las muertes atribuidas en España son inferiores a 1/107 dosis, cifra 25 veces inferior a las muertes por transfusión en nuestro país37.
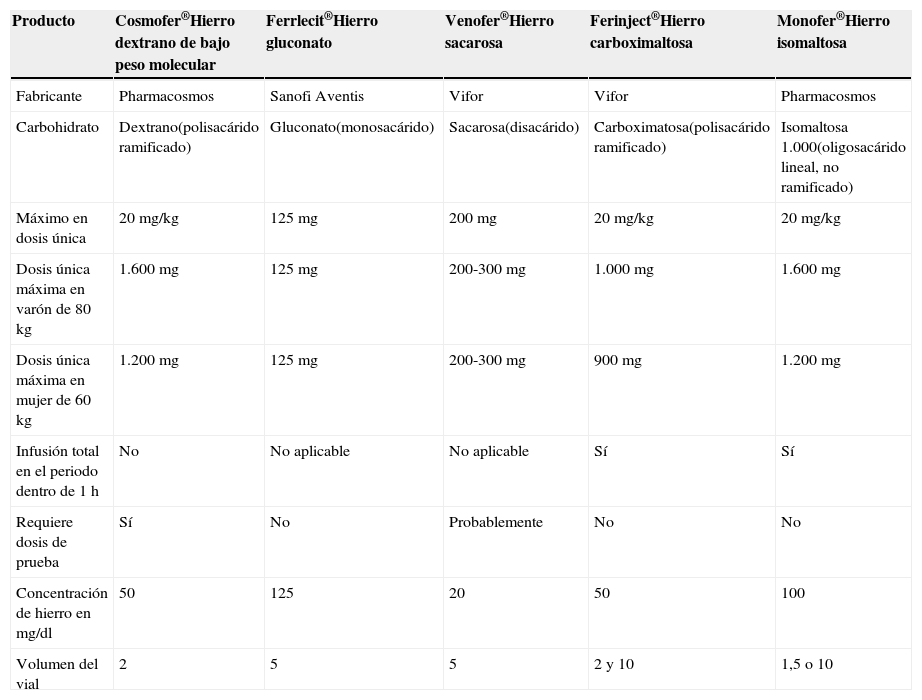
Cuando hablamos de hierro iv en general, debemos tener claro que existen diferentes formulaciones, que no son todas iguales ni mucho menos. Numerosas evidencias demuestran la eficacia del hierro iv, tanto en casos de anemia en pacientes sin y con EII38. En general podemos decir que el hierro iv es más eficaz (en términos de incremento de la Hb y mejora de la calidad de vida) y más rápido que el oral39–42, como demuestra el metaanálisis de Mearin et al., aunque los resultados no son homogéneos en todos los estudios43. Además los preparados más recientes aportan otra ventaja añadida, su cómoda posología, que permite la administración de todo el hierro en una o 2 dosis, minimizando la única incomodidad del tratamiento (el acceso venoso) y asegurando el cumplimiento. Comentaremos y compararemos los aspectos más importantes de las formulaciones que están disponibles en Europa (tabla 3).
- -
Hierro sacarosa (Venofer®): es una de las formulaciones más utilizadas ya hace muchos años. Ello hace que su eficacia y seguridad estén demostradas tanto en ensayos clínicos como por una amplísima experiencia clínica. Su eficacia en los estudios oscila en torno al 75%44–46. Su seguridad es muy bien conocida y las reacciones infusionales graves son extremadamente raras y se cifran en 1:20.000 dosis. Se han relacionado con infusión a una velocidad demasiado rápida (>4mg Fe3+/min) o a concentraciones muy altas (>7mg/Fe3+/kg), lo que podría provocar la existencia de hierro libre no ligado a proteínas. También se ha demostrado seguro en el embarazo y en el posparto47–49. Su inconveniente es que se necesitan varias dosis para administrar todo el hierro requerido. Así, lo habitual es administrar de 200mg por infusión 2 o 3 veces por semana, que podría aumentarse en casos concretos hasta 300mg 3 veces por semana, aunque la dosis máxima recomendada es de 600mg por semana. Se recomienda dosis de prueba en la primera administración.
- -
Hierro carboximaltosa (Ferinject®): actualmente es la formulación de hierro iv que permite administración de dosis altas que más se usa en nuestro país. Tiene la ventaja de poder administrar hasta 1.000mg en una sola infusión (siempre que no supere el tope máximo de 20mg de hierro por kg de peso del paciente). Si la dosis requerida es superior a 1.000mg se administra en varias sesiones, generalmente en 2, con una semana de separación entre ellas. Aunque no disponemos de tanta experiencia como con el hierro sacarosa, los datos existentes sugieren una seguridad cuando menos igual, e incluso no se recomienda dosis de prueba. Las evidencias sobre su eficacia son también firmes, siendo más eficaz que el hierro oral y no menos que el hierro sacarosa. Así, un ensayo clínico reciente que incluía un importante número de pacientes (multicéntrico, 88 hospitales de 14 países), aleatorizado y controlado, comparó 2 dosificaciones diferentes de hierro carboximaltosa frente a hierro sacarosa en enfermos ambulatorios con EII y anemia43. El régimen de hierro sacarosa calculaba la dosis total de hierro de la forma convencional, mientras que el de hierro carboximaltosa lo hacía según un nuevo esquema más simple (ver más adelante). Ambos regímenes fueron eficaces, bien tolerados y demostraron mejoría similar en calidad de vida de los pacientes. Sin embargo, el régimen con hierro carboximaltosa fue superior en la corrección de la anemia (número de pacientes que incrementaron la Hb>2g/l o normalizaron sus cifras), y sobre todo fue más «conveniente» para los pacientes, por el menor número de infusiones necesarias y su menor duración. Este estudio incluyó un análisis de coste-efectividad, demostrando que un curso de tratamiento completo con hierro carboximaltosa resulta más barato que con hierro sacarosa, si tenemos en cuenta los costes directos e indirectos y los beneficios obtenidos50. En el análisis farmacoeconómico realizado en España, estos resultados se reproducen y dentro de los hierros iv disponibles el hierro carboximaltosa muestra el menor coste total por paciente41,51,52
- -
Hierro dextrano de bajo peso molecular (Cosmofer®): su ventaja es que permite administrar hasta 2.000mg por sesión, pero su inconveniente es que requiere infusión muy lenta, de hasta 6h, y probablemente presenta un riesgo superior de reacciones infusionales graves (al fin y al cabo se trata de un dextrano). Requiere dosis de prueba.
- -
Hierro isomaltosa (Monofer®): es una nueva formulación, de momento no disponible en España, que permite el uso de dosis de hasta 1.600mg de hierro en una única infusión, en 30min. Los datos, tanto de ensayos clínicos como de uso en abierto, aunque no demasiado amplios, sugieren un excelente perfil de seguridad. En un análisis de coste-efectividad en el Reino Unido fue la opción preferida en algunos escenarios clínicos53.
Análisis comparativo de las preparaciones más importantes de hierro intravenoso disponibles en Europa
| Producto | Cosmofer®Hierro dextrano de bajo peso molecular | Ferrlecit®Hierro gluconato | Venofer®Hierro sacarosa | Ferinject®Hierro carboximaltosa | Monofer®Hierro isomaltosa |
|---|---|---|---|---|---|
| Fabricante | Pharmacosmos | Sanofi Aventis | Vifor | Vifor | Pharmacosmos |
| Carbohidrato | Dextrano(polisacárido ramificado) | Gluconato(monosacárido) | Sacarosa(disacárido) | Carboximatosa(polisacárido ramificado) | Isomaltosa 1.000(oligosacárido lineal, no ramificado) |
| Máximo en dosis única | 20mg/kg | 125mg | 200mg | 20mg/kg | 20mg/kg |
| Dosis única máxima en varón de 80kg | 1.600mg | 125mg | 200-300mg | 1.000mg | 1.600mg |
| Dosis única máxima en mujer de 60kg | 1.200mg | 125mg | 200-300mg | 900mg | 1.200mg |
| Infusión total en el periodo dentro de 1h | No | No aplicable | No aplicable | Sí | Sí |
| Requiere dosis de prueba | Sí | No | Probablemente | No | No |
| Concentración de hierro en mg/dl | 50 | 125 | 20 | 50 | 100 |
| Volumen del vial | 2 | 5 | 5 | 2 y 10 | 1,5 o 10 |
Cada día se recomienda más frente a la vía oral, porque evita sus efectos adversos gastrointestinales, es muy eficaz y rápido en casi todos los escenarios y asegura el cumplimiento54. En general, la indicación principal es la anemia con componente ferropénico «moderada-grave», entendida como aquella con Hb <10g/dl (o incluso 10,5g/dl) (tabla 4). También estará indicado en aquellos pacientes que, aun con cifras mayores, no toleren el hierro oral, este haya sido ineficaz, y en aquellos en que se necesite una rápida recuperación de la anemia o se precise asociar EPO.
Indicaciones de tratamiento con hierro intravenoso en la enfermedad inflamatoria intestinal
| Anemia grave (hemoglobina<10-10,5g/dl) |
| Intolerancia a la vía oral (actual o previa) |
| Ausencia de respuesta a la vía oral (actual o previa) |
| Enfermedad inflamatoria intestinal activa clínicamente |
| Tratamiento concomitante con eritropoyetina |
| Pacientes que precisan una rápida respuesta (cirugía próxima, mala tolerancia, enfermedad concomitante) |
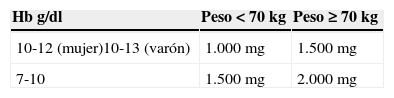
Una vez indicado el hierro iv, lo primero que haremos es calcular la dosis total que necesita nuestro paciente. Esta dosis se calculaba según la fórmula de Ganzoni, aplicable a otras anemias por déficit de hierro. Sin embargo, en el caso de la EII se ha demostrado que la dosis estimada de esta forma es claramente insuficiente, y posiblemente responsable del fracaso del tratamiento en muchos casos. El cálculo de dosis recomendado actualmente en el consenso de ECCO (tabla 5) se basa en un sencillo esquema original del estudio FERGIcor. Sus limitaciones son que no contempla los escenarios de pacientes con Hb <7g/dl ni la ferropenia sin anemia. Se estima que en el primer caso deberíamos añadir 500mg extra de hierro, y en el segundo, la dosis a infundir al paciente podría estar entre 500 y 1.000mg55. La dosis total se administrará de forma diferente según la presentación de hierro que utilicemos y que determina en resumen el número de dosis, y por tanto el número de veces que el paciente tiene que acudir al hospital, pinchazos que recibe y horas que tiene que dejar de trabajar, además de modular también la rapidez con la que se puede recuperar de su anemia y volver a su actividad normal. Está claro que los nuevos hierros, que permiten altas dosis por infusión, son los más recomendables actualmente.
Régimen de dosis fija y simplificada para la administración de hierro intravenoso
| Hb g/dl | Peso<70kg | Peso≥70kg |
|---|---|---|
| 10-12 (mujer)10-13 (varón) | 1.000mg | 1.500mg |
| 7-10 | 1.500mg | 2.000mg |
Hb: hemoglobina.
Fuente: Silverstein y Rodgers38.
La eficacia máxima se alcanza en torno a las 8 semanas del tratamiento, si bien a las 2 semanas ya se puede normalizar la Hb en muchos casos (comunicación personal). Si no conseguimos normalizar la Hb es necesario reconsiderar la etiología de la anemia y la necesidad de otras terapias, en especial los AEE, como veremos más adelante.
Tratamiento con estimulantes de la eritropoyesisLa EPO puede ser muy eficaz en la anemia asociada a un proceso inflamatorio. En esa situación la EPO está deficitaria y administrar AEE conseguirá dirigir el hierro hacia la eritropoyesis, en lugar de que se acumule en el sistema reticuloendotelial. Así, varios estudios han evaluado la eficacia y seguridad de los AEE en diferentes escenarios en la EII, esencialmente en la anemia refractaria al tratamiento con hierro iv56,57. En esos trabajos el tratamiento concomitante con AEE e hierro iv fue más rápido y eficaz, sin efectos secundarios aparentes.
La indicación práctica de los AEE en la AF/APC de la EII se suele limitar a los casos refractarios a dosis adecuadas de hierro iv. Refuerza esta indicación que la anemia requiera transfusiones y que la enfermedad continúe activa a pesar de tratamiento58. Este tratamiento adecuado de la EII es en este escenario aún más importante. Siempre se usará hierro iv concomitante. Es muy probable que algunos pacientes se beneficien del uso de AEE desde el inicio, pero de momento no sabemos identificarlos adecuadamente. Cuando está indicado, el beneficio obtenido con los AEE es firme y debe ser utilizado. Se estima que podría ser necesario en hasta un 25-30% de los pacientes con anemia asociada a la EII, aunque en la práctica no se usa tan habitualmente.
En los estudios en EII se han utilizado diversos AEE, concretamente epoietina alfa (200U/kg 2 veces por semana o 150U/kg 3 veces por semana)59 y darbepoetina alfa (0,9μg /kg una vez a la semana)60. Sus pautas de uso más detallado pueden revisarse en el artículo de Moreno López et al.61.
Seguimiento tras el tratamiento de la anemiaComo hemos visto anteriormente, todos los pacientes con EII deben ser sometidos a controles analíticos periódicos. Si el paciente ha presentado anemia, estos controles han de ser más frecuentes, ya que su reaparición es muy habitual (uno de cada 2 pacientes en 10 meses)24. La recurrencia es menor si hemos normalizado los depósitos de ferritina tras el tratamiento, al menos en el caso del hierro iv. Así, una ferritina postratamiento >400μg/l, expresión de unos niveles elevados de depósitos de hierro, consigue unas tasas de recurrencia inferiores.
Se recomienda, una vez corregida la anemia, monitorizar el déficit de hierro cada 3 meses durante al menos el año siguiente, y cada 6-12 meses posteriormente. Tratar la enfermedad correctamente es nuevamente clave para prevenir la reaparición de anemia. De hecho, cuando reaparece debemos reconsiderar la persistencia de actividad de la EII subyacente. Esto es así porque incluso en el paciente asintomático la anemia se correlaciona bastante bien con la existencia y grado de lesión intestinal62, e incluso puede ser la única expresión de esta actividad. Sin embargo, en la práctica a veces no es posible controlar por completo la actividad de la EII, y en ese caso cobra especial protagonismo la terapia específica de la anemia. Algunos pacientes pueden llegar a precisar la administración de hierro iv a intervalos regulares para prevenir la recidiva de la AF. En los controles periódicos tras el tratamiento, si reaparece la anemia es evidente que debemos tratar nuevamente al paciente. Un estudio reciente va más allá y analiza la conveniencia de un tratamiento preventivo si las cifras de ferritina descienden por debajo de 100μg/l. Este trabajo (FERGImain) evalúa la utilidad para prevenir la reaparición de anemia, de una estrategia de tratamiento activa frente a la habitual de «esperar y ver». En este ensayo, aleatorizado y controlado con placebo, se administra hierro carboximaltosa iv (500mg) a los pacientes cuyas cifras de ferritina caen por debajo de 100μg/l en el seguimiento posterior a un curso de tratamiento exitoso con hierro iv, dentro del estudio FERGIcor. Esta estrategia «proactiva» resultó muy coste-efectiva, puesto que el coste de los pacientes con anemia es más del doble que el de aquellos sin anemia63. Tengamos presente que el riesgo de ampliar las indicaciones con hierro iv es muy bajo en el caso de la EII. Su seguridad a corto plazo está demostrada y el riesgo de sobrecarga de hierro es muy bajo en la EII, ya que cuando reaparece la anemia o la ferropenia, casi indefectiblemente es porque existe un sangrado crónico que persiste. No obstante, se debe evitar alcanzar saturaciones de transferrina superiores al 50% y ferritina>800μg/l64.
Podemos concluir que el manejo de la anemia es parte esencial del tratamiento en los pacientes con EII y con cierta frecuencia está infratratada. Requiere un abordaje diagnóstico amplio, aunque la causa más frecuente en estos pacientes es la ferropenia, asociada o no a APC. Su corrección, además del control del propio proceso inflamatorio, requiere del uso de hierro que, aunque puede administrarse vía oral, en muchas ocasiones deberá suministrarse por vía iv.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dr. José Antonio García Erce, Servicio de Hematología, Hospital San Jorge, Huesca.