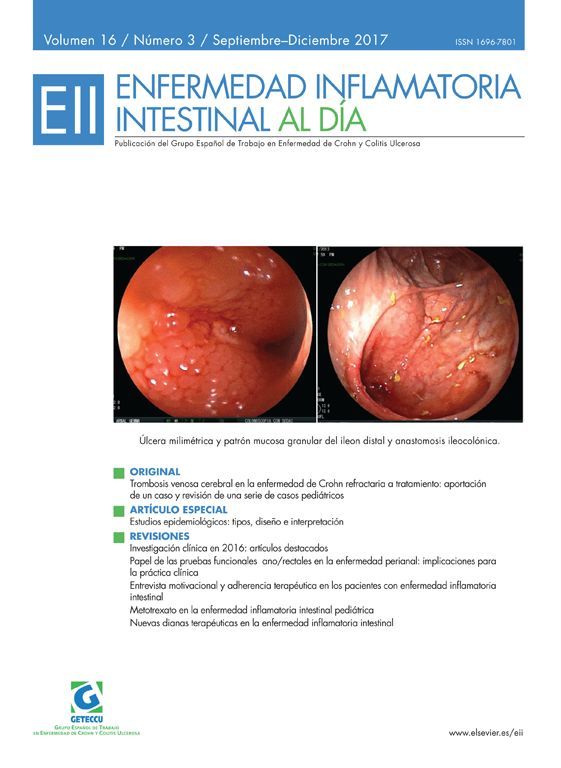
La interleucina-13 (IL-13) es una citocina que juega un papel clave en la inflamación mucosa en la colitis ulcerosa (CU). El tralokinumab es un anticuerpo monoclonal que se une y neutraliza la IL-13 y, por tanto, podría ser efectivo en el tratamiento de la CU. El estudio que se comenta a continuación es un ensayo clínico en fase IIa realizado en pacientes no hospitalizados que presentaban CU activa, índice de Mayo ≥ 6, aleatorizados a recibir 300mg de tralokinumab subcutáneamente versus placebo cada 2 semanas hasta la semana 12. El principal objetivo del estudio fue la respuesta clínica en la semana 8, mientras que la remisión clínica y la curación mucosa fueron objetivos secundarios. La tasa de respuesta clínica fue el 38% (21/56) para tralokinumab vs. 33% para placebo (18/55), p=0,406. La tasa de remisión clínica fue del 18% (10/56) vs. 6% (3/55), p=0,033 y la curación mucosa fue del 32% (18/56) vs. 20% (11/55), p=0,104 para tralokinumab y placebo, respectivamente. El perfil de seguridad del fármaco fue aceptable. Conclusiones: tralokinumab no alcanzó una respuesta clínica significativamente mayor que placebo tras 12 semanas de tratamiento en pacientes con CU activa. Sin embargo, la mayor tasa de remisión clínica en el grupo tralokinumab vs. placebo indica que el fármaco puede ser beneficioso en algún subgrupo de pacientes con CU. El fármaco fue bien tolerado.
ComentariosMientras la enfermedad de Crohn ha sido considerada tradicionalmente una enfermedad mediada inmunológicamente por células Th1, la CU es una enfermedad mediada en gran parte por células Th2, las cuales secretan fundamentalmente IL-4 e IL-13, estimulando la inmunidad humoral. La IL-13 es de especial importancia, pues ejerce un efecto citotóxico contra las células epiteliales, incluyendo la inducción de apoptosis y la alteración de la composición de proteínas de las tight-junctions. De hecho, la colitis inducida experimentalmente por oxazolona se asocia a un aumento de IL-13 y puede ser prevenida mediante el bloqueo de la interacción de la IL-13 con su receptor. El tralokinumab (CAT-354) es un potente anticuerpo monoclonal humano Ig G4 específico de IL-13 que se une a esta y la neutraliza. Está siendo evaluado en estudios clínicos en fase iii en pacientes con asma y en un estudio en fase ii en fibrosis pulmonar idiopática y podría constituir una nueva opción de tratamiento en la CU.
El presente estudio es un ensayo en fase IIa, aleatorizado, doble ciego, placebo-controlado que compara el tratamiento de tralokinumab con placebo en CU. En él participaron 30 centros de 6 países europeos, incluyendo pacientes afectos de CU activa, no hospitalizados con un índice de Mayo ≥ 6 y un subscore endoscópico ≥ 2. El estudio contó con lectura centralizada de las muestras histológicas, pero no de las endoscopias. Los pacientes recibieron 300mg de tralokinumab o placebo vía subcutánea (SC) cada 2 semanas (6 dosis) durante 12 semanas y fueron seguidos otras 12 semanas. El objetivo primario fue valorar la respuesta clínica en la semana 8, definida como un descenso de 3 puntos y al menos 30% del score de Mayo total, y un descenso del subscore de sangrado rectal de al menos un punto o un subscore absoluto de sangrado rectal de 0 a 1. Como principales objetivos secundarios se consideraron, entre otros, la remisión clínica en la semana 8 (score Mayo total ≤2, sin ningún subcore >1); y la curación mucosa en la semana 8 (mejoría del subscore endoscópico de 3 o 2 a 1, o de 1 a 0). Se incluyó a un total de 111 pacientes, 56 con tralokinumab y 55 con placebo. Trece pacientes (23%) en el grupo tralokinumab y 17 (31%) en el grupo placebo habían recibido previamente anti-TNF.
Respecto al objetivo primario, la proporción de pacientes que alcanzaron la respuesta clínica en la semana 8 fue superior en número en el grupo tralokinumab respecto al grupo placebo, sin significación estadística (38% [21/56] vs. 33% [18/55]; p=0,406). En cuanto a los objetivos secundarios, la remisión clínica en la semana 8 fue superior en el grupo tralokinumab respecto al placebo (18% [10/56] vs. 6% [3/55]; p=0,033). La proporción de pacientes que lograron curación mucosa en la semana 8 fue numéricamente superior en el grupo tralokinumab respecto al placebo (32% [18/56] vs. 20% [11/55]; p=0,104). Por otra parte el cambio en la puntuación del índice de Mayo total desde la semana 0 hasta la 8 fue similar en ambos grupos de tratamiento. El análisis farmacocinético mostró niveles relevantes de tralokinumab y el recuento de eosinófilos tendía a ser superior en el grupo tralokinumab vs. el placebo.
Un total de 7 pacientes (13%) en el grupo tralokinumab y 6 (11%) en el grupo placebo tuvieron al menos un efecto adverso, siendo el más frecuente la sintomatología relacionada con la CU. La tasa de abandonos por efectos adversos no difirió entre los grupos de tratamiento.
El hecho de encontrar una diferencia significativa en la remisión clínica es llamativo pues el estudio no estaba diseñado para este fin. Este es un objetivo propuesto para estudios en fase iii, pues no es esperable hallarlas en estudios con un pequeño número de pacientes. Entre las razones para que no se alcanzase un resultado positivo en el objetivo primario (respuesta clínica), los autores discuten diversas cuestiones. En primer lugar, es posible que actuar sobre la vía de la IL-13 sea insuficiente para controlar la actividad en la CU. En segundo, se especula sobre si el período de tratamiento en el estudio fue insuficente para mostrar la eficacia de tralokinumab. Esto parece poco probable ya que la mayor diferencia entre ambos grupos respecto al descenso en el Mayo parcial se obtuvo en la semana 4, lo que indica que el efecto del tralokinumab es precoz y que el período de tratamiento fue suficiente para demostrar eficacia. La alta tasa de abandonos para ambos grupos de tratamiento, cercana al 28%, es otra de sus debilidades. Pudo deberse a que el período de tratamiento y seguimiento, un total de 24 semanas, fuera excesivo para pacientes con una actividad basal considerable y una alta proporción de enfermedad extensa tanto en el grupo placebo como en pacientes sin respuesta a tralokinumab, ya que el principal motivo de abandono fue la propia decisión del paciente. Ello limita las conclusiones obtenidas. Otro de los argumentos manejados para explicar la ausencia de diferencias en la respuesta clínica es la diferencia en las características basales de los pacientes del grupo tralokinumab. En él había una mayor proporción de pacientes con enfermedad extensa. Desafortunadamente, del estudio no se puede intuir qué subgrupos de pacientes se podrían beneficiar de esta nueva diana terapéutica.
Por tanto, de momento está por definir si el bloqueo de la IL-13 constituirá una alternativa terapéutica, bien se utilice en monoterapia, bien dentro de una potencial terapia combinada junto a otros fármacos que actúen sobre otras dianas terapéuticas en CU.
Bibliografía recomendada- •
Biancheri P, Di Sabatino A, Ammoscato F, Facciotit F, Caprioli F, Curciarello R, et al. Absence of a role for interleukin-13 in inflammatory bowel disease. Eur J Immunol. 2014;44:370–385.
- •
Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B,et al. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution. Gastroenterology. 2005;129:550–564.
- •
Oh CK, Faggioni R, Jin F, Wang B, Birrell C, Wilson R, et al. An open-label, single-dose bioavailability study of the pharmacokinetics of CAT-354 after subcutaneous and intravenous administration in healthy males. Br J Clin Pharmacol. 2010;69:645–655
- •
Piper E, Brightling C, Niven R, Oh C, Faggioni R, Poon K,et al. A phase II placebo-controlled study of tralokinumab in moderate-to-severe asthma. Eur Respir J. 2013;41:330–338.
El presente estudio es un ensayo multicéntrico, aleatorizado, doble ciego, placebo-controlado, efectuado en pacientes con CU activa (índice de Mayo ≥ 4 y <10), aleatorizados a recibir 200, 400 o 600mg de anrukinzumab o placebo. Los pacientes recibieron las 5 dosis durante 14 semanas. El objetivo primario fue el cambio de la calprotectina fecal (CF) entre la basal y la de la semana 14. Los objetivos secundarios incluyeron la seguridad, farmacocinética y niveles de IL-13. La población analizada por intención de tratar incluyó a 84 pacientes(21 por brazo). El objetivo primario (cambio en CF) no fue significativamente diferente para ninguno de los grupos de tratamiento respecto a placebo. Las comparaciones exploratorias de cada dosis no fueron distintas, significativamente, respecto a placebo en términos de cambios en el índice de Mayo total, respuesta clínica, remisión clínica y proporción de pacientes con curación mucosa. En todos los grupos de anrukinzumab se observó un aumento de la IL-13 sérica (libre y unida a anrukinzumab), no así en el grupo placebo. El perfil de seguridad no fue diferente entre los grupos anrukinzumab y placebo.
ComentariosAnrukinzumab es un anticuerpo Ig G1 humanizado que se une a IL-13 e inhibe su unión a la cadena IL-R4α, que es parte del complejo R de IL-13, mientras no bloquea la unión de IL-13 a las cadenas IL-13Rα1 o α2.
El estudio que vamos a comentar a continuación es un fase IIa doble ciego realizado en 38 centros de 10 países europeos, EE. UU. y Canadá. Se incluyó a 84 pacientes (de los 152 tratados mediante screening). Fueron aleatorizados a recibir 3 dosis diferentes de anrukinzumab (200, 400 y 600mg) o placebo. Se administraron 5 dosis en las semanas 2, 4, 8 y 12, en un período de tratamiento de 14 semanas. Como objetivo primario se escogió el cambio en el valor de CF desde el momento basal a la semana 14. Este cambio se expresó como 100 × ([postratamiento/basal]-1). Los pacientes debían estar activos con índice de Mayo ≥ 4 y <10 y un subíndice endoscópico ≥ 2 y una CF ≥ 100mg/kg durante el período de screening. Los objetivos secundarios incluyeron cambio en la CF en las semanas 2, 4, 8 y 12, farmacocinética, IL-13 total, anticuerpos antifármaco y neutralizantes y seguridad y tolerabilidad de anrukinzumab. Otros objetivos predefinidos incluían el cambio en el índice de Mayo y en los subíndices, respuesta clínica en la semana 14 (descenso del Mayo basal ≥3 puntos, con al menos un cambio del 30%, y descenso de ≥1 puntos o un índice absoluto de 0 o 1 en el subíndice de sangrado rectal), remisión clínica en la semana 14 (Mayo total ≤2, ningún subíndice >1), lactoferrina fecal, PCR de alta sensibilidad e Ig E, entre otros.
De los 84 pacientes que entraron en el estudio, 57 completaron la fase de tratamiento y 45 el seguimiento durante 18 semanas. Las principales motivos de interrupción del tratamiento (n=39) fueron efectos adversos que incluían empeoramiento de la CU (8), deseo de no seguir participando (11) y respuesta clínica insuficiente (8).
En la semana 14 hubo un 59% de reducción en la CF respecto a la basal en los pacientes del grupo placebo, un 71% de reducción en el brazo anrukinzumab 200mg, un 21% de reducción en el grupo anrukinzumab 400mg y un aumento del 24% en el grupo anrukinzumab 600mg. Este grupo fue el único que alcanzó significación respecto a placebo, pero por incremento de los niveles de CF en lugar del descenso esperado.
La exposición a anrukinzumab (Cmax y AUC) aumentaron de 200 a 600mg con los incrementos de dosis proporcionales en los días 1 y semana 12. El incremento en los niveles de IL-13 se observó en todos los brazos de tratamiento, pero no en el grupo placebo. El máximo incremento se observó tras 2 semanas de inicio del tratamiento. Al final del tratamiento los niveles de IL-13 total descendieron de forma progresiva paralelamente al descenso de la concentración de fármaco. Sin embargo, en algunos pacientes los niveles de la IL-13 total descendieron durante el tratamiento mientras la concentración del fármaco todavía estaba elevada.
No hubo diferencias entre los distintos brazos de anrukinzumab y placebo respecto a los cambios en el índice de Mayo, respuesta, remisión clínica o curación mucosa. No obstante, este estudio preliminar no estaba diseñado para valorar diferencias en estos parámetros clínicos y, por tanto, estos resultados deben ser interpretados con precaución.
Respecto al perfil de seguridad, no se objetivaron diferencias en los efectos adversos en ninguno de los 4 brazos de tratamiento. Los efectos adversos más frecuentes fueron empeoramiento de CU, anemia, nasofaringitis y cefalea.
Un aspecto muy novedoso de este estudio es la elección de los cambios en los valores de CF como objetivo primario. El resultado negativo respecto a la CF es concordante con la falta de eficacia objetivada en los parámetros clínicos en el estudio, lo que apoya el potencial uso en la clínica de la CF como marcador de actividad. Por otra parte, la alta tasa de abandono de pacientes a lo largo del estudio produce una importante pérdida de datos, lo que limita la potencia del estudio. En resumen, este estudio nos muestra que el anrukinzumab tiene actividad biológica frente a IL-13 pero los resultados clínicos y respecto a biomarcadores en CU son negativos, lo que hace cuestionar el papel patogénico de la IL-13 en la CU.
Teóricamente, el bloqueo de IL-13 es una aproximación terapéutica novedosa muy atractiva en el tratamiento del asma y la CU. Sin embargo, los resultados negativos del estudio con tralokinumab publicado en Gut en enero del 2015, junto a los del estudio con anrukinzumab en el mismo sentido son ciertamente desalentadores. En los estudios de bloqueo de IL-13 en pacientes con asma se han detectado biomarcadores que identifican una potente respuesta Th2 y predicen la eficacia terapéutica del bloqueo de IL-13. Un claro ejemplo es el del lebrikizumab, un ac antiIL-13, en el que se evidencia que el subgrupo de pacientes con asma y elevada periostina tenían una mejoría en el volumen de espiración forzada 5 veces mayor respecto al grupo con niveles de periostina bajos. Lamentablemente no disponemos en la actualidad de biomarcadores en este sentido en CU. Por otra parte, está por determinar cuál es el objetivo ideal en estudios preliminares en CU como los 2 comentados. No obstante, los resultados de estos 2 estudios con moléculas que bloquean la IL-13 son claramente negativos, lo que hace albergar escasas esperanzas acerca de su potencial terapéutico en CU en un futuro próximo.
Bibliografía recomendada- •
Arima K, Umeshita-Suyama R, Sakata Y, Akaiwa M, Mao XQ, Enomoto T,et al. Upregulation of IL-13 concentration in vivo by the IL13 variant associated with bronchial asthma. J Allergy Clin Immunol. 2002;109:980–987.
- •
Kasaian MT, Tan XY, Jin M, Fitz L, Marquette K, Wood N,et al. Interleukin-13 neutralization by 2 distinct receptor blocking mechanisms reduces immunoglobulin E responses and lung inflammation in cynomolgus monkeys. J Pharmacol Exp Ther. 2008;325:882–892.
- •
Mannon P, Reinisch W. Interleukin 13 and its role in gut defence and inflammation. Gut. 2012;61:1765–1773.