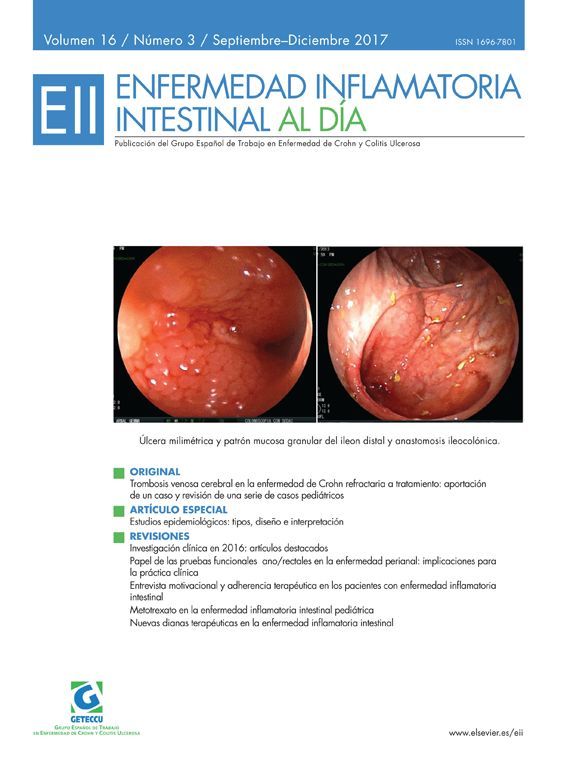
Van Assche G, Manguso F, Zibellini M, Cabriada Nuño JL, Goldis A, Tkachenko E, et al; BETA study participating centers. Oral prolonged release beclomethasone dipropionate and prednisone in the treatment of active ulcerative colitis: Results from a double-blind, randomized, parallel group study. Am J Gastroenterol. 2015;110:708-715. doi: 10.1038/ajg.2015.114
La colitis ulcerosa (CU) se describió en 1875, pero no se descubrieron los primeros tratamientos efectivos como la sulfasalazina hasta la primera mitad del siglo siguiente. En 1955 se publicó el primer ensayo clínico, aleatorizado y controlado que demostró la efectividad de la hidrocortisona en el tratamiento del brote moderado a grave de colitis ulcerosa1. Los receptores de glucocorticoides son ubicuos en los tejidos humanos, por lo que pueden ser útiles en múltiples patologías, pero sus efectos adversos sistémicos pueden limitar su uso y el cumplimiento. Por este motivo, se han desarrollado corticoides orales de baja disponibilidad sistémica como la beclometasona. El objetivo de este tipo de fármacos es mantener la misma eficacia que los corticoides sistémicos pero mejorando su perfil de seguridad2-4. El dipropionato de beclometasona (DPB) se metaboliza rápidamente a beclometasona-17-monopropionato, su metabolito activo, mediante esterasas hepáticas y pulmonares. Este metabolito tiene una afinidad 30 veces mayor que la beclometasona por el receptor glucocorticoide. Los comprimidos están recubiertos de metacrilato, con un núcleo de hidroxipropilcelulosa, permitiendo así la liberación del fármaco en el intestino delgado distal y el colon proximal.
La evidencia hasta ahora sugería que añadir beclometasona a la mesalazina podría mejorar la respuesta clínica en los brotes leves a moderados de CU. Con esta evidencia se recomienda en la Guía clínica de GETECCU su uso a dosis de 5mg/día tras el fallo de la mesalazina y con evaluación precoz de la respuesta5. Posteriormente, hemos dispuesto de los datos de un ensayo clínico aleatorizado, doble ciego, comparando el uso de DPB y prednisona (PD) por vía oral en el brote leve-moderado de CU, que analizamos a continuación6.
¿Se orienta el ensayo a una pregunta bien definida?Sí. La población de estudio está bien definida. Se incluyó a pacientes adultos con CU activa leve o moderada evaluada mediante la presencia de un Disease Activity Index (DAI) de 3 a 9, junto con sangrado rectal y lesión mucosa endoscópica al menos leve. En cuanto a la intervención, el grupo de DPB recibía 5mg al día durante 4 semanas, seguidos de 5mg a días alternos con un placebo los días sin fármaco activo. Los pacientes que recibían PD recibían inicialmente 40mg 2 semanas, con una pauta descendente preestablecida, disminuyendo 10mg cada 2 semanas. La dosis de PD usada es la indicada por la ECCO, pero señalar que en nuestro medio lo más habitual es emplear una dosis de inducción algo más alta (1mg/kg/día) y prolongada.
El objetivo primario de eficacia era evaluar la no inferioridad del fármaco a estudio en cuanto a la respuesta evaluada según el DAI, con un score<3 o un descenso ≥ 3 a las 4 semanas. Como objetivo primario también se evaluó la seguridad en términos de efectos adversos relacionados con el tratamiento junto a una reducción de la producción de cortisol por debajo de<150 nmol/l (5μg/dl). Los objetivos secundarios consistían en una evaluación de la eficacia en términos de mejoría de los síntomas, estado general y severidad, además de la evaluación del perfil global de seguridad.
¿Fue aleatoria la asignación de los pacientes a los tratamientos?Sí. Se los aleatorizó a recibir DPB o PD a razón de 1:1, con un diseño de bloques compensados, de forma centralizada y llevada a cabo con el programa estadístico SAS.
¿Fueron adecuadamente considerados hasta el final del estudio todos los pacientes que participaron en él?Sí. Un total de 297 pacientes fueron evaluados para su posible inclusión en el estudio, siendo aleatorizados finalmente 282 de ellos. El flujo de pacientes se describe detalladamente en la figura 1 del artículo comentado. Se perdieron un total de 16 pacientes con DPB y 13 con PD durante las 8 semanas de estudio. Los motivos de salida del ensayo constan desglosados en la misma figura 1. Tres pacientes con DPB y 6 con PD salieron del ensayo por efectos adversos. Finalizaron el estudio un 88% y un 91% de los aleatorizados a DPB y PD, respectivamente. Los datos perdidos se evalúan mediante la metodología de la última observación llevada hacia delante (last observation carried forward), donde los valores ausentes se sustituyen por el último valor disponible para esa variable.
El análisis estadístico se realizó por intención de tratar y por protocolo para las variables principales. Para las variables de eficacia secundarias se llevó a cabo solo un análisis por intención de tratar.
¿Se mantuvieron ciegos los pacientes, los clínicos y el personal del estudio?Sí. El estudio fue diseñado doble ciego y aleatorizado. Los pacientes desconocían el tratamiento que recibían durante toda la duración del estudio. A todos se les administraba un comprimido diario de la misma forma, color y aspecto, independientemente del grupo al que fueron aleatorizados y la dosis que recibían. A partir de la semana 4, los pacientes recibían DPB 5mg, alternando con placebo, para que todos los pacientes, independientemente del grupo, tomasen siempre la misma cantidad de cápsulas diarias. Los investigadores no conocían el fármaco que recibía cada paciente. Podían conocerlo accediendo al sobre de la aleatorización en caso de necesidad. Ningún sobre se abrió durante el estudio. No consta explícitamente si el resto del personal del estudio estaba ciego.
¿Fueron similares los grupos al comienzo del ensayo?Sí. Los 2 grupos fueron homogéneos en cuanto a sus características basales. Se aleatorizó a 135 pacientes al grupo de DPB y 142 al de PD, cumpliéndose el tamaño muestral estimado. Disponemos de la tabla comparativa de ambos grupos (tabla 1), pero no de su significación estadística. Por ejemplo, en el grupo de PD había más pacientes con colitis izquierda, mientras que con DPB había más pacientes con rectosigmoiditis. Es llamativo también que se incluyó a pacientes con proctitis en ambos grupos (4 en el grupo de beclometasona y 5 en el de PD). Además, se debe destacar que se incluyeron 12 y 14 pacientes, con beclometasona y PD, respectivamente, con actividad endoscópica grave.
Al evaluar la duración de la enfermedad, los 2 grupos tenían una duración similar de la enfermedad (4,1 vs. 3,7 años de media). De todas formas debe tenerse en cuenta el rango, ya que se incluyó a pacientes con una evolución desde los 0,3 y 0,2 años hasta los 39,3 a 38,8 años de evolución en el grupo DPB y PD, respectivamente. En las variables del uso de salicilatos, actividad endoscópica y sangrado rectal, los grupos parecen comparables.
¿Al margen de la intervención en estudio, los grupos fueron tratados de igual modo?Sí. Existían unas reglas preestablecidas de los fármacos permitidos durante el ensayo y los que no. Un 84 y un 83% recibían además salicilatos en el grupo beclometasona y prednisona, respectivamente. Los salicilatos debían estar a una dosis estable en las últimas 2 semanas a una dosis máxima de 3,2g/día, siendo de 3g/día para la sulfasalazina. No se permitía el uso de tratamientos tópicos rectales o antiinflamatorios en las 2 semanas previas ni durante el ensayo. Los pacientes tampoco podían recibir fármacos inmunosupresores o biológicos asociados a los tratamientos del estudio.
¿Es muy grande el efecto del tratamiento?El objetivo primario de eficacia fue demostrar la no inferioridad del fármaco a estudio a las 4 semanas evaluado según el DAI. En el análisis por intención de tratar se observó un 64.6% de respondedores comparado con un 66,2% en el grupo PD (p=0,78, intervalo de confianza [IC] del 95%, 13,00-9,88). Cuando analizamos los datos por protocolo comprobamos un resultado similar, con un 65,1 y un 65,2%, respectivamente (p=0,97, IC del 95%, 11,6-11,53). Esta respuesta observada es algo inferior a la esperada posiblemente por la dosis de PD utilizada y la ausencia de tratamiento tópico rectal5,7. Por otro lado, la proporción de pacientes con actividad clínica moderada, y especialmente endoscópica, podrían también haber condicionado los resultados del efecto. También se confirma la no inferioridad de DPB en cuanto a la remisión clínica y endoscópica a las 4 semanas y en cuanto a mejoría de la rectorragia.
El otro objetivo primario era la seguridad, según la presencia de efectos adversos con una reducción de la producción basal de cortisol<150 nmol/l. Se recogieron 59 eventos con DPB y 76 con PD (p=0,17) a las 4 semanas. La tendencia sí es favorable a DPB teniendo en cuenta las 8 semanas de tratamiento, encontrándose en el límite de la significación estadística (77 vs. 99 eventos, p=0,06). El grupo de PD registró numéricamente más eventos (independientemente de los niveles de cortisol) en las primeras 4 semanas y de forma global. Posiblemente, la dosis moderada de PD y la pauta descendente rápida utilizada, junto con la evaluación a corto plazo (4 semanas), hayan contribuido a la ausencia de diferencias significativas entre los 2 grupos. Además, el diseño del estudio no permitía la suficiente potencia para detectar diferencias en términos de toxicidad corticoidea. Por otro lado, los mismos autores apuntan a la limitación de la técnica de determinación de los niveles basales de cortisol, lo que contribuiría a infraestimar este efecto en el grupo tratado con prednisona.
¿Cuál es la precisión de este efecto?Los autores presentan los resultados como porcentajes junto con los IC del 95%. La diferencia entre los grupos fue de –1,56 (IC del 95%, –13,0 a 9,88) para el objetivo primario de respuesta a la semana 4. Con respecto a la remisión a la semana 4, las diferencias fueron de 3,56 (IC del 95%, –13,34 a 6,21). Las diferencias entre ambos grupos no alcanzan la significación estadística para ninguno de los 2 supuestos. Los IC son amplios, aunque ambos engloban de forma clara al valor nulo. Estos datos confirman la no inferioridad de DPB frente a prednisona, aunque la precisión no es muy alta.
¿Pueden aplicarse estos resultados en tu medio o población local?Sí. Los resultados del ensayo pueden aplicarse en la práctica diaria. La situación clínica que plantea el estudio es frecuente en la consulta de enfermedad inflamatoria intestinal. El uso de corticoides de forma prolongada y sus efectos adversos siguen siendo un problema habitual.
Habría sido muy interesante conocer los resultados en pacientes donde no es recomendable el uso de corticoides sistémicos, como puede ser en caso de diabetes o hipertensión (que fueron específicamente excluidos del estudio), donde los corticoides de acción tópica podrían ser de elección. De todas formas, con este estudio se ha demostrado que el tratamiento con DPB es por lo menos tan eficaz como la PD a las dosis estudiadas y con una tendencia hacia una menor toxicidad sistémica.
¿Se tuvieron en cuenta todos los resultados de importancia clínica?Sí. Además de la variable principal del estudio, se tuvieron en cuenta otras variables de respuesta clínica y de seguridad. La eficacia se evaluó en términos de síntomas de acuerdo con el DAI descrito en la literatura.
Además, se comprobó una respuesta endoscópica como dato más objetivo de cicatrización mucosa a las 4 semanas similar en ambos grupos, alcanzando una proporción similar de pacientes un score endoscópico de 0-1 (odds ratio 0,67, IC del 95% Wald, 0,42-1,09). Algunos datos adicionales, como puede ser la determinación de calprotectina fecal, habrían aportado aún más información clínica de relevancia en el manejo de estas situaciones en el día a día.
¿Los beneficios a obtener justifican los riesgos y los costes?El DPB puede constituir una alternativa en el manejo de brote leve-moderado de CU. De todas formas, no puede recomendarse su uso generalizado, dado que el coste farmacéutico es considerablemente superior a la PD, pero sí puede ser una opción eficaz en pacientes con exposición a dosis altas o ciclos repetidos de corticoides sistémicos y/o riesgo de toxicidad corticoidea. Además, no disponemos de datos acerca de los costes relacionados con un posible mejor cumplimiento de estos fármacos.
Con los estudios que disponemos hasta ahora, la eficacia de la beclometasona alcanza un 60-65% en el tratamiento del brote leve-moderado de CU. Además, con la evidencia actual, al compararla cara a cara con la PD, muestra una tendencia hacia un mejor perfil de seguridad. De todas formas, es necesario ampliar nuestra experiencia con este grupo de fármacos para establecer su papel exacto dentro del algoritmo terapéutico (y su relación con el concepto de corticodependencia, por ejemplo). Al evaluar los datos disponibles en global hasta ahora consideramos que puede tenerse en cuenta como una alternativa válida en aquellos los pacientes con necesidad de ciclos repetidos de corticoides o efectos adversos asociados.
Conflicto de interesesJLC ha participado como investigador principal del estudio que se evalúa y es coautor de la publicación. IR-L declara no tener conflictos de interés relacionados con esta publicación.