El desarrollo de dependencia a corticoides es frecuente en pacientes con colitis ulcerosa (CU). El objetivo de este estudio fue evaluar la eficacia clínica de ADA, entendida como mantenimiento de remisión sin corticoides, en pacientes con CU dependiente de corticoides.
MétodosEstudio multicéntrico, abierto y retrospectivo. Se incluyeron pacientes con CU dependiente de corticoides según criterios de la ECCO. Todos los pacientes recibieron ADA para la inducción 160/80mg y posteriormente 40mg/2 semanas. En caso de pérdida de respuesta se acortó el intervalo de administración o se duplicó la dosis según criterio médico. Los resultados se expresan como media e IC 95% y se analizaron mediante análisis multivariante.
ResultadosSe incluyeron 37 pacientes con CU dependiente de corticoides tratados con ADA (67% mujeres), 65% E3, 12 (32%) naïve a anti-TNF y 25 (68%) habían recibido previamente infliximab. Un 43% necesitaron intensificación con ADA. Tras la inducción, el 35% estaba en remisión sin corticoides, manteniéndola a los 12 meses el 40% de los pacientes. El Mayo parcial basal fue de 6,89; de 3,13 en el mes 6 y de 2,33 en el mes 12. El 48% de los pacientes alcanzaron curación mucosa. Solo 3 pacientes (8%) necesitaron colectomía en el seguimiento. En el análisis multivariante, una menor tasa de remisión se asoció al tratamiento previo con infliximab (HR=12,8; IC 95% 2,24-73,54; p=0,004).
ConclusionesAdalimumab puede ser eficaz para conseguir la remisión clínica sin esteroides y la curación mucosa en pacientes con CU dependiente de corticoides. El uso previo del infliximab es un factor predictivo de menor eficacia.
Steroid dependency develops frequently (more than 30%) with regards to ulcerative colitis (UC) patients. Our aim was to evaluate the clinical efficacy of ADA in steroid-dependent UC patients.
MethodsOpen-label, retrospective, consecutive, and multicentre study. Inclusion criteria were patients over 18 years old with UC and ECCO criteria of steroid-dependency. All patients received ADA treatment for induction (160/80mg) at weeks 0 and 2 and 40mg every 2 weeks thereafter. The main endpoint was clinical remission without steroids. Clinical response, mucosal healing and levels of C-reactive protein and calprotectine were also evaluated. Results are shown in percentages; associations were analyzed by multiple regression whenever appropriate.
ResultsThirty-seven steroid-dependent UC patients treated with ADA: 65% E3. Twelve patients (32%) naive to anti-TNF and 25 (68%) had previously received infliximab. Forty-three percent needed ADA intensification. After induction 35% of patients were in remission and after 12 months 40% of patients were in remission without steroids. The mean partial Mayo score was 6.89 basal, 3.13 at month 6 and 2.33 at month 12 (P<.01). Mucosal healing was achieved in 48% of patients. Only 3 patients (8%) needed a colectomy. We did not observe any association between clinical characteristics and response to ADA, but after multivariate analysis patients with loss of response to ADA had a lower remission rates (HR=12.8; CI 95% 2.24-73.54; P=0.004).
ConclusionsAdalimumab can be effective for clinical remission without steroids and mucosal healing in steroid-dependent UC. Loss of response to ADA is a predictive factor of poorer efficacy.
En la colitis ulcerosa (CU), alcanzar la remisión clínica y la cicatrización de las lesiones mucosas constituyen objetivos terapéuticos para una mejor evolución de la enfermedad, con menores tasas de hospitalización y colectomía. Pero, a día de hoy, un objetivo añadido es alcanzar la remisión libre de esteroides1 por el efecto deletéreo que estos suponen en el paciente por la toma continua y repetida de los mismos. La cicatrización de las lesiones en la CU supone menores tasas de colectomía y hospitalización, mayor número de pacientes en remisión libre de esteroides y mejoría en la calidad de vida. Por este motivo, ha de ser un objetivo a alcanzar con cualquiera de los fármacos utilizados2,3. Hasta un 30-40% de los pacientes con CU necesitarán los corticoides para el control de sus síntomas, con tasas de dependencia a corticoides al año del 20%1.
En los pacientes dependientes de corticoides está recomendado el uso de tiopurínicos como azatioprina (AZA), con tasas de remisión clínica y endoscópica libre de esteroides del 53 y el 21%, respectivamente, a los 6 meses4–6. Tanto en las Guías Europeas como en las de GETECCU la AZA es el tratamiento de elección en la CU dependiente de corticoides7,8.
Los fármacos anti-TNF (infliximab [IFX] y adalimumab) son útiles en pacientes que no responden a terapias previas (aminosalicilatos, corticoides y tiopurínicos), con actividad moderada-grave, pero su papel en la dependencia de corticoides ha sido menos estudiado. La mayoría de los ensayos clínicos avalan su eficacia en la resistencia a corticoides (ACT 1 y ACT 2 para IFX y ULTRA 1 y ULTRA 2 para adalimumab), con tasas de respuesta y remisión a las 52-54 semanas de 64,5 y 27,3%, respectivamente, para IFX9,10 y algo menores para adalimumab11,12. Sin embargo, a pesar de la poca evidencia de su eficacia en la CU dependiente de corticoides, en ambas guías (ECCO y GETECCU) se recomiendan los biológicos en caso de fracaso o intolerancia a inmunosupresores tiopurínicos7,8.
Datos a 4 años del estudio ULTRA 3 y ULTRA 4 con adalimumab muestran tasas de remisión del 24,7% y curación mucosa del 26,3%. Además, hasta un 59% de los pacientes que recibieron corticoides en los estudios de inducción previos pudieron suspenderlos, con una tasa libre de corticoides a los 4 años de tratamiento del 40%. En este estudio se demostraron también menores tasas de hospitalización y de colectomía13.
Los pacientes que habían recibido previamente tratamiento con otro anti-TNF presentaban menores tasas de remisión y curación mucosa. Además del tratamiento previo con otro anti-TNF, se identificaron, como factores predictores de pérdida de respuesta, el aumento de la proteína C reactiva (PCR) y el descenso en las cifras de albúmina.
Las tasas de remisión con anti-TNF en pacientes dependientes de corticoides provienen de estudios con poblaciones heterogéneas y con gran diversidad en los criterios de inclusión. En la práctica clínica, los datos son superiores a los obtenidos en los ensayos clínicos debido a la heterogeneidad de los estudios (gravedad del brote, uso previo de IFX e inmunosupresores, etc.). No obstante, muestran cómo adalimumab es eficaz en inducir y mantener la remisión, así como en permitir la retirada de corticoides en más de un 60%. También consiguen la curación mucosa, incluso en pacientes previamente tratados con IFX14,15.
Otros autores, como Baert et al.16, muestran cómo la respuesta primaria a IFX y los niveles elevados de fármaco en la inducción con adalimumab son factores predictores de buena respuesta a adalimumab en segunda línea de tratamiento, tanto en la semana 12 (respuesta del 30%) como al año de tratamiento (52%), con una tasa de remisión libre de esteroides del 22%.
El objetivo del estudio fue evaluar la eficacia clínica y la remisión libre de esteroides en pacientes con CU dependiente de corticoides tratados con adalimumab. Además se ha evaluado secundariamente la curación mucosa, así como el descenso en la PCR y la calprotectina fecal.
Material y métodosEstudio multicéntrico, abierto, retrospectivo y con inclusión consecutiva según la práctica clínica habitual. Para ello se incluyeron todos los pacientes con CU mayores de 18 años que cumplían criterios de dependencia a corticoides según los criterios de la ECCO (la imposibilidad de reducir la prednisolona u otro corticoide equivalente por debajo de 10mg/día después de los 3 meses del inicio del tratamiento, así como la aparición de recaídas en los 3 meses desde el inicio de los corticoides). Se excluyeron reservoritis, pacientes en edad pediátrica y aquellos que recibieron adalimumab por otra indicación distinta a la dependencia de corticoides.
Todos los pacientes recibieron en la inducción 160/80mg en las semanas 0 y 2 y posteriormente 40mg de adalimumab cada 2 semanas. Se incluyeron tanto pacientes naive como los que habían recibido previamente otro fármaco anti-TNF. Se recogieron variables demográficas que incluían edad, sexo y hábito tabáquico, así como variables clínicas que incluían extensión de la enfermedad de acuerdo con la Clasificación de Montreal, presencia de manifestaciones, tratamientos previos y tratamientos concomitantes con inmunosupresores.
Los pacientes incluidos fueron evaluados al final de la inducción y en los meses 6 y 12. En los pacientes que perdieron respuesta, se acortó el intervalo de administración o se aumentó la dosis, según criterio médico.
El índice clínico utilizado fue el índice de Mayo parcial, y para evaluar la actividad endoscópica, el índice de Mayo endoscópico. La endoscopia se realizó según práctica clínica y se definió curación mucosa como un Mayo 0 o 1 endoscópico. Asimismo, se recogieron los valores de calprotectina y de PCR.
Además de evaluarse la remisión clínica sin esteroides durante todo el tratamiento, se valoró la respuesta clínica, la curación mucosa y la disminución de los valores en la PCR y la calprotectina fecal.
Los resultados se expresaron en porcentajes y se realizó un análisis multivariante mediante regresión de Cox para valorar las asociaciones.
ResultadosSe incluyeron consecutivamente 37 pacientes (en la tabla 1 se muestran las variables sociodemográficas y clínicas de los pacientes incluidos) con CU dependiente de corticoides tratados con adalimumab. La edad media fue de 45 años y la media de años desde el diagnóstico fue de 10. El 40% presentaban manifestaciones extraintestinales, y en cuanto a la distribución según Montreal, el 5% eran E1, el 30% E2 y el 65% tenían afectación extensa (E3). Doce pacientes (32%) eran naive para anti-TNF y 25 (68%) habían recibido previamente IFX. La media de seguimiento fue de 25,9 meses. El 83% de los pacientes recibía tratamiento combinado con inmunosupresores, recibiendo todos tiopurínicos, excepto uno, que recibió metotrexato.
Características sociodemográficas de los pacientes incluidos
| Pacientes, n | 37 |
| Mujeres, n (%) | 25 (67,5) |
| Duración de la enfermedad, media (años) | 11 |
| Manifestaciones extraintestinales, n (%) | 15 (40,5) |
| Colitis extensa (E3), n (%) | 24 (64,8) |
| IFX previo, n (%) | 25 (67,5) |
| Media de seguimiento (meses) | 25,9 |
| Tratamiento concomitante con IMM, n (%) | 31 (83,7) |
| Necesidad de intensificación, n (%) | 16 (43,2) |
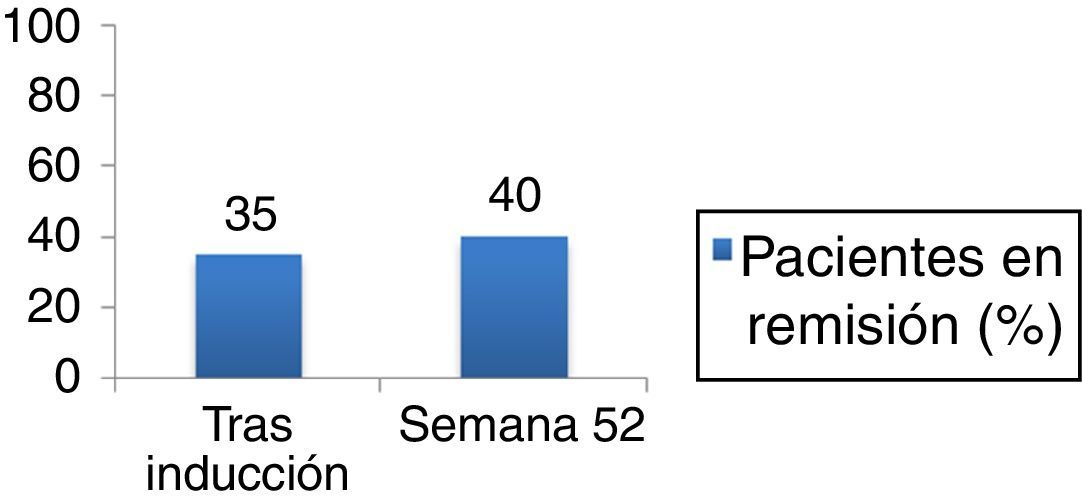
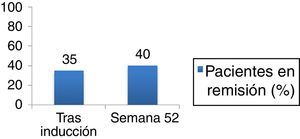
Tras la inducción, el 35% de los pacientes estaba en remisión sin esteroides, manteniéndola el 40% de los pacientes incluidos a los 12 meses (fig. 1).
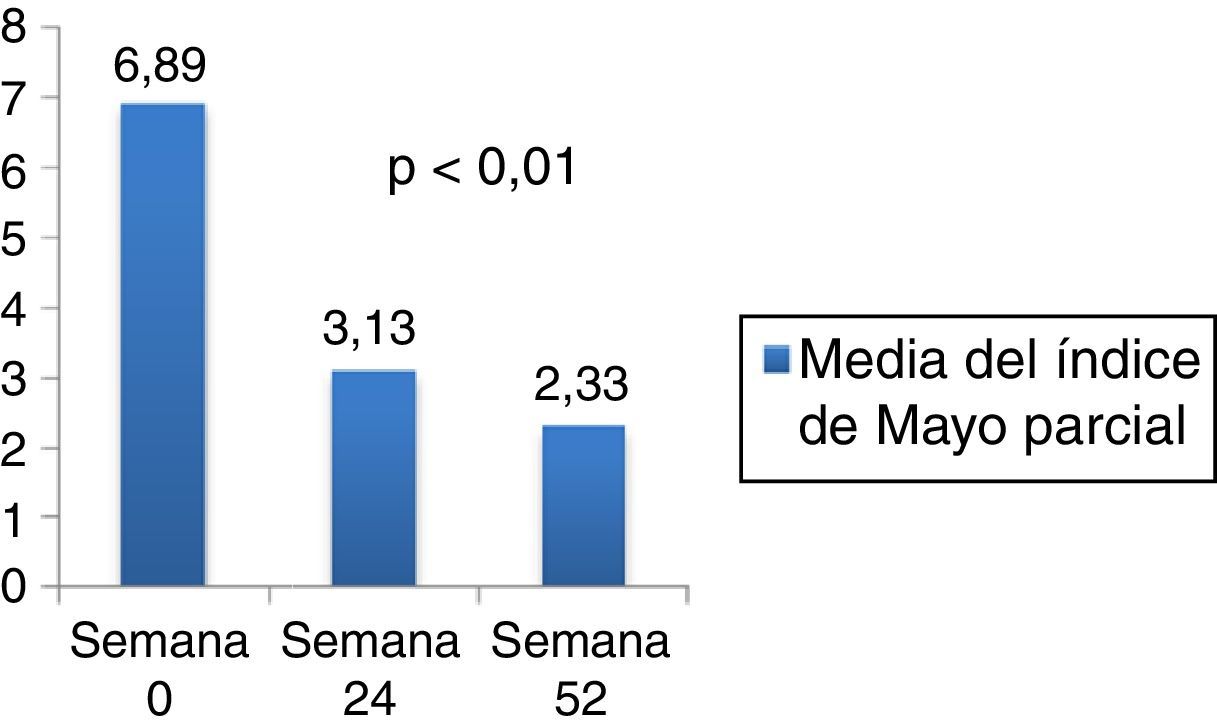
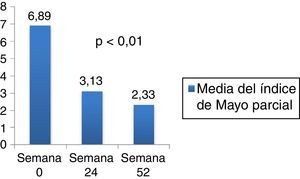
La media del Mayo parcial (fig. 2) al inicio del tratamiento fue de 6,89; de 3,13 a los 6 meses (IC 95% 2,88-4,58; p<0,001) y de 2,33 a los 12 meses de tratamiento (IC 95% 3,43-6,35; p<0,001). La curación mucosa se alcanzó en el 48% de los pacientes.
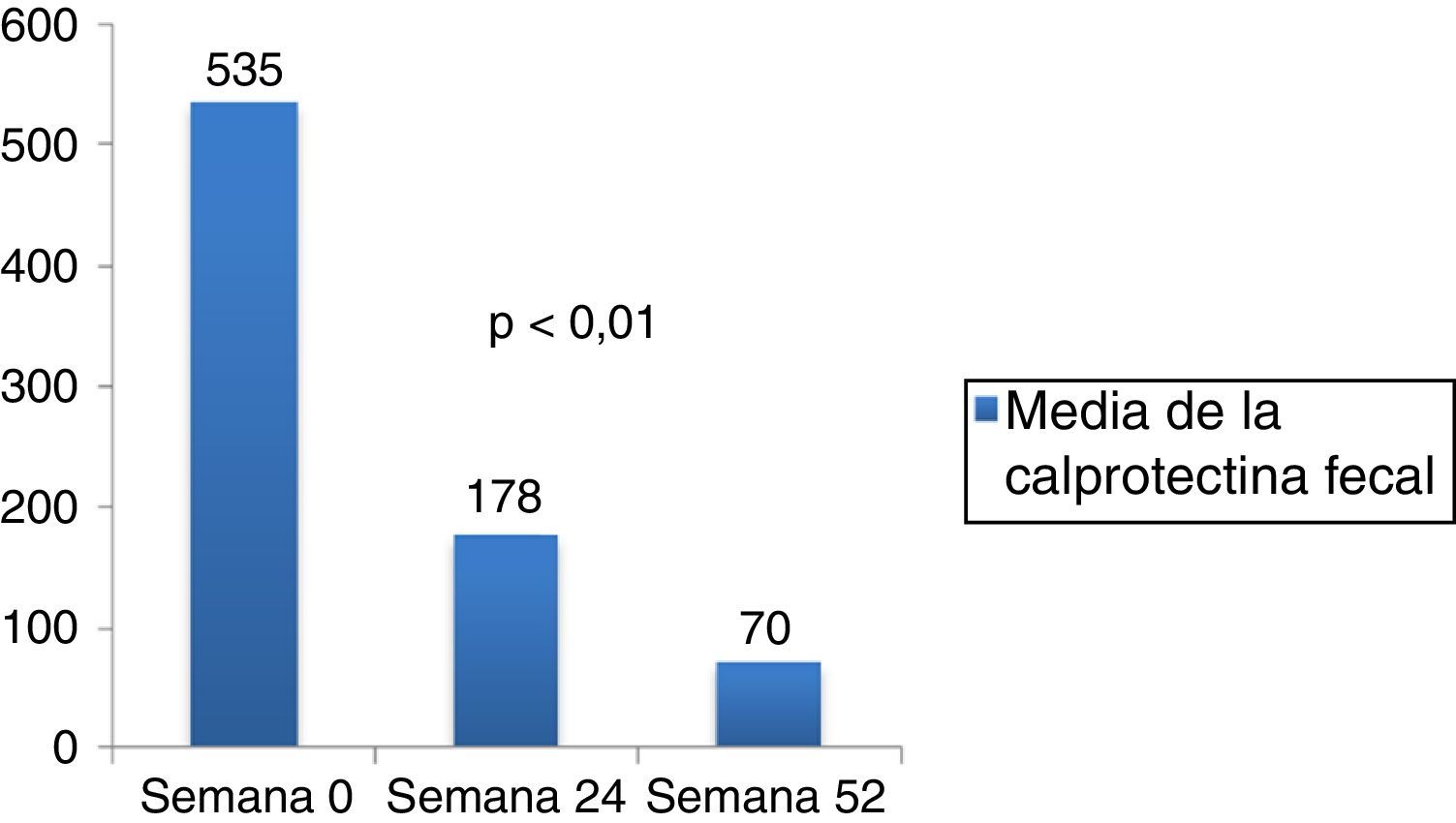
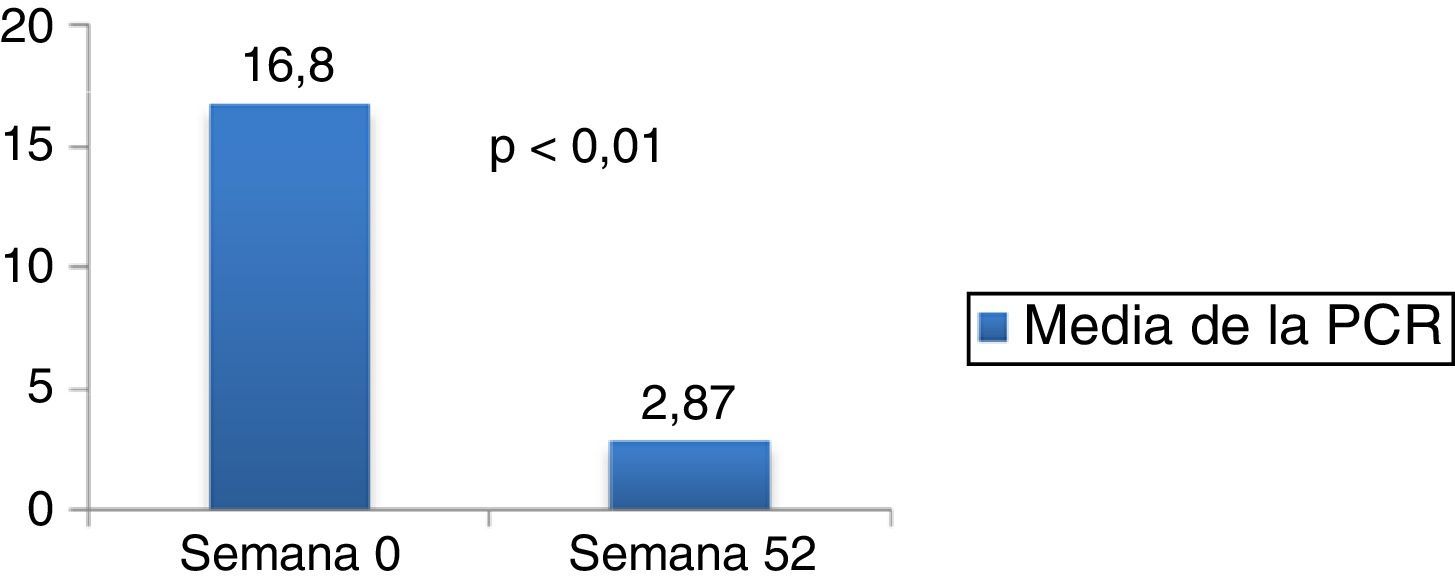
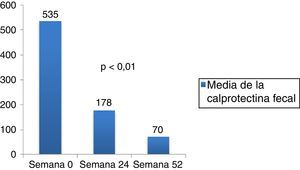
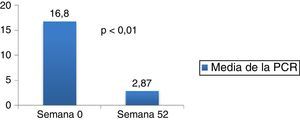
La media de la calprotectina (fig. 3) disminuyó de 535,92 basal a 178,33 en el mes 6 (IC 95% 1,62-713,54; p=0,0049) y a 70 en el mes 12. La PCR (fig. 4) disminuyó de 16,8 a 2,87 en el mes 12 (IC 95% 9,44-18,43; p<0,001).
El 43% precisó intensificación del tratamiento por pérdida de respuesta. Solo 3 pacientes (8%) precisaron colectomía al año. No se observaron efectos adversos graves durante el tiempo de tratamiento que obligasen a abandonar este.
No se observó ninguna asociación entre las características clínicas y el tratamiento concomitante con inmunosupresores y la respuesta a ADA. En el análisis multivariante mediante regresión de Cox, los pacientes que necesitaron intensificación con ADA (HR=48,1; IC 95%1,46-1.589,1; p=0,03) y los pacientes que habían estado con IFX previo (HR=12,8; IC 95% 2,24-73,54; p=0,004) tenían menores tasas de remisión.
DiscusiónAdalimumab ha demostrado ser eficaz para alcanzar la remisión clínica libre de esteroides y la curación mucosa en pacientes con CU dependiente de corticoides. Existen factores predictivos de baja eficacia como el uso previo de IFX.
La dependencia a corticoides en la CU es un problema común entre los pacientes moderados-graves. A pesar de que existe un tratamiento de elección como es AZA7,8, casi un 40% de los pacientes que la reciben, bien no pueden retirar los esteroides, bien deben abandonar la medicación por presencia de efectos adversos. En estos casos parece que los fármacos anti-TNF son el siguiente escalón terapéutico.
Lógicamente, debido a su introducción más temprana en el arsenal terapéutico, existen más datos de eficacia en dependencia a corticoides con IFX. Sin embargo, a pesar de que su utilización en la práctica clínica en este contexto no es infrecuente, existen muy pocos estudios de calidad metodológica que evalúen la eficacia de IFX en la CU dependiente de corticoides. El primer estudio que evaluó la eficacia del fármaco en dependencia de corticoides ha sido un trabajo italiano17 que incluyó 20 pacientes que dividieron en 2 grupos que recibieron IFX o metilprednisolona. Con una media de seguimiento de casi 10 meses se alcanzó la remisión en el 90% de los pacientes del grupo de IFX y en el 80% del grupo de corticoides, concluyendo los autores que IFX es eficaz en el tratamiento de la CU dependiente de corticoides. En otro estudio, realizado por un grupo griego18, incluían 16 pacientes con CU y comparaban IFX de inducción y mantenimiento en las dosis habituales con metilprednisolona y observaron una muy buena respuesta en los 2 grupos, pero en los de tratamiento esteroideo casi todos los pacientes presentaron reacción cushingoide. Estos 2 estudios tienen varias limitaciones, como la falta de evaluación endoscópica para saber si los pacientes conseguían curación mucosa, la ausencia de información sobre si en estos pacientes dependientes de corticoides se había intentado tratamiento con inmunosupresores tiopurínicos y, finalmente, es muy cuestionable que se intente tratar a pacientes dependientes de corticoides con altas dosis de estos. Posteriormente se ha publicado un estudio abierto prospectivo en el que se evaluó la eficacia clínica y endoscópica de IFX en 17 pacientes con CU dependientes de corticoides, todos ellos refractarios o intolerantes a AZA19. Los resultados a 2 años mostraron una remisión clínica y endoscópica superior al 50%, con una alta concordancia entre ambos hallazgos. Por otra parte, también se observó que casi el 20% de los pacientes que habían perdido respuesta volvían a alcanzar la remisión tras intensificar el tratamiento. En otro estudio italiano posterior, pero con un mayor número de pacientes tratados con IFX (n=126), tras una alta tasa de respuesta inicial (76%), de los respondedores, el 64% continuaban a largo plazo en remisión sin esteroides, siendo los resultados bastante similares a los previamente descritos20.
Diferentes estudios han demostrado la eficacia de adalimumab para alcanzar la remisión libre de esteroides y la curación mucosa en la CU. Además de los conocidos estudios pivotales ULTRA11,12, tenemos datos españoles de práctica clínica con 48 pacientes obtenidos del registro ENEIDA, que muestran tasas de remisión del 70, 43,2 y 35% en las semanas 12, 28 y 54, respectivamente. El 81% de los pacientes habían recibido previamente IFX, y el único factor predictivo de respuesta a adalimumab era el haber presentado respuesta a IFX. La tasa de colectomía fue del 22%, mayor en los no respondedores primarios a adalimumab21. Estos datos confirman, al igual que ocurría con IFX, que las tasas de remisión en la práctica clínica son superiores a las de los ensayos pivotales.
Sin embargo, apenas existen datos sobre la eficacia de adalimumab en la práctica clínica en pacientes dependientes de corticoides. Solamente en un subanálisis del estudio multicéntrico italiano, en 40 pacientes con CU dependientes de corticoides tratados con adalimumab14, el 60% fue capaz de retirar los esteroides. En nuestro estudio, adalimumab es eficaz en alcanzar la remisión libre de esteroides (45%) y la curación mucosa (48%) en dependencia a corticoides; sin embargo, nuestra cohorte de 37 pacientes presentaba una media de 11 años de evolución de su enfermedad y, quizás, las tasas más bajas de remisión puedan deberse a una enfermedad más evolucionada. Existen datos, sobre todo en enfermedad de Crohn, donde los anti-TNF son más eficaces en formas tempranas22.
Las tasas de remisión libre de esteroides fueron menores en los que perdieron respuesta a adalimumab, como es lógico, y en los que previamente habían sido tratados con IFX, confirmándose que en CU un segundo anti-TNF presenta menor eficacia que en los pacientes naive. En nuestro estudio solo 3 pacientes (8%) precisaron colectomía al año de seguimiento. Esta tasa es similar a la registrada por el grupo español21, del 11% para pacientes naive y algo más del doble (27%) en pacientes ya tratados previamente con otro anti-TNF.
Al igual que en el estudio de Armuzzi et al. con IFX20, en nuestra serie vimos cómo la PCR en el mes 12 de iniciado el tratamiento se había normalizado. Nosotros aportamos como novedad que hemos observado un descenso significativo en la calprotectina fecal a las 12 semanas y a los 6 meses, confirmando que puede ser un marcador de seguimiento útil en este subgrupo de pacientes.
La principal fortaleza de nuestro estudio es que los pacientes incluidos eran todos dependientes de corticoides según la definición de la ECCO, lo que confiere una mayor homogeneidad a la muestra; además, aportamos datos endoscópicos y biomarcadores en el seguimiento.
La principal limitación de nuestro trabajo es que se trata de un estudio retrospectivo y que el número de pacientes es limitado, por lo que no se han podido realizar algunos subanálisis, como el de los factores asociados a colectomías. Además, incluimos tanto pacientes que eran naive como otros que no, lo que supone un sesgo a la hora de extrapolar resultados.
Como conclusión, presentamos el primer estudio en práctica clínica que evidencia la eficacia de adalimumab en el tratamiento de pacientes con CU dependientes de corticoides. Adalimumab es eficaz para alcanzar la remisión libre de esteroides y la curación mucosa en casi la mitad de nuestra muestra, siendo mejores los resultados en los pacientes naive para anti-TNF. Además, adalimumab disminuye las cifras de PCR y calprotectina fecal, reflejando, de forma indirecta, el control sobre la inflamación y la curación mucosa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesTodos los autores declaran haber tenido bien advisories bien ayuda a asistencia a congresos por parte de ABBVIE.