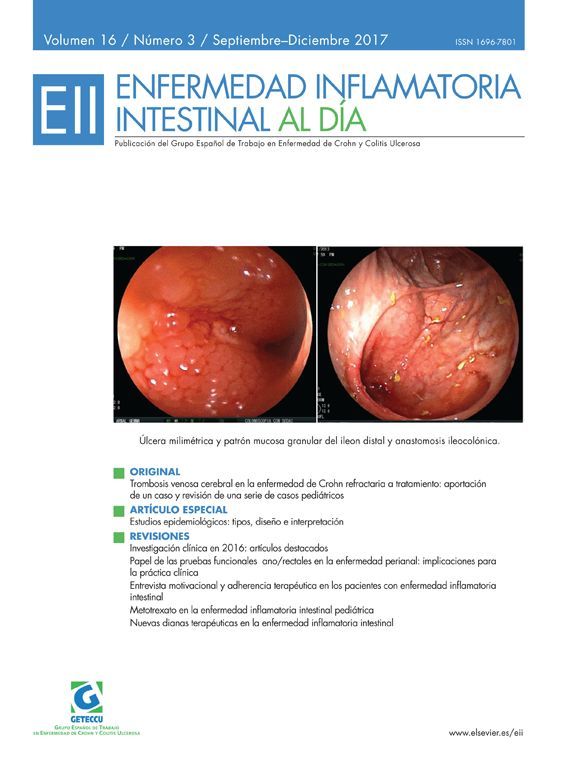
Uno de los principales objetivos en la enfermedad de Crohn es inducir y mantener la remisión para disminuir la tasa de complicaciones y hospitalizaciones, y mejorar la calidad de vida. Actualmente disponemos de inmunosupresores y anticuerpos monoclonales anti-TNF-α que son más efectivos cuando se utilizan de forma combinada. Aún siendo muy efectivos, alrededor de un 30% de los pacientes no responden a la terapia biológica. Además, entre un 10-15% de pacientes en tratamiento biológico pierden respuesta anualmente1. Por esto es importante encontrar nuevas dianas terapéuticas eficaces en pacientes en los que se haya agotado la vía del TNF.
Una de estas nuevas dianas podrían ser las proteínas SMAD7. La enfermedad de Crohn se ha asociado con un descenso anormal de la actividad del TGF-ß1. El TGF-ß1 es una citoquina inmunosupresora que inhibe la proliferación y la diferenciación de células T, y reduce la activación de macrófagos y la maduración de las células dendríticas. El descenso de la actividad de TGF-ß1 es debido al aumento de los niveles de SMAD7, una proteína intracelular que se une al receptor del TGF-ß1 e inhibe su efecto. Mongersen es un oligonucleótido capaz de unirse al mRNA de SMAD7, facilitando su degradación lo que reduce la síntesis de esta proteína y, en consecuencia, aumenta el efecto de TGF-ß1.
Para la evaluación de este artículo seguiremos la metodología Critical Appraisal Skills Programe (CASP) o programa de habilidades en lectura crítica.
¿Se orienta el estudio clínico a una pregunta claramente definida?Sí. Este estudio evalúa la eficacia de Mongersen a diferentes dosis (10, 40 y 160mg) en enfermedad de Crohn activa moderada-severa (CDAI≥220), comparándolo con placebo. El objetivo primario del estudio es evaluar el porcentaje de pacientes en remisión clínica al día 15 (definida como un CDAI<150 y mantenido al menos 2 semanas), así como el perfil de seguridad.
Entre los objetivos secundarios se incluyeron la respuesta clínica (disminución del CDAI≥100 puntos o de ≥70 a los 15, 28 y 84 días) y la normalización de la proteína C reactiva (PCR) después del tratamiento.
La población del estudio está bien definida. Se incluyeron pacientes entre 18 y 75 años, con una actividad de Crohn moderada-severa evaluada por criterios clínicos (CDAI≥220), con lesiones en íleon terminal y/o colon derecho objetivadas mediante pruebas de imagen (endoscopia, RM o TAC) realizadas en el año previo a la inclusión, y con córtico-dependencia o córtico-resistencia.
¿Fue aleatoria la asignación de los pacientes a los tratamientos?Sí. Este es un estudio clínico en fase 2, multicéntrico, randomizado, doble ciego y controlado con placebo. Los pacientes que cumplían criterios de inclusión fueron aleatorizados a recibir durante 2 semanas: Mongersen en 3 tipos de dosis diferentes (10, 40 o 160mg) o placebo; en un ratio 1:1:1:1. La aleatorización fue generada por ordenador y no se llevó a cabo ningún tipo de estratificación.
¿Fueron adecuadamente considerados hasta el final del estudio todos los pacientes que entraron en él?Sí. Se detallan los procedimientos a seguir en el caso de empeoramiento (aumento del CDAI>70 puntos), y las terapias de rescate una vez finalizados los 15 días del tratamiento a estudio. En los pacientes en tratamiento con corticoides en remisión clínica a los 15 días se permitió descender la dosis de esteroides.
Ciento sesenta pacientes completaron el seguimiento de 28 días y 138 a los 84 días. Asimismo se detallan adecuadamente las causas de las pérdidas en el seguimiento.
¿Se mantuvieron ciegos al tratamiento los pacientes, los clínicos y el personal del estudio?Sí. El estudio fue a doble ciego. El placebo y las distintas dosis del fármaco fueron igual en apariencia y sabor. No hay mención de una rama de tratamiento abierto con Mongersen para aquellos pacientes que no respondieran a la inducción.
¿Fueron similares los grupos al comienzo del ensayo?Sí. Los pacientes fueron distribuidos en 4 grupos distintos, según si recibían placebo o Mongersen 10, 40 o 160mg. Los grupos eran similares en cuanto a edad, sexo, índice de masa corporal (IMC), tabaquismo, resecciones intestinales previas, nivel de PCR, porcentaje de córtico-dependencia o córtico-resistencia, y toma de corticoides o uso de inmunomoduladores previo al inicio del tratamiento. La única excepción fue que el CDAI fue mayor en el grupo de 40mg que en el placebo, y la evolución de la enfermedad, que fue más larga en los grupos de 40 y 160mg que en el grupo placebo.
¿Al margen de la intervención en estudio los grupos fueron tratados de igual modo?Dado que el estudio era aleatorizado y doble ciego se supone que los pacientes divididos en los 4 grupos de estudio realizaron un seguimiento en las mismas condiciones.
¿Cuán grande fue el efecto de la intervención?Para el cálculo de la muestra se asumieron tasas de remisión del 50% en el grupo con altas dosis de Mongersen y de un 20% con placebo. Se estimó que serían necesarios 40 pacientes por grupo para obtener una potencia del 90% en el estudio y detectar diferencias en las tasas de remisión entre los grupos.
Sorprende la tasa elevada de remisión clínica obtenida en estos pacientes, —entre el 55 y 65% según las dosis— sobre todo si se compara con estudios previos con infliximab (32,5% a la semana 6 en el estudio SONIC)2, adalimumab (36% a semana 4 en el CLASSIC)3 y vedolizumab (14,5% de remisión clínica en la semana 6 y 39% en la semana 54 en el GEMINI 2 trial)4.
Estas diferencias tan marcadas podrían ser debidas a que en el estudio de Monteleone se usó solamente el CDAI para valorar el grado de actividad previa a la inclusión; no así en los otros estudios citados, donde se requería de una colonoscopia que objetivara inflamación o bien una PCR elevada para ser incluidos.
En el estudio de Monteleone, la PCR a la inclusión fue normal hasta en un 39% de pacientes. Este porcentaje sorprende por ser inusualmente alto y hace sospechar que quizás se incluyeron pacientes que realmente no estaban en un brote agudo de su enfermedad. Sin embargo, las bajas tasas de respuesta al placebo podrían ser interpretadas en sentido contrario, es decir, que no parece que se incluyera un número excesivamente elevado de pacientes con síntomas funcionales y alta respuesta al placebo.
La proporción de pacientes con un CDAI<150 a los días 15, 28 y 84 fue significativamente superior en el grupo de 160 y 40mg. Es llamativo que un tratamiento de tan solo 15 días consiga inducir la remisión en un porcentaje alto (67%) de pacientes con enfermedad de Crohn moderada-severa, y que esta se mantenga hasta 3 meses. Como sugiere Vermeire S. en el editorial que acompaña al artículo5, es posible que ciclos cortos de Mongersen puedan ser suficientes para restaurar los procesos inmunorreguladores y mantener una remisión prolongada.
Únicamente se describieron 9 efectos adversos graves en 6 pacientes, todos ellos relacionados con complicaciones o síntomas de la misma enfermedad de Crohn. La mayoría fueron leves y no hubo diferencias entre los diferentes grupos de tratamiento.
Ante estos resultados los autores concluyen que la tasa de remisión en pacientes tratados con Mongersen a dosis de 40 y 160mg fue claramente superior a placebo. Los resultados son prometedores, aunque serán necesarios nuevos estudios para poder evaluar la utilidad real de esta nueva molécula.
¿Cómo es la precisión de la estimación del efecto de la intervención?El estudio no facilita los intervalos de confianza (IC). Sin embargo en los grupos tratados con 40 y 160mg de Mongersen, incluso con una muestra reducida, los porcentajes de remisión fueron claramente superiores a placebo. Dado que se facilitan el número de pacientes, pueden calcularse los IC, que fueron: 10% (IC 95%: 3-24) para placebo, 55% (IC 95%: 39-70) para Mongersen 40mg y 65% (IC 95%: 49-78) para Mongersen 160mg. Por tanto, el estudio aporta datos convincentes sobre la eficacia del fármaco.
¿Pueden aplicarse estos resultados en tu medio o población local?Al tratarse de un estudio en fase 2, Mongersen todavía no está comercializado, con lo cual su aplicabilidad actual en la práctica clínica es limitada a estudios de investigación.
¿Se tuvieron en cuenta todos los resultados de importancia clínica?Sí. Además de la variable principal de estudio se tuvieron en cuenta aspectos de interés como el perfil de seguridad y la respuesta clínica medida por el CDAI y la PCR. Asimismo se tuvo en cuenta el uso de esteroides o anti-TNF-α previos al tratamiento y también a posteriori. Además se midió la respuesta a nivel molecular mediante niveles de IL-8 y TNF-α en plasma.
Sin embargo, se podrían haber usado datos más objetivos para valorar la respuesta y remisión clínica (específicamente el uso de parámetros endoscópicos como la curación mucosa o también la medida indirecta de la inflamación intestinal mediante determinación de calprotectina fecal).
¿Los beneficios a obtener justifican los riesgos y los costes?La posibilidad de tener un nuevo agente, con formulación oral, con una nueva diana terapéutica (los SMAD7) y altamente efectivo en pacientes refractarios justifica asumir ciertos riesgos en este campo. En función de los resultados obtenidos en el presente estudio, a dosis de hasta 160mg al día, es un fármaco que parece seguro, aunque habrá que valorar estudios con tiempos más prolongados.
FinanciaciónNo se ha recibido ningún tipo de financiación para la realización de este trabajo.