La desnutrición es frecuente en los pacientes con enfermedad inflamatoria intestinal, especialmente en la enfermedad de Crohn, y ejerce un impacto negativo en la evolución de los pacientes. La nutrición enteral puede ejercer un efecto beneficioso tanto sobre el estado nutricional como sobre la evolución de la enfermedad, a través de diversos mecanismos. La nutrición enteral exclusiva no se considera un tratamiento de primera línea en la inducción de la remisión en la enfermedad de Crohn en adultos. Su papel en otras situaciones clínicas, como el mantenimiento de la remisión, no está bien establecido. Son necesarios estudios controlados que permitan definir la utilidad clínica de la nutrición enteral en los pacientes adultos con enfermedad inflamatoria intestinal.
Malnutrition is a common complication in patients with inflammatory bowel disease, especially in those with Crohn's, and it is associated with a negative impact on the patients’ prognosis. Enteral nutrition can induce a beneficial effect on nutritional status as well as on the disease's progression, throughout different mechanisms. Exclusive enteral nutrition is not considered a first-line therapy for the induction of remission in Crohn's disease. Its role in other clinical situations, such as clinical remission maintenance, is not well established. More controlled clinical trials are needed in order to clarify the clinical usefulness of enteral nutrition in inflammatory bowel disease in adults.
El término de enfermedad inflamatoria intestinal (EII) incluye 3entidades clínicas bien diferenciadas que son la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la colitis indeterminada. Los pacientes con EII presentan un elevado riesgo nutricional. La desnutrición es una consecuencia común de las 3entidades, pero que se manifestará con diferentes tipos de déficits nutricionales y grados de severidad en función de la actividad inflamatoria, localización y extensión de la enfermedad. Generalmente los pacientes con afectación del intestino delgado presentan déficits nutricionales más marcados que aquellos que no tienen esta afectación. Por este motivo, la desnutrición es más frecuente y grave en la EC que en la CU1.
La presencia de un deterioro del estado nutricional ejerce un impacto negativo en la evolución de los pacientes, ya que puede condicionar una peor respuesta al tratamiento farmacológico, mayor dificultad en la resolución de las lesiones inflamatorias, así como un incremento del riesgo de infecciones y de la morbimortalidad posquirúrgica. Su frecuencia de presentación no es algo desdeñable, ya que se estima que un 23% de los pacientes con EII que son regularmente seguidos de forma ambulatoria y un 85% de los pacientes hospitalizados presentan deterioro del estado nutricional2.
El soporte nutricional y la corrección de las deficiencias de los micronutrientes es una parte importante del tratamiento integral de los pacientes con EII. Las modalidades clásicas de soporte nutricional son la dieta oral adaptada a la situación clínica, la nutrición enteral (NE) y la nutrición parenteral (NP). La NE en la EII juega un papel primordial como terapia de soporte nutricional en el paciente desnutrido: este es su papel más reconocido y de mayor uso en la práctica clínica habitual. La NE se considera de elección respecto a la NP, siempre y cuando no existan contraindicaciones para su uso, ya que es más fisiológica, más coste-eficiente y tiene menos complicaciones3. La NE se puede utilizar de manera exclusiva (por vía oral o por sonda) o bien asociada a dieta oral basada en alimentos, atendiendo a la situación clínica del paciente. En los casos (muy raros) en los que se requiere NE de larga duración, se puede plantear la colocación de una gastrostomía endoscópica percutánea. En general, se considera que la gastrostomía endoscópica percutánea es una técnica segura en la EC, sin que exista un mayor riesgo de fístulas gástricas o enterocutáneas4.
Los objetivos primarios de la utilización de NE en EII son: prevenir y tratar la desnutrición, favorecer el crecimiento y desarrollo en niños y adolescentes y mejorar la calidad de vida del paciente5. Además de desempeñar un papel relevante en el soporte nutricional de pacientes con EII, la NE podría, con base en sus efectos sobre la fisiología intestinal, influir en la evolución de la enfermedad y, de hecho, se considera una terapia de primera línea en la EC en niños y adolescentes. Sin embargo, en los pacientes adultos, todavía no existe consenso en cuanto a su eficacia e indicaciones en este contexto clínico. Como veremos más adelante, salvo en Japón y otro escaso número de países, la NE no se considera un tratamiento de primera línea para la inducción de remisión en el brote agudo de la EC en adultos, ya que con base en los estudios disponibles su eficacia en adultos parece inferior a la de otros tratamientos, como los corticoides2. Otros contextos clínicos en los cuales el uso de NE parece tener resultados esperanzadores, pero que aún precisan de un mayor número de estudios para hacer una recomendación firme son: como terapia de mantenimiento tanto de forma exclusiva como asociada al uso de anti-TNF, en la prevención de la recidiva posquirúrgica y en la resolución de estenosis en el caso de la enfermedad estenosante de intestino delgado. La baja adherencia al tratamiento con NE por vía oral, especialmente con fórmulas elementales, debido a problemas de palatabilidad, la dificultad para aplicar en nuestro medio algunas modalidades descritas en la literatura (como la administración nocturna con colocación diaria de la sonda) o el coste del tratamiento limitan su utilización a largo plazo.
Los mecanismos por los cuales la NE puede tener un efecto beneficioso sobre el curso clínico de la EII no se conocen con certeza6 (tabla 1). La mejoría de la desnutrición y el efecto nutricional directo al aportar energía y nutrientes esenciales puede tener un efecto beneficioso sobre la respuesta inmune y la cicatrización y la permeabilidad de la mucosa2. Se han descrito varias hipótesis, que incluyen el reposo intestinal relativo, la disminución de la carga antigénica, el efecto de la NE sobre la microbiota7, que induce una reducción de la biodiversidad y disminución de protobacterias8. La NE puede modular de manera favorable la respuesta inmune y ejercer una actividad antiinflamatoria9. Las fórmulas de NE muy pobres en grasa podrían modificar y modular la cascada inflamatoria y la producción de eicosanoides (leucotrieno B4, tromboxano A2, prostaglandina E2)2.
Efecto de la NE sobre la evolución de la EII: mecanismo de acción
| • Secuestro de antígenos intraluminales |
| • Modulación de la respuesta inmune intestinal |
| • Efecto antiinflamatorio |
| • Descenso de producción de citocinas proinflamatorias |
| • Modificación de la captación de ácidos grasos poliinsaturados |
| • Preservación de la barrera intestinal |
| • Mejoría de la cicatrización |
| • Modificación de la microbiota |
| • Regulación de la motilidad intestinal |
| • Mejoría del estado nutricional |
| • Disminución del hipermetabolismo asociado a la EII |
| • Disminución de la hipertrofia del tejido adiposo mesentérico |
A lo largo de esta revisión repasaremos el papel de la NE en el tratamiento de la EII en pacientes adultos, como modalidad de soporte nutricional y atendiendo a su posible papel en la inducción o el mantenimiento de la remisión de la enfermedad. Para ello, se ha realizado una búsqueda bibliográfica en las bases de datos Medline (PubMed), Embase, Cochrane Library y Trip Database, y se han revisado los artículos en lengua castellana e inglés publicados hasta diciembre de 2015, utilizando como palabras clave: «inflammatory bowel disease, Crohn's disease, ulcerative colitis, enteral nutrition, malnutrition, tube feeding, perioperative, randomized controlled trial». Se han incluido los estudios clínicos realizados en pacientes adultos.
Papel de la nutrición enteral en la inducción de remisión en la enfermedad inflamatoria intestinalActualmente, el papel de la NE en el manejo del brote de la EC en pacientes adultos, con base en las guías de consenso de la ECCO sobre el diagnóstico y manejo de la EC publicadas en 201010, queda limitado a su uso concomitante con tratamientos farmacológicos cuando coexiste con alteraciones del estado nutricional y en el caso de contraindicación o rechazo del paciente al uso de corticoesteroides, siempre y cuando no se trate de casos de corticorrefractariedad/corticorresistencia o situaciones clínicas de gravedad en las que es preciso un tratamiento más agresivo mediante el empleo de terapias biológicas o cirugía. Esto contrasta con el manejo realizado en Japón, donde la NE se considera la terapia de primera línea tanto para el manejo del brote de la enfermedad como en el mantenimiento, según las guías del ministerio japonés de salud11. El hecho de que en Occidente juegue un papel más secundario se basa en la existencia de ensayos clínicos en los cuales se compara la eficacia de la NE frente a los corticoides en el manejo del brote de la EC, donde a pesar de obtenerse resultados positivos con la NE, los corticoesteroides se muestran superiores, manteniéndose dicha superioridad incluso cuando se compara frente a fórmulas elementales o poliméricas3. Las recomendaciones de la ECCO se realizaron con base en una revisión sistemática de Cochrane de 200712, que incluía 6ensayos clínicos aleatorizados que comparaban el uso de NE (192 pacientes en total) frente a prednisolona (160 pacientes), en los cuales se mostraba una mayor efectividad del tratamiento con esteroides (OR 0,3; IC 95%: 0,17–0,52). Se debe destacar que la tasa de remisión con NE suele superar el 60%, superior a la que se obtiene con placebo (20-30%)13.
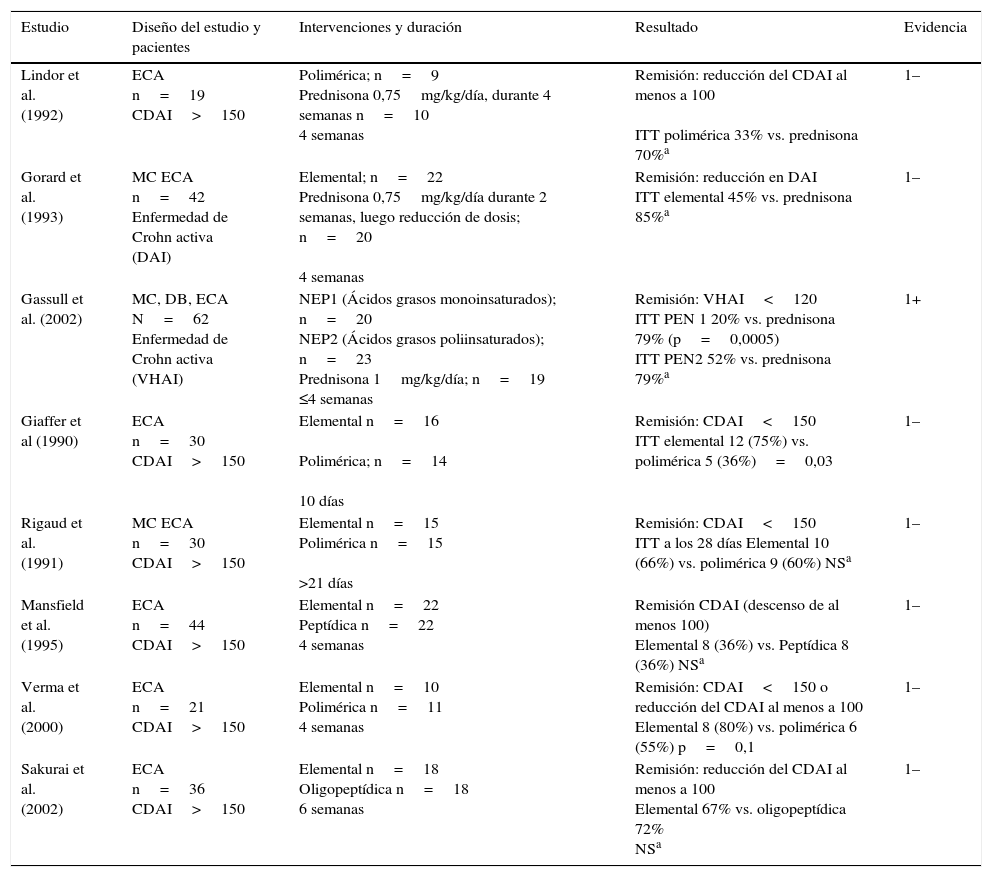
En 2014 se publicaron las guías de la Asociación Británica de Dietética sobre el tratamiento nutricional en pacientes con EC14, en las cuales revisaron 8 ensayos clínicos donde se evaluaba el papel de la NE en la inducción de remisión. Tres de ellos comparaban la NE con el tratamiento corticoideo15–17 y los otros 5 comparaban el uso de fórmulas elementales frente a las no elementales18–22. En todos los casos, la NE se administró por vía oral y, si no era tolerada, a través de sonda nasogástrica. El principal resultado evaluado fue el cambio en el índice de actividad clínica de la enfermedad en el tratamiento, pero no se analizó la tasa de curación mucosa endoscópica o histológica. Todos los estudios se analizaron con detalle y se realizaron recomendaciones en función del grado de evidencia. En esta revisión se concluye que en los pacientes adultos con EC el tratamiento con corticoesteroides es superior a la administración de NE por vía oral o sonda nasogástrica para la inducción de la remisión clínica, con nivel de evidencia débil y que las fórmulas no elementales (peptídicas o poliméricas) son igual de efectivas que las fórmulas elementales, administradas tanto por vía oral como por sonda nasogástrica, para la inducción de remisión clínica, con una duración de administración de entre 10 días y 6 semanas, con un nivel de evidencia moderado (tabla 2).
NE en la inducción de la remisión de la EC en adultos
| Estudio | Diseño del estudio y pacientes | Intervenciones y duración | Resultado | Evidencia |
|---|---|---|---|---|
| Lindor et al. (1992) | ECA n=19 CDAI>150 | Polimérica; n=9 Prednisona 0,75mg/kg/día, durante 4 semanas n=10 4 semanas | Remisión: reducción del CDAI al menos a 100 ITT polimérica 33% vs. prednisona 70%a | 1– |
| Gorard et al. (1993) | MC ECA n=42 Enfermedad de Crohn activa (DAI) | Elemental; n=22 Prednisona 0,75mg/kg/día durante 2 semanas, luego reducción de dosis; n=20 4 semanas | Remisión: reducción en DAI ITT elemental 45% vs. prednisona 85%a | 1– |
| Gassull et al. (2002) | MC, DB, ECA N=62 Enfermedad de Crohn activa (VHAI) | NEP1 (Ácidos grasos monoinsaturados); n=20 NEP2 (Ácidos grasos poliinsaturados); n=23 Prednisona 1mg/kg/día; n=19 ≤4 semanas | Remisión: VHAI<120 ITT PEN 1 20% vs. prednisona 79% (p=0,0005) ITT PEN2 52% vs. prednisona 79%a | 1+ |
| Giaffer et al (1990) | ECA n=30 CDAI>150 | Elemental n=16 Polimérica; n=14 10 días | Remisión: CDAI<150 ITT elemental 12 (75%) vs. polimérica 5 (36%)=0,03 | 1– |
| Rigaud et al. (1991) | MC ECA n=30 CDAI>150 | Elemental n=15 Polimérica n=15 >21 días | Remisión: CDAI<150 ITT a los 28 días Elemental 10 (66%) vs. polimérica 9 (60%) NSa | 1– |
| Mansfield et al. (1995) | ECA n=44 CDAI>150 | Elemental n=22 Peptídica n=22 4 semanas | Remisión CDAI (descenso de al menos 100) Elemental 8 (36%) vs. Peptídica 8 (36%) NSa | 1– |
| Verma et al. (2000) | ECA n=21 CDAI>150 | Elemental n=10 Polimérica n=11 4 semanas | Remisión: CDAI<150 o reducción del CDAI al menos a 100 Elemental 8 (80%) vs. polimérica 6 (55%) p=0,1 | 1– |
| Sakurai et al. (2002) | ECA n=36 CDAI>150 | Elemental n=18 Oligopeptídica n=18 6 semanas | Remisión: reducción del CDAI al menos a 100 Elemental 67% vs. oligopeptídica 72% NSa | 1– |
CDAI: Crohn's disease activity index; DAI: Dutch activity index; DB: doble ciego; ECA: ensayo clínico aletorizado; ITT: intención de tratar; MC: multicéntrico; MUFA: ácidos grasos monoinsaturados; NEP: nutrición enteral polimérica; NS: no significativo; PUFA: ácidos grasos poliinsaturados; VHAI: Van Hees activity index.
En caso de utilizar la NE como terapia de primera línea en la inducción de remisión en la EC, la mayoría de los protocolos incluyen la administración de NE exclusiva, es decir, la administración del 100% de los requerimientos nutricionales, durante un tiempo variable, habitualmente 2-4 semanas. Aunque la NE parcial podría también aportar un beneficio clínico, a día de hoy la NE exclusiva parece superior para la inducción de remisión clínica de dichos pacientes23. La composición de la fórmula empleada para la NE exclusiva (elemental vs. no elemental) no influye en los resultados obtenidos. Una revisión de Cochrane evaluó el efecto de la composición de la fórmula en pacientes que recibían NE exclusiva para la inducción de remisión y no se observaban diferencias significativas en cuanto a eficacia clínica7. El contenido en grasa de la fórmula tampoco parece ejercer un papel relevante12.
Un aspecto sobre el que existe poca información es si la nutrición enteral podría tener un mayor efecto en la inducción de la remisión en pacientes con diagnóstico reciente de EC. La respuesta al tratamiento médico tiende a ser más favorable en niños o jóvenes, o cuando la evolución de la enfermedad es más corta. Dos estudios, publicados hace ya bastantes años23,24, evaluaron el efecto de la NE exclusiva en comparación con el tratamiento corticoideo en pacientes adultos con diagnóstico reciente. En ambos estudios se alcanzó una tasa de remisión en torno al 80%, sin que se observaran diferencias significativas entre el tratamiento con NE y el tratamiento con corticoides.
La utilización de NE podría mejorar la EC con patrón de estenosis inflamatoria. Se ha publicado recientemente un estudio prospectivo observacional que utilizó NE elemental exclusiva por sonda nasogástrica durante 12 semanas en 65 pacientes, de los cuales se evaluaron 59 pacientes: 50 finalizaron el tratamiento con NE y 9 precisaron cirugía. El análisis por intención de tratar mostró que el 81,4% presentaron mejoría sintomática, el 53,8% remisión radiológica y el 64,6% remisión clínica25.
En cuanto al papel de la NE en la CU, la información es escasa y sin claros resultados beneficiosos, lo cual no permite en el momento actual hacer recomendaciones concretas26,27. Los estudios iniciales sobre el efecto de la NE en la inducción de remisión clínica de los pacientes con EII mostraron resultados menos satisfactorios en pacientes con CU o EC con afectación primaria colónica23. Por ejemplo, un estudio prospectivo en el que se comparaba la remisión clínica y endoscópica obtenida en pacientes con afectación ileal, ileocolónica o colónica mostró que en los pacientes con afectación colónica exclusiva los resultados obtenidos eran inferiores24. Sin embargo, 2revisiones sistemáticas fueron incapaces de obtener una conclusión sobre el fenotipo de la enfermedad y su relación con la respuesta a la administración de NE exclusiva7,28. El papel de la NE en el tratamiento de la CU queda limitado, en el momento actual, al soporte nutricional en pacientes con desnutrición5.
A la vista de los resultados de estos estudios, podemos concluir que la NE exclusiva no constituye un tratamiento de primera línea en la inducción de la remisión en la EC de pacientes adultos. Se podría considerar en pacientes que rechacen el tratamiento corticoideo, siempre que la situación clínica lo permita. En cualquier caso, la NE juega un importante papel en el soporte nutricional en los pacientes con EC en fase aguda. Su utilización, como parte del tratamiento global del paciente y siempre que sea clínicamente conveniente, puede favorecer la recuperación. En cuanto a la CU, el soporte nutricional, en sus distintas modalidades, tampoco ha demostrado tener un efecto directo en la actividad inflamatoria o en la evolución clínica de la enfermedad. La NE, por lo tanto, no se recomienda como tratamiento primario para inducir la remisión clínica en la CU5.
Papel de la nutrición enteral en el mantenimiento de la remisión en la enfermedad inflamatoria intestinalEl papel de la NE en el mantenimiento de la remisión en pacientes adultos no está bien establecido. Las guías clínicas europeas en general no recomiendan este tratamiento10. Sin embargo, tal como ocurre en el caso de la inducción de la remisión, la NE por sonda o por vía oral se utiliza de manera habitual en otros países, como Japón.
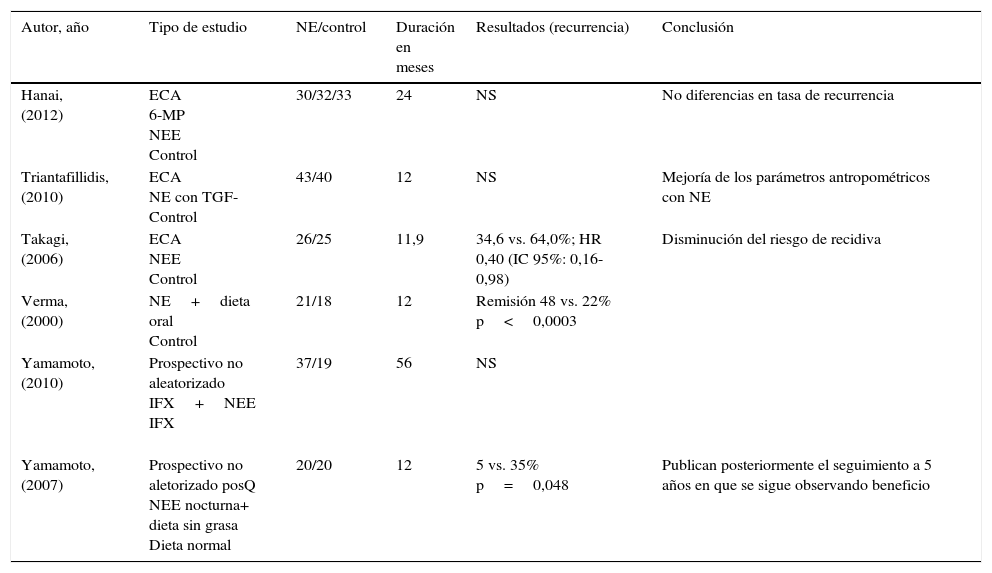
Se han publicado 3ensayos controlados y aleatorizados (tabla 3) y 7estudios no controlados que han evaluado el efecto de la NE sobre el mantenimiento de la remisión en la EC, inducida con tratamiento médico29. Un ensayo controlado y aleatorizado realizado en Japón30, observó que el tratamiento con NE elemental (>900kcal/día) se asoció con una tasa de mantenimiento de la remisión similar al conseguido con 6-mercaptopurina tras 2 años de seguimiento, en pacientes en tratamiento con 5-ASA. Triantafillidis31 evaluó, en un estudio controlado y aleatorizado realizado en 43 pacientes, la eficacia de una fórmula de NE polimérica enriquecida con TGF-β por vía oral, en comparación con un grupo (n=40) que recibió dieta oral y 5-ASA. La tasa de remisión a los 6 meses de seguimiento no fue diferente en los 2grupos, si bien el que recibió NE presentó una mejoría de los parámetros antropométricos. Por último, un grupo de 51 pacientes que habían alcanzado remisión de la enfermedad (mediante NE exclusiva, NPT, prednisona iv o infliximab) se aleatorizaron a recibir la mitad de los requerimientos energéticos mediante NE con fórmula semielemental (oral o por sonda) o una dieta oral libre32. Después de una media de seguimiento de 11,8 meses, la tasa de recidiva fue significativamente menor en el grupo que recibió NE. No se observaron efectos adversos significativos y la tasa de cumplimento fue similar en los 2grupos, no hubo efectos en la calidad de vida o en el coste del tratamiento33. Se han publicado varios estudios de cohorte34–37 que, en general, observan que los pacientes que reciben NE tienen una menor tasa de recidivas que el grupo control. Una revisión sistemática publicada recientemente38 ha revisado estos trabajos y concluye que la NE es más efectiva que la dieta oral convencional y tan efectiva como algunos tratamientos médicos en el mantenimiento de la remisión en la EC, si bien reconoce las limitaciones de los trabajos publicados y aconseja que se realicen más estudios de duración suficiente y con un número adecuado de pacientes, para poder confirmar estos hallazgos. La NE elemental obtuvo unos resultados similares a las fórmulas poliméricas.
NE en el mantenimiento de la remisión en EC: estudios prospectivos
| Autor, año | Tipo de estudio | NE/control | Duración en meses | Resultados (recurrencia) | Conclusión |
|---|---|---|---|---|---|
| Hanai, (2012) | ECA 6-MP NEE Control | 30/32/33 | 24 | NS | No diferencias en tasa de recurrencia |
| Triantafillidis, (2010) | ECA NE con TGF- Control | 43/40 | 12 | NS | Mejoría de los parámetros antropométricos con NE |
| Takagi, (2006) | ECA NEE Control | 26/25 | 11,9 | 34,6 vs. 64,0%; HR 0,40 (IC 95%: 0,16-0,98) | Disminución del riesgo de recidiva |
| Verma, (2000) | NE+dieta oral Control | 21/18 | 12 | Remisión 48 vs. 22% p<0,0003 | |
| Yamamoto, (2010) | Prospectivo no aleatorizado IFX+NEE IFX | 37/19 | 56 | NS | |
| Yamamoto, (2007) | Prospectivo no aletorizado posQ NEE nocturna+ dieta sin grasa Dieta normal | 20/20 | 12 | 5 vs. 35% p=0,048 | Publican posteriormente el seguimiento a 5 años en que se sigue observando beneficio |
ECA: estudio controlado aleatorizado; IFX: infliximab; NE: nutrición enteral; NEE: nutrición enteral elemental; NS: no significativo; posQ: posquirúrgico.
En los último años se han publicado varios estudios, realizados en Japón, y un metaanálisis que han evaluado el efecto de la NE en el mantenimiento de la remisión en pacientes que reciben tratamiento con infliximab. Un estudio prospectivo no aleatorizado39, realizado en un grupo de 56 pacientes, no observó diferencias en la tasa de remisión a 56 semanas entre los pacientes que habían recibido NE elemental y dieta pobre en grasa (37 pacientes) y los que no habían recibido soporte nutricional o dieta especial. Tres estudios retrospectivos observaron que la utilización de NE a una dosis superior a 90040 o 600kcal/día41 se asociaba con una menor tasa de recidiva, en comparación con los pacientes que no recibieron NE o en los que la dosis fue menor, y una mejor respuesta a infliximab en los pacientes con enfermedad de tipo inflamatorio42. Se ha publicado recientemente un metaanálisis43 que analiza estos 4 estudios, que tienen, en general, una calidad metodológica limitada. Según los resultados de este metaanálisis, los pacientes que recibieron NE alcanzaron la remisión clínica en un porcentaje superior al grupo que no recibió NE (69,4 vs. 45,4%; OR 2,73; IC 95%: 1,73-4,13; p<0,01) y mantuvieron esta remisión clínica en un porcentaje mayor después de un año de tratamiento, en comparación con el tratamiento con infliximab de forma exclusiva (74,5 vs. 49,2; OR 2,93; IC 95%: 1,66-5,17; p<0,01). Es necesario tener en cuenta que no disponemos por el momento de estudios controlados y aleatorizados. No se conoce el mecanismo de este posible efecto beneficioso de la NE en los pacientes que reciben infliximab. No existen datos sobre el efecto de la NE sobre la biodisponibilidad de infliximab o si es capaz de disminuir su inmunogenicidad, de forma similar al mecanismo de acción de los inmunomoduladores. No se ha evaluado, por el momento, el efecto de la NE en los pacientes que reciben otros agentes biológicos.
Por último, algunos trabajos han evaluado el efecto de la NE en la prevención de la recurrencia posquirúrgica en la EC. En 2estudios no controlados44,45 se observó que la utilización de NE y dieta oral modificada se asociaba con un menor riesgo de recidiva postoperatoria, especialmente en pacientes con enfermedad perforante. Se ha publicado un estudio prospectivo no aleatorizado realizado en 40 pacientes, en el que se observó que el grupo que recibió NE postoperatoria elemental mediante sonda nasogástrica nocturna tuvo una menor tasa de recidiva clínica (5 vs. 35%; p=0,048) y endoscópica (30 vs. 70%; p=0,027) después de 12 meses46. Esta diferencia en la tasa de recurrencia se mantuvo después de 5 años47. Este estudio, sin embargo, presenta una importante limitación: no es aleatorizado y los grupos se asignaron fundamentalmente atendiendo a la tolerancia prequirúrgica a la NE. El grupo que no recibió NE postoperatoria (y que tuvo una mayor tasa de recurrencia) fue aquel que había presentado intolerancia previa a la NE, con diarrea y otros síntomas digestivos, o bien había rechazado este tratamiento.
Podemos concluir que el papel de la NE en el mantenimiento de la remisión de la EC no está bien establecido. Los estudios publicados presentan limitaciones que disminuyen la validez de sus resultados y su aplicabilidad en la práctica clínica habitual en nuestro medio. En general, son heterogéneos, con un número pequeño de pacientes, hay muy pocos trabajos prospectivos aleatorizados, la duración de la intervención y el tiempo total de seguimiento es corto. En algunos estudios, no se describen las características ni la composición de la fórmula de NE. En la mayor parte de los estudios no se evalúa de manera adecuada el estado nutricional ni se ofrecen resultados de su evolución con el tratamiento. Son necesarios, por lo tanto, más estudios clínicos que permitan definir mejor la utilidad clínica de la NE en estos pacientes. En cuanto a la CU, la NE no ha demostrado influir en el mantenimiento de la remisión, por lo que no se recomienda su uso con esta finalidad. Como en otras ocasiones, es una modalidad de soporte nutricional adecuada para el paciente con desnutrición5.
Papel de la nutrición enteral en la optimización prequirúrgica en la enfermedad inflamatoria intestinalEl deterioro del estado nutricional se asocia con un mayor riesgo de complicaciones postoperatorias en la EII, especialmente sepsis intraabdominal48–50. Cuando se indica tratamiento quirúrgico, los pacientes suelen presentar desnutrición como consecuencia del estado inflamatorio que supone la propia enfermedad, anorexia, dolor abdominal y disminución de la ingesta, malabsorción etc. La hipoalbuminemia (consecuencia de la desnutrición y de la propia situación inflamatoria) es un factor de riesgo de dehiscencia de sutura, una de las complicaciones más graves de la cirugía en la EII. La optimización de la situación nutricional constituye, por tanto, uno de los pilares de la preparación clínica antes de la cirugía51 y podría disminuir el riesgo de complicaciones52.
Aunque existe evidencia sobre el beneficio del soporte nutricional preoperatorio en la cirugía gastrointestinal, existen pocos estudios realizados en pacientes con EII. En un estudio retrospectivo, realizado en 123 pacientes con EC, se compararon las complicaciones posquirúrgicas tras resección intestinal por enfermedad fistulosa en 2grupos de pacientes: con NE peptídica preoperatoria durante 3 meses (44,7%) y un grupo control53. El grupo que había recibido NE preoperatoria presentaba unos niveles significativamente superiores de albúmina e inferiores de PCR antes de la cirugía, y un menor riesgo de sepsis abdominal posquirúrgica (3,6 vs. 17,6%; p<0,05). En cuanto a la CU, no existen datos sobre el papel de la NE prequirúrgica en la prevención de las complicaciones de la cirugía.
Nutrición enteral en la enfermedad inflamatoria intestinal: tipo de fórmulaNo existen recomendaciones concretas sobre el tipo de fórmula de NE. Muchos de los estudios realizados en EC han utilizado fórmulas elementales muy pobres en grasa. Sin embargo, no se ha observado un claro beneficio de las fórmulas elementales frente a las poliméricas7 en la inducción, en el mantenimiento de la remisión o en el soporte nutricional de los pacientes desnutridos. Tampoco existe evidencia sobre el beneficio de nutrientes específicos, como glutamina o inmunonutrientes. Algunas fórmulas contienen factor de crecimiento transformante beta (TGF-β), un polipéptido presente en la leche materna y bovina. Este factor juega un importante papel en la inducción de la tolerancia inmune, la prevención de la autoinmunidad e induce una respuesta antiinflamatoria2. Los estudios que han evaluado esta fórmula se han realizado fundamentalmente en población pediátrica, existen muy pocos datos en adultos31,54 y no se han realizado por el momento estudios aleatorizados que hayan evaluado su eficacia en la inducción de remisión o mantenimiento en EC.
La elección de un tipo u otro de fórmula de NE deberá considerar, por lo tanto, con base en criterios clínicos, teniendo en cuenta los requerimientos de energía, proteína y de otros nutrientes, la presencia o no de malabsorción clínicamente significativa o de enfermedad estenótica y la tolerancia individual al tratamiento.
ConclusionesLa desnutrición es frecuente en los pacientes con EII y puede influir negativamente en la evolución clínica de esta enfermedad. La NE se considera la modalidad de soporte nutricional más adecuada. Sin embargo, los estudios sobre su eficacia y seguridad en el tratamiento de la desnutrición en la EII son muy escasos, incluso en periodos concretos especialmente relevantes, como el perioperatorio.
En cuanto al posible papel de la NE en la inducción o mantenimiento de la remisión, en el momento actual no existe evidencia que apoye su utilización como tratamiento primario de la enfermedad en los pacientes adultos. Otros contextos clínicos que aún precisan de un mayor número de estudios para hacer una recomendación firme son la terapia de mantenimiento, bien de manera exclusiva o asociada al uso de anti-TNF, la prevención de la recidiva posquirúrgica y el tratamiento de la enfermedad estenótica.
Son necesarios, por lo tanto, más estudios que permitan definir con mayor claridad el papel de la NE en el tratamiento de la desnutrición en los pacientes con EII, su posible impacto sobre la evolución clínica de la enfermedad y la calidad de vida de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.