Las manifestaciones extraintestinales en general y, de entre ellas, las articulares en particular, suponen un problema frecuente en los pacientes con enfermedad inflamatoria intestinal. De hecho, la relación entre ambas entidades parece estrecha y cada vez hay más datos que indican que el intestino desempeña un importante papel en la patogenia de las espondiloartritis. La asociación de la enfermedad inflamatoria intestinal con algún tipo de espondiloartritis supone un escenario clínico complejo. Se hace necesario, por tanto, que gastroenterólogos y reumatólogos puedan trabajar juntos y establecer una comunicación fluida que permita a cada paciente recibir el tratamiento más adecuado para cada situación concreta. El objetivo de esta revisión es el de establecer unas recomendaciones sobre el tratamiento de los pacientes con enfermedad inflamatoria intestinal y espondiloartritis asociada, en cada uno de los distintos escenarios clínicos.
Extraintestinal manifestations, particularly arthropaties, are a frequent problem in patients with inflammatory bowel disease. The relationship between those 2entities is close and data suggest that the bowel plays and important role in etiopathogenesis of spondyloarthritis. Association of inflammatory bowel disease with any kind of spondyloarthritis represents a challenging clinical scenario. It is necessary that both gastroenterologists and rheumatologists work together and have a fluent communication that may help the patient to receive the most appropriate treatment for each single situation. The aim of this review is to make some recommendations about the treatment of patients with inflammatory bowel disease and associated spondyloarthritis, in each single different clinical scenario.
La asociación entre la enfermedad inflamatoria intestinal (EII) y diferentes manifestaciones articulares se conoce desde hace décadas, aunque no fue hasta finales de los años noventa cuando se describió el patrón característico de afectación articular en el seno de la EII1. El creciente conocimiento de los mecanismos inflamatorios más íntimos que comparten la afectación intestinal y articular ha favorecido una mejor comprensión del problema inflamatorio como algo sistémico y la adopción de estrategias terapéuticas comunes para abordar pacientes cada vez más complejos. Por todo ello, cada día es mayor el número de pacientes que gastroenterólogos y reumatólogos debemos compartir en la práctica clínica, por lo que el conocimiento que cada especialista tiene de la otra cara de la enfermedad debería aumentar de la misma manera. El objetivo de esta revisión es el de establecer guías de manejo conjunto entre reumatólogos y gastroenterólogos para el tratamiento de pacientes con EII y espondiloartritis (EspA) asociadas2. A tal fin, se han establecido una serie recomendaciones para cada escenario clínico concreto que se recogen al final del documento.
Este documento, basado en una revisión no sistemática de la literatura, ha sido realizado por un grupo de gastroenterólogos miembros del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) y de reumatólogos pertenecientes a la Sociedad Española de Reumatología (SER) con experiencia en estas enfermedades. La versión final del manuscrito ha sido revisada y aceptada por el Comité Científico de GETECCU.
Importancia del abordaje conjuntoCada día disponemos de mayor evidencia sobre la interrelación entre el intestino y las articulaciones y sobre el papel tan relevante que desempeña la microbiota intestinal en la patogenia de las EspA3. En otro sentido, se ha comunicado que más de un 60% de los pacientes con EspA tienen algún grado de inflamación intestinal microscópica; sin embargo, la relevancia clínica de estos hallazgos no está establecida con claridad, ya que clásicamente se considera que solo el 10% de ellos desarrollarán EII4.
Desde el punto de vista de la predisposición genética, es bien conocida la relación entre el HLA-B27 y la espondilitis anquilosante (EA); este marcador es positivo en entre el 75 y el 95% de los pacientes con EA frente a solo un 6-8% de la población general en nuestro medio. En los pacientes con EII, la prevalencia de positividad del HLA-B27 es similar a la de la población general, pero en aquellos pacientes con EII y EA, la positividad de HLA-B27 es más elevada, y puede llegar a ser cercana al 80% en algunas series5. Esto señala que aquellos pacientes con EII y HLA-B27 podrían tener mayor probabilidad de presentar, además, EA. Por otra parte, existe evidencia de que mutaciones de CARD15 (NOD2) confieren mayor riesgo de padecer enfermedad de Crohn (EC). Asimismo algunos estudios han demostrado que mutaciones de CARD15 se asocian con mayor frecuencia a pacientes con EA que tiene inflamación intestinal subclínica y a pacientes con EC que presentan sacroilitis radiográfica6. Por tanto, los polimorfismos de CARD15 podrían explicar, al menos en parte, la conexión genética entre la EC y la EspA.
Estas asociaciones genéticas, junto a la evidencia de los estudios inmunopatológicos, señalan la existencia de vías inflamatorias comunes en ambas enfermedades7. A pesar de todo, todavía no tenemos criterios para identificar a aquellos pacientes con EspA y sin síntomas gastrointestinales en los que estaría indicada la realización de un estudio digestivo con el objetivo de descartar la coexistencia de EII. El diagnóstico y el tratamiento precoz en EII es de enorme importancia, ya que lo contrario puede ocasionar daño intestinal, empeorar el pronóstico y la evolución de la enfermedad8. Por otra parte, las EspA llevan consigo grave daño articular, cuyas secuelas estructurales pueden provocar distintos niveles de discapacidad y deterioro de la calidad de vida de los pacientes, con repercusiones físicas, laborales o sociales. Por tanto, la falta de reconocimiento y de manejo adecuado de este proceso también puede tener repercusiones relevantes9.
En la práctica clínica, los síntomas de EspA no siempre son adecuadamente interpretados en pacientes con EII y, además, en muchos casos los gastroenterólogos no investigan de manera dirigida la presencia de estos síntomas. Del mismo modo, es habitual que los reumatólogos solo consideren la posibilidad de EII ante la presencia de síntomas evidentes y que, en los casos en los que la EII es conocida, la falta de un claro cuadro clínico les lleve a una percepción errónea acerca de la situación de actividad o quiescencia de la EII. Como consecuencia de todo ello, es muy posible que exista un buen número de pacientes sin el adecuado diagnóstico o tratamiento, que seguramente no reciben el tratamiento más apropiado y que pueden llegar a sufrir discapacidad y deterioro de la calidad de vida9,10.
Aquellos pacientes en los que se asocian EII y EspA son especialmente complejos y con frecuencia presentan problemas clínicos de difícil abordaje. El adecuado manejo de estos pacientes debe incluir el apropiado reconocimiento y caracterización de ambas enfermedades. Además, el objetivo del tratamiento debe ser controlar tanto la inflamación intestinal como la articular, así como evitar situaciones que puedan agravar la morbilidad e incapacidad de cualquiera de las 2entidades. La interpretación de las diferentes situaciones clínicas en las que se encuentra cada una de las enfermedades, incluso la valoración de la actividad inflamatoria de cada una de ellas, supone con frecuencia una dificultad para la otra parte. Por todo ello es fundamental la cooperación y la comunicación fluida entre gastroenterólogos y reumatólogos en su abordaje y tratamiento.
Epidemiología, descripción y clasificación de las manifestaciones articulares en la enfermedad inflamatoria intestinalAproximadamente un tercio de los pacientes con EII presentan manifestaciones musculoesqueléticas que se encuadran dentro de un grupo de enfermedades reumatológicas denominadas EspA. Las EspA comparten manifestaciones clínicas como la sacroilitis y el dolor axial inflamatorio, la artritis periférica con predominio en los miembros inferiores, entesitis o dactilitis; además, las EspA se caracterizan por la ausencia de factor reumatoide, la presencia de manifestaciones extraarticulares compartidas, una agregación familiar significativa y asociación con el antígeno HLA-B27.
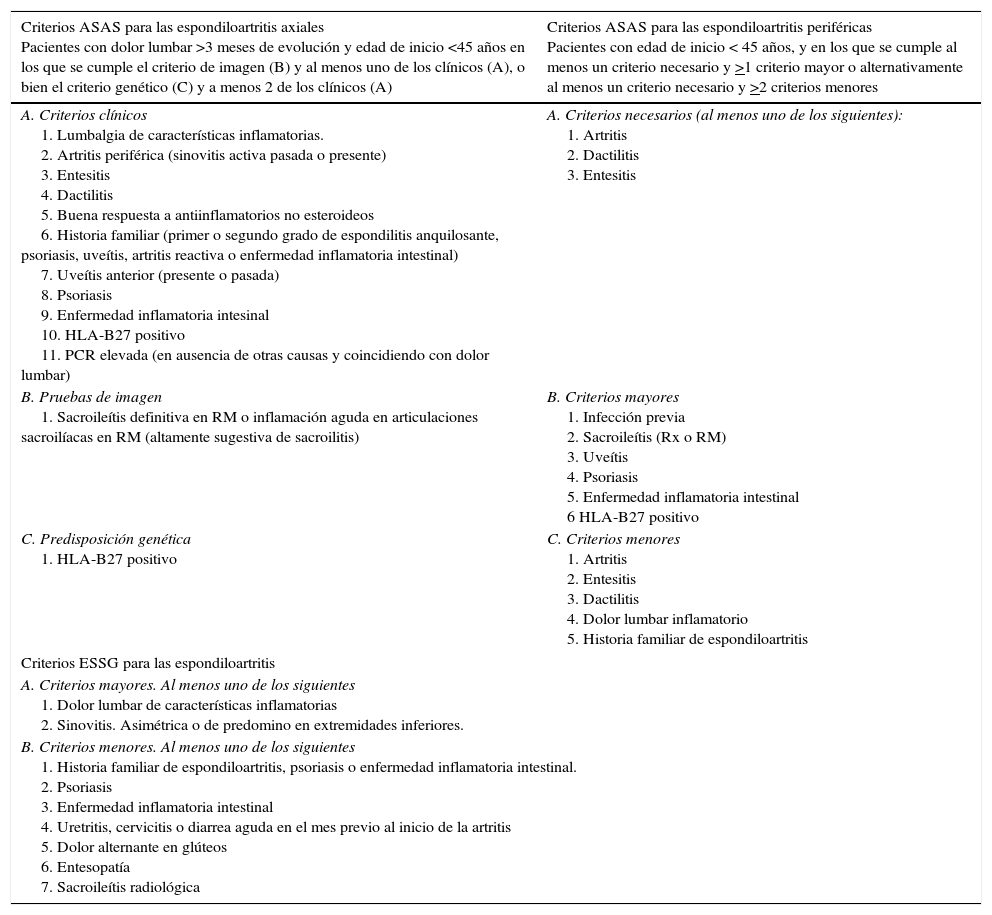
La clasificación de las EspA ha variado bastante en los últimos años, y el desarrollo de la resonancia magnética (RM) ha permitido un diagnóstico precoz de la afectación sacroilíaca. La clasificación actual de las EspA incluye distintas enfermedades como la EA, la EspA axial no radiográfica, la artritis psoriásica, la artritis asociada a la EII, otras artritis enteropáticas, la artritis reactiva, la EspA indiferenciada y, asimismo, enfermedades sin afectación articular como la uveítis asociada a HLA-B27 y la insuficiencia aórtica con alteraciones de la conducción. Se han desarrollado varios criterios de clasificación de las EspA, pero no existen en la actualidad criterios validados para el diagnóstico de la EspA asociada a la EII, de modo que suelen emplearse los criterios de la Assessment of SpondyloArthritis international Society (ASAS) o de la European Spondylarthropathy Study Group (ESSG) que se recogen en la tabla 1. A efectos prácticos, estos criterios se resumen en la presencia de dolor axial inflamatorio o artritis (de predominio en las extremidades inferiores) en un paciente que padezca EC o CU11–15.
Criterios para el diagnóstico y clasificación de las espondiloartritis
| Criterios ASAS para las espondiloartritis axiales Pacientes con dolor lumbar >3 meses de evolución y edad de inicio <45 años en los que se cumple el criterio de imagen (B) y al menos uno de los clínicos (A), o bien el criterio genético (C) y a menos 2 de los clínicos (A) | Criterios ASAS para las espondiloartritis periféricas Pacientes con edad de inicio < 45 años, y en los que se cumple al menos un criterio necesario y >1 criterio mayor o alternativamente al menos un criterio necesario y >2 criterios menores |
|---|---|
| A. Criterios clínicos 1. Lumbalgia de características inflamatorias. 2. Artritis periférica (sinovitis activa pasada o presente) 3. Entesitis 4. Dactilitis 5. Buena respuesta a antiinflamatorios no esteroideos 6. Historia familiar (primer o segundo grado de espondilitis anquilosante, psoriasis, uveítis, artritis reactiva o enfermedad inflamatoria intestinal) 7. Uveítis anterior (presente o pasada) 8. Psoriasis 9. Enfermedad inflamatoria intesinal 10. HLA-B27 positivo 11. PCR elevada (en ausencia de otras causas y coincidiendo con dolor lumbar) | A. Criterios necesarios (al menos uno de los siguientes): 1. Artritis 2. Dactilitis 3. Entesitis |
| B. Pruebas de imagen 1. Sacroileítis definitiva en RM o inflamación aguda en articulaciones sacroilíacas en RM (altamente sugestiva de sacroilitis) | B. Criterios mayores 1. Infección previa 2. Sacroileítis (Rx o RM) 3. Uveítis 4. Psoriasis 5. Enfermedad inflamatoria intestinal 6 HLA-B27 positivo |
| C. Predisposición genética 1. HLA-B27 positivo | C. Criterios menores 1. Artritis 2. Entesitis 3. Dactilitis 4. Dolor lumbar inflamatorio 5. Historia familiar de espondiloartritis |
| Criterios ESSG para las espondiloartritis | |
| A. Criterios mayores. Al menos uno de los siguientes 1. Dolor lumbar de características inflamatorias 2. Sinovitis. Asimétrica o de predomino en extremidades inferiores. | |
| B. Criterios menores. Al menos uno de los siguientes 1. Historia familiar de espondiloartritis, psoriasis o enfermedad inflamatoria intestinal. 2. Psoriasis 3. Enfermedad inflamatoria intestinal 4. Uretritis, cervicitis o diarrea aguda en el mes previo al inicio de la artritis 5. Dolor alternante en glúteos 6. Entesopatía 7. Sacroileítis radiológica | |
PCR: proteína C reactiva; RM: Resonancia magnética; Rx: radiografía simple.
La prevalencia de EspA en pacientes con EII oscila entre el 17 y el 46% según los estudios12,16, aunque los estudios epidemiológicos disponibles sobre EII y EspA son muy heterogéneos12,16–18. La EspA asociada a la EII puede preceder a su diagnóstico (hasta en un tercio de los casos, con mayor frecuencia en pacientes HLA-B27+), aparecer después (aproximadamente en el 25% de los casos) o simultáneamente (40%). En otros casos la afectación inflamatoria intestinal puede ser silente o paucisintomática11–14.
De acuerdo con la presentación clínica, los pacientes con EspA se pueden clasificar en 2grandes grupos: síntomas de predominio periférico (EspA-p) o axial (EspA-Ax)19,20, aunque ambos patrones pueden coexistir en un mismo paciente, y se pueden asociar a entesitis, dactilitis u otras manifestaciones extraarticulares, sobre todo uveítis. De forma típica, hasta un 10% de los pacientes tienen afectación cutánea que puede incluir el eritema nudoso, el pioderma gangrenoso o la estomatitis aftosa1,11–14.
Se han estudiado diversos factores de riesgo para presentar EspA en EII, como son la actividad inflamatoria (fundamentalmente en el caso de la EspA-p) y la extensión, el tabaquismo, la apendicectomía o la presencia de otras manifestaciones extraintestinales21–24. Además, la afectación cólica parece relacionarse más con la EspA que la proctitis aislada o la afectación ileal12. Los pacientes con proctitis ulcerosa tienen menor riesgo de desarrollar EspA en comparación con aquellos que presentan colitis izquierda o extensa, mientras que los pacientes con EC de afectación ileal tienen menor riesgo de desarrollar EspA que aquellos con afectación cólica12.
Afectación axialLa afectación axial se caracteriza por la presencia de sacroilitis, a menudo asimétrica, con o sin afectación vertebral concomitante. De acuerdo con los conceptos más actuales (tabla 1), la EspA-Ax incluye un espectro de entidades desde la EA a la EspA-Ax no radiológica. En general, se considera que no guarda relación con la actividad intestinal11,13,25,26. Según las diferentes series, puede tener una prevalencia entre el 2 y el 36% de los pacientes con EII, y es algo más frecuente en EC y en varones1. La prevalencia de la EspA-Ax se ha incrementado en los últimos años con la aparición de los nuevos criterios diagnósticos y se sitúa entre el 12 y el 46%12. El HLA-B27 está presente en entre el 25 y el 78% de los pacientes con EII y EA, pero solo en el 7-15% de los pacientes con sacroilitis aislada5,27.
Artritis periféricaSe asocia con menos frecuencia a la presencia de HLA-B27 y en general tiene curso no erosivo y no deformante. La característica clínica principal de la EspA-p es la presencia de artritis, dactilitis o entesitis (tabla 1). La prevalencia de la EspA-p alcanza entre el 5 y el 28% de los pacientes con EII, igualmente con más prevalencia en EC que en CU, con afectación cólica y en mujeres1,18,28 y típicamente afecta con más frecuencia a las articulaciones de miembros inferiores16,27,29,30. Se reconocen 2patrones diferentes, aunque en ocasiones pueden coexistir en el mismo paciente11,13,25,26,31:
Oligoartritis o tipo i(afectación de menos de 5articulaciones)Suele ser de curso agudo, de inicio en unas 24-48 h y a menudo coincide con la actividad intestinal de la enfermedad, especialmente en la CU. Afecta sobre todo a grandes articulaciones, generalmente en las extremidades inferiores y con distribución asimétrica. Suele autolimitarse en unas 6-10 semanas y presentar una buena respuesta al tratamiento con corticoide. Puede tener curso crónico aproximadamente en el 10% de los casos, y con frecuencia se asocia a eritema nudoso.
Poliartritis o tipo ii (afectación de 5o más articulaciones)La poliartritis tiende a tener un curso persistente, clásicamente se considera independiente de la actividad inflamatoria intestinal de la enfermedad y puede evolucionar a formas crónicas en alrededor del 40% de los casos. Se asocia de forma característica a uveítis, pero no a otras manifestaciones extraarticulares.,
Afectación articular secundaria a tratamientoAlgunos de los fármacos empleados en el tratamiento de la EII pueden producir efectos adversos articulares, que deben diferenciarse de las EspA. Los más relevantes son los ocasionados por los corticoides (osteoporosis, necrosis ósea avascular) o tiopurinas31.
Por otra parte, la aparición de lupus inducido por los tratamientos biológicos frente al factor de necrosis tumoral α (anti-TNFα) es un problema infrecuente, aunque puede afectar en torno al 0,1%, si bien la prevalencia de positivización de anticuerpos antinucleares puede alcanzar hasta el 40%. También se han descrito cuadros similares asociados a sulfasalazina (SSZ) o a la mesalazina15,32,33.
Proceso diagnóstico en un paciente con enfermedad inflamatoria intestinal y artralgiasNo existen criterios validados de derivación de Gastroenterología a Reumatología para pacientes con EII y clínica osteoarticular. Se han publicado estrategias de derivación para el diagnóstico precoz de EspA, pero no específicamente en pacientes con EII34. Por lo tanto, en términos generales y dada la gran heterogeneidad y frecuencia de los síntomas articulares en los pacientes con EII, la presencia de artralgias podría hacer razonable la valoración por Reumatología. Recientemente se han publicado unas recomendaciones de un panel de expertos de la ASAS para derivación de pacientes con sospecha de EspA-Ax desde cualquier ámbito y para su valoración por un reumatólogo, aunque estas deben aún ser validadas en la práctica clínica35.
De acuerdo con lo anterior, los criterios de derivación de un paciente con EII y artralgias a Reumatología se resumen en la tabla 2.
Criterios de derivación de pacientes con enfermedad inflamatoria intestinal y artralgias a Reumatología
| Dolor lumbar de características inflamatorias |
| HLA-B27 positivo |
| Sacroileítis objetivada en pruebas de imagen (radiografía convencional o resonancia magnética) |
| Manifestaciones periféricas (artritis, entesitis o dactilitis) |
| Manifestaciones extraarticulares (psoriasis, uveítis) |
| Historia familiar de espondiloartritis |
| Buena respuesta a AINE |
| Aumento de reactantes de fase aguda no explicados por la actividad intestinal |
Al menos uno de estos criterios.
AINE: antiinflamatorio no esteroideo.
En la aproximación diagnóstica a un paciente con EII y artralgias, tanto la anamnesis como el conocimiento de la exploración del aparato locomotor llevarán al diagnóstico en la gran mayoría de los pacientes. Es fundamental conocer si el dolor que refiere el paciente es a nivel de entesis o articulación propiamente dicha, si hay tumefacción articular, si el dolor axial es de características mecánicas o inflamatorias, si la EII está activa o hay uso de fármacos concomitantes, entre otras cosas. En ocasiones las técnicas de imagen adecuadas, fundamentalmente RM y ecografía, serán de gran ayuda diagnóstica.
Una de las manifestaciones clínicas cardinales es la presencia de dolor lumbar inflamatorio. En no pocas ocasiones se necesita amplia experiencia en el reconocimiento de este tipo de dolor, pues hay con frecuencia dolores mecánicos que son fácilmente confundibles. Las características que permiten identificar la naturaleza inflamatoria de un dolor articular se recogen en la tabla 315,31,36,37. De hecho, los pacientes que están expuestos a tratamientos esteroideos prolongados tienen riesgo de desarrollo de fracturas vertebrales38, por lo que debe ser considerada esta posibilidad en caso de dolor vertebral agudo, especialmente cuando este es de características diferentes al inflamatorio típico de la afectación axial39.
Tratamientos empleados en las espondiloartritis y la enfermedad inflamatoria intestinalEl tratamiento convencional de las EspA incluye fundamentalmente medidas no farmacológicas y antiinflamatorios no esteroideos (AINE), ya sean clásicos o inhibidores específicos de la COX-2 (COXIB), aunque en el caso de las formas periféricas también se suele considerar la SSZ. El tratamiento biológico anti-TNFα se reserva habitualmente para aquellos pacientes con EspA refractarios a la terapia convencional. Dada la escasa evidencia sobre la utilidad de otras alternativas inmunomoduladoras, su uso no se contempla en las EspA-Ax, aunque podría considerarse de manera individualizada en la EspA-p15,40–44.
A continuación se describe brevemente la evidencia disponible sobre la utilidad y el uso de las diferentes alternativas terapéuticas que habitualmente se emplean en pacientes con EII y EspA.
Medidas no farmacológicasLa piedra angular del tratamiento no farmacológico de la EspA es la educación del paciente y el ejercicio físico regular, ya que mejoran la función física, la sensación global de bienestar y la flexibilidad. Se debe adecuar el ejercicio al tipo de afectación articular y las características del paciente, pero en términos generales se recomiendan ejercicios de fortalecimiento muscular, mantenimiento de la forma física, estiramiento y fisioterapia cuando sea necesaria1. Independientemente de los síntomas intestinales, la terapia física y la rehabilitación siempre están indicadas como terapia de soporte en el manejo de la EspA y no presentan contraindicación en los pacientes con EII coexistente15,39–41. Tanto el ejercicio físico domiciliario como las terapias físicas asistidas, ya sean individuales o grupales, son efectivas en mejorar la calidad de vida del paciente, así como la terapia ocupacional, las asociaciones de pacientes y los grupos de autoayuda39.
Antiinflamatorios no esteroideos clásicos e inhibidores específicos de la COX-2Tanto los AINE clásicos como los COXIB están indicados como fármacos de primera línea para el tratamiento de los pacientes con EspA para el control del dolor y la rigidez matinal15,39,45,46.
Los analgésicos convencionales como el paracetamol se emplean con frecuencia como alternativa en pacientes en los que el uso de AINE clásicos o COXIB está contraindicado, habida cuenta de su buen perfil de seguridad, especialmente desde el punto de vista gastrointestinal; sin embargo, no existe evidencia específica sobre su utilidad en EspA y un reciente metaanálisis indica que el uso de paracetamol en osteoartritis es inefectivo15,39,47,48.
La influencia de los AINE clásicos o de los COXIB en la actividad o aparición de recaídas en EII es controvertida, y la ficha técnica de la mayoría de los AINE recogen la recomendación de las autoridades reguladoras de no utilizarlos en las EII, lo que supone un importante condicionante en la toma de decisiones en la práctica clínica diaria. Existen muchas limitaciones para poder evaluar la seguridad de estos tratamientos en pacientes con EII. No hay evidencia directa de que ocasionen deterioro de la EII, ya que los datos procedentes de estudios controlados son muy escasos. Sin embargo, los AINE son causa potencial de daño intestinal en el intestino delgado o grueso, que no puede ser prevenido con el empleo concomitante de inhibidores de la bomba de protones y que puede ocurrir también en pacientes que no padecen EII. Por otra parte, no todos los AINE comportan el mismo riesgo de toxicidad47; en este sentido, y si bien la toxicidad digestiva de los COXIB parece menor que la del resto de los AINE, su potencial toxicidad cardiovascular obliga a limitar su uso en el tiempo, sobre todo en pacientes de mayor riesgo. Finalmente, es probable que la predisposición a la toxicidad de los AINE en la EII sea individual, y que solo el curso clínico de cada paciente permita establecer estrategias terapéuticas individualizadas49–51.
Diferentes estudios indican que los AINE se asocian a un discreto aumento del riesgo de recidiva de la EII. Aunque los datos disponibles son poco concluyentes, apuntan a que los COXIB podrían ser más seguros que los AINE clásicos en este escenario50,52,53. Hay poca información acerca de los posibles mecanismos subyacentes en la inducción de exacerbaciones en la EII en relación con AINE. Entre ellos está la inhibición de la COX, que disminuye la producción de prostaglandinas, esenciales para mantener los mecanismos de defensa de la mucosa intestinal47,50. Diferentes estudios no demuestran mayor riesgo de exacerbación de la EII en pacientes tratados con celecoxib durante 2semanas54 y etoricoxib durante 3 meses55, lo que indica que el tratamiento con COXIB, al menos a corto plazo, no parece aumentar el riesgo de recaída en EII, si bien las limitaciones de los estudios obligan a tomar estos datos con cautela50,56,57.
Así pues, considerando la actividad de la EII y el riesgo de toxicidad intestinal, parece prudente evitar en lo posible el empleo de los AINE clásicos e incluso de los COXIB en casos de EII activa o de difícil control. Se debe alcanzar el control del proceso inflamatorio con los tratamientos disponibles, ya sean inmunomoduladores convencionales o biológicos, y emplear alternativas analgésicas (como el paracetamol o el tramadol) cuando sea posible. En aquellos casos en los que la EII esté bien controlada, es aceptable el uso cauteloso y durante el periodo de tiempo más corto posible de los COXIB47,50,58,59. En caso de ser necesario el empleo de un AINE clásico por un proceso agudo intercurrente, sería conveniente escoger aquel con un mejor perfil de seguridad gastrointestinal (ibuprofeno o naproxeno)47. En cualquier caso, es recomendable una conversación abierta con el paciente acerca de las incertidumbres sobre el uso de los AINE en el contexto de la EII, en la que se le proporcione una información lo más ponderada posible sobre el riesgo y los beneficios de su uso.
Sulfasalazina, mesalazinaTanto SSZ como mesalazina tienen una eficacia contrastada en algunas formas de EII; sin embargo, no existe evidencia que apoye el empleo de SSZ en el manejo de la EspA-Ax, por lo que su uso no se puede recomendar. Tampoco hay datos que indiquen la utilidad de mesalazina para el tratamiento de la EspA-Ax40,41. Solo en las formas precoces de EspA-p y con elevación de la velocidad de sedimentación glomerular, la SSZ parece beneficiosa, generalmente a dosis de entre 2 y 3g al día15,60,61.
EsteroidesEl uso de corticoesteroides para el tratamiento de la EspA-Ax no está apoyado por la evidencia15,40,41. Sin embargo, el empleo de esteroides sistémicos a dosis bajas puede ser una opción en casos de EspA-p en los que exista contraindicación para el uso de AINE39. Además, en formas oligoarticulares, entesíticas o dactilitis se puede aplicar en forma de infiltraciones cuyo uso viene avalado más por práctica clínica que por la evidencia científica15,62–64.
En los casos en los que la actividad de la EII determine la necesidad del uso de tratamiento esteroideo por vía oral o rectal, la coexistencia de una EspA no contraindica su uso, aunque hay que tener presente el riesgo de osteoporosis asociada al uso de corticoides. En los pacientes con EII que reciben corticoesteroides deben seguirse las recomendaciones para la prevención de osteoporosis inducida por corticoides65–67.
InmunomoduladoresTanto metotrexato (MTX) como las tiopurinas —azatioprina (AZA) o mercaptopurina (MP)— son habitualmente empleados en el tratamiento de la EII, pero no han demostrado ser efectivos en la EspA-Ax, ni en el control de los síntomas ni en la detención o retraso del daño estructural articular40,41.
Con respecto a la EspA-p, ni la evidencia científica ni la experiencia apoyan el empleo de AZA o MP15,39. Sin embargo, el MTX parece útil en las formas EspA-p12,13,68, aunque la evidencia científica es escasa; puede ser además un fármaco eficaz en la EC, si bien las dosis e incluso la vía de administración pueden variar entre una indicación y la otra69,70.
Leflunomida también podría ser útil en la afectación periférica y la dactilitis de las EspA-p, aunque no existe evidencia de su utilidad en la afectación entesítica. Además, se ha comprobado que también podría ser útil en la EC43,71,72. Por otra parte, sus efectos secundarios, sobre todo la diarrea, limitan su uso, especialmente en pacientes con EII.
Los inmunosupresores calcineurínicos como ciclosporina, de nuevo con escasa evidencia, podrían ser útiles en la EspA-p, al menos para aquellos pacientes con artritis y dactilitis, aunque no hay datos de eficacia en pacientes con entesitis15,39,43.
Tratamientos biológicos anti-TNFαLos tratamientos biológicos anti-TNFα en la EspA se suelen reservar para pacientes refractarios a la terapia convencional. Generalmente se considera que un paciente con EspA-Ax es refractario a terapia convencional cuando se han utilizado al menos 2AINE con potencia antinflamatoria demostrada durante un periodo de al menos 4semanas, a la dosis máxima recomendada o tolerada, excepto en aquellos pacientes en los que haya evidencia de toxicidad o contraindicación a los AINE. Teniendo en cuenta lo comentado previamente, los pacientes con EII podrían incluirse en este último grupo39–41. En el caso de la EspA-p, el concepto de refractariedad a la terapia convencional incluye además SSZ a dosis de 2-3g/d durante al menos 3 meses39. El empleo de otras alternativas inmunomoduladoras en pacientes con EspA-p debe considerarse de manera individualizada, ya que no existe suficiente evidencia científica ni experiencia clínica como para recomendar su uso15,44.
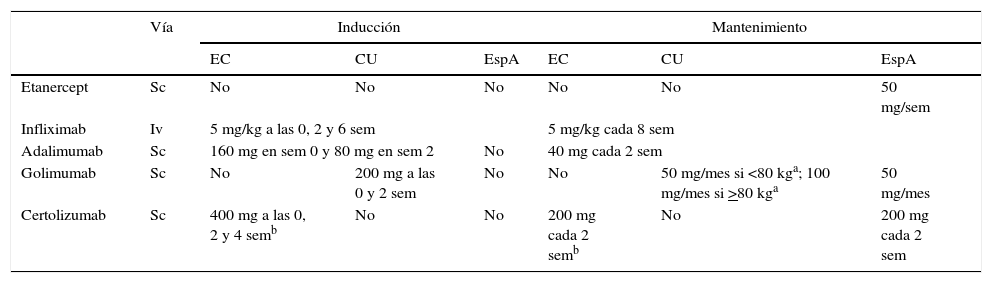
El tratamiento con anti-TNFα para la EspA tiene distintas alternativas: etanercept infliximab, adalimumab, golimumab y certolizumab, cuyas dosis y posología se resumen en la tabla 4.
Dosis y posología de los tratamientos anti-TNFα en sus diferentes indicaciones
| Vía | Inducción | Mantenimiento | |||||
|---|---|---|---|---|---|---|---|
| EC | CU | EspA | EC | CU | EspA | ||
| Etanercept | Sc | No | No | No | No | No | 50 mg/sem |
| Infliximab | Iv | 5 mg/kg a las 0, 2 y 6 sem | 5 mg/kg cada 8 sem | ||||
| Adalimumab | Sc | 160 mg en sem 0 y 80 mg en sem 2 | No | 40 mg cada 2 sem | |||
| Golimumab | Sc | No | 200 mg a las 0 y 2 sem | No | No | 50 mg/mes si <80 kga; 100 mg/mes si >80 kga | 50 mg/mes |
| Certolizumab | Sc | 400 mg a las 0, 2 y 4 semb | No | No | 200 mg cada 2 semb | No | 200 mg cada 2 sem |
CU: colitis ulcerosa; EC: enfermedad de Crohn; EspA: espondiloartritis; Iv: administración intravenosa; Sc: administración subcutánea; sem: semanas.
En pacientes con EspA asociada a EII, deberían emplearse preferiblemente tratamientos biológicos útiles en ambas enfermedades: infliximab y adalimumab son eficaces en la inducción y el mantenimiento de la remisión en pacientes con EC, tanto luminal como perianal. En pacientes con CU, además de infliximab y adalimumab, golimumab también ha demostrado ser eficaz en la inducción y el mantenimiento de la remisión73–78. No existen datos sobre la utilidad de golimumab en la EC, por lo que esta indicación no se recoge en la ficha técnica. Certolizumab no está aprobado por la Agencia Europea del Medicamento para la EII. Etanercept no ha mostrado eficacia en pacientes con EII, e incluso se han descrito exacerbaciones de la EC en pacientes con artritis tratados con etanercept79–81.
La intensificación del tratamiento anti-TNFα es una medida aceptada en casos de pérdida de eficacia, bien sea aumentando la dosis o acortando el intervalo de administración. En casos de fallo primario del tratamiento en pacientes con EspA, está aceptado igualmente el cambio de anti-TNFα. En aquellos pacientes con EspA en los que se alcanza una remisión clínica mantenida se acepta la reducción o espaciamiento de dosis, aunque se desaconseja la suspensión del tratamiento biológico, ya que existe evidencia suficiente como para considerar que la tasa de recaída es elevada15,39–43. Por su parte, no existe evidencia que avale la retirada ni la reducción de la dosis de anti-TNFα en los pacientes con EII que se encuentran en remisión, por lo que no se recomienda de manera sistemática. La reducción de la carga terapéutica se debe considerar de manera cuidadosa e individualizada y se desaconseja especialmente en los casos de EC perianal en los que la recidiva y las complicaciones parecen más frecuentes tras la suspensión del tratamiento biológico40,41,76,82.
Otros tratamientos biológicosUstekinumab es un anticuerpo monoclonal IgG1 totalmente humano que se une con gran afinidad y especificidad a la subunidad proteica p40 de las citocinas humanas IL-12 e IL-23. Actualmente su uso está aprobado para el tratamiento de la psoriasis y artritis psoriásica (a dosis de 45mg por vía subcutánea en la semana 0, 4 y posteriormente cada 12 semanas) y su indicación para EspA y EC se encuentra en proceso de aprobación83,84.
Secukinumab, un anticuerpo monoclonal anti IL-17A, ha demostrado eficacia en el tratamiento de las EspA y está recientemente autorizada su comercialización con esta indicación85. Sin embargo, no solo no ha demostrado eficacia en la EII, sino que además ha presentado altas tasas de efectos adversos comparado con placebo en este escenario86.
Vedolizumab es un anticuerpo monoclonal humanizado dirigido frente a la integrina α4β7. Se trata de un tratamiento muy selectivo, ya que bloquea la interacción entre la α4β7 y MAdCAM-1, que se expresa principalmente en las células endoteliales del intestino y que tiene un papel crítico en la migración de los linfocitos T al tracto gastrointestinal. Vedolizumab es útil para inducir y mantener la remisión en la EC y en la CU, pero por su acción específica en el tubo digestivo no sería esperable que fuera también útil en el tratamiento de las EspA75,87,88.
Situaciones clínicasExisten guías y recomendaciones para el manejo de la EII, tanto para EC como para CU, así como para las diferentes formas de EspA40,41,76,78,89–91. Sin embargo, la asociación de estas entidades en un mismo paciente obliga a tener en consideración diferentes aspectos de ambas enfermedades a la hora de aplicar estas recomendaciones de manera racional a cada paciente concreto11,13,26,31.
Enfermedad inflamatoria intestinal y espondiloartritis axial activasLa lumbalgia de características inflamatorias en un paciente con EII debe hacer sospechar la presencia de EspA-Ax asociada. Dadas las implicaciones terapéuticas de la asociación, el gastroenterólogo debe adoptar una actitud proactiva en la detección de síntomas que permitan sospechar la presencia de esta asociación en pacientes con EII27,92–94. Por otro lado, y más allá de un adecuado diagnóstico diferencial, en pacientes con exposición previa a corticoterapia sistémica, la fractura vertebral debe ser siempre descartada40,41.
Aunque mesalazina y SSZ son eficaces en una importante cantidad de pacientes con CU, no son útiles para la EspA-Ax15,40,41,78. Los AINE son de utilidad en el manejo de la EspA-Ax, aunque deben emplearse con cautela en el tratamiento de la EspA asociada a la EII por su potencial toxicidad gastrointestinal, aunque puede ser aceptable el uso cuidadoso de COXIB durante periodos cortos11,13,47,76,95.
Los corticoides sistémicos son eficaces en la inducción de la remisión de la EC luminal, pero no se recomiendan como tratamiento de mantenimiento ni a medio ni a largo plazo y no han demostrado ser eficaces en el control de la EspA-Ax asociada. Por otra parte, las tiopurinas (AZA o MP), habitualmente empleadas en la EII corticodependiente, no han demostrado eficacia en el control de la EspA-Ax; MTX puede ser eficaz en la EC, pero no ha demostrado eficacia en la CU ni en la EspA-Ax15,31,40,41,70,78.
Infliximab y adalimumab han demostrado ser eficaces en la inducción y el mantenimiento de la remisión tanto en la EC luminal como en la perianal, mientras que infliximab, adalimumab y golimumab en la CU y también en la EspA-Ax. Además, los tratamientos biológicos en la EspA-Ax están indicados en aquellos pacientes refractarios a AINE, los cuales no se pueden recomendar de manera general ni por largos periodos de tiempo en pacientes con EII. Por todo ello, deben considerar esta alternativa de manera conjunta, gastroenterólogo y reumatólogo, e individualizada para cada paciente en el que coexistan ambas entidades, tal y como se recomienda en el primer consenso europeo sobre manifestaciones extraintestinales de la EII11,13,26,31. Las dosis recomendables en este contexto son las que se han demostrado eficaces en la EII, ya que son mayores que las habitualmente empleadas en los pacientes que padecen solo EspA-Ax y, por tanto, serían dosis eficaces para ambas enfermedades (tabla 4).
Etanercept, a pesar de haberse demostrado útil en el tratamiento de la EspA-Ax, debe evitarse en este contexto. Vedolizumab es eficaz en la EC, pero no lo es en la EspA, por lo que tampoco es una opción recomendable en este escenario clínico87. En resumen, en pacientes con EII y EspA-Ax asociada activas es recomendable considerar de manera conjunta e individualizada el tratamiento biológico anti-TNFα (infliximab, adalimumab o golimumab, este último únicamente en caso de CU).
Aunque la artritis periférica es una manifestación asociada a la EII, existen otras situaciones que pueden provocar artralgias y que deben considerarse en el diagnóstico diferencial, ya que pueden ser subsidiarias de un manejo específico. Ante un paciente con EII y artritis periférica, hay que considerar la posibilidad de que las artralgias guarden relación con alguno de los tratamientos recibidos como los corticoides, las tiopurinas, o que se trate de una manifestación de la inmunogenicidad de los fármacos anti-TNFα en el contexto del lupus inducido31. Además, en pacientes de determinada edad o que hayan recibido tratamiento esteroideo prolongado, también es posible que se den otras circunstancias que justifiquen las artralgias y que no se deben confundir con la artritis asociada a la EII. La artritis reumatoide o la osteonecrosis deben incluirse también en el diagnóstico diferencial11,13,59.
La artritis periférica suele mejorar con AINE, pero no se pueden recomendar de manera general debido a su potencial toxicidad gastrointestinal. Los AINE deben evitarse en la medida de lo posible o al menos emplearse con cautela: el empleo de ciclos cortos de inhibidores de la COX-2 es aparentemente más apropiado por su perfil de seguridad en este tipo de pacientes11,13,31,59,95.
Comúnmente se acepta que la artritis periférica (fundamentalmente la oligoartritis con o sin entesitis o dactilitis) se asocia a la actividad de la EII11,13,59. Por tanto, los esfuerzos terapéuticos deben ir encaminados a alcanzar la remisión de la EII, ya sea con aminosalicilatos en el caso de la CU, corticoesteroides sistémicos o con fármacos biológicos anti-TNFα, según la situación clínica31,59,76,90. Con respecto a los tratamientos biológicos anti-TNFα, las dosis y la posología se resumen en la tabla 4.
Por otra parte, y si la afectación articular es limitante, es razonable adoptar medidas específicas como el reposo, la fisioterapia o incluso la inyección local de esteroides. Aunque los aminosalicilatos no tienen una clara indicación en la EC, existen datos que justifican el tratamiento con SSZ en casos de EC y EspA-p, o incluso la sustitución de mesalazina por SSZ en pacientes con CU y EspA-p11,13,40,41.
MTX puede ser útil como tratamiento de la EC y existen datos que señalan su utilidad en pacientes con EspA-p, por lo que puede considerarse como alternativa en la inducción de la remisión de la EC o en su mantenimiento en caso de EspA-p asociada, según las dosis y la posología que habitualmente se emplean en Reumatología, que son mayores que las que se suelen utilizar en la EII. En caso de que se considere tratamiento combinado de un biológico con un inmunosupresor para la EII, podría ser razonable considerar MTX en lugar de AZA en pacientes con EspA-p asociada, teniendo en cuenta que cuando se emplea combinado con un anti-TNF, parece que MTX es eficaz a partir de 12,5mg/semana11,13,15,59,70,96. En resumen, en pacientes con EII activa y EspA-p asociada, la prioridad del tratamiento debe ser la inducción de la remisión de la EII. En algunos casos puede ser necesario añadir tratamientos específicos para la EspA-p asociada que, según las características y gravedad del cuadro, pueden incluir reposo y fisioterapia, SSZ (en el caso de la colitis ulcerosa es recomendable emplear SSZ en lugar de mesalazina), ciclos cortos de COXIB, MTX o inyección local de esteroides. La terapia anti-TNFα debe considerarse en los pacientes refractarios a estos tratamientos.
Existe una pobre correlación entre la ausencia de síntomas, la normalidad de biomarcadores séricos y la ausencia de lesiones mucosas de la EII97–99. Es decir, la ausencia de síntomas no implica necesariamente que la EII se encuentre controlada por completo. Por tanto, ante la presencia de síntomas de EspA que obligan a un cambio en la actitud terapéutica en un paciente que, por otro lado, no presenta síntomas digestivos evidentes, es recomendable que el paciente sea evaluado por Gastroenterología para descartar la presencia de actividad de la EII, con el fin de elaborar un plan de tratamiento global. Esto es especialmente relevante en aquellas formas de EspA-p que se asocian a actividad de la EII.
La aproximación inicial en este escenario es la evaluación clínica, a través de una anamnesis adecuada y dirigida, acompañada de una analítica sanguínea convencional. En este sentido, cabe destacar que la EspA no se caracteriza por acompañarse de elevación de los reactantes de fase aguda, por lo que la elevación de velocidad de sedimentación glomerular o de la proteína C-reactiva (PCR) debe hacer sospechar actividad de la EII subclínica11.
En los casos en que exista sospecha o dudas acerca de la situación de actividad o quiescencia de la EII, puede ser necesario recurrir a exploraciones complementarias. En general, la manera más fiable de descartar la presencia de lesiones mucosas en la EII es la endoscopia digestiva, pero no deja de ser un procedimiento cuya disponibilidad no es siempre la deseable y cuyo carácter invasivo hace que no sea bien aceptado por los pacientes. Alternativamente, y según el contexto, podrían utilizarse la ecografía, la enterorresonancia magnética o la determinación de calprotectina en heces como marcador de actividad inflamatoria en la EII100–103.
En caso de que se comprobara la presencia de actividad relevante de la enfermedad, lo razonable sería considerar a la EII como activa y seguir las recomendaciones propuestas más arriba.
Si la EII se encuentra efectivamente en remisión, el tratamiento debe estar orientado a conseguir la remisión de la EspA, teniendo en cuenta los tratamientos necesarios para la EII. Es útil la adopción de medidas específicas como la fisioterapia o incluso la inyección de esteroides locales11,13,40,41. Los AINE deben emplearse con cautela, dado el riesgo de recidiva de la EII que pueden comportar, y la utilización de COXIB parece más apropiada11,13,95,104,105. Es conveniente emplear SSZ incluso en pacientes con EC o en lugar de mesalazina en pacientes con CU si se trata de EspA-p, no así en el caso de EspA-Ax.
El empleo de inmunosupresores para la EspA-p debe tener en cuenta la naturaleza y las necesidades terapéuticas de la EII concomitante. Así, MTX o leflunomida podrían ser alternativas razonables para controlar la EspA-p, aunque la EII puede suponer una limitación a su uso. La escasa experiencia con leflunomida en la EII así como su perfil de seguridad la hacen poco atractiva para este tipo de pacientes39. Por otra parte, en pacientes cuya EII se mantiene en remisión bajo tratamiento con AZA, su sustitución por MTX con la intención de controlar además los síntomas de la EspA-p debe considerarse con mucha cautela, especialmente en pacientes con CU, ya que no se ha demostrado la eficacia de MTX en este tipo de pacientes70.
En caso de que estas medidas no fueran útiles, está indicado el tratamiento biológico anti-TNFα teniendo en cuenta que sería razonable su empleo según la pauta y las dosis de infliximab, adalimumab o golimumab recomendadas en Reumatología (tabla 4), que son diferentes de las que se recomiendan para pacientes con EII15,40,41. Lo más razonable sería seleccionar el agente biológico anti-TNFα que haya demostrado ser útil también en la EII que tenga cada paciente, aunque esta se encuentre inactiva. En este sentido, solo debería considerarse golimumab en el caso de que la EII fuera CU y debería evitarse etanercept en este tipo de pacientes, no solo porque su eficacia no se ha demostrado en EII, sino porque además se ha descrito como un posible factor desencadenante de ella79–81. Dado que certolizumab no está aprobado para la EII en Europa, posiblemente tampoco sea la opción más apropiada.
Finalmente, si el paciente mantiene la EII en remisión gracias a un tratamiento anti-TNFα, a pesar de lo cual la EspA permanece activa y se considera que MTX podría ser útil para controlar esta última, puede ser razonable asociar MTX al tratamiento biológico si este se encontraba en monoterapia o incluso sustituir AZA por MTX, empleando las dosis y la vía de administración que se consideren adecuadas por parte de Reumatología. Si MTX no es útil para controlar la EspA, se puede considerar la intensificación o el cambio de biológico anti-TNFα; la determinación de niveles de fármaco y anticuerpos pueden ser de ayuda en este escenario106. En resumen, en un paciente con EspA activa y que no presenta síntomas digestivos evidentes, debe ser evaluado por Gastroenterología para descartar actividad de la EII asociada. Aunque esta se encuentre efectivamente en remisión, debe ser tenida en cuenta a la hora de establecer el tratamiento de la EspA, tanto en lo que se refiere al tratamiento con AINE, seleccionando preferiblemente un COXIB, como al tratamiento inmunomodulador o biológico, en cuyo caso lo recomendable es emplear aquel que también sea útil en la EII.
El tratamiento en estos casos debe ir orientado a alcanzar la remisión de la EII, siguiendo el planteamiento general del tratamiento de la EII en cada uno de sus distintos escenarios, aunque teniendo en cuenta la naturaleza y las necesidades terapéuticas de la EspA asociada.
En aquellos casos en los que se emplean AINE para mantener la remisión de la EspA, este tratamiento debe evitarse y optar por otras alternativas como SSZ o infiltraciones locales de esteroides cuando sea posible31,47. Cabe la posibilidad de que esta limitación obligue a considerar como alternativa el tratamiento anti-TNFα, lo cual debe ser tenido en cuenta a la hora de plantear el tratamiento de la EII15,31,40.
En el caso de la CU puede ser aconsejable incrementar las dosis de aminosalicilatos, lo cual no siempre es posible cuando se trata de SSZ, por lo que puede ser razonable optar por dosis altas de mesalazina y añadir mesalazina tópica en los casos en los que resulte apropiado78,89.
Con respecto al uso de inmunomoduladores, no sería necesario cambiar de criterio si se pretende usar AZA para la EII, la alternativa más habitual, si la EspA no necesita de inmunosupresores para mantenerse en remisión59. Si el paciente que precisa inmunosupresores para la EII ya estaba recibiendo MTX por algún tipo de EspA-p, no es apropiada su sustitución por AZA, ya que esta no es útil en la EspA11. Por otra parte, cabe la posibilidad de que la dosis que recibiera el paciente para mantener la remisión de la EspA fuera insuficiente para inducir o mantener la remisión de la EC, y el paciente se pueda beneficiar de un ajuste de dosis o cambio en la vía de administración59,70. No es de esperar que esto ocurra si se trata de un paciente con CU70. Si MTX no es útil en la inducción o el mantenimiento de la remisión de la EII a pesar de ser eficaz en el control de la EspA, estaría indicado el empleo de tratamientos biológicos, ya fueran anti-TNFα o no. Por otra parte, si la EspA-p se controla con leflunomida, y dado que la diarrea es un efecto adverso frecuente, es razonable proponer una alternativa terapéutica en aquellos pacientes con actividad de la EII13,39.
En aquellos pacientes que mantienen la remisión de la EspA con tratamientos biológicos anti-TNFα pero presentan actividad de la EII, es posible que las dosis que son suficientes para la EspA no lo sean para la EII15,40. Estos pacientes se pueden beneficiar de un ajuste de dosis, pero también de la asociación de un inmunosupresor y, en último término, de un cambio de biológico. La posibilidad de determinar los niveles de fármaco y anticuerpos puede ser de ayuda para tomar la mejor decisión106. Si el tratamiento anti-TNFα empleado para mantener la remisión de la EspA no es apropiado para la EII, es razonable el cambio de biológico (tabla 4). Por otra parte, si la EspA necesita de un tratamiento anti-TNFα para mantenerse en remisión, es preciso evitar en la medida de lo posible el cambio de diana terapéutica en el tratamiento de la EII. En resumen, en un paciente con EII activa y EspA en remisión es recomendable limitar al máximo el consumo de AINE, incluidos los COXIB, y seguir las pautas generales del tratamiento de la EII, teniendo en cuenta los tratamientos que son necesarios para el control de la EspA.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesTodos los autores cumplen con los requisitos de autoría, y declaran los siguientes conflictos de intereses.
Yago González Lama. Asesoramiento científico, soporte para la investigación y/o actividades formativas: AbbVie, MSD, Takeda, Shire Pharmaceuticals, Ferring, Tillots Pharma, Kern Pharma, Gebro Pharma, Medtronic.
Javier P. Gisbert. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Kern Pharma, Biogen, Takeda, Janssen, Pfizer, Roche, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
María Chaparro. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, AbbVie, Hospira, Dr. Falk Pharma.
María Esteve. Asesoramiento científico, soporte para investigación y/o actividades formativas: Tillots- Pharma, Abbie, MSD, Gebro Pharma y Takeda.
Guillermo Bastida. Asesoramiento científico, soporte para la investigación y/o actividades formativas: Zambon, Takeda, AbbVie, Jansen, Pfizer, Ferring, Shire.
Ana Gutiérrez. Asesoramiento científico, soporte para investigación y/o actividades formativas: Abbvie, MSD, Takeda, Hospira, Kern Pharma, Shire Pharmaceuticals, Faes Farma, Ferring.
Eugeni Domènech. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, AbbVie, Hospira, Pfizer, Kern Pharma, Takeda, Celgene, Ferring, Shire Pharmaceuticals, Tillotts Pharma, Gebro Pharma, Otsuka Pharmaceutical.
Rocío Ferreiro. Asesoramiento científico, soporte para investigación y/o actividades formativas: Abbvie, Tillots Pharma.
Fernando Gomollón. Asesoramiento científico, soporte para investigación y/o actividades formativas: Biogen, Kern, Hospira, Takeda, Abbvie, Shire y MSD.
Beatriz Sicilia. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie.
El resto de los autores declaran no tener conflicto de intereses en relación con este trabajo.