Sr. Editor: La diseminación de patógenos multirresistentes, entre ellos Pseudomonas aeruginosa productora de carbapenemasa o Enterobacteriaceae productora de betalactamasas de espectro extendido (BLEE), es un problema de crecientes dimensiones, especialmente en aquellas áreas hospitalarias en las que ingresan los pacientes más graves como las unidades de cuidados intensivos o de hematología 1,2.
Presentamos el caso de una mujer ecuatoriana de 26 años de edad, diagnosticada de leucemia linfoide aguda tipo Burkitt, que fue ingresada en el Servicio de Hematología del Hospital Son Llàtzer de Palma de Mallorca el 15 de julio de 2004. La paciente recibió profilaxis con ciprofloxacino además de la quimioterapia para el tratamiento de la leucemia aguda. El 23 de julio presentó dos úlceras perianales profundas y dolorosas con cultivos inicialmente negativos. Las úlceras fueron tratadas localmente con corticoides y con una pomada de colagenasa, sin presentar mejoría. El 28 de julio, debido a un síndrome febril, la paciente recibió tratamiento con piperacilina-tazobactam, amikacina y teicoplanina hasta el 24 de agosto, fecha en que desapareció la fiebre. El 17 de agosto se aisló de la úlcera P. aeruginosa multirresistente (PA-SL1) y Klebsiella pneumoniae productora de BLEE (KP-SL1). La paciente fue aislada para disminuir el riesgo de transmisión de los patógenos multirresistentes a otros pacientes en el Servicio de Hematología. Se inició tratamiento tópico con permanganato potásico (1:10.000 solución acuosa), ácido fusídico y sulfadiazina argéntica. El 31 de agosto fue dada de alta con una mejoría parcial de las úlceras y cultivos negativos. Once días más tarde, la paciente reingresó para recibir otro ciclo de quimioterapia, reactivándose las úlceras perianales. Los cultivos fueron negativos para P. aeruginosa, aunque K. pneumoniae productora de BLEE fue otra vez aislada en la úlcera y posteriormente en un hemocultivo extraído el 22 de septiembre. Se instauró tratamiento con imipenem y amikacina hasta el 4 de octubre, dándose de alta con hemocultivos y cultivos de las úlceras negativos.
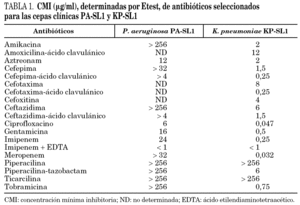
La identificación de las cepas de P. aeruginosa y K. pneumoniae se realizó mediante el sistema VITEK2 (tarjeta ID-GNB, bioMérieux, Marcy-l'Etoile, Francia). Las concentraciones inhibitorias mínimas (CIM) se determinaron por Etest (AB Biodisk, Solna, Suecia), y se interpretaron según los puntos de corte del National Committee for Clinical Laboratory Standards (NCCLS) 3. Adicionalmente, se usaron tiras de imipenem-imipenem + EDTA (MBL) como técnica de cribado para la detección de carbapenemasas de clase B. PA-SL1 fue resistente a todos los antibióticos analizados, incluyendo todos los betalactámicos (con la excepción de aztreonam, que presentó resistencia intermedia), ciprofloxacino, gentamicina, tobramicina y amikacina (tabla 1). Además, la resistencia al imipenem se inhibió con EDTA, sugiriendo la producción de una carbapenemasa de clase B. Por otra parte, KP-SL1 mostró una susceptibilidad disminuida inhibible por ácido clavulánico a todas las cefalosporinas de espectro extendido y al aztreonam, y una resistencia intermedia a la amoxicilina-ácido clavulánico (tabla 1).
La actividad carbapenemasa de la cepa PA-SL1 se estudió siguiendo protocolos previamente descritos 4. Brevemente, se determinó la tasa de hidrólisis de imipenem (solución 100 mM en 30 mM de tampón ACES pH 7,0) a partir del extracto celular crudo, obtenido por sonicación y resuspensión en tampón ACES, mediante espectrofotometría a 297 nm. Asimismo, se determinó la actividad hidrolítica después de la incubación de los extractos en EDTA 2 mM durante 15 min. La cepa de P. aeruginosa COL-1 5 productora de VIM-2 y la cepa de P. aeruginosa PA2A8 hiperproductora de la cefalosporinasa cromosómica AmpC (colección de laboratorio) fueron usadas como controles positivo y negativo, respectivamente. La determinación del punto isoeléctrico de las betalactamasas se realizó por la técnica de isoelectroenfoque (IEF) utilizando el Sistema Phast (Pharmacia, Uppsala, Suecia) con los geles Phast (gradiente de pH 3-9). El extracto sonicado de PA-SL1 mostró una alta tasa de hidrólisis de imipenem (13,5 nmol/min/mg de proteína), similar a la cepa COL-1 (21,0 nmol/min/mg de proteína), a diferencia de la cepa control hiperproductora de AmpC (0,18 nmol/min/mg de proteína). La hidrólisis de imipenem resultó inhibible por EDTA ya que la actividad carbapenemasa fue únicamente del 2,7% del valor original después de la incubación en presencia de EDTA 2 mM.
Para la detección de los genes bla implicados, se realizó la amplificación por reacción en cadena de la polimerasa (PCR) usando cebadores específicos para blaIMP-16, blaIMP-2 7, blaVIM-14, blaVIM-25 y blaSHV8. Las reacciones de secuenciación se llevaron a cabo con el BigDye Terminator kit (PE Applied Biosystems, Foster City, Estados Unidos) y las secuencias fueron analizadas con el secuenciador de ADN ABI Prism 3100 (PE Applied Biosystems). La amplificación por PCR del ADN extraído de PA-SL1 utilizando los distintos cebadores para genes tipo blaIMP y blaVIM fue únicamente positiva para blaVIM-2. Dos productos de PCR independientes fueron secuenciados, confirmando la presencia de blaVIM-2. La CMI de PA-SL1 para el aztreonam (12 μg/ml) fue más alta de lo esperable para una cepa productora de VIM-2 5, lo que hace suponer la presencia de un mecanismo de resistencia adicional como la hiperexpresión de AmpC o de bombas de expulsión.
Por otra parte, se demostró la producción de SHV-2 en KP-SL1 mediante IEF, amplificación por PCR con cebadores específicos de SHV y posterior secuenciación. La PCR con los cebadores para blaVIM-2 en KP-SL1 y la amplificación de blaSHV en PA-SL1 fueron negativas.
Se determinó la relación clonal de los aislados de K. pneumoniae detectados en los dos cultivos de la úlcera (recogidos durante cada uno de los ingresos), así como en el aislado del hemocultivo obtenido en el segundo ingreso mediante electroforesis en campo pulsado (PFGE), usando XbaI como enzima de restricción 8. Para la separación del ADN se utilizó el aparato CHEF-DRIII (Bio-Rad, La Jolla, Estados Unidos) con las siguientes condiciones: 6 V/cm 2 durante 20 h con pulsos de 2 a 35 s. El análisis de los patrones de PFGE confirmó que los tres aislados de K. pneumoniae, obtenidos de los dos cultivos de úlcera y del hemocultivo, tenían un patrón idéntico, lo que demuestra la presencia de una única cepa que persistió desde el primer ingreso.
El aislamiento de P. aeruginosa productora de carbapenemasa está aumentando en muchos países, en ocasiones formando parte de brotes epidémicos 2. Los genes de las carbapenemasas se localizan habitualmente en integrones, por lo que es frecuente la multirresistencia antibiótica asociada 4,5. La cepa PA-SL1 fue resistente a los tres aminoglucósidos más usados en la práctica clínica gentamicina, tobramicina y amikacina, cuyos determinantes de resistencia están asociados con frecuencia a integrones 9. Además, PA-SL1 fue resistente al ciprofloxacino e intermedio al aztreonam. Debido al elevado riesgo terapéutico y epidemiológico que suponen este tipo de cepas, es recomendable mantener una vigilancia activa incluso en aquellos países que aparentemente presentan una baja prevalencia de P. aeruginosa productora de carbapenemasa, como el nuestro, en el que únicamente se han detectado hasta la fecha de forma aislada en Barcelona 10,11. Por fortuna, aparentemente PA-SL1 no se diseminó a otros pacientes del área de Hematología, lo que podría haber tenido consecuencias dramáticas, ni la paciente desarrolló una infección sistémica (como sí ocurrió con KP-SL1), para la que no se hubiera podido administrar ningún tratamiento efectivo.
Agradecimientos
Agradecemos a Enrique Ruiz de Gopegui la detección de la cepa multirresistente de P. aeruginosa, a Diana Alonso su colaboración en la caracterización bioquímica de la carbapenemasa, a C. Vidal y C. Santos la realización de los estudios de secuenciación y a P. Nordmann el proporcionarnos la cepa de P. aeruginosa COL-1 usada como control.