Introducción
La infección nosocomial es motivo de creciente preocupación en el ámbito hospitalario por su contribución al incremento de la morbilidad y la mortalidad, la prolongación de la estancia hospitalaria y al aumento de los costes asociados. La magnitud del problema justifica la búsqueda continua de nuevas estrategias para mejorar su prevención, vigilancia y tratamiento. La terapia con antibióticos intravenosos constituye el pilar fundamental del tratamiento, y son los antibióticos betalactámicos (penicilinas, cefalosporinas y carbapenemes) los más ampliamente prescritos y recomendados como tratamiento de elección por las guías clínicas actuales 1. Dicha clase de antibióticos se caracteriza generalmente por presentar semividas de eliminación cortas, que condicionan su forma de administración; habitualmente mediante infusiones intermitentes (II) de corta duración (30-60 min) varias veces al día. Recientemente, ha crecido el interés en la búsqueda de pautas de administración de antibióticos betalactámicos en infusión continua (IC) 2,3. El fundamento de esta nueva estrategia terapéutica se halla en la aplicación de criterios farmacocinéticos (FC) y farmacodinámicos (FD) para el diseño de los esquemas posológicos. Además, otro factor que permite plantearse la utilización de la IC es la estabilidad que poseen la mayoría de antibióticos betalactámicos a temperatura ambiente, durante tiempos iguales o superiores a las 24 h 4 (véase la tabla 1).
Esta revisión pretende realizar una recopilación de la evidencia existente de la utilización de pautas de administración de betalactámicos en IC y analizar las ventajas e inconvenientes de su aplicación en la práctica clínica. Con tal fin, hemos llevado a cabo una búsqueda de los estudios más relevantes publicados hasta el momento, a través de Medline.
Utilización de índices FC/FD para diseño de regímenes terapéuticos
Los antibióticos betalactámicos presentan un patrón de actividad bactericida dependiente del tiempo 5. El citado patrón se caracteriza por el aumento de la actividad bactericida con el incremento de la concentración de antibiótico, hasta llegar a un determinado valor de concentración, normalmente de 4 a 5 veces la concentración inhibitoria mínima (CIM), a partir del cual la actividad bactericida se mantiene constante en el tiempo, independientemente de la concentración de antibiótico 6.
Otro factor importante que hay que tener en cuenta es el efecto postantibiótico (EPA), el cual se define por el tiempo que tarda en restablecerse el crecimiento bacteriano, una vez el antibiótico ha desaparecido del medio. En general, los antibióticos dependientes del tiempo presentan EPA cortos, principalmente en el caso de que el agente infeccioso sea gramnegativo 7.
El índice FC/FD que mejor se correlaciona con la eficacia clínica de los antibióticos betalactámicos es el tiempo durante el cual la concentración de antibiótico libre en estado de equilibrio estacionario (Css) supera la CIM (Tss> CIM) del microorganismo responsable de la infección. En la literatura médica existe cierta controversia entre los valores óptimos de Tss > CIM que conviene alcanzar, y que pueden variar en función del antibiótico, agente infeccioso y estado inmunitario del paciente. En general, se asume que, para conseguir el máximo efecto terapéutico, el Tss > CIM debe ser superior al 40-50% del intervalo de dosificación 8, aunque algunos autores proponen maximizar el Tss> CIM para lograr mejores resultados, sobre todo para tratar infecciones por Pseudomonas aeruginosa (por ello, se citan valores de Tss > CIM del 60-70% 9) y en casos de pacientes inmunodeprimidos 10 (con valores de Tss> CIM del 90-100% 2). Este objetivo puede conseguirse: a) aumentando la frecuencia de administración, con el inconveniente de un incremento del tiempo de enfermería; b) aumentando la dosis de antibiótico, estrategia que implica mayor consumo de antibiótico y concentraciones máximas del fármaco en sangre más elevadas (aumenta la probabilidad de aparición de efectos adversos), y c) administrando el antibiótico en IC de 24 h. De la siguiente ecuación (Eq. 1), que relaciona la dosis, el intervalo posológico y el Tss> CIM, se deduce que al duplicar una dosis, el Tss> CIM aumenta de forma proporcional al logaritmo de ésta, mientras que al reducir el intervalo posológico a la mitad, el Tss> CIM se duplica 2.
(Eq.1):
Tss > CIM (%) = ln [D/(Vd · CIM)] · t1/2/ln2 · 100/T
D: dosis (mg)
Vd: volumen de distribución (L)
t1/2: semivida de eliminación (h)
T: intervalo posológico (h)
La probabilidad de aparición de microorganismos resistentes es otro factor que puede minimizarse mediante la selección de la pauta de tratamiento antibiótico. Las mutaciones que dan lugar a la aparición de poblaciones de microorganismos resistentes se producen hasta una concentración de antibiótico denominada concentración de prevención de mutaciones (CPM), a partir de la cual no se observa crecimiento de mutantes. El tiempo durante el cual la concentración de antibiótico se halla por encima de la CIM y por debajo de la CPM recibe el nombre de ventana de selección. A mayor ventana de selección, relación CPM/CIM y semivida de eliminación del antibiótico, mayor es la probabilidad de aparición de resistencias. En consecuencia, podríamos asumir que la IC de antibióticos betalactámicos tendría la mínima probabilidad de selección de microorganismos resistentes, al ser la ventana de selección mucho menor que en los regímenes de II. Además, la mayoría de regímenes en IC suelen iniciarse con una dosis de carga del antibiótico, acortando así el intervalo de tiempo durante el cual las concentraciones del mismo se hallan por debajo de la CPM.
Eficacia de la administración de betalactámicos en IC según criterios FC/FD
Se han desarrollado modelos in vitro para comparar la erradicación de cepas de P. aeruginosa con distintos grados de sensibilidad, entre regímenes de ceftazidima administrada en II e IC 11-13. Estos estudios coinciden en señalar los regímenes en IC como más efectivos, sobre todo en casos de microorganismos con sensibilidad intermedia-resistente a ceftazidima, en dosis totales diarias inferiores o iguales a las utilizadas para la II.
Otra metodología utilizada para comparar ambos regímenes de administración (IC frente a II) consiste en realizar ensayos en grupos de pocos individuos (pacientes o voluntarios sanos), que reciben el tratamiento antibiótico de estudio. Se obtienen muestras de sangre para análisis de las concentraciones de antibiótico y posterior cálculo de los parámetros FC de la población de individuos. Los datos FD se obtienen cultivando las muestras frente a una cepa microbiológica elegida, para obtener datos de actividad bactericida, o bien de registros de los valores de CIM de los microorganismos más frecuentes en cada ámbito. Siguiendo esta metodología, diversos estudios con ceftazidima en voluntarios sanos 14 o en pacientes de unidad de cuidados intensivos (UCI) 15-18 mostraron una mejora del perfil FC/FD (según el Tss > CIM) con la administración del antibiótico en IC frente a II. Los estudios de Nicolau et al 14 y Benko et al 15 analizan, además, la actividad bactericida frente a cepas de P. aeruginosa (CIM: 4 μg/ml) y Escherichia coli (CIM: 0,25 a 0,50 μg/ml), y obtienen resultados equivalentes entre ambos regímenes de administración. Es interesante destacar que Benko et al 15 utilizaron dosis de 3 g de ceftazidima en IC frente a dosis de 2 g/12 h en II, con resultados equivalentes en el análisis FD.
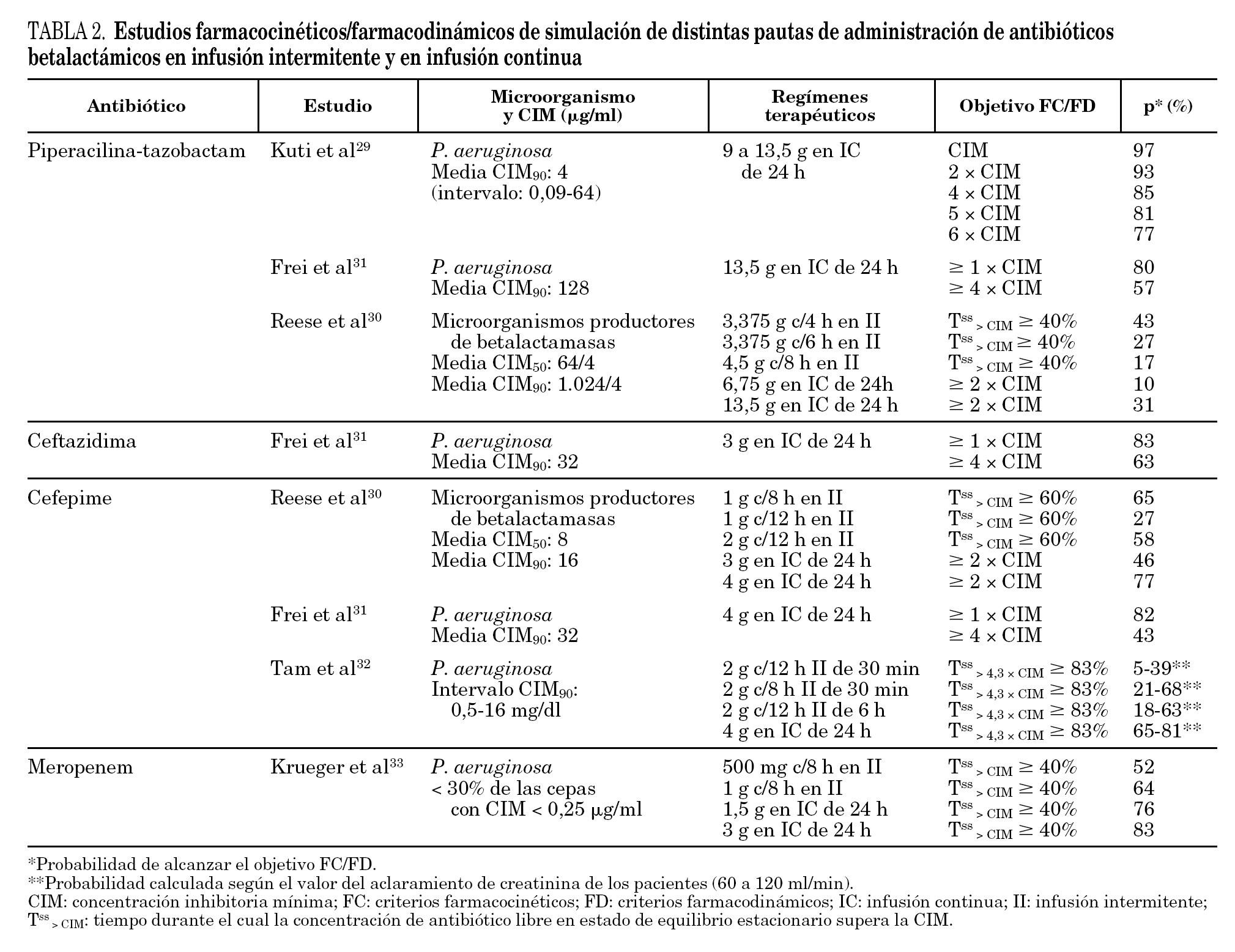
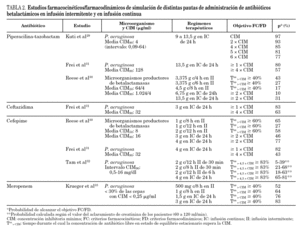
De forma análoga, se han estudiado pautas en IC de piperacilina-tazobactam en pacientes 19 y en voluntarios sanos 20 que han demostrado una buena actividad bactericida con una dosis total diaria un 15% menor que los regímenes comparativos en II 20. En el estudio de Burgess et al 19 se aprecia mayor actividad bactericida con una pauta de piperacilina-tazobactam 12 g/1,5 g en IC frente a 3 g/0,375 g cada 6 h en II (p = 0,024) frente a cepas de P. aeruginosa (CIM: 4 μg/ml).
El mismo tipo de diseño se empleó en un estudio con cefepima en voluntarios sanos, con las siguientes pautas posológicas: 2 g/12 h en II, 3 g en IC y 4 g en IC. Los resultados mostraron que frente a microorganismos con CIM ≤4 μg/ml, solamente el régimen de 4 g en IC conseguía Css/CIM ≥4 durante todo el intervalo posológico (Tss > CIM = 100%) en todos los pacientes, mientras que para el régimen de 2 g/12 h en II, se conseguían valores de Tss> CIM ≥70% en el 92% de los pacientes 21.
Dado que los carbapenemes parecen tener EPA más largos que las penicilinas y cefalosporinas para los microorganismos gramnegativos, se ha propuesto que el Tss> CIM diana para maximizar la actividad bactericida debería ser igual o superior al 40% 22. Con tal fin, se ha estudiado la posibilidad de administrarlos en IC o bien mediante infusiones cortas de, por ejemplo, 3 h de duración. En un estudio realizado con 6 voluntarios sanos 23, se comparó la administración de pautas de meropenem de 2 g/8 h y 500 mg/8 h, infundidas en bolo frente a las mismas pautas en infusiones cortas de 3 h. Para una CIM de 4 μg/ml, los valores de Tss> CIM fueron del 58% y del 30% para las dosis de 2 g y 500 mg en bolo, mientras que para las pautas en infusión corta fueron del 73 y 43%, respectivamente. Además, para cepas de microorganismos resistentes como puede ser P. aeruginosa con CIM del orden de 16 mg/ml, los valores de Tss> CIM obtenidos al administrar 2 g de meropenem, fueron del 48 y 32% para la infusión corta y el bolo, respectivamente. El estudio de Jaruratanasirikul et al 24 obtiene también una optimización significativa del Tss> CIM con la administración de meropenem en infusión corta de 3 h. Así mismo, también se ha estudiado la administración de meropenem en IC. Thalhammer et al 25 realizaron un estudio cruzado en pacientes de UCI comparando la administración de meropenem 3 g en IC frente a 2 g/8 h en II. La Css y la Cmín para los regímenes en IC e II, respectivamente, fueron comparables (11,9 ± 5,0 mg/ml frente a 8,5 ± 1,0 μg/ ml), cifrándose teóricamente, para ambas pautas, el Tss> CIM en un 100% si se consideran los valores de CIM de los agentes infecciosos más comunes en pacientes de UCI. Por tanto, se concluye que la administración de la mitad de la dosis de meropenem en IC podría resultar igualmente eficaz que la pauta habitual en II.
Boselli et al 18 evalúan la penetración de ceftazidima en líquido intersticial pulmonar (epithelial lining fluid: ELF) en pacientes de UCI que reciben una dosis de 4 g del antibiótico en IC. La penetración del fármaco en ELF fue del 20 ± 8,9%. Referente a las concentraciones que se alcanzan en ELF (8,2 ± 4,8 mg/ml), éstas superan en cuatro veces la CIM para la mayoría de patógenos, con un Tss> CIM óptimo, a excepción de ciertas cepas de P. aeruginosa, Acinetobacter baumanii y algunas enterobacteriáceas, para las cuales los autores concluyen que sería necesario aumentar la dosis o bien asociar otro antibiótico. También se estudió la penetración de cefepima en ELF, en idénticas condiciones 26. Tras la administración de 4 g del antibiótico en IC, la penetración de cefepima en ELF fue, sorprendentemente, del 100%, cuando la penetración de cefalosporinas en tejido pulmonar ha sido establecida en sólo el 5-20% 27,28. Esta diferencia, según los autores, podría explicarse por la diversidad de metodologías empleadas. Las concentraciones de cefepima en ELF obtenidas fueron de 14,1 ± 2,8 mg/ml, que de forma análoga al estudio con ceftazidima, son óptimas para el tratamiento de la mayoría de patógenos, a excepción de las cepas más resistentes.
Recientemente, se han publicado estudios basados en la integración de datos FC/FD mediante el uso de modelos teóricos basados en simulaciones de Monte Carlo. Este tipo de análisis FC/FD permite estimar la probabilidad de obtener un determinado valor de Tss > CIM en una población diana, para un antibiótico y agente infeccioso concretos. Para ello, se requiere disponer de una estimación de la variabilidad de la exposición al fármaco en la población estudiada (datos obtenidos de un análisis FC poblacional) e información de la sensibilidad del agente infeccioso al antibiótico (distribución de los valores de CIM). Hasta el momento disponemos de estudios realizados con piperacilina-tazobactam 29-31, aztreonam 31, ceftazidima 31, cefepima 30-32 y meropenem 33,34 (tabla 2). Todos ellos coinciden en resaltar la mayor probabilidad de alcanzar el Tss> CIM óptimo (con Css/CIM ≥4) con regímenes en IC frente a los actualmente empleados en II. Esta diferencia se hace especialmente relevante a medida que aumenta la CIM, planteando la conveniencia de implementar regímenes de administración de betalactámicos en IC. Aun así, en casos de infección por patógenos muy resistentes, como ciertas cepas de P. aeruginosa, A. baumanii y microorganismos productores de betalactamasas de amplio espectro, la probabilidad de éxito terapéutico de la IC de antibióticos betalactámicos (ceftazidima, cefepima, aztreonam y piperacilina-tazobactam) en las dosis estudiadas resulta insuficiente, por lo que se hace necesaria la asociación de otro antibiótico o bien el uso de dosis superiores. En este sentido, Tam et al 32 cuantifican en un 65-81% la probabilidad de conseguir Css de cefepima óptimas (4,5 veces la CIM; Tss> CIM ≥83%) frente a una distribución de CIM de P. aeruginosa, con una pauta de 4 g de cefepima en IC, en comparación con valores de 4-38% con 2 g/12 h en II y 21-68% con 2 g/8 h en II.
Krueger et al 33 también comparan la administración de 2 pautas de meropenem en II (0,5 g/8 h y 1 g/8 h) frente a 2 pautas en IC (1,5 y 3 g), obteniendo una probabilidad de superar el índice FC/FD diana establecido (Tss> CIM > 40%) para P. aeruginosa del 52 y 64%, respectivamente, para ambos regímenes en II, y del 76 y 83% para ambas pautas en IC. Kuti et al 34 comparan las dosis habituales de 1 g y 2 g/8 h en bolo, frente a las siguientes pautas en infusiones cortas de 3 h: 500 mg, 1 g y 2 g/8 h; 1 g y 2 g/12 h. Es interesante observar que los autores no hallan diferencias significativas entre las mismas dosis administradas en bolo o infusión corta, frente a bacterias con alta sensibilidad al antibiótico (enterobacteriáceas); mientras que para microorganismos con CIM elevadas (como ciertas cepas de Acinetobacter y P. aeruginosa) la infusión corta obtiene mayor probabilidad de superar el objetivo FC/FD. Además, las pautas en infusión corta de 500 mg/8 h, 1 g y 2 g/12 h, permiten la optimización del Tss> CIM con menor dosis total diaria que las pautas de administración en bolo.
Evaluación de la eficacia y los costes de la administración de betalactámicos en IC
Actualmente, disponemos de pocos ensayos clínicos comparativos que analicen la eficacia de la IC de antibióticos betalactámicos frente a la II en humanos, principalmente por la complejidad que entrañan (tabla 3).
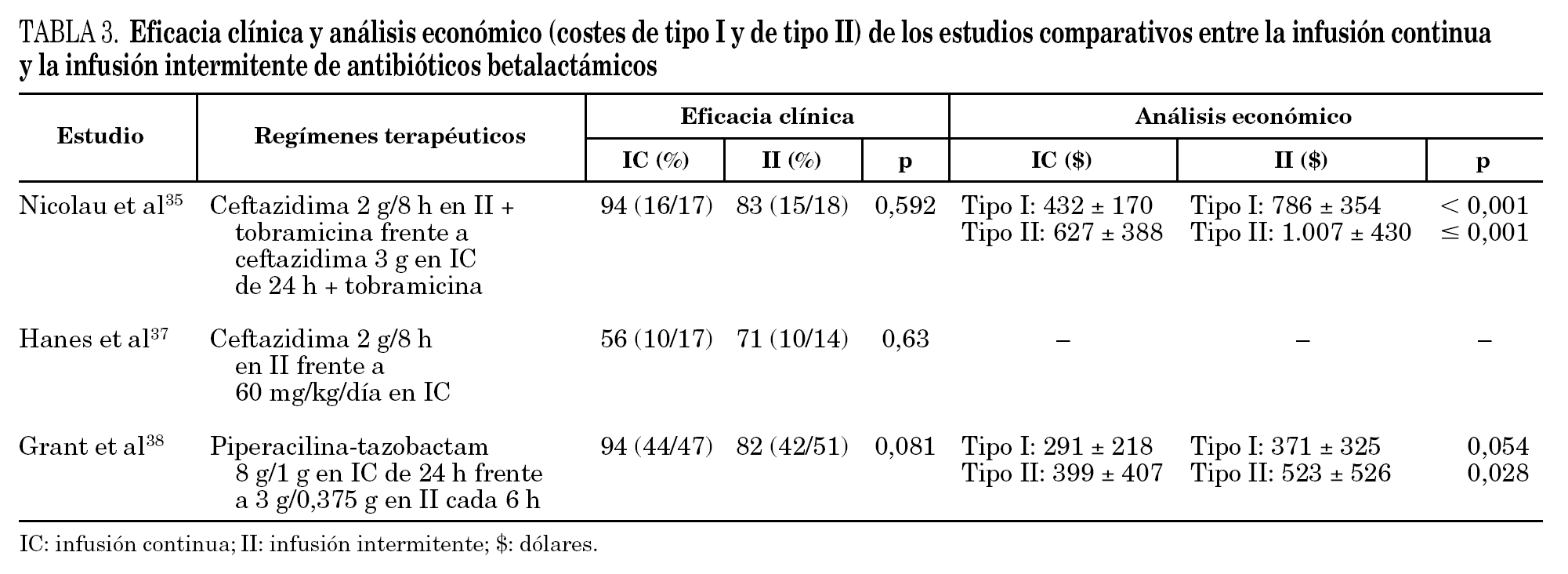
En un estudio con ceftazidima en pacientes de UCI diagnosticados de neumonía nosocomial, los pacientes se aleatorizaron para recibir ceftazidima 2 g/8 h en II frente a 3 g en IC (previa dosis de carga de 1 g), en asociación con tobramicina. La respuesta clínica (IC: 16/17 [94%]; II: 15/18 [83%]) y microbiológica (IC: 10/13 [76%]; II: 12/15 [80%]) fue similar en ambos grupos de tratamiento 35; mientras que en el análisis farmacoeconómico 36, los costes asociados de tipo I (derivados de la adquisición del fármaco) y de tipo II (relacionados con el uso del fármaco: preparación, administración, tratamiento de efectos adversos, antibióticos concomitantes, fracaso terapéutico) fueron significativamente menores con el régimen en IC que los del régimen en II (tipo I: 432 ± 170 dólares frente a 786 ± 354 dólares, p < 0,001; tipo II: 627 ± 388 dólares frente a 1.007 ± 430 dólares; p ≥0,001). Tampoco se hallaron diferencias significativas de respuesta clínica en un estudio realizado en pacientes traumatológicos con diagnóstico de neumonía nosocomial no complicada, a los que se administró ceftazidima 2 g/8 h en II frente a 60 mg/kg/día en IC (previa dosis de carga de 2 g) 37.
Grant et al 39 evaluaron la eficacia clínica de la administración de piperacilina-tazobactam en IC (8 g/1 g, cambiando a 12 g/1,5 g en caso de sospecha de infección por P. aeruginosa) frente a II (3 g/0,375 g cada 6 h o bien 4 g/0,5 g cada 8 h), en pacientes con distintos tipos de infección y observaron que ambos tratamientos fueron equivalentes en términos de eficacia clínica (IC: 94%, II: 82%; p = 0,081) y microbiológica (IC: 89%, II: 73%; p = 0,092). De forma análoga al estudio anterior, se demostraron diferencias significativas en el análisis farmacoeconómico para los costes de tipo II, favorables al tratamiento en IC (IC: 399 ± 407 dólares; II: 523 ± 526 dólares; p = 0,028) 38.
Situaciones especiales
Además del tratamiento de las infecciones nosocomiales agudas en pacientes inmunocompetentes, la IC de antibióticos betalactámicos puede ser de especial utilidad en situaciones clínicas como la neutropenia febril (NF) y el tratamiento de infecciones por gramnegativos en pacientes con fibrosis quística (FQ).
Neutropenia febril
Respecto a la antibioterapia con betalactámicos en pacientes inmunodeprimidos, algunos autores proponen objetivos de Tss> CIM 90-100% para maximizar la eficacia del tratamiento. Hasta la fecha, se han realizado algunos estudios no comparativos de administración de ceftazidima en IC, en poblaciones de pacientes neutropénicos. Egerer et al 39 reunieron a 87 pacientes con NF tras haber sido sometidos a dosis elevadas de quimioterapia y trasplante autólogo de células madre. Los pacientes recibieron 4 g de ceftazidima en IC (bolo inicial de 2 g) en monoterapia. La respuesta al tratamiento fue favorable en el 64% de los casos con diagnóstico de cáncer de mama y en el 63% de pacientes diagnosticados de mieloma múltiple. Cuando se añadió un antibiótico glucopeptídico al tratamiento, la fiebre remitió en 11 y 10 pacientes del primer y segundo grupos, respectivamente. Los autores concluyen que la administración de ceftazidima en IC en este tipo de pacientes es sencilla y eficaz, y es, por lo tanto, susceptible de ser aplicada en régimen domiciliario. Esto supondría una reducción sustancial de los costes derivados del ingreso de estos pacientes en el hospital. Otro grupo de investigadores proponen la administración de dosis bajas de ceftazidima en IC en pacientes que desarrollen NF con criterios de bajo riesgo 40. Se administraron 2 g de ceftazidima en IC (bolo inicial de 1 g) a un total de 135 pacientes con enfermedades malignas no hematológicas, que presentaron NF. El 68% de los individuos respondió favorablemente al cabo de 48 h de tratamiento, mientras que el 18% requirió la modificación de la terapia antiinfecciosa. La IC de ceftazidima en dosis bajas permitió reducir los costes relacionados con el tratamiento de los pacientes y los costes derivados de la estancia, al ser la duración media de la hospitalización de sólo 4 días.
Cuando se evaluó la administración de ceftazidima en IC en pacientes hematológicos con NF, se observó que éstos presentaban valores más elevados de volumen de distribución y aclaramiento del fármaco en comparación con los voluntarios sanos 41,42. Tomándolo en consideración, Pea et al 43 proponen la administración de 6 g de ceftazidima en IC en pacientes hematológicos de alto riesgo con NF, con el objetivo de superar 4 o 5 veces la CIM de 8 mg/l para P. aeruginosa. Los autores observaron que el 70% de los pacientes consiguieron alcanzar el objetivo, pero señalan que en algunos casos sería necesario emplear dosis más altas y monitorizar las concentraciones plasmáticas de antibiótico.
Es interesante comentar los resultados de eficacia clínica obtenidos en un estudio retrospectivo en pacientes neutropénicos con fiebre y bacteriemia, a los que se administró meropenem. El Tss> CIM fue significativamente mayor en los pacientes que respondieron al tratamiento (Tss > CIM medio: 83%) en comparación con los que fracasaron (Tss > CIM medio: 59%), p = 0,04 10. Las conclusiones de este estudio confirman que la prolongación del Tss> CIM se relaciona con una mejora de la eficacia del tratamiento antibiótico.
Fibrosis quística
La perfusión continua de antibióticos betalactámicos también puede ser beneficiosa en pacientes con FQ, en los que la prevalencia de la infección pulmonar crónica causada por P. aeruginosa es muy elevada. En muchos de los casos es necesario tratar las agudizaciones de la infección pulmonar con ciclos de terapia antibiótica de unas 3 semanas de duración con un betalactámico solo o asociado a un aminoglucósido. Existen todavía pocos estudios con antibióticos betalactámicos en IC en este tipo de pacientes. El estudio de Vinks et al 44 demostró que la IC de ceftazidima en régimen ambulatorio (dosis de 100 mg/ kg/día durante una media de 21 días) en 17 pacientes con FQ, fue clínicamente eficaz (mejoría clínica del 91% de pacientes, mantenida a las 4-6 semanas postratamiento en el 70%), consiguiendo valores medios de Css de 28,4 ± 5,0 mg/l, superiores a la CIM de la mayoría de cepas de P. aeruginosa aisladas en las muestras de esputo. Rappaz et al 45 realizaron un estudio comparativo en niños con FQ e infección pulmonar crónica por P. aeruginosa, entre un régimen de ceftazidima en bolo cada 8 h (dosis de 200 mg/kg/día) frente un régimen en IC (dosis de 100 mg/kg/día). La Css media del régimen de ceftazidima en IC superó la CIM de las cepas de P. aeruginosa aisladas en los cultivos, mientras que las concentraciones plasmáticas mínimas de ceftazidima con el régimen en II fueron muy variables y en algunos de los casos (32%) inferiores a la CIM. Sin embargo, la eficacia clínica fue similar para ambos regímenes de tratamiento. Los autores concluyen que el régimen de ceftazidima en IC en el domicilio del paciente permitiría reducir sustancialmente los costes asociados al tratamiento. Además, también destacan que el tratamiento domiciliario goza de mayor aceptación por parte de los pacientes, evitándoles los repetidos y prolongados ingresos en el hospital.
Recientemente, se ha propuesto que la utilización de meropenem en IC para pacientes con FQ podría resultar beneficiosa, atendiendo a su amplio espectro de actividad, especialmente frente a Pseudomonas sp. Un estudio farmacocinético realizado en 7 pacientes con FQ demostró que la administración de meropenem en IC en dosis de 3 y 6 g cada 24 h proporcionaba valores de Css superiores a la CIM para microorganismos considerados sensibles (CIM de 4 μg/ml) o con sensibilidad intermedia (CIM de 8 μg/ml), respectivamente 46.
Discusión
La evidencia científica disponible hasta el momento actual nos indica que la administración de antibióticos betalactámicos en IC puede resultar ventajosa para el tratamiento de la infección nosocomial. Sin embargo, todavía disponemos de pocos estudios comparativos que evalúen la eficacia clínica y microbiológica obtenida con las pautas habituales, frente a las pautas en IC diseñadas según criterios FC/FD. Los escasos estudios comparativos que se han realizado hasta el momento son poco concluyentes, hecho que podría atribuirse, en parte, al reducido tamaño de la muestra y a que los diseños de los mismos no han tenido en cuenta la integración de criterios FC/FD para la optimización de los esquemas posológicos.
La investigación promocionada por la industria farmacéutica (alrededor del 80% de los ensayos clínicos realizados en España) se centra en el desarrollo de nuevas moléculas o bien de nuevas presentaciones para fármacos ya comercializados. Tal realidad supone que la promoción de ensayos clínicos con la finalidad de diseñar pautas óptimas de tratamiento con antibióticos betalactámicos comercializados, queda en manos de grupos de investigadores independientes, que obviamente disponen de menos recursos y menor capacidad de reclutamiento de pacientes.
Debemos salvar algunos obstáculos cuando nos disponemos a utilizar una terapia con antibióticos betalactámicos en IC, en la práctica clínica. En un primer término, son pocos los laboratorios de microbiología que informan al clínico de la CIM del agente infeccioso. Además, los parámetros FC de los antibióticos descritos en la literatura médica se han obtenido, de forma general, en poblaciones de voluntarios sanos, que en muchos de los casos difieren de los pacientes con infecciones graves. Por ejemplo, Boselli et al 26 obtuvieron concentraciones de cefepima de 13,5 ± 3,3 μg/ml en pacientes sépticos tras la administración de 4 g del antibiótico en IC, mientras que un estudio en voluntarios sanos 21 obtenía concentraciones de 20,3 ± 3,3 μg/ml, tras la misma pauta de dosificación. Por este motivo, y por la amplia variabilidad FC interindividual que se atribuye a las poblaciones de pacientes críticos 47, podría ser interesante la monitorización de las concentraciones plasmáticas de antibiótico, sobre todo en caso de microorganismos con CIM elevadas, cuando conviene asegurar Css/CIM > 4.
En casos de pacientes que reciben múltiples fármacos por vía intravenosa, la carencia de estudios de compatibilidad entre fármacos representa una dificultad para establecer regímenes de administración de betalactámicos en IC. El desarrollo de este tipo de estudios se hace necesario sobre todo si consideramos que son los pacientes graves, politratados, los que podrían obtener un mayor beneficio de la terapia con betalactámicos en IC.
En relación con los carbapenemes, queremos destacar la diversidad de opiniones que existe acerca de la conveniencia de administrar meropenem en IC. Algunos autores argumentan que, debido al mayor EPA de los carbapenemes en comparación con los demás betalactámicos, es suficiente diseñar pautas en infusión de corta duración o bien reducir el intervalo posológico, para optimizar la farmacodinamia del antibiótico, sin tener que recurrir a pautas de administración en IC. Además, se debe considerar que la estabilidad de meropenem en una solución de cloruro sódico al 0,9% a 25 °C es de 8 h, o bien de 48 h a 4 °C (según datos de la ficha técnica del producto), de forma que la administración en IC supone realizar cambios frecuentes de la bolsa de infusión o disponer de un sistema de refrigeración.
Así mismo merece especial atención la aplicación de la IC de antibióticos betalactámicos en pacientes con NF y FQ. Los estudios realizados hasta el momento, mayoritariamente con ceftazidima, obtienen buenos resultados de eficacia clínica, aunque todavía queda por establecer si existe superioridad de eficacia en comparación con los regímenes clásicos de administración en II. Gran parte de los autores concluyen que la utilización de la IC de betalactámicos en estos pacientes resulta rentable, ya que suelen requerir múltiples ciclos de antibioterapia, en algunos casos de larga duración, y el régimen en IC permite realizar el tratamiento de forma ambulatoria. En este caso, conviene tener en cuenta los estudios de estabilidad llevados a cabo por Viaene et al 48 y Baririan et al 49 que desaconsejan la utilización de bombas de infusión portátiles de ceftazidima o cefepima en contacto directo con el cuerpo del paciente. Según estos estudios, la estabilidad de las diluciones de ceftazidima y cefepima a temperatura corporal (37 °C) es de unas 8 y 12-13 h, respectivamente, mientras que se mantiene para períodos de 24 h a temperatura ambiente (25 °C) 48-50.
Si nos centramos en la vertiente económica, algunos de los estudios realizados concluyen que la administración de antibióticos en IC es rentable. Partiendo de una eficacia clínica igual o superior a la administración en II, la IC reduce los costes derivados de la adquisición del fármaco (se requieren dosis menores), y ahorra tiempo de enfermería. Si además se añade la posibilidad de realizar el tratamiento ambulatoriamente, la reducción de los costes es aún más acentuada.
Correspondencia: Dra. E. López.
Servicio de Farmacia. Hospital Clínic de Barcelona.
Villarroel, 170, escalera 8, planta 0. 08036 Barcelona. España.
Correo electrónico: ester.ls@gmail.com
Manuscrito recibido el 8-11-2005; aceptado el 8-5-2006.