El objetivo de este documento es dar a conocer a la comunidad científica y a los profesionales que tratan a pacientes infectados por el virus de la inmunodeficiencia humana (VIH) las alteraciones osteoarticulares más relevantes, así como su diagnóstico y tratamiento.
Estas recomendaciones han sido consensuadas por un panel de expertos del Plan Nacional sobre el Sida (PNS) y del grupo de Estudio de Sida (GESIDA). Para ello se han revisado los resultados sobre eficacia y seguridad de ensayos clínicos y estudios de cohortes y de farmacocinética publicados en revistas biomédicas (PubMed y Embase) o presentados a congresos. Se han definido tres niveles de evidencia según la procedencia de los datos: nivel A, estudios aleatorizados y controlados; nivel B, estudios de cohortes o de casos y controles; y nivel C, estudios descriptivos u opinión de expertos. En cada una de las situaciones se ha decidido recomendar, considerar o no recomendar.
La disminución de la densidad de la masa ósea es la afectación más frecuente en el paciente con infección por el VIH. Afecta principalmente durante el primer año de tratamiento con terapia antirretroviral (del 2 al 4%), con recuperación parcial posterior. Estaría recomendada la realización de un DXA a pacientes con infección por el VIH mayores de 50 años y/o que presenten factores de riesgo o antecedentes de fracturas óseas. El tratamiento con bifosfonatos ha demostrado ser eficaz. Las infecciones osteoarticulares son más frecuentes que en población no infectada. Por ello, se debe tener en cuenta el nivel de inmunosupresión, la práctica de riesgo y el tratamiento antirretroviral para un correcto enfoque diagnóstico y terapéutico. Las pruebas analíticas y de imagen recomendadas en los procesos músculo-esqueléticos en el sujeto con VIH son las mismas que en la población general. En pediatría, la osteonecrosis y la disminución de la densidad mineral ósea son las alteraciones más frecuentes.
Es necesario un diagnóstico precoz de las alteraciones óseas. Hay que incidir en evitar los factores de riesgo modificables e iniciar tratamiento cuando sea necesario. Los bifosfonatos se han mostrado eficaces en la osteoporosis.
The aim of this paper is to present the most relevant musculoskeletal disorders, their diagnosis and treatment to the scientific community and the professionals in charge of patients with human immunodeficiency virus (HIV) infection.
These recommendations have been agreed by a panel of experts from the National AIDS Plan (PNS) and the AIDS Study Group (GESIDA). The group have reviewed the efficacy and safety results of clinical trials, cohort studies and pharmacokinetic studies published in biomedical journals (PubMed and Embase), or presented at conferences. Three levels of evidence have been defined according to the sources of data: level A, randomized controlled trials; level B, cohort or case-control; and level C, descriptive studies and expert opinion. Based on this evidence, the authors have decided to recommend, consider or not recommend for each situation.
The decrease in bone mineral density is common in HIV-infected patients on antiretroviral treatment, especially during the first year (from 2 to 4%), with a subsequent partial recovery. A dual energy x-ray absorptiometry (DEXA) scan is recommended in patients over 50years old with HIV infection, history of bone fractures and/or risk factors. Treatment with bisphosphonates has been shown to be effective. Osteoarticular infections are more frequent than in the non-infected population. The level of immunosuppression, risk practice, and antiretroviral treatment should be considered for a proper diagnosis and therapeutic approach. Laboratory and imaging procedures recommended for the study of musculoskeletal processes in HIV infected subjects are the same as in the general population. Osteonecrosis and decreased bone mineral density are the most frequent alterations in children.
An early diagnosis of bone disorders is needed. The influence of modifiable risk factors must be avoided and initiate treatment when necessary. Bisphosphonates have been effective in osteoporosis.
La infección por el virus de la inmunodeficiencia humana (VIH) se caracteriza por la presencia de múltiples manifestaciones clínicas que pueden afectar a cualquier órgano, aparato o sistema. Las enfermedades osteoarticulares pueden aparecer en cualquier momento de la evolución clínica de la infección, aunque la mayoría de ellas son más frecuentes en etapas tardías, y en ocasiones llegan a ser invalidantes para el paciente.
El objetivo de este documento es dar a conocer a la comunidad científica y a los profesionales que tratan a pacientes infectados por el VIH las alteraciones osteoarticulares más relevantes, así como su diagnóstico y tratamiento.
MetodologíaEl Panel está formado por un grupo de clínicos expertos en el tratamiento de pacientes infectados por el VIH y reumatólogos. Estos profesionales han sido designados por la Secretaría del Plan Nacional sobre el Sida (PNS) y la Junta Directiva del grupo de Estudio de Sida (GESIDA). Los miembros se han dividido en grupos formados por un redactor y varios consultores para actualizar cada capítulo de las recomendaciones. Tres miembros del Panel actúan como coordinadores.
Para la elaboración de estas guías cada autor ha revisado los datos más relevantes de las publicaciones científicas (PubMed y Embase; idiomas español, ingles y francés) y las comunicaciones a los congresos más recientes en la materia.
El documento ha sido discutido y consensuado en una reunión presencial de los coordinadores y redactores. Tras ello, el documento ha sido expuesto durante un periodo de tiempo en la web de las entidades promotoras para que los profesionales a los que va dirigido y quien esté interesado puedan sugerir matices o cambios que pueden ser o no aceptados por el Panel a posteriori.
La jerarquización de la evidencia está ligada a la solidez del diseño de cada estudio y es esencial si sus resultados van a matizar una recomendación de práctica clínica. En este consenso la gradación de la evidencia se ha efectuado según la clasificación de la IDSA: nivel A, estudios aleatorizados y controlados; nivel B, estudios de cohortes o de casos y controles; y nivel C, estudios descriptivos u opinión de expertos.
Bases fisiopatológicas de las alteraciones óseas en la infección VIHDe las diversas entidades revisadas en el documento únicamente en dos, la osteonecrosis y la osteoporosis, es posible invocar mecanismos etiopatogénicos específicos de la infección por VIH o su tratamiento, es decir diferentes o añadidos a los de la población general.
OsteonecrosisLa mayor parte de los factores considerados en la literatura (tabaco, alcohol, hiperlidemia, corticoides, uso de drogas intravenosas, radioterapia/quimioterapia, vasculitis, pancreatitis) son comunes a los de la población general, y los propios de la infección por VIH (terapia antirretroviral [TARV], baja cifra de CD4) lo son con escaso grado de evidencia.
OsteoporosisPapel de la infección por VIHExisten muchos estudios epidemiológicos que demuestran una mayor prevalencia de disminución de la densidad mineral ósea (DMO) en la población infectada por VIH y aunque muchos no depuran otros factores de confusión (tabaco, etc.) existen cada vez más evidencias que indican que la propia infección se asocia con una disminución de la DMO, que puede ser más intensa en pacientes con otros factores de riesgo añadidos. Una hipótesis plausible es que sea consecuencia del estado proinflamatorio y de la activación inmune asociada a la infección por VIH.
Papel de la terapia antirretroviralLa TARV se ha asociado con DMO baja en numerosos estudios clínicos transversales y metaanálisis1. Se ha señalado un riesgo relativo de osteopenia de 2,5 en los pacientes con TARV frente a los no tratados. Más difícil es, no obstante, establecer posibles relaciones con fármacos específicos, o clases, con resultados dispares sobre todo en relación con los inhibidores de proteasa (IP). Hay concordancia en varios ensayos clínicos en que cualquier TARV se asocia con pérdida de masa ósea, sobre todo en el primer año – del 2 al 4%-, con recuperación parcial posterior1,2. Existen datos controvertidos sobre el papel de los IP en la osteopenia/osteoporosis, pero datos recientes los asocian a una pérdida de masa ósea3. En el caso de los nucleósidos, existen datos de diferentes ensayos clínicos (GS 903; ACTG 5224s; STEAL; ASSERT) que indican que tenofovir disoproxil fumarato (TDF) se asocia con mayor pérdida de DMO que los análogos con los que se compara, si bien en ninguno de ellos se han observado diferencias en la aparición de fracturas.
Los factores que se han relacionado con la osteoporosis en los pacientes infectados por VIH se reflejan en la tabla 1.
Factores relacionados con osteoporosis en pacientes infectados por VIH
| Relacionados con la Infección VIH |
| Duración de la infección |
| Carga viral elevada |
| Alteraciones de la distribución grasa* |
| Relacionados con el tratamiento |
| Uso de tenofovir y posiblemente inhibidores de la proteasa |
| Acidosis láctica* |
| Alteraciones del metabolismo de la grasa* |
Se señalan con un asterisco aquellos cuya relación es más cuestionada.
Es necesario realizar una analítica que incluya hemograma con velocidad de sedimentación globular, coagulación y parámetros bioquímicos de función hepática y renal. También, está indicado determinar reactantes de fase aguda (velocidad de sediemntación globular y proteína C reactiva-PCR). Su determinación puede ayudar a diferenciar los procesos inflamatorios de los infecciosos y a evaluar la respuesta al tratamiento.
Pruebas inmunológicas4Los pacientes infectados por el VIH presentan una mayor prevalencia de diferentes autoanticuerpos. En cerca del 20% de los pacientes infectados por el VIH se detecta la presencia de factor reumatoide, anticuerpos antinucleares, crioglobulinas y anticuerpos anticitoplasma de neutrófilos. Estos porcentajes se incrementan en los coinfectados por el virus de la hepatitis C y en los enfermos con procesos reumatológicos tipo lupus eritematoso sistémico.
El 40-50% de los pacientes VIH positivos presentan títulos elevados de anticuerpos anticardiolipina, anticoagulante lúpico y tests luéticos falsamente positivos, pero rara vez desarrollan manifestaciones clínicas de síndrome antifosfolipido. En los pacientes infectados por el VIH no se ha encontrado relación entre el desarrollo de artritis y la presencia del factor reumatoide, anticuerpos antipéptido citrulinado cíclico y el antigeno HLA B27, excepto en los pacientes caucásicos que desarrollan artritis reactivas que suelen ser HLA-B27 positivos.
Balance metabólicoSe aconseja realizar, junto a los estudios densitométricos, un balance metabólico (fosfatasa alcalina, calcio, fósforo y 25-OH vitamina D, y en casos seleccionados, marcadores bioquímicos del remodelado óseo). Más del 75% de los enfermos infectados por el VIH presentan niveles insuficientes de vitamina D.
Estudio del líquido sinovialEl análisis del líquido sinovial es una prueba necesaria para el diagnóstico de las enfermedades articulares y está indicado realizarlo ante cualquier artritis. Su estudio debe incluir las características macro y microscópicas habituales: glucosa, proteínas, recuento celular, fórmula leucocitaria, presencia de cristales con el microscopio óptico de luz polarizada y cultivos para gérmenes aeróbicos, anaeróbicos, micobacterias y hongos según las sospechas clínicas. En los procesos artríticos no infecciosos el líquido sinovial suele ser inflamatorio con 5.000-50.000 leucocitos/mm3 (60-90% polimorfonucleares). En las artritis bacterianas el líquido sinovial suele ser purulento, con más de 50.000 leucocitos/mm3 (> 90% de polimorfonucleares).
Pruebas de imagenRadiografía convencionalEs la primera prueba de imagen que debemos solicitar para el diagnóstico y el seguimiento. La radiología simple sigue siendo el primer método de diagnóstico por imagen; otras pruebas de imagen son: la ecografía, la tomografía axial computarizada (TAC) y la resonancia magnética (RM).
Tomografía axial computarizada y resonancia magnéticaLa TAC y la RM son las dos técnicas de imagen más útiles para el diagnóstico de las enfermedades músculo-esqueléticas. Ambas permiten el diagnóstico y localización de artritis, celulitis, fascitis, piomiositis y osteomielitis con gran sensibilidad y aportan información sobre la extensión del proceso, así como sobre la existencia de complicaciones locales.
En general la RM es más sensible que la TAC en los procesos de partes blandas y la TAC nos aporta mayor información en las enfermedades óseas, aunque con frecuencia hay que realizar ambas técnicas para una perfecta evaluación de la infección.
EcografíaLa ecografía mediante ultrasonidos proporciona imágenes de gran calidad de los tejidos de partes blandas del aparato locomotor. Su principal utilidad es el estudio de las estructuras articulares y periarticulares, como tendones y bolsas sinoviales, tejido celular subcutáneo, fascias y músculos. Nos permite valorar la integridad de estas estructuras y dirigir punciones diagnósticas y terapéuticas.
Otras técnicasDensitometría ósea5,6La densitometría axial de rayos X de doble energía (dual energy X-ray absortiometry [DXA]) constituye el patrón oro para el análisis de la DMO.
La DXA también nos permite predecir el riesgo de fractura y monitorizar la evolución de la osteoporosis y su respuesta al tratamiento. Cada descenso de la DMO en una desviación estándar incrementa el riesgo relativo de fractura al doble. El intervalo que debe transcurrir entre dos exploraciones evolutivas es de dos años, aunque en pacientes con marcada pérdida de masa ósea puede reducirse a un año.
Medicina NuclearGammagrafía ósea con tecnecio (Tc)Las gammagráfias óseas realizadas con tecnecio son de gran utilidad en las fases iniciales de los procesos infecciosos y tumorales del aparato locomotor. Estos estudios son muy sensibles pero inespecíficos y se producen acúmulos del trazador en los procesos inflamatorios, traumáticos y neoplásicos que cursan con reacción osteoblástica.
Gammagrafía con galio y con leucocitos marcadosEl citrato de galio 67 y los leucocitos marcados del propio paciente son trazadores que se depositan en los tejidos óseos y extraóseos con marcada inflamación como ocurre en las enfermedades infecciosas y en algunos tumores.
Nuevas técnicas de Medicina NuclearLa SPECT (Single Photon Emisión Computed Tomography) y la PET (Positron Emisión Tomography). Su utilidad es escasa en el estudio de las enfermedades del aparato locomotor. La PET se utiliza de forma excepcional en los procesos músculo-esqueléticos y sirve para determinar la naturaleza benigna o maligna de una lesión conocida o detectar tumores malignos o recidivas de dichas neoplasias. La PET asociado a la TAC permite la localización precisa y extensión de los procesos tumorales.
Osteopenia y osteoporosisEvaluación clínicaLa estimación del riesgo de fracturas de un paciente con infección VIH debe estar basada, en primer lugar, en la valoración clínica. La evaluación clínica debe centrarse en la identificación de ciertos factores que se han descrito relacionados con un incremento del riesgo de fracturas óseas de naturaleza no traumática7 (mayor edad, historia previa de fracturas óseas por fragilidad), si bien se han descrito múltiples factores de riesgo (tabla 2). Existen tres lugares característicos de estas fracturas por fragilidad, que son las fracturas vertebrales, las del cuello del fémur y de la muñeca (la fractura de Colles).
Factores de riesgo para osteoporosis, descenso de la DMO o fracturas óseas
| Edad (>65 años mujer y >70 años varón) |
| Menopausia |
| Historia previa de fracturas óseas por fragilidad |
| Bajo peso corporal (IMC<20 kg/m2) |
| Tabaquismo |
| Excesivo consumo de alcohol |
| Tratamientos asociados a reducción de la DMO* |
| Mayor tendencia a las caídas |
| Hipogonadismo |
| Hiperfunción tiroidea |
| Malabsorción intestinal |
| Hepatopatías crónicas |
| Diabetes tipo 1 |
| Enfermedad inflamatoria intestinal |
| Déficit de vitamina D (25[OH]D3<30 ng/mL) |
| Riesgo de fractura a los 10 años en algoritmo FRAX >3% cadera o >20% en cualquier localización |
| Recomendaciones para el despistaje de OP en pacientes con infección VIH |
| Menos de 50 años: opcional |
| Si más de dos factores de riesgo para OP: aconsejable (nivel C, categoría III) |
| Más de 50 años |
| Sin (o menos de dos) factores de riesgo: aconsejable (nivel B, categoría II) |
| Más de dos factores de riesgo: recomendado (nivel A, categoría I) |
*Corticoides, anticonvulsivos, antiácidos que contengan aluminio, hormonas tiroideas en exceso, heparina, pentamidina, ketoconazol, colestiramina y posiblemente determinados antirretrovirales.
La densitometría ósea mediante DXA es el procedimiento estándar en la evaluación de los trastornos de la densidad mineral ósea. La DMO se expresa en gramos de mineral por unidad de superficie (cm2). La Organización Mundial de la Salud (OMS) estableció unas categorías sobre la base de criterios epidemiológicos que tienen en cuenta la evolución de los valores de la DMO. – Normal: cuando la DMO es superior a –1 DE en la escala T. – Osteopenia: cuando la DMO se sitúa entre –1 y –2,5 DE en la escala T. – Osteoporosis: cuando la DMO es inferior a –2,5 DE en la escala T. – Osteoporosis grave o establecida: cuando al criterio de osteoporosis se añade la presencia de fracturas. La escala T toma como referencia la DMO de la población joven cuando se alcanza el pico máximo de masa ósea. La escala Z relaciona los valores de DMO del sujeto con los correspondientes a su mismo grupo de etnia, edad y sexo.
Indicaciones de la DXA en pacientes con infección por VIHSiguiendo las recomendaciones de 2007 de la International Society for Clinical Densitometry (ISCD)8 se recomienda realizar una DXA en las siguientes circunstancias clínicas:
- •
Mujeres mayores de 65 años.
- •
Mujeres posmenopáusicas por debajo de los 65 años con factores de riesgo para fracturas óseas.
- •
Mujeres durante la transición de la menopausia con factores de riesgo para fractura, fracturas previas, o uso de medicación con riesgo de afectar a la densidad mineral ósea.
- •
Varones por encima de los 70 años.
- •
Varones por debajo de los 70 años con factores de riesgo para fracturas.
- •
Adultos con historia de fracturas por fragilidad.
- •
Adultos de cualquier edad con una enfermedad asociada a reducción de la masa ósea, o en tratamiento prolongado con fármacos que se asocian a una reducción de la DMO.
- •
Cualquier paciente en el que se considere el tratamiento farmacológico para aumentar la masa ósea.
- •
Cualquier paciente que esté en tratamiento, para monitorizar el efecto de este.
- •
Cualquier paciente que no reciba tratamiento en el que la evidencia de una masa ósea reducida pudiera conducir a tratamiento.
- •
Se consideran factores de riesgo para fractura las siguientes circunstancias:
- –
Bajo peso corporal (por debajo de 58kg o IMC por debajo de 20kg/m2).
- –
Tabaquismo activo. La mayor intensidad del tabaquismo puede acentuar el riesgo de DMO reducida.
- –
Excesivo consumo de alcohol.
- –
Edad.
- –
Historia de fracturas óseas en familiar de primer grado.
- –
Artritis reumatoide.
- –
Enfermedades asociadas con osteoporosis secundaria como hipogonadismo, menopausia precoz, hipertiroidismo, malabsorción intestinal, hepatopatías crónicas, diabetes tipo 1 o enfermedad inflamatoria intestinal.
- –
El Panel considera que la realización de la DXA en pacientes con infección por VIH podría estar particularmente indicada en pacientes que presenten un mayor número de factores de riesgo para osteoporosis, fracturas óseas o descenso de la DMO. La opinión del Panel es recomendar la realización de esta prueba a pacientes con infección por el VIH mayores de 50 años. Consideramos que la prueba estaría especialmente indicada en pacientes con infección por VIH mayores de 50 años que además presenten más de dos factores de riesgo.
Uso del algoritmo FRAX en pacientes con infección VIHEl algoritmo FRAX9 (Fracture Risk Assessment Tool) (www.shef.ac.uk/FRAX) ha sido elaborado a instancias de la OMS en 2008. Permite estimar el riesgo de fractura de cadera o el riesgo combinado de una fractura ósea mayor relacionada con osteoporosis, para un paciente sin tratamiento para la osteoporosis entre los 40-90 años. La mayor utilidad de esta herramienta es la evaluación del riesgo de fracturas en mujeres posmenopáusicas por encima de los 50 años, y no se ha reconocido su aplicabilidad para pacientes más jóvenes ni en pacientes con infección por VIH.
Osteopenia y osteoporosis: manejo terapéuticoEl manejo terapéutico de la osteopenia/osteoporosis radica en primer lugar en su prevención; por lo tanto, debe dirigirse hacia la toma de medidas para reducir los factores de riesgo asociados a la disminución de la DMO, que se pueden categorizar en: 1)modificables: hábitos tóxicos (tabaco, alcohol), estilo de vida (sedentarismo, exposición solar), nutricionales (IMC<20kg/m2, déficit de alimentos ricos en calcio); 2) potencialmente modificables: enfermedades endocrinas, reumáticas, fármacos (corticoides, anticonvulsivos, antiácidos que contengan aluminio, hormonas tiroideas en exceso, heparina, pentamidina, ketoconazol, colestiramina y posiblemente determinados antirretrovirales); 3) factores no modificables: edad, sexo, menopausia y patrón genético.
Consideraciones antes de iniciar el tratamientoLa pérdida de DMO, en particular en individuos menores de 50 años, obliga a descartar patologías que provocan la osteoporosis secundaria. La experiencia del tratamiento farmacológico de la osteoporosis se documenta en la mayoría de los casos en mujeres posmenopáusicas y tras tratamiento corticoideo. Sin embargo, en varones es escasa y se limita a estudios en los últimos años. En pacientes VIH con una edad inferior a 50 años debemos incidir en las medidas no farmacológicas y el aporte de calcio y vitamina D; algunos autores recomiendan repetir la DEXA al año antes de iniciar el tratamiento farmacológico. La elección de qué pacientes con infección por el VIH deben ser tratados se fundamenta en los mismos criterios que en la población general, que se basarán en el T-score inferior a -2,5 y con más de 3% de riesgo de fractura de cadera en la escala de FRAX en pacientes mayores de 50 años. En menores de 50 años se debe utilizar el Z-score como criterio diagnóstico.
Los bifosfonatos se han asociado a osteonecrosis mandibular10; esta asociación aumenta en pacientes con neoplasias y los sometidos a maniobras quirúrgicas odontológicas previas por lo que es aconsejable realizar una exploración odontológica y posponer el tratamiento al menos seis meses en el caso de intervención odontológica.
Medidas no farmacológicasEstilo de vidaEl sedentarismo es un factor de riesgo importante; se recomienda fomentar el ejercicio, paseos diarios de al menos 30 minutos. Asimismo, la exposición solar cuando sea posible de al menos 15 minutos diarios, recordando que los filtros solares totales inhiben la absorción de vitamina D. Además se aconseja el abandono de hábitos tóxicos como el tabaquismo y la reducción del consumo de alcohol. La metadona se ha asociado a inhibición de la producción de hormonas como la testosterona relacionada con pérdida de la DMO.
Aportes nutricionalesPara favorecer una buena homeostasis ósea es necesario el concurso de minerales como calcio, fósforo, magnesio, flúor y cobre. Se aconseja una dieta adecuada con aporte de calcio con más de 800mg/día; estas necesidades se suplen con la toma diaria de dos vasos de leche, 50g de queso y dos yogures. Otros alimentos ricos en calcio son: pescado (sardinas, salmón, lenguado, besugo, boquerones con espina…), marisco-crustáceos (berberechos, mejillones, gambas..), verduras-hortalizas (espinacas, col, acelgas, berro, ajos, cebollas..), legumbres (garbanzos, lentejas, judía blanca, soja…), frutos secos (nueces, almendras, avellana, pistachos..), yema de huevo, pulpo, etc. Además, se precisa del concurso de vitamina A, C y en particular de vitamina D, que se encuentra en alimentos como hígado, yema de huevo y lácteos fortificados. En mujeres posmenopáusicas y varones mayores de 65 años se aconseja el consumo alimentos ricos en fitofenoles (soja). Es también importante valorar la reducción de la ingesta excesiva de aquellos alimentos que interfieren en la absorción del calcio como el exceso de: sal, alcohol, oxalatos, xantinas y cafeína.
Suplementos de calcio-vitamina DNo existen estudios aleatorizados en pacientes VIH, que valoren el beneficio de suplementos de calcio y vitamina D. En la población general, a dosis de 1.200mg/800UI día de calcio y vitamina D respectivamente disminuye el riesgo de fractura en más del 12% tanto en hombres como en mujeres y aumenta al 24% en aquellos con buena adherencia11. Los datos de eficacia en pacientes VIH de aportes nutricionales, se limitan a estudios que los sitúan como el grupo control de los bisfosfonatos, resultando siempre inferior con relación a la ganancia de la DMO. Si se plantea el tratamiento con vitamina D, es aconsejable conseguir un nivel de 25-OH vitamina D >30 ng/ml. Hay que recordar que las necesidades de ingesta de calcio varían con la edad, la gestación y el sexo. Además el umbral de absorción de calcio elemental se limita al 50% del total del calcio ingerido y este se satura a dosis superiores a 500mg por toma.
Medidas farmacológicas en pacientes VIH positivosExisten pocos estudios farmacológicos en la población VIH; sin embargo, su metodología y diseño nos revelan la eficacia y seguridad de los bisfosfonatos (alendronato y zoledronato) para el tratamiento de la osteoporosis en pacientes VIH con tratamiento antirretroviral. No obstante, puesto que el seguimiento de los estudios realizados es relativamente corto (unos dos años), es preciso evaluar la seguridad a más largo plazo. Negredo et al aleatorizaron a 25 pacientes con TARV y osteoporosis a una pauta con 70mg/semanal de alendronato más una intervención dietética con un aporte mínimo de 1.200g de calcio. A las 96 semanas, apreciaron un aumento significativo en el grupo del alendronato de la DMO a nivel de la columna (en cadera se demostró una mejoría a los dos años de seguimiento) y mejoría de los porcentajes del T-score en ambas regiones de estudio12. Otros autores apreciaron en tres estudios comparativos, con criterios de selección diferentes (T-score <-1,5 o de <-1) mejoría de la DMO en ambos sexos, superior en el grupo del alendronato en todas las regiones analizadas excepto en el cuello femoral13–15. La experiencia con zoledronato en la población con infección por VIH es aún más escasa. Se han realizado dos interesantes estudios16,17, con un diseño a doble ciego y aleatorizado, que sitúan al zoledronato como una buena opción en pacientes VIH. Una importante aportación es que los marcadores de resorción ósea (N-telopéptido en orina), disminuyen un 60% el primer trimestre y a diferencia de otros estudios con alendronato, se mantienen estables durante los dos años de seguimiento16. Este hecho presenta actualmente cierta relevancia, puesto que algunos autores apuntan que la depleción mantenida de los marcadores de resorción ósea que produce el alendronato podría dificultar la recuperación o curación de las fracturas.
Osteonecrosis en la infección por VIHEn los últimos años se ha observado una incidencia creciente de osteonecrosis y fracturas patológicas en los mismos, sobre todo desde la generalización de la terapia antirretroviral de gran actividad, sin embargo, los distintos estudios de casos y controles realizados no confirman por el momento esta hipótesis18,19.
Tipos y clasificaciónLa clasificación se realiza principalmente mediante pruebas de imagen, diferenciándose dos periodos: precolapso y poscolapso (tabla 3).
Clasificación de la osteonecrosis:
| Estadio 0: diagnóstico histológico (todas las pruebas de imagen son normales) |
| Estadio 1: radiología simple y TAC normales con estudio por RMN o estudio histológico positivo. La extensión del compromiso se define como: A)<15%; B) entre el 15 y el 30%; C) > 30% |
| Estadio 2: estudio con radiología simple positiva pero sin colapso. La extensión se clasifica igualmente como A, B, C |
| Estadio 3: signos tempranos de aplanamiento y de imagen en “semiluna”. Se puede requerir estudio con TAC. El grado de extensión se clasifica como A, B, C, pero se puede precisar el grado de depresión ósea (mm) |
| Estadio 4: aplanamiento de la cabeza femoral o evidencia de colapso |
| Estadio 5: similar al 4 más pérdida del espacio articular |
| Estadio 6: similar al 5 más destrucción de la articulación |
Clasificación ARCO (Pavelka K. Osteonecrosis. Ballieres Best Pract Res Clin Rheumatol. 2000; 14:399-414).
Se debe realizar un diagnóstico diferencial con osteoartritis, artrosis o artritis reumatoide, aunque los antecedentes del paciente o la exposición a factores de riesgo pueden hacernos sospechar la existencia de una osteonecrosis. (tabla 4)
Manifestaciones clínicas
| Presentación aguda en pocas ocasiones |
| Inicio insidioso |
| Movilidad preservada en fases iniciales |
| Molestia-dolor leve a moderado a nivel periarticular. Puede ser fijo o irradiarse |
| El dolor provoca impotencia funcional |
| El 85% presenta afectación de una o ambas cabezas femorales. Cursa con dolor en región inguinal y cara anterior del muslo |
| El dolor puede aumentar o aparecer con la carga de peso o con los movimientos |
Queda reflejado en la tabla 5.
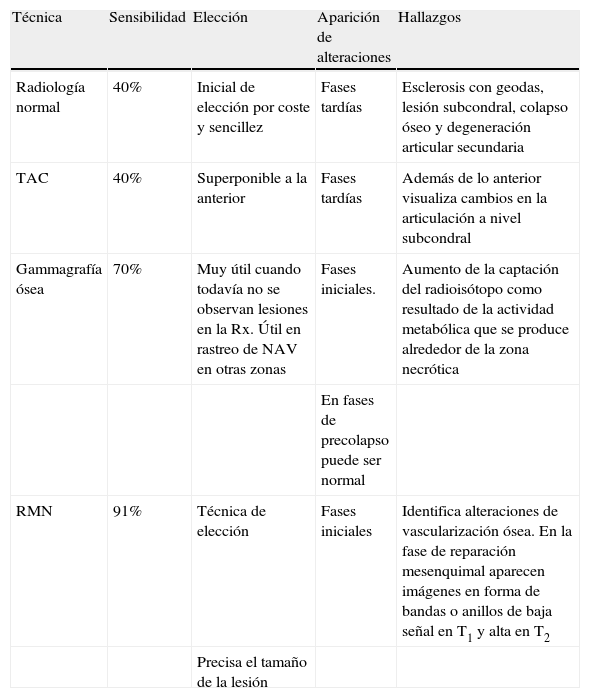
Diagnóstico
| Técnica | Sensibilidad | Elección | Aparición de alteraciones | Hallazgos |
| Radiología normal | 40% | Inicial de elección por coste y sencillez | Fases tardías | Esclerosis con geodas, lesión subcondral, colapso óseo y degeneración articular secundaria |
| TAC | 40% | Superponible a la anterior | Fases tardías | Además de lo anterior visualiza cambios en la articulación a nivel subcondral |
| Gammagrafía ósea | 70% | Muy útil cuando todavía no se observan lesiones en la Rx. Útil en rastreo de NAV en otras zonas | Fases iniciales. | Aumento de la captación del radioisótopo como resultado de la actividad metabólica que se produce alrededor de la zona necrótica |
| En fases de precolapso puede ser normal | ||||
| RMN | 91% | Técnica de elección | Fases iniciales | Identifica alteraciones de vascularización ósea. En la fase de reparación mesenquimal aparecen imágenes en forma de bandas o anillos de baja señal en T1 y alta en T2 |
| Precisa el tamaño de la lesión |
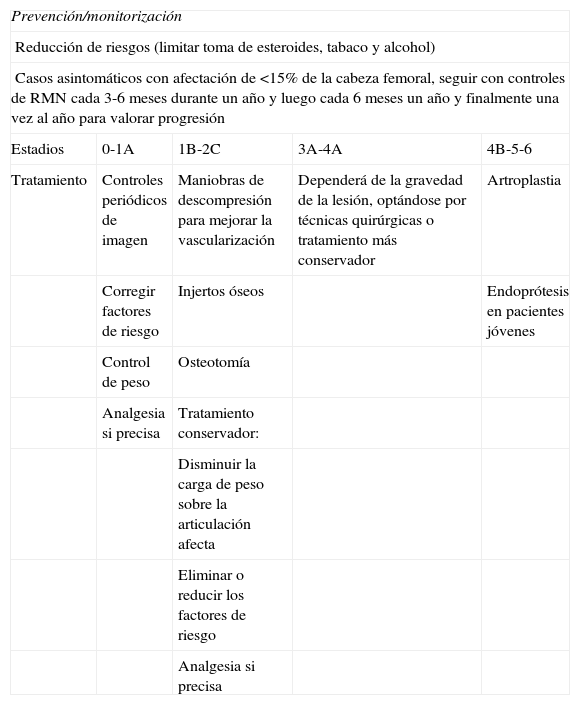
En estos momentos disponemos de recomendaciones de tratamiento basadas en las de la población no infectada y elaboradas por expertos a falta de más de estudios y/o ensayos clínicos dada la baja prevalencia de la patología20,21 (tabla 6).
Tratamiento
| Prevención/monitorización | ||||
| Reducción de riesgos (limitar toma de esteroides, tabaco y alcohol) | ||||
| Casos asintomáticos con afectación de <15% de la cabeza femoral, seguir con controles de RMN cada 3-6 meses durante un año y luego cada 6 meses un año y finalmente una vez al año para valorar progresión | ||||
| Estadios | 0-1A | 1B-2C | 3A-4A | 4B-5-6 |
| Tratamiento | Controles periódicos de imagen | Maniobras de descompresión para mejorar la vascularización | Dependerá de la gravedad de la lesión, optándose por técnicas quirúrgicas o tratamiento más conservador | Artroplastia |
| Corregir factores de riesgo | Injertos óseos | Endoprótesis en pacientes jóvenes | ||
| Control de peso | Osteotomía | |||
| Analgesia si precisa | Tratamiento conservador: | |||
| Disminuir la carga de peso sobre la articulación afecta | ||||
| Eliminar o reducir los factores de riesgo | ||||
| Analgesia si precisa | ||||
- •
La prevalencia de las infecciones osteoarticulares (IOA) en los pacientes con infección por el VIH es superior a la de la población general, oscilando entre el 0,15-33%22,23. En España es del 3,6%. Se describen con más frecuencia en los usuarios de drogas por vía parenteral. En la era TARV se ha comunicado un aumento en la incidencia, con aparición de nuevos síndromes por reconstitución inmune24,25.
- •
Cualquier microorganismo capaz de causar infecciones de partes blandas o diseminación hematógena puede causar una IOA en estos pacientes. En general los organismos piógenos predominan con linfocitos CD4 >250 células/mm3 y los patógenos oportunistas en estadios avanzados de inmunosupresión. El germen causal más frecuente es el S. aureus (30-80%). M. tuberculosis causa el 2-14%.
- •
La clínica es similar a la de los pacientes no infectados por el VIH. Se pueden presentar cuadros atípicos en función de la etiología, el grado de inmunosupresión o en el contexto de un síndrome inflamatorio de respuesta inmune 26.
- •
La artritis infecciosa (AI) es la IOA más prevalente. Puede afectarse cualquier articulación, con mayor frecuencia grandes articulaciones, y puede ser poliarticular. En pacientes hemofílicos afecta a las articulaciones con artropatía del hemofílico. En la AI tuberculosa con frecuencia hay afectación de partes blandas y osteomielitis (OM) concomitante. En relación con el consumo de heroína marrón se puede producir una AI por C. albicans con lesiones cutáneas y endoftalmitis.
- •
La OMtiende a aparecer con menos nivel de linfocitos CD4 que la AI. Es una infección más grave, con mortalidad de hasta el 20%. Con más frecuencia la localización es en columna vertebral, tibia, huesos de la muñeca, cabeza femoral y costillas, aunque cualquier hueso puede verse afectado. La espondilodiscitis constituye el 50-60% de las tuberculosis osteoarticulares.
- •
El diagnóstico no difiere del de la población general. Con cultivo del material drenado y del aspirado del líquido sinovial, hemocultivos, y biopsia ósea y sinovial se identifica la causa hasta en el 80% de los casos. Son polimicrobianas en un 15-30%.
- •
El tratamiento27 es similar al de la población no infectada. En la AI la presencia del VIH no parece modificar las características ni el curso clínico, y casi el 100% de los pacientes se recuperan con los antibióticos adecuados. Se precisa cirugía diagnóstica o terapéutica en el 40%. En la OM generalmente se requiere tratamiento médico y quirúrgico, resultando en la curación en el 90% de los casos. Se precisa cirugía en la OM de un hueso largo en estadios II, III o IV, y en estadio I si la fiebre persiste al tercer-cuarto día de tratamiento o se documenta la existencia de un absceso, y cuando existe déficit neurológico, inestabilidad, y probabilidad o existencia de deformidades.
- •
La afección tumoral ósea del paciente con infección por el VIH rara vez es primaria y en general forma parte de una enfermedad con expresión sistémica. El linfoma no Hodgkin y el sarcoma de Kaposi (SK) son los tumores que con mayor frecuencia afectan al sistema osteoarticular.
- •
En el SK28 la afectación ósea es rara y generalmente por extensión directa desde una lesión cutánea o ganglionar, o como lesiones metastásicas en el contexto de afectación multifocal con lesiones muco-cutáneas severas. Las localizaciones más frecuentes son la pelvis, la cadera, la columna y las costillas. Las lesiones vertebrales pueden producir compresión medular con secuelas neurológicas. La afectación articular es excepcional. La biopsia es necesaria para el diagnóstico definitivo. Se recomienda tratamiento con quimioterapia sistémica y TARV.
- •
En el linfoma29 la afectación ósea ocurre en el 20-30% de los casos de enfermedad sistémica. Las localizaciones más frecuentes son el cráneo, la pelvis, la columna y las extremidades inferiores, con frecuencia asociado a masa necrótica de partes blandas. Se ha descrito la afectación ósea primaria. Se requiere biopsia para el diagnóstico. El tratamiento incluye quimioterapia, radioterapia, ocasionalmente cirugía, y TARV.
- •
La frecuencia de mieloma es mayor que en la población general30. Los pacientes suelen ser más jóvenes, y el curso clínico es más agresivo. Se han descrito plasmocitomas solitarios.
Es la manifestación más frecuente, es de naturaleza reactiva y aparece según las series entre un 20 a 70%31. Suelen ser oligoarticulares y afectan a cualquier grupo articular, siendo las articulaciones más frecuentes rodillas, hombros y codos. Pueden aparecer en cualquier momento de la enfermedad pero inicialmente se describieron en enfermos más inmunodeprimidos; en estos se describió un síndrome doloroso intenso de corta duración (painful articular syndrom) que precisaba el uso de opiáceos en el 10% de los casos y que precedía a la muerte de los pacientes en los meses siguientes. El tratamiento es sintomático con analgésicos o antiinflamatorios no esteroideos.
Artritis asociada al VIHSuele ser aguda de inicio brusco, no erosiva, que puede aparecer como una poliartritis asimétrica de grandes articulaciones, rodillas y tobillos, con o sin fiebre con marcadores negativos (factor reumatoide, anticuerpos antinucleares y HLA B27) y asociada al propio VIH en líquidos y membranas sinoviales con positividad de la carga viral en líquido sinovial; puede aparecer hasta en un 30-35%31,32. Responde bien a antiinflamatorios no esteroideos (AINE), aunque también se puede emplear la hidroxicloroquina, sulfasalazina y dosis bajas de esteroides140 y suele durar unos 15 días, hasta 6 semanas.
Espondiloartropatias seronegativasArtritis reactivaAparece con un frecuencia 10 veces superior que en la población sana, entre 0,1 al 10% se asocia al HLA- B27 en un 80% de los casos, probablemente está relacionada tanto con el VIH como con otras infecciones concomitantes transmitidas por vía sexual o gastrointestinal. El curso clínico suele ser más grave en forma de oligoartritis asimétrica, suele afectar a miembros inferiores e interfalángicas de manos y pies, con o sin onicodistrofia, tienen menor frecuencia de sacroileitis y aparecen más manifestaciones extraarticulares (50%) como la balanitis circinada, uretritis, conjuntivitis, queratoderma blenorrágico y ulceras orales, siendo más rara la uveitis. Se considera que el líquido sinovial es inflamatorio cuando presenta entre 2.000 y 10.000 células.
El tratamiento frecuentemente es dificultoso y con escasa respuesta; de elección son los AINE especialmente la indometacina por su capacidad de inhibir la replicación viral in vitro; se ha utilizado también añadida la sulfasalazina, hidroxicloroquina y el metotrexate.
Artritis psoriásicaPuede aparecer en el 25-50%32 de los pacientes, suele ser poliarticular, de miembros inferiores, asimétrica y progresiva, y a menudo se acompaña de enteropatía, dactilitis y compromiso ungueal. La psoriasis suele exacerbarse y tiende a progresar conforme declina la inmunidad. Su gravedad se relaciona con la situación inmunológica del paciente; cuanto más inmunodeprimido mayor gravedad. El tratamiento consiste en metotrexate o salazopirina, acompañados de AINE. En los casos rebeldes se puede emplear terapia biológica (anti-TNF)32.
Espondiloartropatías indiferenciadasTiene una prevalencia de 180 por 100.000 habitantes. Hay pacientes que desarrollan enteritis, oligoartritis, dactilitis, conjuntivitis, uveítis anterior aguda recidivante a veces con sacroileitis entre el 2-11% de los pacientes infectados. El tratamiento suelen ser AINE, y si es extensa, sulfasalazina.
Enfermedades autoinmunesSíndrome secoEs conocido como diffuse infiltrating lymphocytic syndrome. Clínicamente cursa con xerostomía, xerostalmia y queratoconjuntivitis, puede afectar a glándulas salivares, pulmones, riñones y tracto gastrointestinal, suele cursar con adenopatías y a menudo es independiente de autoanticuerpos específicos anti-Ro y anti-La que sí están presentes en el síndrome de Sjögren clásico33. Responde muy bien al tratamiento corticoideo y desde el uso de la TARV ha disminuido notablemente su incidencia.
Otras manifestacionesLa vasculitis leucocitoclástica, la vasculitis necrotizante, la púrpura de Schölein-henoch, la vasculitis por hipersensibilidad, la panarteritis nodosa, la vasculitis inespecífica con infiltrado inflamatorio de neutrófilos y mononucleares, son muy raras en la infección por VIH y representan menos del 1% de todas las vasculitis.
La fibromialgia cumple criterios hasta en un 20%, suele acompañarse de síntomas depresivos y predomina más en varones.Algunos autores han sugerido que la presencia de enfermedades autoinmunes como el lupus eritematoso sistémico puede de alguna manera tener un efecto protector contra el VIH, no obstante se han descrito exacerbaciones del mismo con coinfecciones con virus B y C durante el tratamiento con interferón y ribavirina, ya que el interferón actúa como activador de este tipo de enfermedades.
TratamientoSe basa en el uso de antiinflamatorios y analgésicos. A veces es útil la infiltración de corticoides de las articulaciones afectadas.
La sulfasalazina se ha usado eficazmente en el tratamiento de las espondiloartropatías seronegativas. La hidroxicloroquina tiene un doble efecto antiinflamatorio y antiviral. También, y con control estricto, se puede usar metotrexate y corticoides. Etanercept, infliximab y adalimumab son anti-TNF biológicos que se han utilizado en los casos de espondiloartritis rebeldes al tratamiento clásico.
Alteraciones oseas en niños infectados por el VIHLas patologías óseas descritas hasta la actualidad en población pediátrica infectada por el VIH son fundamentalmente la osteonecrosis y la disminución de la masa ósea.
Clínica y factores de riesgoOsteonecrosis (necrosis aséptica o necrosis avascular)La localización más frecuente es a nivel de la cabeza del fémur y se denomina enfermedad de Perthes. La manifestación clínica habitual es el dolor y la impotencia funcional que se manifiesta como “cojera” ipsilateral. Un estudio multicéntrico observacional encontró que la frecuencia de la enfermedad de Perthes se multiplica por 9 en los niños infectados por el VIH, comparados con la población de niños sanos34. El uso de corticoides y la hiperlipemia podrían estar asociados a la patogenia de esta enfermedad35.
Disminución de la masa óseaPara el diagnóstico de osteopenia/osteopororsis en caso de los niños debe utilizarse el Z-score. Se considera osteopenia cuando Z está entre –1 y –2,5 DE y osteoporosis con una puntuación Z menor de –2,5 DE. La posición oficial de la ISCD, sin embargo, es que no debe utilizarse la clasificación de la OMS para los pacientes menores de 20 años, debiendo emplearse el término “densidad ósea baja para la edad cronológica” para los niños y adolescentes con un valor de Z-score inferior a –2 DE36.
Hay pocos datos sobre el papel de la TARV en la masa ósea (MO) en niños. En macacos jóvenes se ha descrito disminución de MO con el uso de tenofovir. En niños, los resultados son contradictorios37,38. Los marcadores de formación y de reabsorción ósea muestran también resultados muy variables en niños.
Diagnóstico y tratamientoOsteonecrosisLa prueba inicial para la valoración de un niño con sospecha de osteonecrosis es la radiografía de cadera. La realización de otras pruebas complementarias se decidirá de acuerdo con el traumatólogo infantil.
El tratamiento será similar al del niño sin infección por VIH, y deberá ser realizado por un traumatólogo infantil experto.
Osteoporosis- –
Medición de la densidad mineral ósea: el método de elección para valorar el contenido mineral óseo y la DMO es la DXA. La tomografía computarizada cuantitativa (TCC) es un método alternativo a la DXA, que realiza un estudio en tres dimensiones. Sin embargo no existen muchos datos de referencia en niños sanos y su principal desventaja es la alta dosis de radiación.
- –
Disminución en la masa ósea en niños infectados por el VIH: los primeros estudios indicaban disminución de la DMO en niños con infección por VIH39. Sin embargo, datos más recientes demuestran que los niños infectados tienen una DMO disminuida al medirla con DXA, pero no al hacerlo con la TCC, debido a que los niños con infección por el VIH tienen una talla inferior a la población normal40. Por lo tanto, es obligado corregir el resultado de la DXA no solo para la edad y sexo sino también por el peso, la talla y la edad ósea del niño.
El único ensayo terapéutico pediátrico publicado administró vitamina D y calcio a niños con valor Z a nivel lumbar inferior a –1 DE, sin encontrar mejoría respecto al grupo no tratado tras una media de 10 meses de seguimiento41. Las guías americanas de manejo del niño con infección por el VIH42 sugieren la posibilidad de tratamiento con bifosfonatos en niños con fracturas no traumáticas y con disminución de la MO, pero hay muy pocos datos al respecto43,44.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La Secretaría del Plan Nacional sobre el Sida y la junta directiva de GESIDA agradecen las aportaciones y opiniones de los doctores José Mª Miró, María Luisa Álvarez, María Coronado, Enrique Redondo y Pedro Ferrer, que han contribuido a mejorar la redacción y a enriquecer el contenido del documento.
Miembros del Panel de expertos de PNS y GESIDA
Todos los miembros de este Panel son autores del presente artículo.
Coordinadores
Rosa Polo (Secretaría del Plan Nacional sobre el Sida. Ministerio de Sanidad, Política Social e Igualdad. Madrid).
Eugenia Negredo (Fundación de la Lluita contra el Sida. Hospital Universitario Germans Trias i Pujol. Badalona. Barcelona).
Francisco Javier Pascua (Servicio de Medicina Interna. Hospital San Pedro de Alcántara. Complejo Hospitalario de Cáceres. Cáceres).
Redactores
Vicente Estrada (Servicio de Medicina Interna. Hospital Cínico San Carlos. Madrid).
Juan Flores (Servicio de Medicina Interna-Infecciosas. Hospital Arnau. Valencia).
M. José Galindo (Servicio de Medicina interna-Infecciosas. Hospital Clínico. Valencia).
Jesús Alberto García Vadillo (Servicio de Reumatología. Hospital Universitario de la Princesa. Madrid).
Félix Gutiérrez (Unidad de Enfermedades Infecciosas. Hospital Universitario de Elche. Universidad Miguel Hernandez, Alicante).
Jaime Locutura (Sección de Medicina Interna-Infecciosas. Hospital General Yagüe. Burgos).
Rebeca Longueira Suárez (Unidad de infecciosas-Medicina Interna. Complejo Hospitalario Universitario de Vigo).
Ana Mariño (Servicio de Medicina Interna-Infecciosas. Hospital Arquitecto Marcide. Área Sanitaria de Ferrol. La Coruña).
Antonio Ocampo (Unidad de Infecciosas- Medicina Interna. Complejo Hospitalario Universitario de Vigo. Vigo. Pontevedra);
Rosa Polo (Secretaría del Plan Nacional sobre el Sida. Ministerio de Sanidad, Política Social e Igualdad. Madrid).
Pablo Rojo (Sección de Inmunodeficiencias. Departamento de Pediatria. Hospital 12 de Octubre. Madrid).
Revisores
Laura Capa (Secretaría del Plan Nacional sobre el Sida. Ministerio de Sanidad y Política Social e Igualdad. Madrid).
Jesús Alberto García Vadillo (Servicio de Reumatología. Hospital Universitario de la Princesa. Madrid).
Inmaculada Gisbert (Secretaría del Plan. Nacional sobre el Sida. Ministerio de Sanidad, Política Social e Igualdad. Madrid).
Hernando Knobel (Servicio de Medicina Interna-Infecciosas. Hospital del Mar. Barcelona).
María José Mellado (Servicio de Pediatría. Hospital Carlos III. Madrid).
Eugenia Negredo (Fundación de la Lluita contra el Sida. Hospital Universitario Germans Trias i Pujol. Badalona. Barcelona).
Francisco Javier Pascua (Servicio de Medicina Interna. Hospital San Pedro de Alcántara. Complejo Hospitalario de Cáceres. Cáceres).
Jesús Sanz (Servicio de Medicina Interna-Infecciosas. Hospital Universitario de la Princesa. Madrid).
Este documento está avalado por el Consejo Asesor del Plan Nacional sobre el Sida.