Las guías GESIDA proponen pautas preferentes de inicio de tratamiento antirretroviral en pacientes infectados por el VIH. El objetivo de este análisis es comparar los costes y la eficacia de darunavir/r QD frente a otros inhibidores de la proteasa (IP) potenciados recomendados por GESIDA en pacientes naïve.
MétodosMediante un modelo de coste-eficacia se compararon los IP/r recomendados como pautas preferentes o alternativas en pacientes naïve, junto con un tratamiento de base con 2 ITIAN. La eficacia se midió mediante la respuesta virológica (carga viral <50 copias/ml) a las 48 semanas ajustada por los niveles basales de carga viral y recuentos de CD4. Para generar la «frontera de eficiencia» y ratios de coste-eficacia se utilizaron los costes españoles y las tasas de eficacia a las 48 semanas.
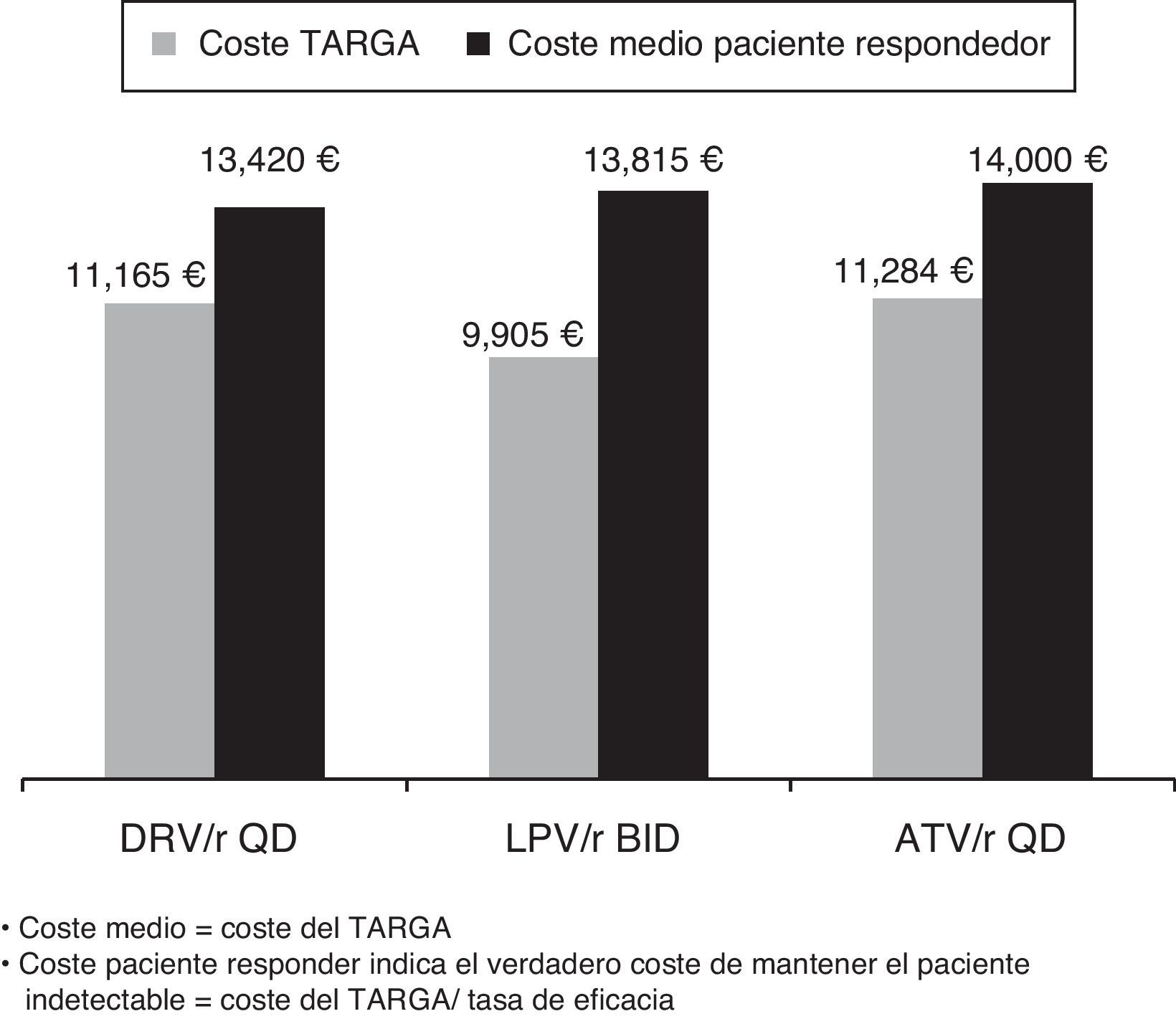
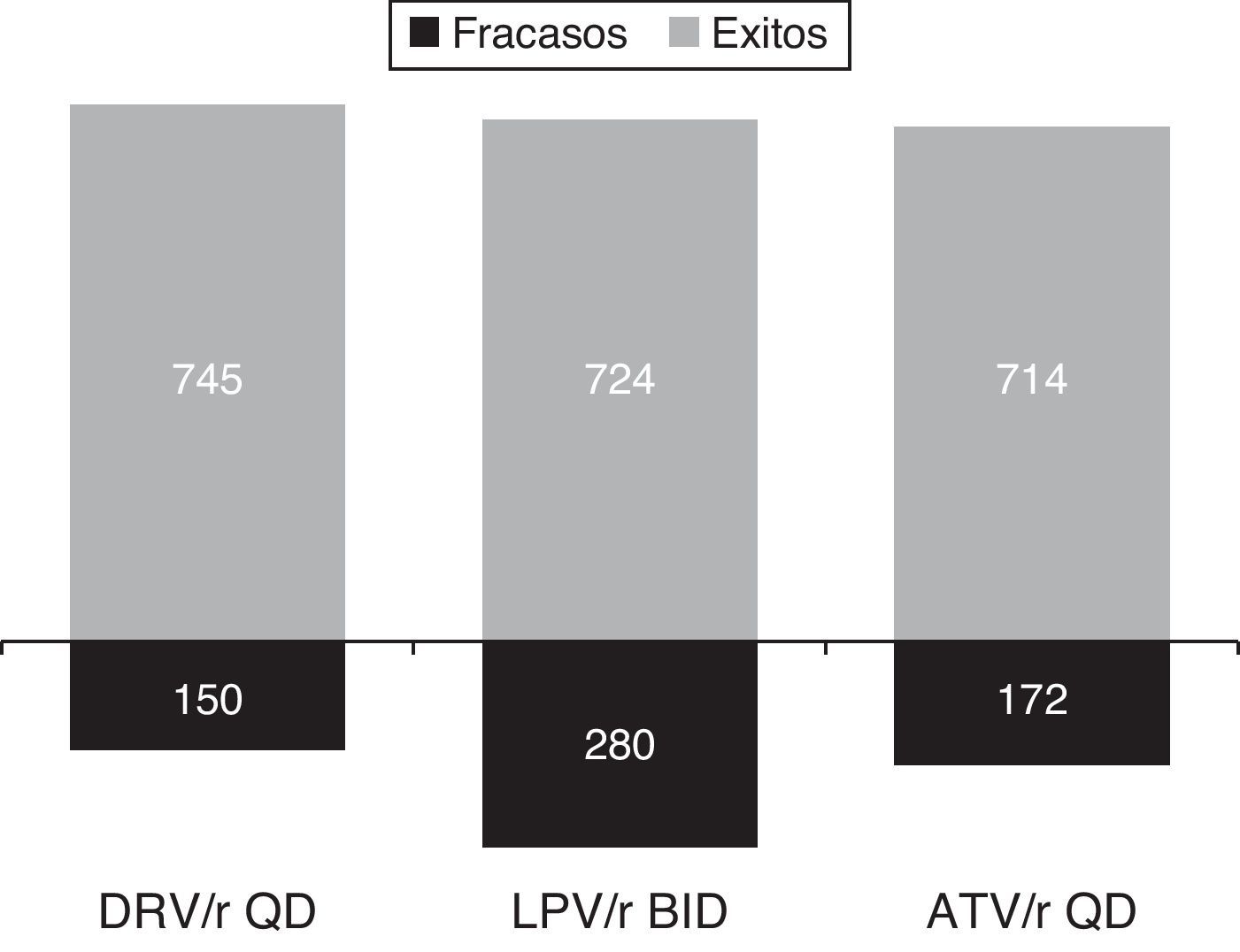
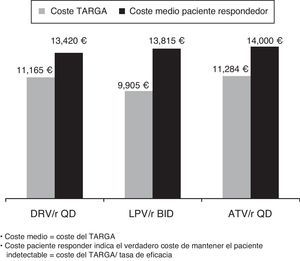
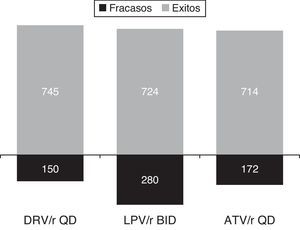
ResultadosEl modelo estimó que el inicio del tratamiento en naïve con darunavir/r QD se mostró como la opción preferente basada en un IP/r más coste-eficaz. El coste medio del TARGA por paciente respondedor era menor para darunavir/r (13.420€) que para atazanavir/r (14.000€) o lopinavir/r (13.815€). Se estimó que darunavir/r sería el IP preferente más eficiente, mientras que atazanavir/r QD y lopinavir/r BID resultarían opciones «dominadas», situándose fuera de la frontera de la eficiencia. Partiendo de un presupuesto fijo de 10 millones de €, se estimó que la pauta de inicio con darunavir/r QD conseguiría un mayor número de pacientes respondedores (745) que con atazanavir/r QD (714) o lopinavir/r BID (724). Al mismo tiempo, darunavir/r QD reduciría el número de pacientes que fracasarían al tratamiento (150) en comparación con atazanavir/r QD (172) o lopinavir/r (286).
ConclusionesSegún este modelo, darunavir/r QD es el IP/r preferente más coste-efectivo para el tratamiento de la infección por el VIH-1 basado en IP/r en pacientes naïve en España.
GESIDA (AIDS Study Group) has proposed preferred regimens of antiretroviral treatment as initial therapy in HIV infected patients. The objective of this analysis is to compare the costs and effectiveness of darunavir/r QD and other ritonavir-boosted (/r) protease inhibitors (PIs) currently recommended in GESIDA guidelines for treatment-naïve patients.
MethodsA cost-efficacy model compared the boosted PIs recommended as preferred or alternative treatment choices, each used with a nucleoside reverse transcriptase inhibitor backbone. Efficacy was measured by 48-week virological response (viral load < 50 copies/mL) adjusted by baseline viral load and CD4 cell count. To generate efficiency frontiers and cost-efficacy ratios, one-year antiretroviral therapy costs in Spain, and 48-week efficacy values were used.
ResultsThe model estimated that starting treatment with darunavir/r QD was the most cost-effective choice compared with the other preferred PI/r based therapies. The average cost per patient with a virological response was lower for darunavir/r QD (13,420€) than for atazanavir/r QD (14,000€), or lopinavir/r BID (13,815€). Among the preferred PI/r-based therapies, darunavir/r QD also was estimated to be the most efficient option for treatment-naïve patients. Atazanavir/r QD and lopinavir/r BID were found to be «dominated» by darunavir/r) and, consequently, were outside the efficiency frontier of PI/r-based first-line treatment. Given a fixed budget of 10 million euros for PI/r-based first-line therapy, the model estimated that darunavir/r QD would yield more responders (745) than atazanavir/r QD (714), or lopinavir/r BID (724). At the same time, darunavir/r QD would reduce the number of individuals failing treatment (150) compared with atazanavir/r QD (172) and lopinavir/r BID (286).
ConclusionsIn this model, darunavir/r QD was found to be the most cost-effective choice, among the preferred PI/r-based therapies recommended in the Spanish guidelines for treatment-naïve patients.
El coste del tratamiento de la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) ha venido creciendo debido a que la prevalencia y la supervivencia de los pacientes infectados por el VIH sigue aumentando y, por tanto, requieren pautas de tratamiento antirretroviral de gran actividad (TARGA) durante toda su vida, repercutiendo en los costes globales del tratamiento1–5. Por consiguiente, es importante que los profesionales sanitarios tengan en consideración no solo la eficacia y la seguridad de los tratamientos existentes para el VIH-1 sino, también, el uso eficiente de los recursos a largo plazo.
Este enfoque adquiere especial relevancia a la hora de iniciar un tratamiento antirretroviral en pacientes naïve, al representar la mejor oportunidad para mantener de forma sostenida la carga viral plasmática indetectable, ya sea por la menor probabilidad de aparición de fracasos con resistencias o por una mejor adherencia a los fármacos con buen perfil de tolerabilidad y posología simplificada6–10.
Además, el grado y la duración del éxito virológico del primer tratamiento de un paciente naïve aplaza la necesidad de pautas más costosas en líneas posteriores de tratamiento5,11.
Los análisis de coste-eficacia son uno de los pilares de la evaluación económica y determinan cuánto cuesta realmente conseguir respuesta virológica al tratamiento. En esta línea, el ratio de coste-eficacia incremental (en inglés ICER) expresa el grado de esfuerzo económico que se debe realizar para conseguir una unidad de eficacia adicional. Este es un paso importante en las evaluaciones de los medicamentos, puesto que ya no se debería hablar de «medicamentos caros o baratos», sino coste-efectivos y cuál sería el coste-eficacia incremental cuando comparamos diferentes alternativas terapéuticas.
El objetivo del presente estudio fue realizar un análisis de coste-eficacia de las diferentes pautas de inicio en pacientes naïve que contienen un IP/r atendiendo a su disponibilidad y precio en España.
MétodosVisión general del modeloSe desarrolló un modelo de coste-eficacia para comparar los 5 IP/r recomendados actualmente para el tratamiento de la infección por el VIH-1 en pacientes naïve en España como opciones preferentes o alternativas. Las opciones preferentes de tratamiento basadas en un IP/r son: darunavir/r 800/100mg QD, atazanavir/r 300/100mg QD y lopinavir/r 800/200mg dosis diaria total (400/100mg BID). Entre las opciones alternativas figuran: saquinavir/r 1.000/100mg BID y fosamprenavir/r 700/100 BID12. En las guías GESIDA 2012 ya no se hace la diferenciación entre pautas preferentes y alternativas, figurando únicamente las pautas «recomendadas» (anteriormente denominadas preferentes) a las cuales daremos especial relevancia en este análisis.
Los resultados de este modelo están basados en la combinación de un IP/r con 2 inhibidores de la transcriptasa inversa análogos a nucleósidos (ITIAN). En el análisis de referencia, el tratamiento de base con ITIAN consistió en tenofovir más emtricitabina 300/200mg QD, o tenofovir más lamivudina 300/300mg QD13-24.
En nuestro análisis solo se incluyeron los costes de adquisición de los antirretrovirales, ya que es lo que más directamente incide sobre el presupuesto de farmacia y del hospital. Para cada pauta analizada se calculó, a partir de un presupuesto fijo de 10 millones de €, el número de éxitos y fracasos a las 48 semanas de tratamiento.
En una situación de crisis económica y escasez de recursos, se pone de manifiesto la necesidad de reducir al máximo el número de pacientes que fracasan al tratamiento y con ello el impacto presupuestario del coste del tratamiento de rescate y seguimiento de esos pacientes (mayor número de revisiones, consultas sin cita, análisis de control, tests de resistencias...). Modelos de evaluación económica como este pueden ayudar a los profesionales y gestores sanitarios a objetivar la toma de decisiones en el manejo de la infección por VIH.
EficaciaA falta de más datos procedentes de ensayos clínicos comparativos directos entre los IP/r incluidos en este análisis, los datos de eficacia clínica del modelo se basaron en los resultados de una revisión sistemática y un metaanálisis de ensayos clínicos recientemente publicado por Hill et al., que incluyó más de 5.000 pacientes y 12 ensayos clínicos pivotales en pacientes naïve, cuyo resultado tiene un nivel de evidencia 1A (estudios aleatorizados y controlados)25. Se eligió como criterio de valoración de la eficacia para el metaanálisis la respuesta virológica (es decir, una carga viral <50 copias/ml) a las 48 semanas12,26,27.
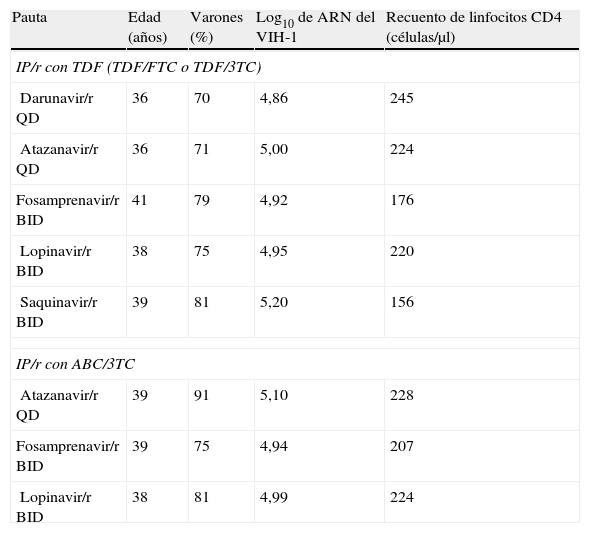
Las características basales de los pacientes agrupados según el IP potenciado y el tratamiento con 2 ITIAN se resumen en la tabla 1.
Características basales de los participantes en los ensayos clínicos incluidos en el metaanálisis, según el IP potenciado y el tratamiento de base con ITIAN
| Pauta | Edad (años) | Varones (%) | Log10 de ARN del VIH-1 | Recuento de linfocitos CD4 (células/μl) |
| IP/r con TDF (TDF/FTC o TDF/3TC) | ||||
| Darunavir/r QD | 36 | 70 | 4,86 | 245 |
| Atazanavir/r QD | 36 | 71 | 5,00 | 224 |
| Fosamprenavir/r BID | 41 | 79 | 4,92 | 176 |
| Lopinavir/r BID | 38 | 75 | 4,95 | 220 |
| Saquinavir/r BID | 39 | 81 | 5,20 | 156 |
| IP/r con ABC/3TC | ||||
| Atazanavir/r QD | 39 | 91 | 5,10 | 228 |
| Fosamprenavir/r BID | 39 | 75 | 4,94 | 207 |
| Lopinavir/r BID | 38 | 81 | 4,99 | 224 |
3TC: lamivudina; ABC: abacavir; ARN: ácido ribonucleico; FTC: emtricitabina; IP: inhibidor de la proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de nucleósido; /r: potenciado con ritonavir; TDF: tenofovir disoproxil fumarato; VIH-1: virus de la inmunodeficiencia humana de tipo 1.
Fuente: Brogan et al.34.
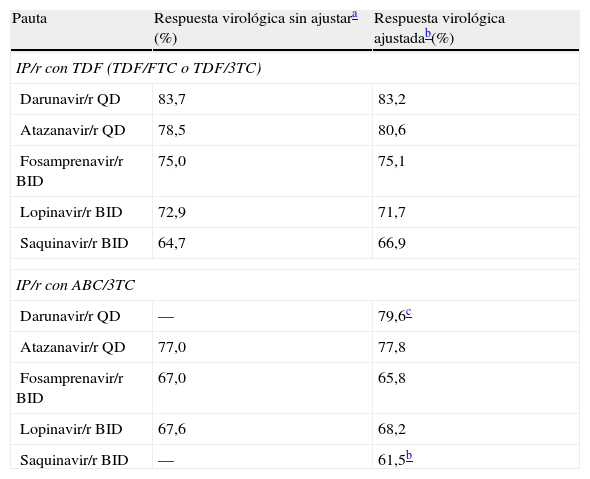
Las estimaciones de eficacia virológica fueron ajustadas por las características basales para tener en cuenta las diferencias entre las poblaciones de los diversos ensayos clínicos. Entre las diferentes variables testadas de las características basales, solo la carga viral basal y el recuento de linfocitos CD4 se mostraron estadísticamente significativos y por ello fueron retenidos en nuestro modelo de metarregresión. La eficacia virológica de darunavir/r QD y de saquinavir/r en combinación con ABC/3TC no se pudo obtener a partir de los resultados de los ensayos clínicos; por tanto se calcularon los valores a partir del modelo de regresión desarrollado para el metaanálisis25 (tabla 2).
Eficacia virológica, según el IP/r y el tratamiento de base con ITIAN
| Pauta | Respuesta virológica sin ajustara (%) | Respuesta virológica ajustadab(%) |
| IP/r con TDF (TDF/FTC o TDF/3TC) | ||
| Darunavir/r QD | 83,7 | 83,2 |
| Atazanavir/r QD | 78,5 | 80,6 |
| Fosamprenavir/r BID | 75,0 | 75,1 |
| Lopinavir/r BID | 72,9 | 71,7 |
| Saquinavir/r BID | 64,7 | 66,9 |
| IP/r con ABC/3TC | ||
| Darunavir/r QD | — | 79,6c |
| Atazanavir/r QD | 77,0 | 77,8 |
| Fosamprenavir/r BID | 67,0 | 65,8 |
| Lopinavir/r BID | 67,6 | 68,2 |
| Saquinavir/r BID | — | 61,5b |
3TC: lamivudina; ABC: abacavir; FTC: emtricitabina; IP: inhibidor de la proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de nucleósido; /r: potenciado con ritonavir; TDF: tenofovir.
Fuente: Brogan et al.34.
Para construir la frontera de eficiencia del TARGA basado en un IP/r para pacientes naïve se utilizaron los costes anuales de los antirretrovirales y la eficacia virológica ajustada por la carga viral basal y recuento de lifoncitos CD4 para cada pauta de comparación derivada de dicho metaanálisis25.
La frontera de eficiencia pone en evidencia el «trade-off» entre valor (eficacia) y costes para un determinado objetivo terapéutico. Los comparadores están ordenados por orden creciente de costes, y se excluye de la frontera de eficiencia cualquier pauta que fuera igual o menos eficaz a mayor coste que otra alternativa existente. A lo largo de la frontera de eficiencia, las pautas de tratamiento son progresivamente más eficaces y más costosas. En realidad, muchas veces, algunas terapias situadas en el extremo izquierdo de la frontera podrían no ser evaluadas, puesto que son muy inferiores en términos de valor (eficacia) pero sirven para poder construir la frontera. El área situada por debajo de la frontera de eficiencia representa las pautas que son «dominadas» por las demás pautas existentes, mientras que el área situada por encima de la misma representaría las posibles nuevas pautas que serían superiores a las existentes («pautas dominantes»).
Esta metodología ha ganado popularidad recientemente, sobre todo en Alemania28 que la utiliza como elemento clave para la evaluación económica de los medicamentos y fijación de precios29. Se trata de una extensión de los conceptos incrementales empleados habitualmente en los análisis tradicionales de coste-eficacia, al indicar el coste incremental por paciente adicional con respuesta virológica a las 48 semanas a lo largo de la frontera de eficiencia30,31.
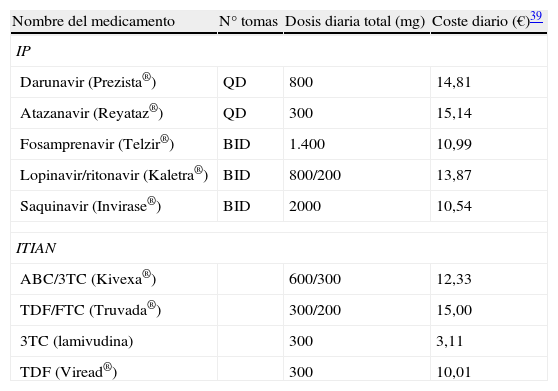
Costes de los antirretroviralesLos costes anuales de adquisición de los antirretrovirales se calcularon teniendo en cuenta los precios españoles en € de marzo de2012, y se basaron en las dosis de los IP/r y de los ITIAN utilizados en cada uno de los ensayos clínicos. Los costes unitarios de todos los fármacos se basaron en los costes de adquisición por las farmacias hospitalarias (es decir, PVL IVA)32. En la tabla 3 se presenta la dosis diaria y el coste diario de cada antirretroviral incluido en el modelo.
Costes de los antirretrovirales (PVL IVA)
| Nombre del medicamento | N° tomas | Dosis diaria total (mg) | Coste diario (€)39 |
| IP | |||
| Darunavir (Prezista®) | QD | 800 | 14,81 |
| Atazanavir (Reyataz®) | QD | 300 | 15,14 |
| Fosamprenavir (Telzir®) | BID | 1.400 | 10,99 |
| Lopinavir/ritonavir (Kaletra®) | BID | 800/200 | 13,87 |
| Saquinavir (Invirase®) | BID | 2000 | 10,54 |
| ITIAN | |||
| ABC/3TC (Kivexa®) | 600/300 | 12,33 | |
| TDF/FTC (Truvada®) | 300/200 | 15,00 | |
| 3TC (lamivudina) | 300 | 3,11 | |
| TDF (Viread®) | 300 | 10,01 | |
3TC: lamivudina, ABC: abacavir; FTC: emtricitabina; IP: inhibidor de la proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de nucleósido; TDF: tenofovir.
Ritonavir como potenciador (Norvir®): dosis diaria total 100 o 200mg; coste diario: 0,78 € por 100mg.
Fuente: base de datos Nomenclator Integra, Marzo de 2012.
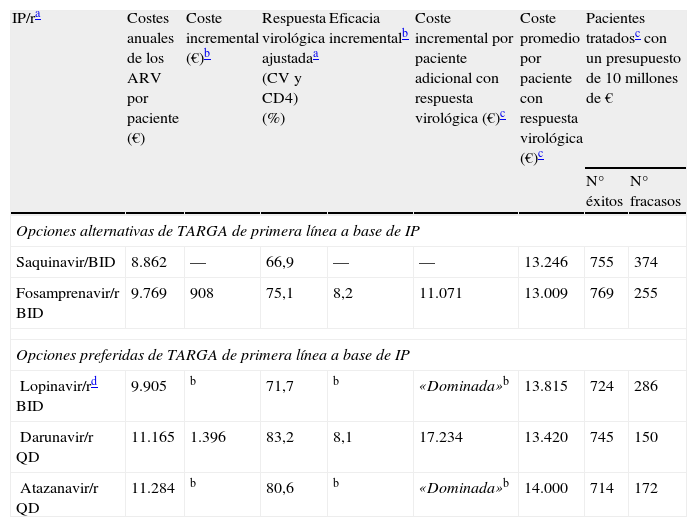
Los resultados del modelo mostraron cómo, entre las pautas preferentes recomendadas por el grupo GESIDA para el TARGA basado en un IP/r para pacientes naïve, darunavir/r QD tendría el menor coste medio por paciente respondedor (13.420€) en comparación con lopinavir/r BID (13.815€) o atazanavir/r QD (14.000€) (fig. 1).
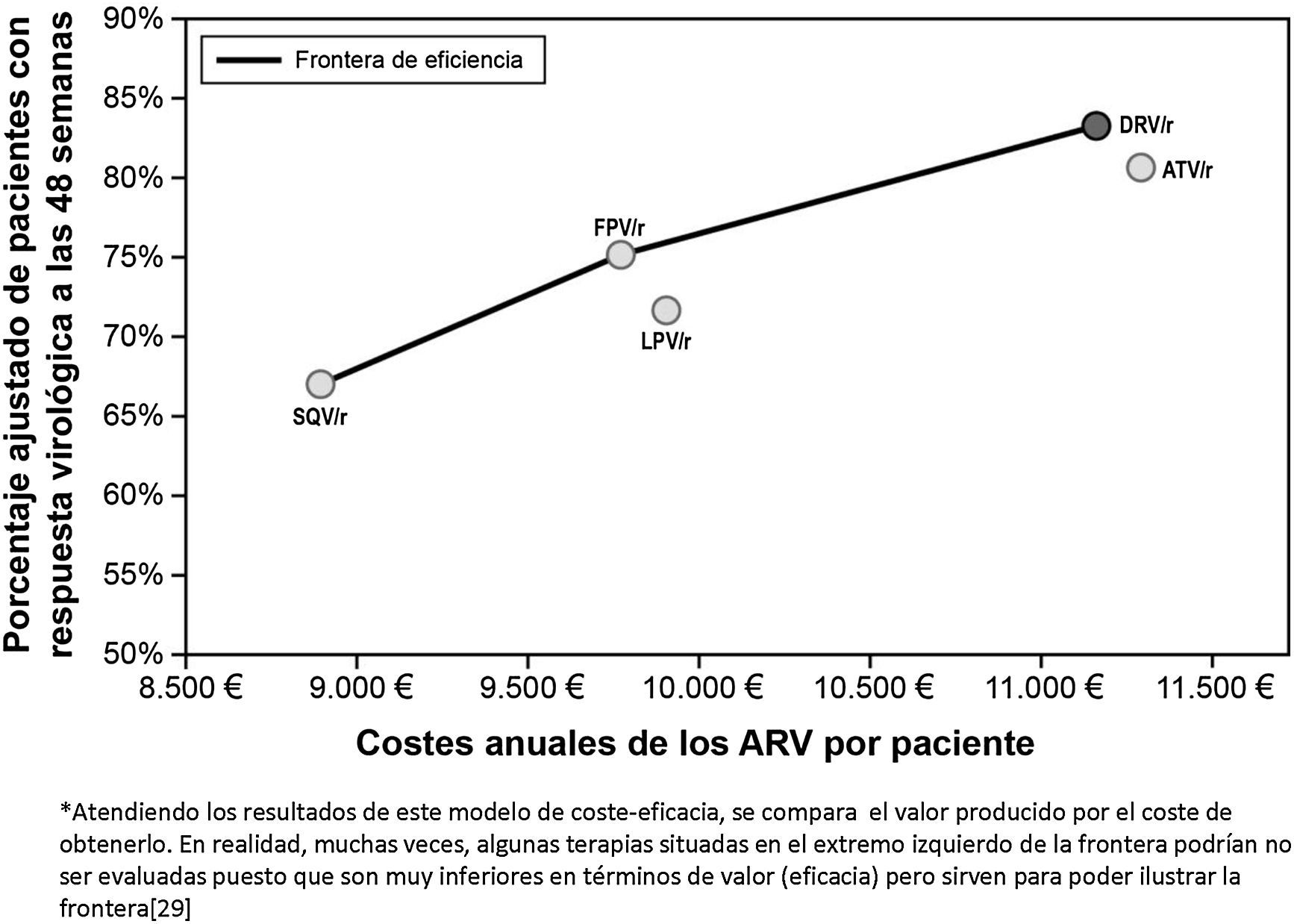
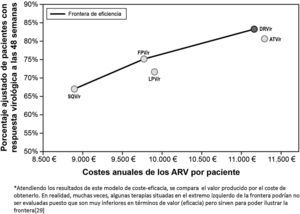
La representación grafica del análisis de coste-eficacia se puede hacer mediante la construcción de la frontera de eficiencia entre las diferentes alternativas de tratamiento analizadas. El punto de partida se construye a partir de saquinavir/r con un coste medio anual del TARGA de 8.862€ con una eficacia del 66,9%. La siguiente pauta a lo largo de la frontera de eficiencia es la de fosamprenavir/r con un coste medio anual del TARGA de 9.769€ con una eficacia del 75,1%. Lopinavir/r, a su vez, no se situaría en la frontera de la eficiencia ya que tendría una eficacia (71,7%) inferior a fosamprenavir/r con un coste medio anual del TARGA de 9.905€). En este sentido, lopinavir/r sería considerado una pauta «dominada» (más cara y menos eficaz)12.
El TARGA con darunavir/r QD, cuyo coste medio anual es de 11.165€ y cuya eficacia es del 83,2%, mostró un incremento absoluto de eficacia del 8,1% respecto a la pauta de fosamprenavir/r BID (alternativa anterior en la frontera de eficiencia), con un coste medio adicional anual de 1.396€ por paciente tratado, resultando en un ratio de coste-eficacia incremental de 17.234€ por cada paciente adicional con respuesta virológica a las 48 semanas. Cabe destacar que el coste por paciente responder es solo una parte del análisis, por lo cual es necesario analizar qué pasaría con los pacientes que no responden al tratamiento pautado. En este sentido, en una situación de crisis económica y escasez de recursos, se pone de manifiesto la necesidad de no solo mirar el número de pacientes que respondan al tratamiento sino también reducir al máximo el número de pacientes que fracasan y con ello el impacto presupuestario del coste del tratamiento de rescate y seguimiento de esos pacientes – tema que se abordará más adelante en este artículo. La pauta con atazanavir/r QD, por su parte, sería más cara (11.284€) y menos eficaz (80,6%) que con darunavir/r 800/100mg QD, situándose por debajo de la frontera de eficiencia (opción «dominada»), asociándose a un coste incremental por paciente adicional con respuesta virológica a las 48 semanas superior a darunavir/r (27.539€ vs. 17.234€), cuando ambos se compararon con la pauta anterior en la frontera de eficiencia (tabla 4).
Resultados de los análisis de coste-eficacia a las 48 semanas del TARGA basado en IP/r más tratamientos de base con ITIAN que incluyera TDF
| IP/ra | Costes anuales de los ARV por paciente (€) | Coste incremental (€)b | Respuesta virológica ajustadaa (CV y CD4) (%) | Eficacia incrementalb | Coste incremental por paciente adicional con respuesta virológica (€)c | Coste promedio por paciente con respuesta virológica (€)c | Pacientes tratadosc con un presupuesto de 10 millones de € | |
| N° éxitos | N° fracasos | |||||||
| Opciones alternativas de TARGA de primera línea a base de IP | ||||||||
| Saquinavir/BID | 8.862 | — | 66,9 | — | — | 13.246 | 755 | 374 |
| Fosamprenavir/r BID | 9.769 | 908 | 75,1 | 8,2 | 11.071 | 13.009 | 769 | 255 |
| Opciones preferidas de TARGA de primera línea a base de IP | ||||||||
| Lopinavir/rd BID | 9.905 | b | 71,7 | b | «Dominada»b | 13.815 | 724 | 286 |
| Darunavir/r QD | 11.165 | 1.396 | 83,2 | 8,1 | 17.234 | 13.420 | 745 | 150 |
| Atazanavir/r QD | 11.284 | b | 80,6 | b | «Dominada»b | 14.000 | 714 | 172 |
ARV: antirretroviral; CV: carga viral; IP: inhibidor de la proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de nucleosido; /r: potenciado con ritonavir; TARGA: tratamiento antirretroviral de gran actividad; TDF: tenofovir.
«Dominada» alude a las pautas que son más costosas y menos eficaces que otras existentes. El ratio de coste-eficacia incremental solo se calculó para las pautas no dominadas. Por consiguiente, en esta tabla se omitieron el coste incremental y la eficacia incremental de cualquier pauta dominada.
La respuesta virológica y el éxito del tratamiento se definieron como la obtención de CV <50 copias/ml a las 48 semanas de tratamiento. La respuesta virológica se ajustó respecto a los valores basales de carga viral y del recuento de linfocitos CD4 para tener en cuenta las diferencias en las poblaciones estudiadas en los ensayos clínicos.
La pauta LPV/r no ha sido respaldada como preferente por la totalidad del panel de las guías GESIDA/PNS20.
Si analizamos únicamente las pautas preferentes según el grupo GESIDA, basadas en un IP/r, darunavir/r QD sería considerado como el único IP que se situaría en la frontera de la eficiencia. O sea, sería el IP preferente más eficiente en el tratamiento de la infección por el VIH en pacientes naïve (fig. 2)
Si partiéramos de un presupuesto anual fijo de 10 millones de € para el TARGA en pacientes naïve basado en un IP/r, y teniendo en cuenta solo el coste del TARGA y la eficacia en ensayos clínicos, el número de pacientes que podría ser tratado con éxito durante un año sería de 769 con la pauta alternativa de fosamprenavir/r BID, seguida por la pauta de darunavir/r QD, con 745 tratados con éxito. Por otro lado, el número de individuos que fracasarían al tratamiento (% tasa de fracaso) se vería minimizado por una pauta como la de darunavir/r QD, con apenas 150 pacientes (17%), en comparación con los 255 fracasos (25%) observados con fosamprenavir/r, 286 fracasos (28%) con lopinavir/r y 172 fracasos (19%) con atazanavir/r (tabla 4).
Según el último documento de consenso de GESIDA, se excluyen de las pautas de inicio recomendadas los tratamientos alternativos, ya que el panel considera que todos los pacientes deben ser tratables con las pauta recomendadas, o anteriormente llamadas preferentes. Esta actualización refuerza los resultados de este análisis, posicionado a darunavir/r como el único IP/r recomendado situado en la frontera de eficiencia para el tratamiento de la infección por el VIH-1 en pacientes naïve. Darunavir/r QD se mostró como el IP/r recomendado más coste-efectivo que, a su vez, maximizaría el número de pacientes con respuesta virológica (carga viral <50 copias/ml) a las 48 semanas y minimizaría el número de fracasos, garantizando una mejor utilización de los recursos disponibles (fig. 3).
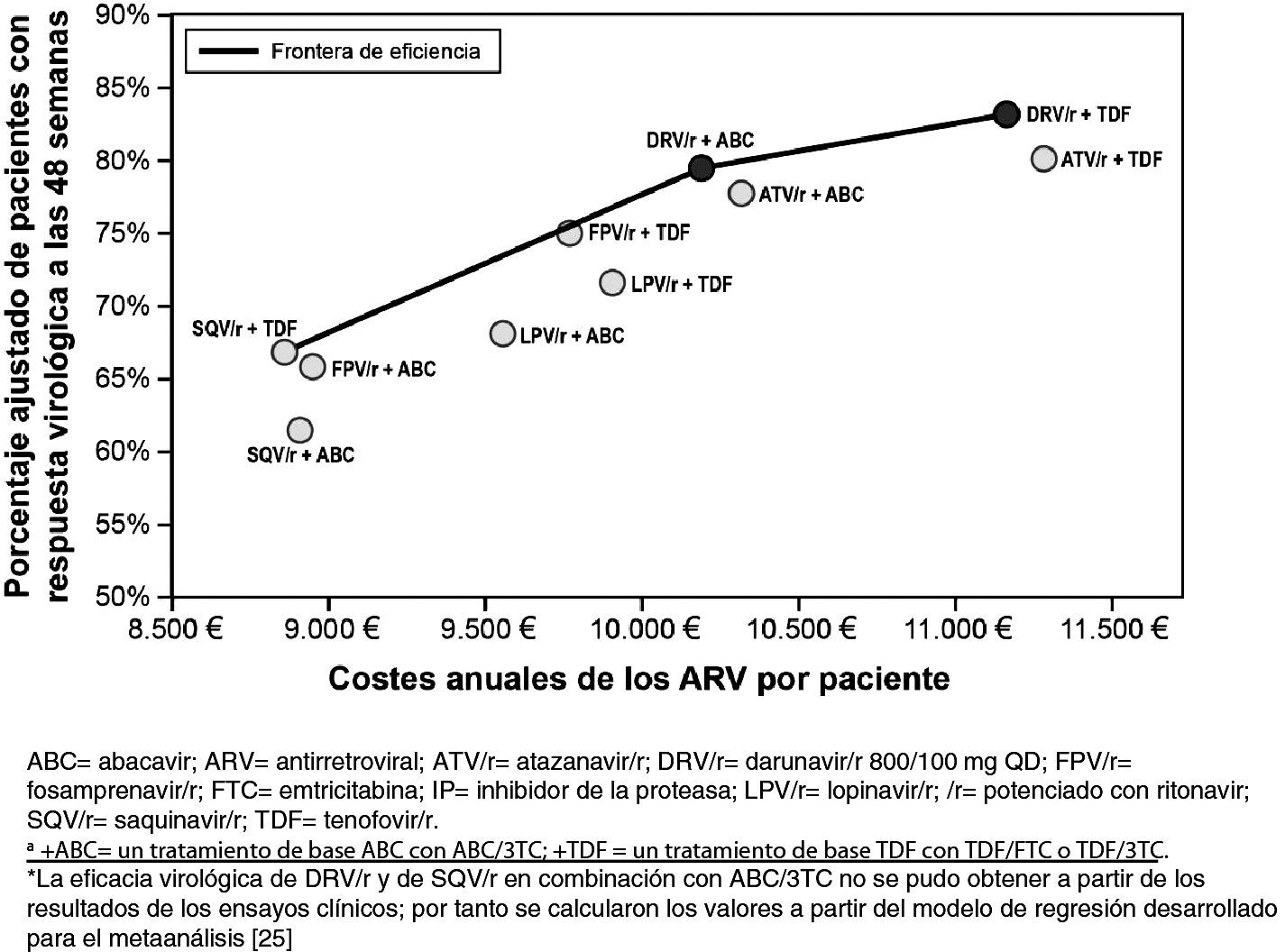
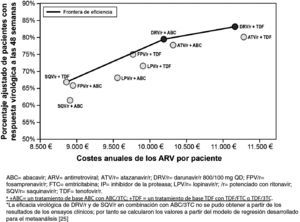
Paralelamente, se ha realizado un análisis de variabilidad para corroborar la robustez de los resultados y la fiabilidad del modelo utilizado en este estudio, en un escenario de reducción de precios del 7,5% para tener en cuenta el cambio legislativo en España33. Los resultados del análisis de variabilidad reforzaron las conclusiones del análisis anterior, ya que los mismos regímenes de tratamiento se mantuvieron en la frontera de eficiencia. Se llevó a cabo un segundo análisis de variabilidad para testar la consistencia de los resultados en función del tratamiento de base empleado, que incluyera tenofovir o abacavir. Este análisis puede resultar de utilidad en el caso de los médicos para los que la elección del IP potenciado y de la pareja de ITIAN sea interdependiente (fig. 4). Darunavir/r QD ha demostrado ser la pauta preferente, según las guías GESIDA, basada en un IP/r más coste-eficaz independiente del tratamiento de base elegido. El coste del tratamiento antirretroviral anual por individuo con respuesta virológica a la semana 48 fue de 13.420€ para darunavir/r QD con un tratamiento de base que incluyera tenofovir y 12.800€ con uno que incluyera abacavir. Estos costes fueron inferiores a otras terapias combinadas que incluyeran lopinavir (13.815€ (con tenofovir) y 14.018€ (con abacavir) o atazanavir/r (14.000€ [con tenofovir] y 13.249€ [con abacavir]).
DiscusiónNormalmente, cuando se introducen nuevos tratamientos los costes marginales para obtener beneficios adicionales tienden a elevarse28. Sin embargo, en este caso, la introducción de darunavir/r QD en el arsenal terapéutico para tratar a los pacientes naïve infectados por el VIH-1 ofreció una mayor eficacia por menor coste («pauta dominante») que atazanavir/r QD («pauta dominada»), modificando la pendiente de la frontera de eficiencia. Este cambio en la trayectoria de la frontera de eficiencia indica que el TARGA con darunavir/r QD representa una opción eficiente de tratamiento, especialmente entre las pautas recomendadas por las guías GESIDA basadas en un IP/r de inicio de tratamiento en pacientes naïve28.
Las conclusiones de este estudio fueron coherentes con las de estudios semejantes realizados en EE.UU. y Alemania, donde, independiente de la diferencia de precios y mercados con España, también se observó la mayor coste-eficacia de darunavir/r QD en comparación con atazanavir/r QD y lopinavir/r BID en pacientes naïve34,35. Una de las posibles limitaciones de nuestro análisis es que está basado en resultados de combinaciones no directas entre los diferentes IP/r aquí analizados. Pero ante la ausencia de ensayos comparativos directos, la utilización de metaanálisis es considerada una metodología válida y de práctica habitual en análisis farmacoeconómicos. Otra limitación es que las estimaciones de costes aplicadas en nuestro modelo se basaron solo en los costes de los antirretrovirales y no se ha tenido en cuenta la repercusión en costes de las diferencias de eficacia y tolerabilidad de los diversos IP/r incluidos en este análisis como, por ejemplo, la repercusión en términos de costes y presión asistencial de un mayor número de revisiones, consultas sin cita previa, análisis de control, tests de resistencias, manejo de efectos secundarios entre otros. Sin embargo, el objetivo de nuestro estudio era evaluar únicamente el coste por respondedor de los diferentes IP/r en el tratamiento de la infección por el VIH-1 en pacientes naïve en España. Darunavir/ QD ha mostrado un perfil de tolerabilidad gastrointestinal que podría ser similar al de atazanavir/r QD, y un perfil lipídico que estaría en línea con el de saquinavir/r BID y atazanavir/r QD; los 3 tendrían mejores perfiles de seguridad y tolerabilidad que lopinavir/r BID y fosamprenavir/r BID14–16,18,36–38. Por consiguiente, la inclusión de los costes debidos a acontecimientos adversos puede influir en la comparación de costes, especialmente en el caso de darunavir/r QD y de atazanavir/r QD en comparación con fosamprenavir/r BID y lopinavir/r BID.El modelo tampoco tiene en cuenta el impacto potencial de mayores tasas de fracaso de las pautas de inicio en pacientes naïve sobre futuras opciones terapéuticas, debido al horizonte temporal de un año. La omisión de líneas de tratamiento posteriores probablemente dio lugar a una subestimación del beneficio asociado a las pautas con mayores niveles de eficacia virológica y tasas más bajas de abandono a las 48 semanas, como son las que contienen darunavir/r QD y atazanavir/r QD14–16,18,25,38. Un análisis con un horizonte temporal más prolongado permitiría determinar los beneficios económicos y de salud a largo plazo de la respuesta virológica sostenida y del aplazamiento de segundas líneas de tratamiento o de rescate, pero requeriría múltiples supuestos con respecto a la secuenciación de tratamiento, costes y criterios de valoración de los resultados en salud a largo plazo5. Por el contrario, el horizonte temporal de un año que consideramos en nuestro análisis permitió que el modelo utilizara solo los datos disponibles de los ensayos clínicos y de este modo evitó la necesidad de asunciones a largo plazo.
Apoyarse únicamente en los resultados de los ensayos clínicos representa una limitación de nuestro estudio a la vez que un punto fuerte, porque los ensayos clínicos tienen un sesgo de selección inherente en cuanto que habitualmente incluyen a pacientes motivados que alcanzan grados relativamente altos de cumplimiento terapéutico ya que el control y seguimiento son más estrictos. En la práctica clínica real, sin embargo, los grados de cumplimiento (y, por consiguiente, las tasas de respuesta virológica) son menores que en los ensayos clínicos. En consecuencia, es probable que este estudio infravalorara el coste que supone conseguir respuesta virológica para las pautas aquí analizadas basadas en un IP/r. El cumplimiento del tratamiento antirretroviral, sin embargo, depende en gran medida de su complejidad y/o tolerabilidad. En particular, se ha demostrado que las pautas de administración una vez al día se asocian a un mejor cumplimiento que las de administración 2 veces al día39–41. Por tanto, la transferibilidad de las conclusiones de este estudio a la práctica clínica habitual es aplicable al máximo cuando se consideran los tratamientos de administración una vez al día, entre ellos darunavir/r QD.
En el presente análisis no se incluyeron las pautas de TARGA basadas en inhibidores de la transcriptasa inversa no análogos de nucleósidos o en inhibidores de la integrasa. En su lugar, el objetivo era valorar la utilidad de las opciones disponibles, asumiendo una decisión clínica ya tomada de utilizar un IP/r.
Por último, aunque los resultados de los análisis tradicionales de coste-eficacia se comparan a menudo con un valor estándar de referencia de disposición a pagar (en inglés, «willingness to pay») —como 30.000€ por año de vida ganado ajustado por calidad de vida42— no existe tal valor de referencia con el que comparar nuestros resultados de coste-eficacia. Sin embargo, el uso del método de la frontera de eficiencia ofrece un marco importante para determinar el valor de los nuevos tratamientos y su acceso al mercado28.
A pesar de estas limitaciones, esta evaluación facilita información importante sobre el valor económico de los IP/r actualmente recomendados por las guías GESIDA para el tratamiento de pacientes naïve.
Según los resultados de este modelo, el inicio de tratamiento con darunavir/r QD en se mostraría una pauta más coste-eficaz comparada con el resto de pautas preferentes basadas en un IP/r para el tratamiento de pacientes naïve.
Conflicto de interesesLa financiación de este estudio ha estado a cargo de Johnson & Johnson Pharmaceutical Services LLC. Los autores Erik Smets y Ines Adriaenssen trabajan en Johnson & Johnson Pharmaceutical Services LLC. Joana Gostkorzewicz y Francisco Ledesma trabajan en Janssen España. Anita Brogan, Andrew Hill, Anthony Sawyer, han declarado no tener conflictos de Interés. Pere Domingo ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.