El panel de expertos de GESIDA/Plan Nacional sobre el Sida ha propuesto «pautas preferentes» de tratamiento antirretroviral (TARV) como terapia de inicio en pacientes infectados por VIH para 2013. El objetivo de este estudio es evaluar los costes y la eficiencia de iniciar tratamiento con estas pautas.
MétodosEvaluación económica de costes y eficiencia (coste/eficacia) mediante construcción de árboles de decisión. Se definió eficacia como la probabilidad de tener carga viral <50copias/ml en la semana48 en análisis por intención de tratar. Se definió coste de iniciar tratamiento con una pauta como los costes del TARV y de todas sus consecuencias (efectos adversos [EA], cambios de pauta y estudio de resistencias) que se producen en las siguientes 48semanas. Se utilizó la perspectiva del Sistema Nacional de Salud, considerando solo costes directos diferenciales: fármacos (a precio oficial), manejo de EA, estudios de resistencias y determinación de HLA B*5701. El ámbito es España, con costes de 2013. Se realizó análisis de sensibilidad determinista construyendo 3escenarios para cada pauta: basal, más favorable y más desfavorable.
ResultadosEn el escenario basal, los costes de iniciar tratamiento oscilaron entre 6.747euros para TDF/FTC+NVP y 12.059euros para TDF/FTC+RAL. La eficacia osciló entre 0,66 para ABC/3TC+LPV/r y ABC/3TC+ATV/r, y 0,87 para TDF/FTC+RAL y ABC/3TC+RAL. La eficiencia, en términos de coste/eficacia, osciló entre 8.396 y 13.930euros por respondedor a las 48semanas, para TDF/FTC/RPV y TDF/FTC+RAL, respectivamente.
ConclusiónConsiderando el precio oficial del TARV, la pauta más eficiente fue TDF/FTC/RPV, seguida de las otras pautas que contienen no nucleósidos. El análisis de sensibilidad confirmó la robustez de estos hallazgos.
The GESIDA and National AIDS Plan panel of experts have proposed “preferred regimens” of antiretroviral treatment (ART) as initial therapy in HIV infected patients for 2013. The objective of this study is to evaluate the costs and effectiveness of initiating treatment with these “preferred regimens”.
MethodsAn economic assessment of costs and effectiveness (cost/effectiveness) was performed using decision tree analysis models. Effectiveness was defined as the probability of having viral load <50copies/mL at week48, in an intention-to-treat analysis. Cost of initiating treatment with an ART regime was defined as the costs of ART and its consequences (adverse effects, changes of ART regime and drug resistance analyses) during the first 48weeks. The perspective of the analysis is that of the National Health System was applied, only taking into account differential direct costs: ART (official prices), management of adverse effects, resistance studies, and determination of HLA B*5701. The setting is Spain and the costs are those of 2013. A sensitivity deterministic analysis was performed, constructing three scenarios for each regimen: baseline, most favourable, and most unfavourable cases.
ResultsIn the baseline case scenario, the cost of initiating treatment ranges from 6,747euros for TDF/FTC+NVP to 12,059euros for TDF/FTC+RAL. The effectiveness ranges between 0.66 for ABC/3TC+LPV/r and ABC/3TC+ATV/r, and 0.87 for TDF/FTC+RAL and ABC/3TC+RAL. Effectiveness, in terms of cost/effectiveness, varies between 8,396euros and 13,930euros per responder at 48weeks, for TDF/FTC/RPV and TDF/FTC+RAL, respectively.
ConclusionsTaking ART at official prices, the most effective regimen was TDF/FTC/RPV, followed by the rest of non-nucleoside containing regimens. The sensitivity analysis confirms the robustness of these findings.
El tratamiento antirretroviral (TARV) ha disminuido drásticamente la morbimortalidad de la infección por el virus de la inmunodeficiencia humana (VIH) y ha cambiado su historia natural1,2. El TARV suele basarse en combinaciones de 3fármacos y su objetivo es reducir la carga viral plasmática por debajo del límite de detección (en general <50copias/ml) y mantenerla suprimida el mayor tiempo posible. Con las pautas actuales de TARV es posible, en la mayoría de los casos, una restauración parcial del sistema inmune, cuantitativa y cualitativamente, con cierto grado de dependencia del nivel de inmunodepresión de partida3-6. El TARV da lugar a una reducción drástica de la mortalidad y permite que la esperanza de vida se acerque a la de la población general7,8. Con ello el TARV, globalmente considerado, se ha convertido en una de las intervenciones médicas con mejor relación coste/eficacia de la historia de la medicina, incluyendo los países en vías de desarrollo9-17.
Entre las diferentes combinaciones posibles para el TARV inicial, el panel de expertos del Grupo de Estudio de Sida (GESIDA), de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), y el Plan Nacional sobre el Sida (PNS) consideran «pautas preferentes» para el 2013 diversas combinaciones avaladas por ensayos clínicos aleatorizados y por la opinión de los expertos del panel18. Sin embargo, en un entorno de recursos limitados, cualquier intervención terapéutica debe utilizarse de manera eficiente, y en consecuencia es necesario considerar los costes en los que se incurre con los distintos TARV y los resultados que se obtienen para poder establecer las pautas más eficientes dentro de las que el documento de consenso de GESIDA/PNS acepta como preferentes. Naturalmente, además del coste de los fármacos, existen otros costes asociados, tales como los derivados del manejo de los EA, o estudios de resistencias, entre otros. En 2011 y 2012 se publicaron 2estudios en los que se evaluó la eficiencia de las pautas de TARV preferentes de GESIDA/PNS19,20. Las pautas consideradas como preferentes para 2013 no son las mismas que en 2012. Además existe nueva evidencia científica y se han producido cambios en los costes que podrían modificar los hallazgos obtenidos del estudio de 201220.
Por estas razones se ha desarrollado el presente proyecto, cuyo objetivo es evaluar los costes de iniciar una pauta y la eficiencia en términos de coste/eficacia de iniciar las distintas pautas de TARV que las guías de GESIDA/PNS de 2013 proponen como terapia preferente de inicio en pacientes infectados por el VIH que no han recibido TARV previo (pacientes naives).
MétodosAl inicio del proyecto se constituyó un comité científico (CC) designado por GESIDA, compuesto por 15expertos españoles (los autores de este trabajo excepto AJB y PL) con experiencia en el manejo clínico de pacientes infectados por el VIH. Las tareas del CC han sido: asesoramiento general, validar las asunciones realizadas en el modelo de evaluación económica, proporcionar los ensayos clínicos utilizados como fuente de evidencia científica y proporcionar información como expertos cuando la evidencia científica era insuficiente.
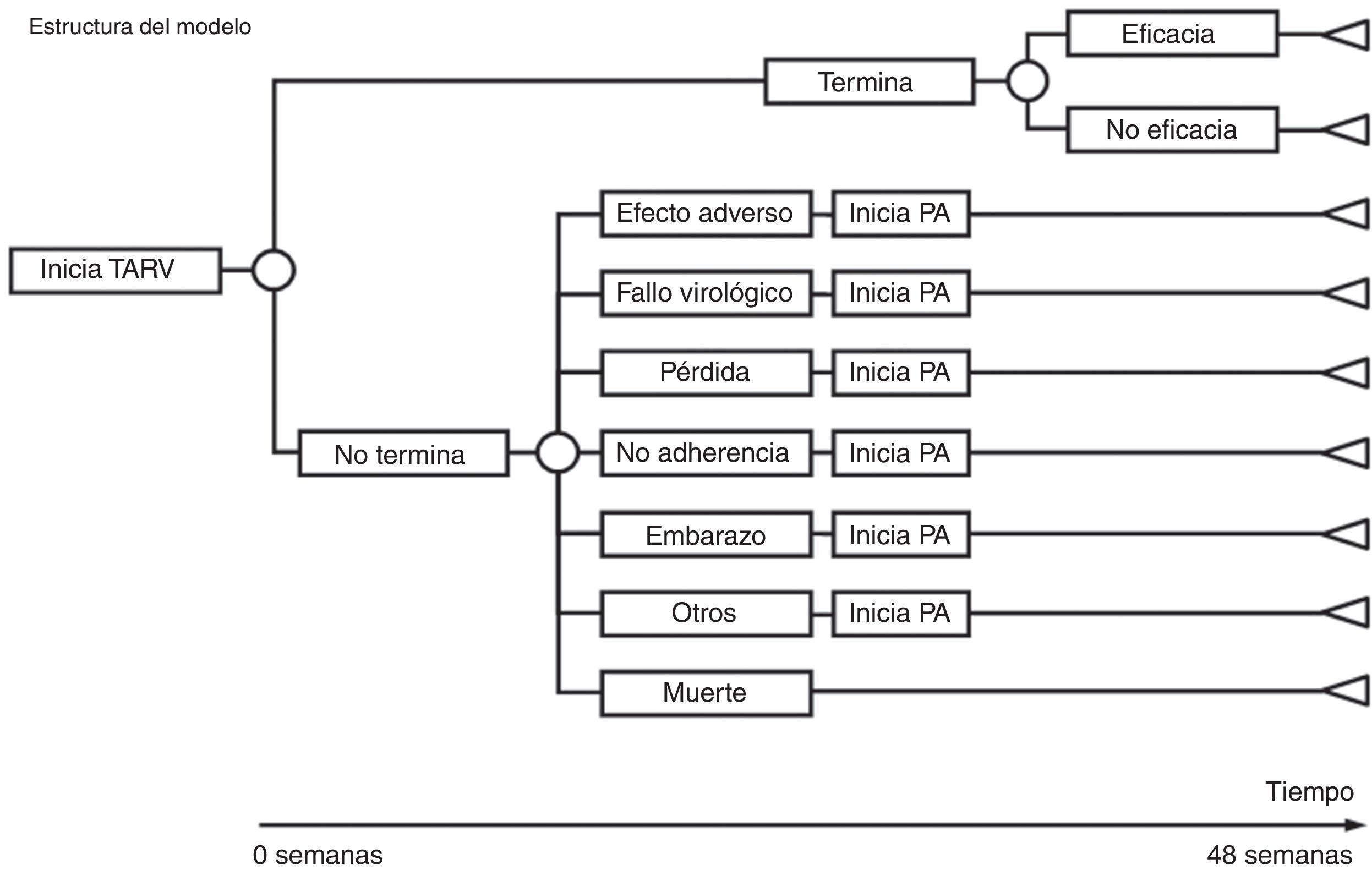
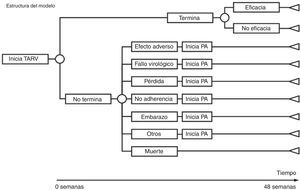
DiseñoEstudio de evaluación económica de los costes y de la eficiencia (coste/eficacia) mediante la construcción de árboles de decisión con análisis de sensibilidad determinista. Para ello se han construido árboles de decisión que permiten calcular los costes, la eficacia y la eficiencia de cada una de las pautas recomendadas por GESIDA/PNS (tabla 1). La perspectiva del análisis es la del financiador: el Sistema Nacional de Salud (SNS). En consecuencia, se han tenido en cuenta solo los costes directos. El ámbito es España. El horizonte temporal del modelo es de 48semanas. Se trata de un estudio de costes y de coste/eficacia, porque los resultados del TARV se basan en los obtenidos en ensayos clínicos.
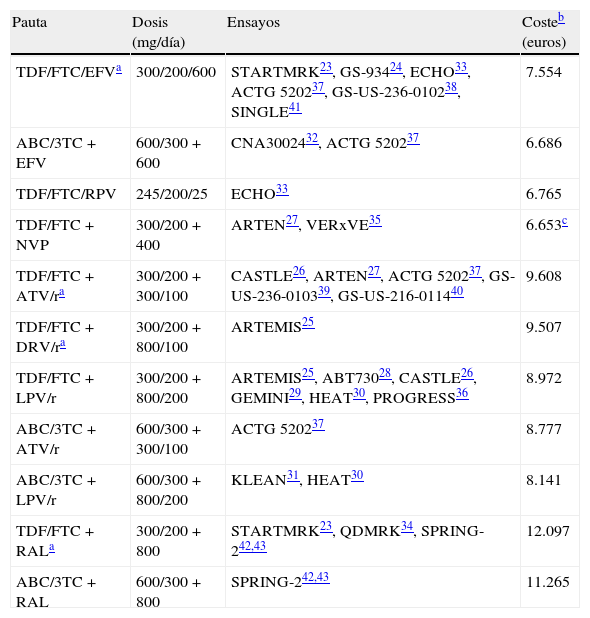
Pautas evaluadas, ensayos en los que se basa el modelo y coste de la pauta
| Pauta | Dosis (mg/día) | Ensayos | Costeb (euros) |
| TDF/FTC/EFVa | 300/200/600 | STARTMRK23, GS-93424, ECHO33, ACTG 520237, GS-US-236-010238, SINGLE41 | 7.554 |
| ABC/3TC+EFV | 600/300+600 | CNA3002432, ACTG 520237 | 6.686 |
| TDF/FTC/RPV | 245/200/25 | ECHO33 | 6.765 |
| TDF/FTC+NVP | 300/200+400 | ARTEN27, VERxVE35 | 6.653c |
| TDF/FTC+ATV/ra | 300/200+300/100 | CASTLE26, ARTEN27, ACTG 520237, GS-US-236-010339, GS-US-216-011440 | 9.608 |
| TDF/FTC+DRV/ra | 300/200+800/100 | ARTEMIS25 | 9.507 |
| TDF/FTC+LPV/r | 300/200+800/200 | ARTEMIS25, ABT73028, CASTLE26, GEMINI29, HEAT30, PROGRESS36 | 8.972 |
| ABC/3TC+ATV/r | 600/300+300/100 | ACTG 520237 | 8.777 |
| ABC/3TC+LPV/r | 600/300+800/200 | KLEAN31, HEAT30 | 8.141 |
| TDF/FTC+RALa | 300/200+800 | STARTMRK23, QDMRK34, SPRING-242,43 | 12.097 |
| ABC/3TC+RAL | 600/300+800 | SPRING-242,43 | 11.265 |
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV: efavirenz; FTC: emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir DF; 3TC: lamivudina.
Pautas consideradas como preferentes por la totalidad del panel de expertos de GESIDA y Plan Nacional sobre el Sida 201318.
Coste de 48 semanas, de precio de venta del laboratorio (PVL) más 4% de IVA con la reducción obligatoria del 7,5%, basados en los combos Atripla®, Truvada®, Kivexa® y Eviplera®18.
Como modelo de análisis económico se han diseñado tantos árboles de decisión como pautas recomendadas. Para construir cada árbol de decisión se ha partido de los ensayos clínicos en los que se utiliza la pauta correspondiente y se ha reproducido su estructura en cuanto a eficacia, EA y causas de abandono (tabla 1 y fig. 1).
Fuentes de evidencia para asignar la eficacia, efectos adversos y abandonosEl CC aportó los ensayos clínicos aleatorizados que potencialmente proporcionaban información útil para los modelos de evaluación económica de las diferentes pautas a evaluar. Se han considerado los ensayos que cumplen los siguientes criterios de inclusión: 1)evalúan al menos una de las pautas consideradas; 2)utilizan o permiten calcular como criterio de eficacia el porcentaje de pacientes con carga viral indetectable (<50copias/ml) a las 48semanas; 3)tienen un horizonte temporal de 48semanas; 4)describen las pérdidas de seguimiento, y 5)describen los EA producidos. Los artículos fueron leídos de forma independiente por 2investigadores (PL y AJB), quienes decidieron si el artículo cumplía los criterios de inclusión, en cuyo caso se incluyó como fuente de evidencia para el modelo. La inclusión y la exclusión de artículos fueron validadas por el CC.
Fuentes de información cuando no existía evidencia científica: utilización de la opinión de expertosPara obtener información sobre variables necesarias en el modelo de evaluación económica cuando no existía evidencia científica disponible, se utilizó la opinión de 9expertos miembros del CC. Dos investigadores (PL y AJB) elaboraron hojas de recogida de datos que reunían las variables de interés y que fueron enviadas a cada uno de los expertos. No se permitió la interacción entre expertos, de manera que sus respuestas fueron individuales e independientes. Para las variables continuas (p.ej., días de duración de un prurito, o veces que tienen que acudir a un especialista por fallo renal), se calculó la media de las estimaciones de los expertos. Para las variables dicotómicas (p.ej., si el EA es grave/moderado, tiene relación con el TARV sí/no, o es crónico/aislado) se decidió asignar la opinión de la mayoría. Los estimadores de síntesis elaborados fueron validados por todos los miembros del CC.
Definición y cálculo de eficaciaComo medida de eficacia se ha considerado una proporción en la que el numerador es el número de pacientes con carga viral indetectable (<50copias/ml) en la semana48 después de iniciar el TARV (respondedores) y el denominador el número de pacientes que han iniciado el TARV. Esto implica que todos los pacientes que se pierden o abandonan el tratamiento por cualquier razón se consideran no respondedores al TARV. En definitiva, se ha calculado la eficacia por análisis por intención de tratar en los expuestos (intent-to-treat exposed [ITT-E]) siguiendo la modalidad de pérdidas o seguimientos incompletos igual a fracaso (missing or non-completer=failure). Este criterio podía no ser el end-point principal del ensayo, pero se podía calcular en todos los artículos evaluados. Cuando se disponía de más de un ensayo clínico que evaluaba la misma pauta, se calculó la eficacia como una proporción en la que el numerador es la suma de respondedores y el denominador es la suma de los pacientes que han iniciado el TARV en los ensayos clínicos que evalúan esa pauta.
Definición y cálculo de costesSe han considerado solo los costes directos. En este estudio se entiende por costes directos el consumo de recursos del SNS. Dentro de estos costes se han considerado únicamente los costes diferenciales, es decir, los costes que no son idénticos en todas las pautas consideradas. Los costes diferenciales que se han tenido en cuenta son: TARV, manejo de EA, estudio genotípico de resistencias y determinación de HLA B*5701. Los costes directos se han calculado multiplicando los recursos utilizados por el coste unitario de cada recurso. El coste de iniciar una pauta es el coste del TARV y todas las consecuencias (p.ej., EA o necesidad de cambiar a otra pauta) que se producen en 48semanas por haber tomado la decisión de iniciar TARV con esa pauta.
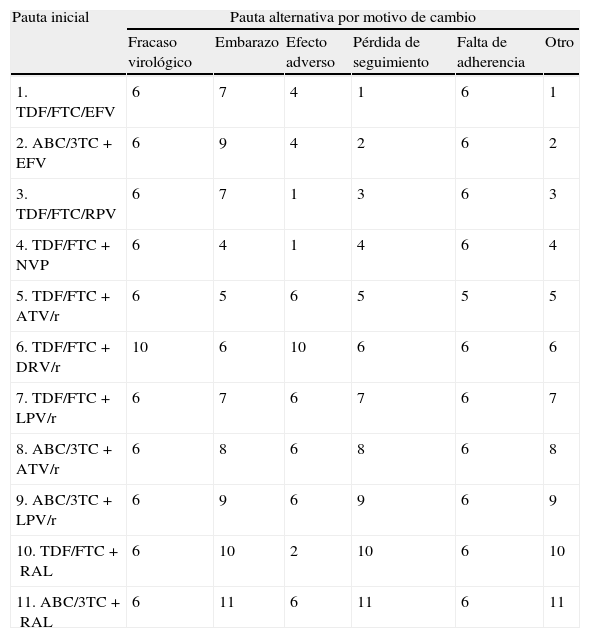
Utilización de recursosTratamiento antirretroviralA los pacientes que en el ensayo finalizan el tratamiento se les ha asignado el coste de 48semanas de la pauta con la que inician tratamiento. Para los pacientes que no finalizan el tratamiento, se asume que dejan de recibir la pauta inicial, en promedio, a las 24semanas. Por tanto, a estos pacientes se les ha asignado el coste de 24semanas de la pauta inicial y el coste de 24semanas de la pauta alternativa. La pauta alternativa fue decidida en función del motivo de no finalización, según la opinión del CC (tabla 2).
Pautas alternativas a la pauta inicial en función del motivo de cambio (consenso del comité científico)
| Pauta inicial | Pauta alternativa por motivo de cambio | |||||
| Fracaso virológico | Embarazo | Efecto adverso | Pérdida de seguimiento | Falta de adherencia | Otro | |
| 1. TDF/FTC/EFV | 6 | 7 | 4 | 1 | 6 | 1 |
| 2. ABC/3TC+EFV | 6 | 9 | 4 | 2 | 6 | 2 |
| 3. TDF/FTC/RPV | 6 | 7 | 1 | 3 | 6 | 3 |
| 4. TDF/FTC+NVP | 6 | 4 | 1 | 4 | 6 | 4 |
| 5. TDF/FTC+ATV/r | 6 | 5 | 6 | 5 | 5 | 5 |
| 6. TDF/FTC+DRV/r | 10 | 6 | 10 | 6 | 6 | 6 |
| 7. TDF/FTC+LPV/r | 6 | 7 | 6 | 7 | 6 | 7 |
| 8. ABC/3TC+ATV/r | 6 | 8 | 6 | 8 | 6 | 8 |
| 9. ABC/3TC+LPV/r | 6 | 9 | 6 | 9 | 6 | 9 |
| 10. TDF/FTC+RAL | 6 | 10 | 2 | 10 | 6 | 10 |
| 11. ABC/3TC+RAL | 6 | 11 | 6 | 11 | 6 | 11 |
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV: efavirenz; FTC: emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir DF; 3TC: lamivudina.
Se han considerado como EA aquellos que el ensayo identificaba como atribuibles al TARV. Cuando el ensayo ofrecía una lista de EA sin especificar si eran atribuibles o no al TARV, se utilizó el criterio del CC. Los ensayos clínicos habitualmente ofrecen información de aquellos EA que se producen en más del 2% de los pacientes tratados con alguna de las pautas comparadas. Por lo tanto, se han tenido en cuenta solo los EA que se producen en al menos el 2% de los pacientes. Los EA se clasificaron en crónicos y aislados, según la opinión del CC. Los EA crónicos son aquellos que cuando se producen, se mantienen a lo largo del tratamiento (p.ej., dislipidemia). Los EA aislados son aquellos que se producen puntualmente (p.ej., erupción cutánea).
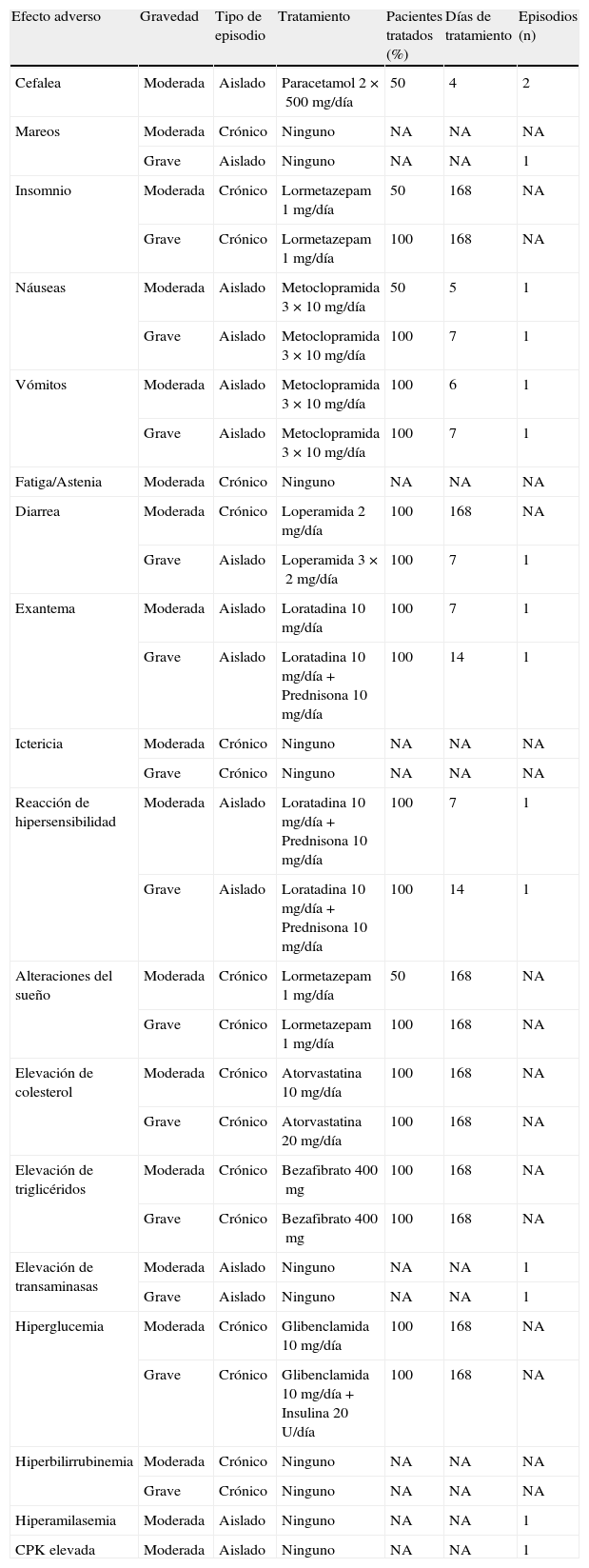
Los recursos considerados para el manejo de los EA han sido: tratamiento farmacológico, visitas a urgencias, visitas adicionales al especialista en VIH, visitas a otros especialistas, pruebas diagnósticas e ingreso hospitalario. A los pacientes que en el ensayo finalizan el tratamiento se les ha asignado el coste del manejo de los EA producidos en las 48semanas de la pauta con la que inician tratamiento. Para los pacientes que no finalizan el tratamiento se asume que dejan de recibir la pauta inicial, en promedio, a las 24semanas. Por tanto, a estos pacientes se les ha asignado el coste de EA de 24semanas de la pauta inicial y el coste de EA de 24semanas de la pauta alternativa (tabla 2). Se asumió que, en promedio, los EA crónicos se producen en la mitad de la duración del TARV. En consecuencia, se imputa el coste del tratamiento farmacológico del EA crónico durante la mitad del periodo que ha recibido una pauta de TARV determinada. El uso de recursos para el manejo de los EA y la probabilidad de su gravedad han sido estimados por el CC (tabla 3).
Utilización de recursos en el manejo de efectos adversos
| Efecto adverso | Gravedad | Tipo de episodio | Tratamiento | Pacientes tratados (%) | Días de tratamiento | Episodios (n) |
| Cefalea | Moderada | Aislado | Paracetamol 2×500mg/día | 50 | 4 | 2 |
| Mareos | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Insomnio | Moderada | Crónico | Lormetazepam 1mg/día | 50 | 168 | NA |
| Grave | Crónico | Lormetazepam 1mg/día | 100 | 168 | NA | |
| Náuseas | Moderada | Aislado | Metoclopramida 3×10mg/día | 50 | 5 | 1 |
| Grave | Aislado | Metoclopramida 3×10mg/día | 100 | 7 | 1 | |
| Vómitos | Moderada | Aislado | Metoclopramida 3×10mg/día | 100 | 6 | 1 |
| Grave | Aislado | Metoclopramida 3×10mg/día | 100 | 7 | 1 | |
| Fatiga/Astenia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Diarrea | Moderada | Crónico | Loperamida 2mg/día | 100 | 168 | NA |
| Grave | Aislado | Loperamida 3×2mg/día | 100 | 7 | 1 | |
| Exantema | Moderada | Aislado | Loratadina 10mg/día | 100 | 7 | 1 |
| Grave | Aislado | Loratadina 10 mg/día+Prednisona 10mg/día | 100 | 14 | 1 | |
| Ictericia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Crónico | Ninguno | NA | NA | NA | |
| Reacción de hipersensibilidad | Moderada | Aislado | Loratadina 10 mg/día+Prednisona 10mg/día | 100 | 7 | 1 |
| Grave | Aislado | Loratadina 10 mg/día+Prednisona 10mg/día | 100 | 14 | 1 | |
| Alteraciones del sueño | Moderada | Crónico | Lormetazepam 1mg/día | 50 | 168 | NA |
| Grave | Crónico | Lormetazepam 1mg/día | 100 | 168 | NA | |
| Elevación de colesterol | Moderada | Crónico | Atorvastatina 10mg/día | 100 | 168 | NA |
| Grave | Crónico | Atorvastatina 20mg/día | 100 | 168 | NA | |
| Elevación de triglicéridos | Moderada | Crónico | Bezafibrato 400mg | 100 | 168 | NA |
| Grave | Crónico | Bezafibrato 400mg | 100 | 168 | NA | |
| Elevación de transaminasas | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Grave | Aislado | Ninguno | NA | NA | 1 | |
| Hiperglucemia | Moderada | Crónico | Glibenclamida 10mg/día | 100 | 168 | NA |
| Grave | Crónico | Glibenclamida 10mg/día+Insulina 20U/día | 100 | 168 | NA | |
| Hiperbilirrubinemia | Moderada | Crónico | Ninguno | NA | NA | NA |
| Grave | Crónico | Ninguno | NA | NA | NA | |
| Hiperamilasemia | Moderada | Aislado | Ninguno | NA | NA | 1 |
| CPK elevada | Moderada | Aislado | Ninguno | NA | NA | 1 |
| Efecto adverso | Gravedad | Pacientes visitan urgencias (%) | Visitas especialista habitual (n) | Visitas otro especialista (n) | Pruebas realizadas | Ingreso (días) | % de gravedad |
| Cefalea | Moderada | 0 | 0,4 | 0,0 | Ninguna | 0 | 100 |
| Mareos | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 5 | 1,0 | 0,0 | Ninguna | 0 | 10 | |
| Insomnio | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 80 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 20 | |
| Náuseas | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 15 | |
| Vómitos | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 40 | 1,5 | 0,0 | Ninguna | 0 | 15 | |
| Fatiga/Astenia | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 100 |
| Diarrea | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 100 | 1,0 | 0,0 | Coprocultivo | 3 | 10 | |
| Exantema | Moderada | 50 | 1,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 100 | 1,0 | 1,0 | Ninguna | 6 | 5 | |
| Ictericia | Moderada | 0 | 1,0 | 0,0 | Transaminasas+coagulación | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | Transaminasas+coagulación+ECOa | 3b | 5 | |
| Reacción de hipersensibilidad | Moderada | 50 | 1,0 | 0,0 | Ninguna | 0 | 95 |
| Grave | 100 | 2,0 | 0,5 | Analítica | 7 | 5 | |
| Alteraciones del sueño | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 85 |
| Grave | 0 | 1,0 | 0,0 | Ninguna | 0 | 15 | |
| Elevación de colesterol | Moderada | 0 | 0,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 0 | 0,0 | 0,0 | Ninguna | 0 | 10 | |
| Elevación de triglicéridos | Moderada | 0 | 0,0 | 0,0 | Ninguna | 0 | 90 |
| Grave | 0 | 0,0 | 0,0 | Ninguna | 0 | 10 | |
| Elevación de transaminasas | Moderada | 0 | 1,0 | 0,0 | Analítica | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | Analítica+ECO | 0 | 5 | |
| Hiperglucemia | Moderada | 0 | 1,0 | 0,0 | Ninguna | 0 | 98 |
| Grave | 50 | 1,0 | 1,0 | Curva de glucemia+insulinemia | 0 | 2 | |
| Hiperbilirrubinemia | Moderada | 0 | 1,0 | 0,0 | Transaminasas+coagulación | 0 | 95 |
| Grave | 0 | 1,0 | 0,0 | Transaminasas+coagulación+ECO | 3 | 5 | |
| Hiperamilasemia | Moderada | 0 | 1,0 | 0,0 | Analítica | 0 | 100 |
| CPK elevada | Moderada | 0 | 0,5 | 0,0 | Ninguna | 0 | 100 |
ECO: ecografía; n: número; NA: no aplica.
Los estudios genotípicos de resistencias que se han considerado como coste diferencial son: a)siempre que hay fracaso virológico, estudio de resistencias convencional, y b)si el fracaso virológico se produce en una pauta que contiene raltegravir (RAL), estudio de resistencia al RAL. Para las pautas que contienen abacavir (ABC) se ha considerado la determinación de HLA B*5701 antes de iniciar el tratamiento.
Coste unitario de los recursosTratamiento antirretroviralLos costes de cada pauta se calcularon a partir del precio de venta del laboratorio (PVL) más 4% de IVA con la reducción obligatoria del 7,5%. Esta reducción obligatoria la estableció el gobierno español como una de las medidas extraordinarias para la reducción del déficit público21. El precio de cada TARV se ha calculado a partir del precio de los fármacos que lo componen. Para la combinación ABC y lamivudina (3TC) se ha utilizado el precio de Kivexa®. Para la combinación emtricitabina (FTC) y tenofovir DF (TDF) se ha utilizado el precio de Truvada®. Para la pauta TDF/FTC/efavirenz (EFV) se ha utilizado el precio de Atripla®. Para la pauta TDF/FTC/rilpivirina (RPV) se ha utilizado el precio de Eviplera®. Los precios se obtuvieron del documento de consenso de GESIDA/PNS de 201318 (tabla 1).
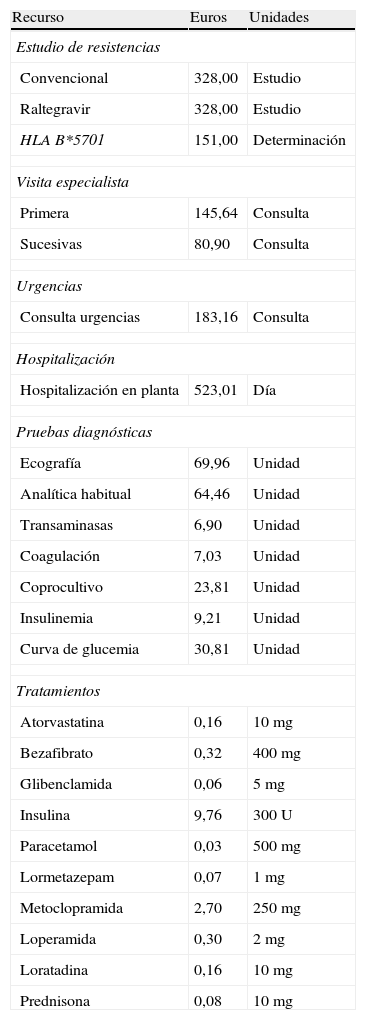
Coste de los efectos adversosPara asignar el coste del tratamiento de los fármacos utilizados en el manejo de los EA, se identificó el coste de los fármacos a precio de venta al público más IVA22. En caso de disponer de más de un preparado comercial, se eligió el coste del más barato. Para los demás recursos utilizados en el manejo de los EA (visitas a urgencias, visitas adicionales al especialista en VIH, visitas a otros especialistas, pruebas diagnósticas e ingreso hospitalario), dado que en España la sanidad es competencia de las comunidades autónomas, no existe un precio único nacional. Por lo tanto, se han utilizado las tarifas oficiales del precio de los recursos de las comunidades autónomas. El coste de cada unidad de recurso ha sido estimado como la media de los precios públicos (a aplicar por los centro sanitarios a terceros obligados al pago o a los usuarios sin derecho a asistencia sanitaria) correspondientes a los servicios sanitarios prestados por los Servicios de Salud de las Consejerías de Sanidad de las diferentes comunidades autónomas (tabla 4).
Coste unitario de los recursos utilizados
| Recurso | Euros | Unidades |
| Estudio de resistencias | ||
| Convencional | 328,00 | Estudio |
| Raltegravir | 328,00 | Estudio |
| HLA B*5701 | 151,00 | Determinación |
| Visita especialista | ||
| Primera | 145,64 | Consulta |
| Sucesivas | 80,90 | Consulta |
| Urgencias | ||
| Consulta urgencias | 183,16 | Consulta |
| Hospitalización | ||
| Hospitalización en planta | 523,01 | Día |
| Pruebas diagnósticas | ||
| Ecografía | 69,96 | Unidad |
| Analítica habitual | 64,46 | Unidad |
| Transaminasas | 6,90 | Unidad |
| Coagulación | 7,03 | Unidad |
| Coprocultivo | 23,81 | Unidad |
| Insulinemia | 9,21 | Unidad |
| Curva de glucemia | 30,81 | Unidad |
| Tratamientos | ||
| Atorvastatina | 0,16 | 10mg |
| Bezafibrato | 0,32 | 400mg |
| Glibenclamida | 0,06 | 5mg |
| Insulina | 9,76 | 300U |
| Paracetamol | 0,03 | 500mg |
| Lormetazepam | 0,07 | 1mg |
| Metoclopramida | 2,70 | 250mg |
| Loperamida | 0,30 | 2mg |
| Loratadina | 0,16 | 10mg |
| Prednisona | 0,08 | 10mg |
Debido a la escasez de información oficial sobre el coste del estudio de resistencias y de determinación de HLA B*5701, se han utilizado los costes del Hospital Clínic de Barcelona (tabla 4).
Definición y cálculo de eficienciaLa eficiencia ha sido definida en términos de coste/eficacia. Para cada pauta, se ha calculado como un cociente en el que el numerador es el coste de iniciar tratamiento con esa pauta y el denominador es la eficacia. Representa el coste de conseguir un respondedor en la semana48.
Análisis de sensibilidadPara estimar el efecto de la incertidumbre procedente de los estimadores (p.ej., de eficacia, EA o costes) se ha realizado un análisis de sensibilidad determinista para cada uno de los modelos. Para ello se han construido 3escenarios: basal, más favorable y más desfavorable para cada pauta de inicio de TARV. En el escenario basal la eficiencia se ha calculado como un cociente en el que el numerador es el estimador central del coste y el denominador es el estimador central de la eficacia. En el escenario más favorable la eficiencia se ha calculado como un cociente en el que el numerador es el estimador más favorable del coste y el denominador es el estimador más favorable de la eficacia. En el escenario más desfavorable, los ratios de eficiencia se han calculado como un cociente en el que el numerador es el estimador más desfavorable del coste y el denominador es el estimador más desfavorable de la eficacia.
Para calcular el estimador central del coste se ha aplicado el estimador central de la probabilidad de EA, y los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. Para calcular el estimador más favorable del coste se ha aplicado el límite inferior del intervalo de confianza al 95% (IC95%) de la probabilidad de EA, y un 15% menos de los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. Para calcular el estimador más desfavorable del coste se ha aplicado el límite superior del IC95% de la probabilidad de EA, y un 15% más de los costes medios del manejo de los EA, estudio de resistencias y determinación de HLA B*5701. En todos los escenarios se ha utilizado el mismo coste de cada pauta de TARV, dado que en este coste no hay ninguna incertidumbre. Para calcular el estimador más favorable y más desfavorable de la eficacia se han utilizado, respectivamente, los límites superior e inferior del IC95%.
Aplicación informáticaDebido a que los costes locales de un hospital concreto pueden ser diferentes a los utilizados en el modelo, se ha desarrollado una aplicación informática que permite asignar costes locales para calcular los costes del TARV, los costes de iniciar una pauta, la eficiencia (coste/eficacia) y la eficiencia relativa de iniciar tratamiento con las diferentes pautas. La aplicación está disponible gratuitamente en <https://dl.dropboxusercontent.com/u/35731022/coste-eficacia-2013/aplicacion-tarv-vih-2013.exe> y en <http://www.gesida.seimc.org>.
ResultadosAdemás de los 14ensayos incluidos en el estudio realizado para 201220 (STARTMRK23, GS-93424, ARTEMIS25, CASTLE26, ARTEN27, ABT73028, GEMINI29, HEAT30, KLEAN31, CNA3002432, ECHO33, QDMRK34, VERxVE35, PROGRESS36), el CC seleccionó 7ensayos clínicos adicionales que evalúan la eficacia de las pautas preferentes del documento de consenso de GESIDA/PNS de 201318: ACTG520237 (incluyendo datos no publicados aportados por los autores del ACTG5202), GS-US-236-010238, GS-US-236-010339, GS-US-216-011440, SINGLE41, SPRING-242,43 y STAR44. De estos estudios, el STAR no cumple uno de los criterios de inclusión (no describe las pérdidas de seguimiento). Finalmente, con la evidencia científica disponible se han podido evaluar todas las pautas recomendadas como preferentes. En la tabla 1 se presentan los ensayos de los que se obtuvo la información para evaluar cada una de las pautas.
Los costes de las pautas de TARV durante 48semanas oscilan entre 6.653 y 12.097euros, correspondientes a TDF/FTC+nevirapina (NVP) (considerando el precio de NVP de liberación prolongada) y TDF/FTC+RAL, respectivamente (tabla 1).
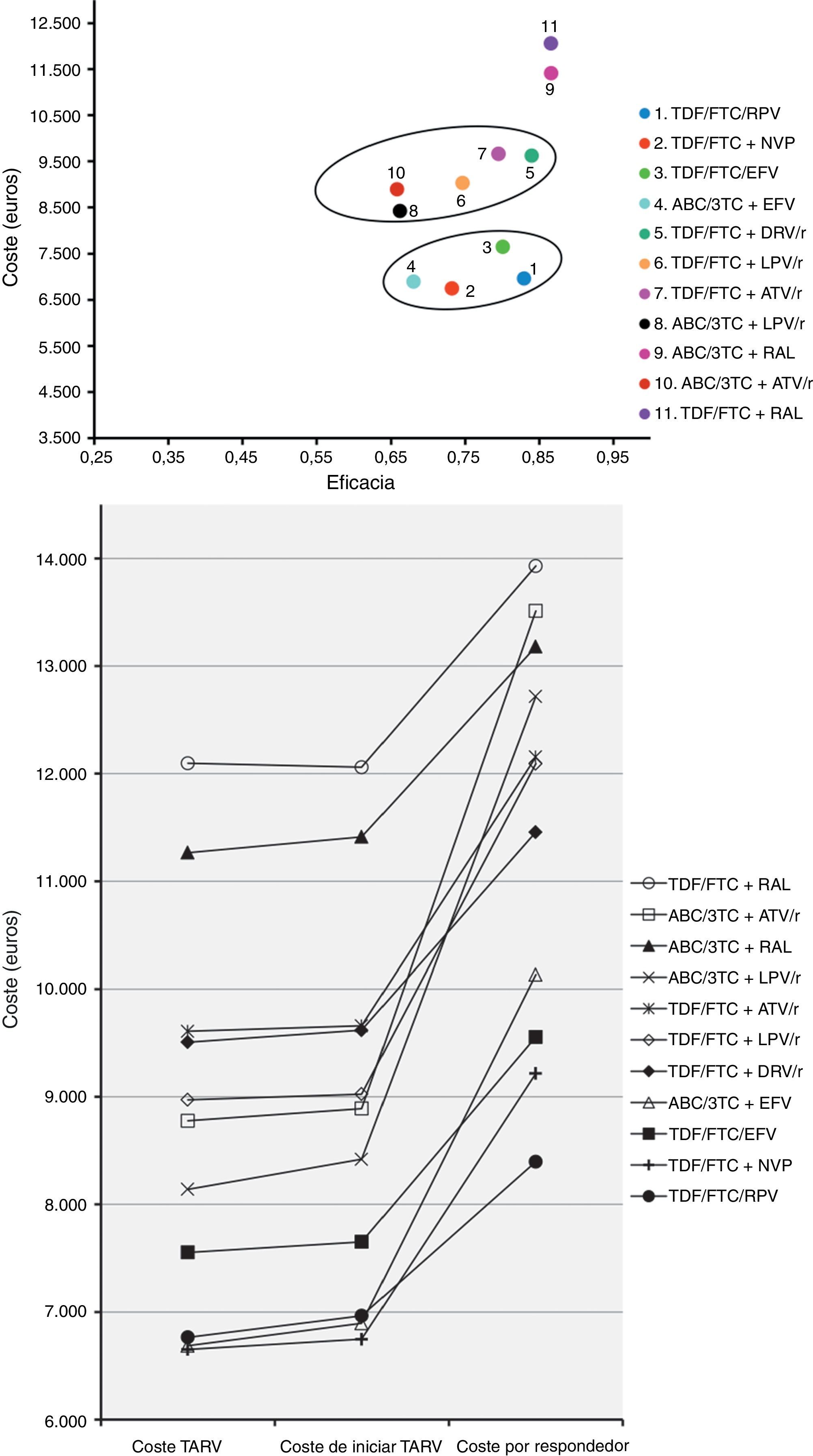
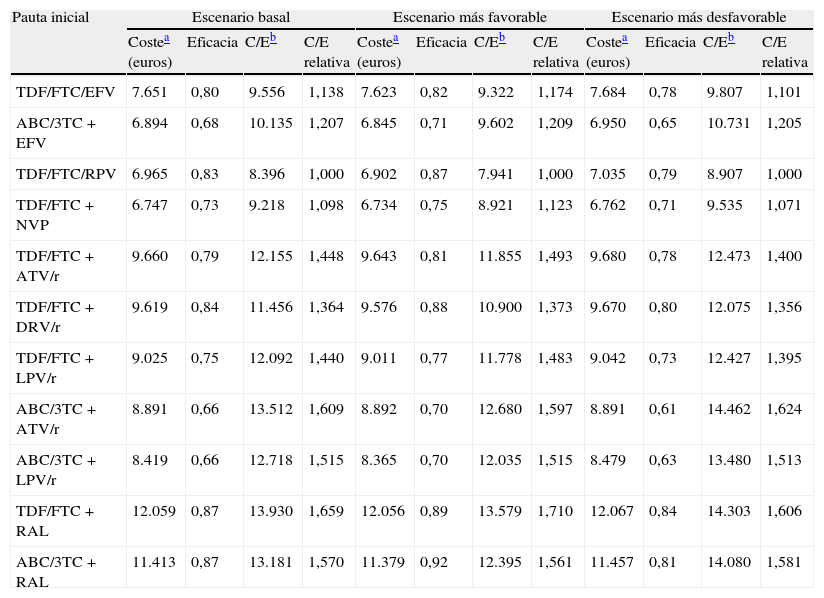
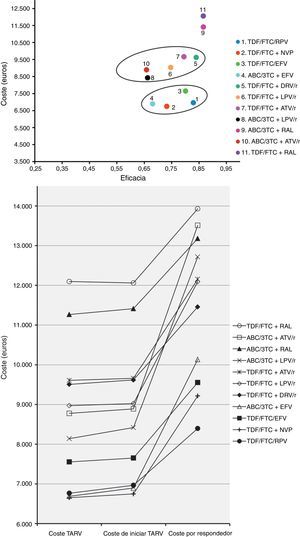
Los costes de iniciar tratamiento en el escenario basal oscilan entre 6.747euros para TDF/FTC+NVP y 12.059euros para TDF/FTC+RAL. Entre las pautas que contienen un inhibidor de la proteasa potenciado con ritonavir (IP/r), ABC/3TC+lopinavir (LPV)/r es la que tiene un menor coste. En el escenario más favorable, los costes oscilan entre 6.734 y 12.056euros, para TDF/FTC+NVP y TDF/FTC+RAL, respectivamente. En el escenario más desfavorable, oscilan entre 6.762 y 12.067euros, para TDF/FTC+NVP y TDF/FTC+RAL, respectivamente (tabla 5 y fig. 2A,B).
Coste, eficacia, eficiencia (coste/eficacia) y eficiencia relativa de iniciar tratamiento con las diferentes pautas (tomando como referencia la pauta TDF/FTC/RPV). Análisis de sensibilidad
| Pauta inicial | Escenario basal | Escenario más favorable | Escenario más desfavorable | |||||||||
| Costea (euros) | Eficacia | C/Eb | C/E relativa | Costea (euros) | Eficacia | C/Eb | C/E relativa | Costea (euros) | Eficacia | C/Eb | C/E relativa | |
| TDF/FTC/EFV | 7.651 | 0,80 | 9.556 | 1,138 | 7.623 | 0,82 | 9.322 | 1,174 | 7.684 | 0,78 | 9.807 | 1,101 |
| ABC/3TC+EFV | 6.894 | 0,68 | 10.135 | 1,207 | 6.845 | 0,71 | 9.602 | 1,209 | 6.950 | 0,65 | 10.731 | 1,205 |
| TDF/FTC/RPV | 6.965 | 0,83 | 8.396 | 1,000 | 6.902 | 0,87 | 7.941 | 1,000 | 7.035 | 0,79 | 8.907 | 1,000 |
| TDF/FTC+NVP | 6.747 | 0,73 | 9.218 | 1,098 | 6.734 | 0,75 | 8.921 | 1,123 | 6.762 | 0,71 | 9.535 | 1,071 |
| TDF/FTC+ATV/r | 9.660 | 0,79 | 12.155 | 1,448 | 9.643 | 0,81 | 11.855 | 1,493 | 9.680 | 0,78 | 12.473 | 1,400 |
| TDF/FTC+DRV/r | 9.619 | 0,84 | 11.456 | 1,364 | 9.576 | 0,88 | 10.900 | 1,373 | 9.670 | 0,80 | 12.075 | 1,356 |
| TDF/FTC+LPV/r | 9.025 | 0,75 | 12.092 | 1,440 | 9.011 | 0,77 | 11.778 | 1,483 | 9.042 | 0,73 | 12.427 | 1,395 |
| ABC/3TC+ATV/r | 8.891 | 0,66 | 13.512 | 1,609 | 8.892 | 0,70 | 12.680 | 1,597 | 8.891 | 0,61 | 14.462 | 1,624 |
| ABC/3TC+LPV/r | 8.419 | 0,66 | 12.718 | 1,515 | 8.365 | 0,70 | 12.035 | 1,515 | 8.479 | 0,63 | 13.480 | 1,513 |
| TDF/FTC+RAL | 12.059 | 0,87 | 13.930 | 1,659 | 12.056 | 0,89 | 13.579 | 1,710 | 12.067 | 0,84 | 14.303 | 1,606 |
| ABC/3TC+RAL | 11.413 | 0,87 | 13.181 | 1,570 | 11.379 | 0,92 | 12.395 | 1,561 | 11.457 | 0,81 | 14.080 | 1,581 |
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV: efavirenz; FTC: emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir DF; 3TC: lamivudina.
Representación del escenario basal. A)Coste: coste de iniciar una pauta, considerando todas las consecuencias (incluyendo EA y cambios a otras pautas) que se producen en 48semanas por haber tomado la decisión de iniciar TARV con esa pauta. Eficacia: proporción de pacientes con carga viral indetectable (<50copias de ARN del VIH/ml de plasma) en la semana48. La pendiente resultante entre la ordenada en el origen y el punto de cada pauta corresponde a la eficiencia, en términos de coste/eficacia, y representa el coste para el SNS de conseguir un respondedor en la semana48. B)Coste TARV: coste farmacéutico de cada pauta durante 48semanas (PVL+4% IVA–7,5% de reducción). Coste de iniciar TARV: coste de iniciar una pauta, considerando todas las consecuencias (incluyendo EA y cambios a otras pautas) que se producen en 48semanas por haber tomado la decisión de iniciar TARV con esa pauta. Coste por respondedor: coste para el SNS de obtener un respondedor (<50copias de ARN del VIH/ml de plasma) a las 48semanas, calculado como el coste de iniciar TARV dividido por la eficacia.
ABC: abacavir; ATV: atazanavir; DRV: darunavir; EFV: efavirenz; FTC: emtricitabina; LPV: lopinavir; NVP: nevirapina; /r: potenciado con ritonavir; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir DF; 3TC: lamivudina.
La eficacia en el escenario basal oscila entre 0,66 (66% de respuesta a las 48semanas) para ABC/3TC+LPV/r y ABC/3TC+atazanavir (ATV)/r, y 0,87 para TDF/FTC+RAL y ABC/3TC+RAL. En el escenario más favorable oscila entre 0,70 para ABC/3TC+LPV/r y ABC/3TC+ATV/r, y 0,92 para ABC/3TC+RAL. En el escenario más desfavorable oscila entre 0,61 para ABC/3TC+ATV/r y 0,84 para TDF/FTC+RAL (tabla 5 y fig. 2A).
La eficiencia, en términos de coste/eficacia, en el escenario basal oscila entre 8.396 y 13.930euros por respondedor, para TDF/FTC/RPV y TDF/FTC+RAL, respectivamente. En el escenario más favorable oscila entre 7.941 y 13.579 euros por respondedor, para TDF/FTC/RPV y TDF/FTC+RAL, respectivamente. En el escenario más desfavorable, oscila entre 8.907 y 14.462euros por respondedor, para TDF/FTC/EFV y ABC/3TC+ATV/r, respectivamente. En términos relativos, si se inicia TARV con la pauta TDF/FTC+RAL, conseguir un respondedor es un 65,9% más caro que con la pauta TDF/FTC/RPV en el escenario basal, un 71,0% más caro en el escenario más favorable, y un 60,6% más caro en el escenario más desfavorable (tabla 5 y fig. 2A,B).
Entre las pautas que contienen inhibidores de la transcriptasa inversa no nucleósidos, la más eficiente es globalmente TDF/FTC/RPV, seguida de TDF/FTC+NVP, TDF/FTC/EFV y ABC/3TC+EFV. Con esta última pauta, conseguir un respondedor es un 20,7% más caro respecto a TDF/FTC/RPV, pudiendo oscilar entre 20,5 y 20,9% para los escenarios más desfavorable y favorable, respectivamente. Entre las pautas que contienen IP/r, la más eficiente es TDF/FTC+darunavir (DRV)/r, y la menos eficiente es ABC/3TC+ATV/r, con la que conseguir un respondedor es un 17,9% más caro respecto a TDF/FTC+DRV/r, pudiendo oscilar entre 16,3 y 19,8% según el escenario (tabla 5 y fig. 2A,B).
DiscusiónDe las pautas de TARV que en el documento de consenso de GESIDA/PNS de enero de 201318 son consideradas como preferentes para pacientes naives, TDF/FTC+NVP es la menos costosa tanto considerando únicamente el coste del TARV como considerando el coste de iniciar tratamiento con una pauta, que incluye el coste derivado del manejo de los EA, del estudio de resistencias y HLA B*5701, y los derivados de los cambios de pauta que se producen. Sin embargo, la pauta TDF/FTC/RPV es la más eficiente en términos de coste/eficacia, a pesar de que existen 3pautas que en los ensayos clínicos presentan mayor eficacia (TDF/FTC+RAL, ABC/3TC+RAL y TDF/FTC+DRV/r)23,25,34,42,43,45. Las pautas que contienen RAL son las más eficaces, pero son también las menos eficientes como consecuencia de su elevado coste, junto con la pauta ABC/3TC+ATV como consecuencia de su baja eficacia.
El coste de iniciar tratamiento con una pauta es lo que realmente le cuesta al SNS la decisión de iniciar esa pauta, porque incluye los costes de TARV y el coste de las consecuencias (p.ej., EA o cambios de pauta) que se producen, mientras que para la farmacia de un hospital el único coste es el del TARV. La relación coste/eficacia refleja el coste para el SNS de obtener un respondedor (a las 48semanas en nuestro caso). En algún caso, el médico y/o el paciente pueden preferir una pauta con un no nucleósido, con un IP/r o con RAL por razones clínicas o por preferencias personales. En estos casos habría que considerar los costes de iniciar un tratamiento, su eficacia y el ratio de coste/eficacia dentro de cada uno de estos 3tipos de pautas46.
Para todas las pautas, el principal coste de iniciar tratamiento es el del TARV, debido a su elevado precio. Por otra parte, el coste derivado del manejo de los EA es muy bajo, ya que una proporción muy baja de pacientes presenta EA y el coste de su manejo también es bajo.
El presente estudio tiene limitaciones. Una de las posibles limitaciones es que está basado en ensayos clínicos realizados en diferentes países, en diferentes periodos de tiempo, con diferentes criterios de inclusión y exclusión de pacientes e incluso con diferentes presentaciones de un mismo fármaco para el caso de las pautas con LPV (cápsulas y comprimidos) o con NVP (formulación normal y de liberación retardada), por lo que los resultados podrían haber sido diferentes si todas las pautas se hubieran administrado en poblaciones y momentos similares. Por ejemplo, los estudios realizados más recientemente incluyen menores porcentajes de pacientes con peor pronóstico: aquellos con cifras bajas de linfocitos CD4 (<100/200células/μl) y cifras elevadas de carga viral plasmática (>100.000copias/ml). Esto conlleva que se obtengan resultados de eficacia más elevados que en estudios realizados en períodos anteriores. Este hecho podría favorecer a los fármacos que solo disponen de estudios recientes. Por otra parte, hay fármacos que tienen limitaciones de uso: NVP solo puede iniciarse en mujeres con cifras de CD4<250células/μl o varones con CD4<400células/μl, y RPV solo está aprobada para uso en sujetos con carga viral plasmática basal inferior a 100.000copias/ml, aunque en el presente análisis se ha utilizado la eficacia global sin tener en cuenta la carga viral basal. En los estudios de RPV se seleccionaron pacientes similares a los incluidos en los estudios del resto de fármacos, por lo que los datos de eficacia se refieren a grupos de pacientes comparables. Sin embargo, en los estudios de NVP considerados (ARTEN27 y VERxVE35) solo se incluyó a sujetos con cifras bajas de CD4, que puede explicar los resultados de eficacia menores que en el resto de las pautas. Además, para el estudio ACTG 520237 no se disponía de datos de los EA a 48semanas, por lo que se han considerado los datos a 96semanas, asumiendo que la mayoría de los EA se producen en las primeras 48semanas. Otra limitación es que no todos los ensayos especifican qué EA son atribuibles al TARV, habiéndose considerado los EA que en opinión de los expertos son atribuibles a los TARV, por ser la mejor evidencia disponible. Las pautas con ABC/3TC salen penalizadas en términos de coste-eficacia en parte porque en los ensayos que las avalan (fundamentalmente el ACTG 5202) no se realizó sistemáticamente la determinación de HLA B5701 a todos los pacientes que tomaron ABC/3TC; esto podría explicar que el número de abandonos por EA fuera superior, lo cual se traduce en una menor eficacia. Esta no es la práctica clínica en la actualidad, puesto que en todos los casos que se utiliza ABC/3TC se realiza previamente dicha determinación. De igual manera, en función de la opinión de expertos, se han estimado los recursos necesarios para el manejo de los EA y las pautas alternativas que se emplean cuando se suspende la pauta inicial, ya que no existe mejor evidencia científica. Aunque la metodología utilizada asegura un consenso a nivel nacional, los cálculos podrían diferir en otros países. Finalmente, para evaluar la eficacia de las pautas se ha utilizado la modalidad de análisis por intención de tratar en los expuestos (ITT-E) asignando las pérdidas o seguimientos incompletos a fracasos (missing or non-completer=failure) que no coincide necesariamente con el end-point principal de algunos estudios, pero los datos de las publicaciones permiten calcularlo. Podrían haberse utilizado otras modalidades de análisis para calcular la eficacia, con lo que los resultados quizás hubieran sido algo diferentes. Por otra parte, cuando se ha dispuesto de más de un ensayo clínico para una pauta, no se ha podido realizar un metaanálisis, debido a que no tienen comparadores comunes. Otra limitación sería que los hallazgos son aplicables exclusivamente a España y teniendo en cuenta los precios oficiales de los medicamentos, sin considerar posibles descuentos locales, aunque sean habituales. En conjunto, todas estas limitaciones obligan a interpretar los resultados con cautela, especialmente en entornos alejados del promedio español.
El estudio también tiene sus fortalezas, entre ellas, que se ha utilizado la mejor evidencia científica disponible, y que para manejar la incertidumbre subyacente en los costes y resultados se ha llevado a cabo un análisis de sensibilidad que permite conocer el rango de verosimilitud en el que podrían oscilar los ratios de coste/eficacia para cada pauta de TARV. Otra fortaleza es que como los estimadores de eficacia aplicados en el modelo son universales y la metodología es aplicable a cualquier entorno, los resultados podrían ser válidos en cualquier contexto, si se pudiesen asignar los costes locales.
Por estas razones, y teniendo en cuenta que los costes de los recursos utilizados en el manejo de pacientes con VIH son diferentes para cada centro —pudiendo ser diferentes incluso los costes del TARV—, así como la potencial utilización de fármacos genéricos en el futuro47, se ha desarrollado una aplicación informática disponible gratuitamente en <https://dl.dropboxusercontent.com/u/35731022/coste-eficacia-2013/aplicacion-tarv-vih-2013.exe> y en <http://www.gesida.seimc.org> que permite calcular los costes de TARV, los costes de iniciar TARV, la eficiencia (coste/eficacia) y la eficiencia relativa de iniciar tratamiento con las diferentes pautas considerando los costes locales. Esta aplicación permite a los centros interesados realizar sus propias estimaciones utilizando el mismo modelo de evaluación económica desarrollado en este estudio.
El diseño idóneo para conocer la eficiencia del TARV en la práctica clínica habitual sería un estudio de coste/efectividad de cohortes prospectivas con pacientes seguidos durante periodos de tiempo prolongados, pero es poco probable que estos estudios puedan ser realizados. A falta de este tipo de estudios, los modelos de coste/eficacia permiten examinar los costes y la eficiencia del TARV con la mejor evidencia científica disponible.
Los hallazgos del presente estudio resultan relevantes porque los sistemas sanitarios tienen como misión maximizar los resultados de salud en la población con los recursos disponibles, que son inherentemente limitados. En este contexto, garantizar la sostenibilidad del sistema requiere una utilización eficiente de los recursos48,49. Estudios de evaluación económica como este realizados periódicamente pueden ayudar a los profesionales sanitarios, gerentes y decisores políticos a mejorar su proceso de toma de decisiones en el manejo de la infección por VIH.
FinanciaciónEl estudio ha sido promovido y financiado por el Grupo de Estudio de Sida (GESIDA) de la SEIMC y ha contado con el patrocinio científico y soporte de la Red de Investigación en Sida (RIS RD06/0006 y RD12/0017).
Conflicto de interesesAntonio Javier Blasco no tiene potenciales conflictos de intereses relacionados con el presente estudio.
Josep Maria Llibre ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen, Merck, Pfizer, Roche y ViiV Healthcare y ha recibido compensación económica por conferencias de Abbott, Boehringer- Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen-Cilag, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare, así como pagos por desarrollos de presentaciones educacionales para Boehringer-Ingelheim, Merck y ViiV.
José R. Arribas ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Janssen; ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, y ha recibido pago por desarrollo de presentaciones educacionales para Janssen.
Vicente Boix ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, y ha recibido compensación económica por charlas de Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare.
Bonaventura Clotet ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Gilead Sciences, Janssen, Merck, Shionogy, Tibotec y ViiV Healthcare.
Pere Domingo ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
Juan González-García ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag y Merck Sharp & Dohme y ha recibido compensación económica por charlas patrocinadas por Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Hernando Knobel ha efectuado labores de consultoría para los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen, Merck y ViiV Healthcare, y ha recibido compensación económica por conferencias de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, Janssen y ViiV Healthcare.
Juan Carlos López Bernaldo de Quirós ha efectuado labores de consultoría en los laboratorios Gilead, Abbott, Bristol-Myers-Squibb, y ha recibido compensación económica por charlas patrocinadas por Abbott, Bristol-Myers-Squibb, Gilead, ViiV Health Care, Boehringer, Janssen-Cilag, MSD.
Fernando Lozano ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen-Cilag and Roche Pharmaceuticals, y ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen-Cilag, Merck-Sharp & Dohme, Pfizer y Roche Pharmaceuticals.
José M. Miró ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Bristol- Myers Squibb, Cubist, Gilead Sciences, Merck, Novartis, Pfizer y Theravance, ha disfrutado de becas para investigación clínica de Cubist, Novartis, Fondo de Investigaciones Sanitarias (FIS) del Instituto de Salud Carlos III (Madrid), Fundación para la Investigación y Prevención del Sida en España (FIPSE, Madrid), Ministerio de Sanidad, Política Social e Igualdad (MSPSI, Madrid), National Institutes of Health (NIH, Bethesda, MA, EE.UU.), ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Cubist, GlaxoSmithKline, Gilead Sciences, Janssen, Merck, Novartis, Pfizer, Roche, Schering-Plough, Theravance y ViiV Healthcare. El Dr. J.M. Miró tuvo durante el año 2011 una beca (INT 10/219) de Intensificación de la Actividad Investigadora del Sistema Nacional de Salud y del Departamento de Salud de la Generalitat de Cataluña (Programas I3 SNS y PRICS).
Daniel Podzamczer ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, GlaxoSmithKline, Pfizer y Roche, ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, GlaxoSmithKline, Pfizer y Roche, y ha recibido compensación económica por charlas de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, GlaxoSmithKline, Janssen, Merck y Roche.
Juan Miguel Santamaría ha efectuado labores de consultoría en los laboratorios Janssen-Cilag y Merck Sharp & Dohme y ha recibido becas y ayudas de investigación de Abbott y Merck. Ha participado en charlas o simposios patrocinados por Janssen-Cilag, Merck Sharp & Dohme, Gilead y Abbott.
Montserrat Tuset ha disfrutado de becas para investigación clínica de laboratorios Bristol-Myers Squibb, Gilead Sciences y Merck, y ha recibido compensación económica por charlas de Janssen, Merck y ViiV Healthcare.
Laura Zamora no tiene conflictos de intereses.
Pablo Lázaro no tiene potenciales conflictos de intereses relacionados con el presente estudio.
Josep M. Gatell ha efectuado labores de consultoría en los laboratorios Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbott Laboratories, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare, y ha recibido compensación económica por charlas de Abbott Laboratories, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Merck y ViiV Healthcare.