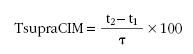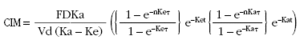Introducción
La cavidad oral está formada por un conjunto de tejidos y estructuras que constituyen diferentes ecosistemas colonizados por diferentes microorganismos que forman la microbiota oral. Una alteración en este sistema ecológico puede provocar la aparición de enfermedades e infecciones cuya evolución estará condicionada por el estado general de salud del paciente, la causa de la infección, su localización y gravedad, así como por el tratamiento instaurado1.
El tratamiento de este tipo de procesos incluye a menudo el empleo de agentes antimicrobianos, aunque cabe destacar el hecho de que los tratamientos con antibióticos no están indicados para la mayoría de pacientes con terapia periodontal2. Sin embargo, hay claras evidencias que demuestran que odontólogos de diferentes países los prescriben inadecuadamente tanto terapéutica como profilácticamente3-9. Algunas publicaciones recogen la gravedad de la situación en España, donde el elevado consumo de antibióticos y la rápida incorporación de nuevas moléculas antimicrobianas al arsenal terapéutico han propiciado la elevada tasa de resistencia antimicrobiana, que es una de las más altas en la Unión Europea, especialmente a nivel comunitario10-12.
Ante esta situación, en los últimos años se están buscando vías para mejorar el uso de estos fármacos, fundamentalmente con dos objetivos: asegurar que se administre el antibiótico indicado a las dosis e intervalos adecuados, y evitar la aparición de cepas bacterianas resistentes. Para ello se han introducido los "índices de eficacia"13 como parámetros que tienen en consideración tanto las propiedades farmacocinéticas como las propiedades farmacodinámicas de los antibióticos. La farmacocinética estudia los procesos de absorción, distribución y eliminación del fármaco y sus metabolitos a lo largo del tiempo. La farmacodinámica estudia la relación entre el antimicrobiano y el microorganismo a través del tiempo, determinando los efectos de las variaciones de las concentraciones de fármaco en el efecto bactericida.
Considerando los pocos ensayos clínicos bien diseñados realizados hasta el momento sobre el tratamiento antimicrobiano de este tipo de infecciones14, en este estudio se han aplicado criterios farmacocinéticos/farmacodinámicos con el objetivo de evaluar la eficacia de los tratamientos más utilizados para tratar las infecciones orales odontogénicas.
Métodos
En primer lugar se llevó a cabo una búsqueda bibliográfica utilizando la base de datos Medline para conocer los microorganismos implicados con más frecuencia en las infecciones odontógenas y los antibióticos más utilizados en la práctica clínica. Posteriormente se buscaron los parámetros farmacocinéticos de los antimicrobianos y sus valores de concentración inhibitoria mínima (CIM90) frente a las bacterias implicadas.
Aunque la microbiota oral es extraordinariamente compleja, diversos autores incluyen las siguientes bacterias entre las más frecuentemente aisladas en este tipo de infecciones: estreptococos del grupo viridans, Peptostreptococcus spp., Prevotella intermedia, Porphyromonas gingivalis y Fusobacterium nucleatum1,15,16.
Entre los tratamientos estudiados se incluyeron representantes de las familias de antibióticos más utilizados. Se ha evaluado la eficacia de antibióticos del grupo de los betalactámicos: amoxicilina, con o sin ácido clavulánico (AMOX, AMOX-CA), cefuroxima axetilo (CROX-AX) y penicilina V (PENV); macrólidos: azitromicina (AZI), eritromicina (ERY) y espiramicina (SPR); lincosaminas: clindamicina (CLI); quinolonas: levofloxacino (LVX) y moxifloxacino (MXF); nitroimizadoles: metronidazol (MTR); tetraciclinas: minociclina (MIN); y ketólidos: telitromicina (TEL).
Los fármacos se dividieron en dos grupos:
1.Aquellos que tienen actividad antimicrobiana dependiente de tiempo (amoxicilina, cefuroxima axetilo, penicilina V, eritromicina, espiramicina y clindamicina), cuya eficacia radica en que sus concentraciones se encuentren durante el tiempo necesario por encima de la CIM de la bacteria que produce el proceso infeccioso. Niveles mayores no aumentan el efecto bactericida. Esto se debe a que la velocidad bactericida es relativamente pequeña y sólo persiste si los niveles se mantienen por encima de la CIM.
2.El segundo grupo lo constituyen los que poseen actividad dependiente de concentración (azitromicina, levofloxacino, moxifloxacino, metronidazol, minociclina y telitromicina), en los que el efecto bactericida aumenta a medida que se incrementa la concentración hasta llegar a un punto de máximo efecto.
En el caso de los antimicrobianos de actividad dependiente de tiempo, se ha utilizado como índice de eficacia el tiempo durante el cual las concentraciones plasmáticas permanecen por encima de la CIM una vez se ha alcanzado el estado estacionario, expresado como porcentaje del intervalo de dosificación (tsupraCIM). Para ello se ha utilizado la siguiente ecuación, que rige la evolución de las concentraciones plasmáticas tras una administración extrabasal en un régimen de dosis múltiples.
donde C es la concentración plasmática a tiempo t, F la fracción biodisponible, D la dosis administrada, Vd el columen de distribución, Ka y Ke la constante de absorción y eliminación respectivamente, n el número de dosis administradas y t el intervalo de dosificación.
Se han calculado en un intervalo de tiempo dentro del estado de equilibrio estacionario los tiempos t1 y t2 en los que el valor de la ecuación coincide con el de la CIM, es decir, se ha despejado t de la siguiente ecuación:
Este cálculo se ha hecho utilizando el programa DERIVE17, introduciendo parámetros poblacionales medios. Al despejar t se obtienen, como se ha dicho, dos tiempos t1 y t2. Por diferencia entre t2 y t1 se puede calcular el tiempo que las concentraciones plasmáticas superan el valor de CIM dentro de ese intervalo, y para calcular el valor como porcentaje del intervalo de dosificación se utiliza la siguiente ecuación:
Se considera que un tratamiento es eficaz cuando tsupraCIM es mayor al 40% para penicilinas y 50% para el resto de antibióticos18.
Para los antimicrobianos dependientes de concentración se calculó el cociente ABC/CIM90, siendo ABC el área bajo la curva concentración plasmática-tiempo en 24 h. El ABC de azitromicina, levofloxacino, metronidazol y minococlina se obtuvo a partir de simulaciones realizadas con el programa WinNonlin19, siguiendo un modelo monocompartimental con absorción y eliminación de primer orden. Para llevar a cabo las simulaciones se utilizaron parámetros farmacocinéticos poblacionales medios. Con moxifloxacino y telitromicina no se pudieron llevar a cabo las simulaciones y se consideraron valores medios de ABC obtenidos de la literatura especializada. Para conseguir eficacia con este tipo de antibióticos es necesario alcanzar un valor de ABC/CIM90 superior a 25 en infecciones no graves en pacientes inmunocompetentes18.
Resultados
En la tabla 1 se muestran los valores de CIM90 de los antimicrobianos frente a los cinco microorganismos considerados. La tabla 2 presenta los parámetros farmacocinéticos medios poblacionales que se han utilizado para llevar a cabo el estudio. En las tablas 3, 4 y 5 se pueden ver los regímenes de dosificación que se han estudiado con cada antibiótico, así como cuáles de las 47 pautas de dosificación estudiadas resultan eficaces para el tratamiento de infecciones provocadas por los cinco microorganismos considerados.
La tabla 3 muestra los valores de tsupraCIM de los tratamientos con penicilinas. Los valores sombreados corresponden a los casos en los que se consigue un valor de tsupraCIM > 40%, que se corresponde con los tratamientos eficaces. Los tratamientos con los que se obtienen valores inferiores al 40% se presentan sin sombrear. Amoxicilina-ácido clavulánico presentó índices de eficacia adecuados con cuatro de las seis posologías estudiadas. Con penicilina V y amoxicilina no se obtuvieron resultados tan satisfactorios con todos los microorganismos.
En la tabla 4 se presentan los resultados de los tratamientos con el resto de antibióticos dependientes de tiempo. En este caso se presentan sombreadas las pautas con las que se consiguió un tsupraCIM > 50% y sin sombrear si no se alcanzó dicho valor. Los regímenes posológicos estudiados para cefuroxima axetilo, eritromicina y espiramicina no proporcionaron buenos resultados. Clindamicina en cambio ofreció valores de tsupraCIM > 50% frente a todos los microorganismos al administrar por lo menos 300 mg/6 h.
Los resultados de los antibióticos con actividad dependiente de concentración se presentan en la tabla 5. Los tratamientos eficaces, que se presentan sombreados, son aquellos con los que se obtuvo un cociente ABC/CIM > 25. Moxifloxacino fue el único antibiótico de este grupo con el que se obtuvieron índices de eficacia adecuados en todos los casos.
Discusión
En todas las áreas médicas es muy importante seleccionar adecuadamente el fármaco administrado y la odontología no es una excepción. Una correcta selección del antibiótico es muy importante dado que éstos pueden ser una herramienta muy útil en odontología siempre que se usen de forma correcta y en los casos en los que sea necesario recurrir a éstos. Es necesario seleccionar un fármaco que resulte eficaz y seguir un régimen posológico que asegure concentraciones adecuadas de dicha molécula en el lugar de la infección.
Los regímenes de dosificación de los antimicrobianos están condicionados por las características farmacocinéticas y farmacodinámicas de los mismos. Durante mucho tiempo sólo se tenían en cuenta las propiedades farmacocinéticas (qué efecto ejerce el organismo sobre el fármaco, que normalmente se refleja por el perfil de concentraciones plasmáticas, aunque es de especial interés la penetración del fármaco en el lugar de la infección). Pero para asegurar la eficacia terapéutica también es necesario tener en cuenta las propiedades farmacodinámicas, es decir, qué efecto produce el fármaco sobre el organismo. La susceptibilidad del individuo al antibiótico, determinada por la CIM es reflejo de la potencia del fármaco. Para entender la importancia del régimen posológico en la eficacia del tratamiento es necesario integrar las características farmacocinéticas y farmacodinámicas.
El estudio farmacocinético/farmacodinámico se presenta como una nueva vía para evaluar la sensibilidad bacteriana a los regímenes de dosificación con el fin de evitar opciones poco adecuadas y que contribuyan al desarrollo de resistencias.
Considerando que en la práctica habitual el tratamiento antimicrobiano en infecciones orofaciales se instaura sin llevar a cabo un cultivo, aislamiento e identificación de los microorganismos implicados, se aconseja establecer un tratamiento que abarque los microorganismos más frecuentemente aislados. En consecuencia, y en función de los resultados obtenidos en este estudio aplicando criterios farmacocinéticos/farmacodinámicos, los antibióticos de elección serían clindamicina, moxifloxacino y amoxicilina-clavulánico. En lo referente a clindamicina, se recomienda administrar 300 mg/6 h, ya que es la dosis mínima eficaz de este antimicrobiano. No es recomendable recurrir a dosis más altas dado que se vería favorecida la aparición de efectos adversos. El tratamiento habitual con moxifloxacino, consistente en 400 mg/24 h resulta adecuado para este tipo de infecciones. Respecto a amoxicilina-ácido clavulánico, los regímenes más adecuados serían 500 mg/8 h, por ser la mínima dosis eficaz de amoxicilina, o 1.000 mg/ 12 h por ser mayor el intervalo de dosificación, de modo que el número de tomas diarias se reduce de tres a dos. La administración de 500 mg/8 h implica la administración conjunta de 125 mg de ácido clavulánico, lo que supone una dosis diaria de 375 mg que podría favorecer la aparición de trastornos digestivos asociados al inhibidor de betalactamasas. Por otro lado, en el mercado no existe ninguna formulación con amoxicilina-ácido clavulánico que incluya 1.000 mg de amoxicilina, por lo que sería necesario administrar conjuntamente 1 comprimido de 500 mg de amoxicilina más otro de 500/125 mg de amoxicilina-ácido clavulánico cada 12 h. Esto podría disminuir la adherencia al tratamiento por parte del paciente y conducir al abandono del mismo.
Por otro lado, Rhodogil® es una especialidad recomendada frecuentemente en este tipo de infecciones que merece ser mencionada. El tratamiento consiste en 2 comprimidos cada 8 h, lo que equivale a 500 mg de espiramicina y 250 mg de metronidazol. Según los resultados de este estudio, dichas dosificaciones no cubren adecuadamente el espectro bacteriano de este tipo de infecciones.
Por último, cabe decir que sería conveniente desarrollar ensayos clínicos en este campo que pudieran confirmar los resultados obtenidos en este estudio, porque a pesar de que se ha demostrado la utilidad del análisis farmacocinético/farmacodinámico en otros campos de la patología infecciosa, como infecciones del tracto respiratorio y otitis media20-22, hasta el momento no se ha aplicado para infecciones odontógenas. Tal y como sugieren Presston et al23, los resultados obtenidos en este estudio PK/PD podrían ser útiles para el diseño de ensayos clínicos, ya que el hecho de conocer los índices de eficacia de cada tratamiento podría permitir una óptima selección de la dosificación a la hora de diseñar dichos ensayos clínicos para maximizar la respuesta del tratamiento con cada antibiótico.