Introducción
La resistencia mediada por betalactamasas de espectro extendido (BLEE) continúa siendo la principal causa de resistencia a las oxiiminocefalosporinas en enterobacterias. En gran medida las BLEE derivan de betalactamasas de amplio espectro, tipo TEM-1 y SHV-1 1, sin embargo surgieron nuevas familias como PER (1 y 2) 2, las OXA derivadas 3 y las CTX-M derivadas, incluyendo en éstas a Toho (1 y 2) 4, que no están estrechamente relacionadas a TEM ni a SHV.
En Alemania, a comienzos de 1989, Bauerfeind describió aislados clínicos de Escherichia coli resistentes a cefotaxima productores de una BLEE no derivada de TEM ni SHV, a la que llamó CTX-M-1 en referencia a su potente actividad de hidrólisis sobre cefotaxima. Al mismo tiempo, en Argentina fueron aisladas distintas serovariedades de Salmonella con características de resistencia similares a la anterior. Las betalactamasas responsables de la resistencia a cefotaxima (CTX) observada mostraban un valor de punto isoeléctrico (pI) alcalino, con una actividad de hidrólisis mayor sobre CTX respecto de ceftazidima (CAZ) y con sensibilidad a los inhibidores como sulbactam, tazobactam y ácido clavulánico 5. Esta enzima fue denominada CTX-M-2 6. Actualmente, Argentina muestra una alta prevalencia de CTX-M-2 dentro de la familia Enterobacteriaceae y, en menor proporción, otras BLEE como PER-2 y enzimas SHV derivadas 7.
Hasta el momento, la familia CTX-M está integrada por más de 30 enzimas que pueden subclasificarse de acuerdo con la similitud en las secuencias de aminoácidos. La enzima CTX-M-2 pertenece al grupo que lleva el mismo nombre 4. Las enzimas naturales de Kluyvera ascorbata presentan un alto grado de identidad con las enzimas del grupo CTX-M-2 (> 98%), por lo que han sido propuestas como posibles antecesores de esta betalactamasa plasmídica 8.
Debido a que existen notables diferencias entre las BLEE prevalentes en nuestra región y las del hemisferio norte de América y otras regiones del mundo, es necesario evaluar la capacidad de los distintos métodos para detectar las BLEE presentes en nuestra región.
En este trabajo se han identificado las BLEE presentes en aislados clínicos de Klebsiella pneumoniae, E. coli y Proteus mirabilis.
El objetivo principal fue investigar la presencia de las distintas BLEE en estas especies de enterobacterias y comparar tres métodos microbiológicos para su detección. Se estandarizó el método de placas con agar Müeller-Hinton suplementado con clavulanato de litio y se comparó con métodos ya descritos, como la técnica de sinergia de doble disco y los discos de CTX y CAZ suplementados con el inhibidor propuesto por el National Committee for Clinical Laboratory Standards (NCCLS) 9,10.
Métodos
Se estudiaron todos los aislados de K. pneumoniae, E. coli y P. mirabilis de pacientes internados en diferentes sectores del Hospital J.M. Cullen de la ciudad de Santa Fe, Argentina, desde el mes de enero hasta junio de 2000. La identificación de las cepas se realizó mediante pruebas bioquímicas convencionales. Para el estudio se incorporaron los aislados clínicos resistentes a CTX y/o CAZ, tomando como punto de corte el propuesto por el NCCLS 10.
Pruebas de sensibilidad a antibióticos
Se evaluó la sensibilidad a antibióticos por el método de difusión con discos y el método de dilución en agar, de acuerdo con lo establecido por el NCCLS 10,11. Los antibióticos utilizados en el método de difusión fueron: ampicilina (AMP), amoxicilina-ácido clavulánico (AMC), piperacilina (PIP), cefalotina (CEF), cefoxitina (CXT), cefotaxima (CTX), ceftazidima (CAZ) e imipenem (IMP), gentamicina (GEN), amikacina (AKN), trimetoprima + sulfametoxazol (TMS) y ciprofloxacino (CIP) (Laboratorio Britania, Argentina). Los antibióticos ensayados por el método de dilución fueron: ampicilina (Bagó) (AMP), ampicilina (Bagó)/clavulanato de litio (Roemmers) (AMC), piperacilina (John Wyeth) (PIP), cefalotina (Glaxo) (CEF), cefoxitina (CXT), cefotaxima (Hoechst Marion Roussel) (CTX), cefotaxima (Hoechst Marion Roussel)/clavulanato de litio (Roemmers) (CTX-cla), ceftazidima (Glaxo) (CAZ), ceftazidima (Glaxo)/clavulanato de litio (Roemmers) (CAZ-cla) e imipenem (Merck-Sharp and Dohme) (IMP).
Métodos microbiológicos para la detección de BLEE
1. Método de sinergia de doble disco. Se ensayaron discos de CTX (30 μg), CAZ (30 μg) y AMC (20/10 μg) dispuestos en una placa de agar Müeller-Hinton de acuerdo con lo descrito en la bibliografía 9. Las placas se incubaron 18-24 h a 37 °C en atmósfera aeróbica.
Los aislados que presentaron un ensanchamiento en la zona de inhibición comprendida entre los discos de CTX o CAZ y AMC se consideraron positivos para la presencia de BLEE.
2. Ensayo confirmatorio de la presencia de BLEE (normas NCCLS). Se ensayaron discos estándar de CTX (30 μg) y CAZ (30 μg), y los mismos suplementados con 10 μg de clavulanato de litio en una placa de agar Müeller-Hinton, siguiendo la metodología propuesta por el NCCLS 10. Estos discos fueron preparados en el laboratorio agregando 10 μl de una solución de clavulanato de litio (1 mg/ml) a discos comerciales de las respectivas oxiiminocefalosporinas.
Se compararon los diámetros de halos de los discos ensayados con y sin el inhibidor de betalactamasas.
Un incremento mayor o igual a 5 mm en la zona de inhibición del disco que contiene el inhibidor de betalactamasas fue considerado positivo para la presencia de BLEE.
3. Placas de agar Müeller-Hinton suplementado con clavulanato de litio. Se prepararon placas de Petri de 90 mm de diámetro con 25 ml de agar Müeller-Hinton, suplementado con clavulanato de litio (Roemmers) (MH-cla) en una concentración final de 4 μg/ml, y placas con 25 ml de agar Müeller-Hinton sin inhibidor de betalactamasas. En ambas placas se sembró un inóculo bacteriano equivalente en densidad a la escala 0,5 Mc Farland (10 8 unidades formadoras de colonias [UFC]/ml) y se ensayaron discos de CTX (30 μg) y CAZ (30 μg) incubándose 18-24 h a 37 °C en aerobiosis. Luego se compararon los diámetros de halo de inhibición obtenidos en ambas placas por cada aislado estudiado. Un incremento mayor o igual a 5 mm en la zona de inhibición del disco ensayado en la placa suplementada con inhibidor fue considerado positivo para la presencia de BLEE.
Determinación del punto isoeléctrico
Los extractos enzimáticos crudos se obtuvieron por cultivo en 50 ml de caldo tripteína-soja suplementado con ampicilina 50 μg/ml e incubados 18 h a 37 °C, y luego se centrifugaron a 8.000 rpm durante 20 min a 4 °C con rotor SS-34 (Sorvall). La rotura de la envoltura celular se realizó mediante sonicado respetando las siguientes condiciones: 8 ciclos de 30 s cada uno con un output 4-5 en baño de hielo empleando un sonicador Vibra Cell (Sonics & Materials Inc., Estados Unidos). Posteriormente se centrifugó a 15.000 rpm durante 20 min a 4 °C con rotor SS-34 (Sorvall). La determinación del pI se realizó por el método de Mathew et al 12 en geles de poliacrilamida al 30% de amplio rango de pH 3-10, utilizando un equipo LKB Multiphor II (Pharmacia Sweden).
Para evidenciar la actividad enzimática de las betalactamasas, los geles se revelaron por el método yodométrico de Labia y Barthélémy 13 utilizando de manera alternativa AMP (500 μg/ml) y CTX o CAZ (1.000 μg/ml) como sustrato 5. Los puntos isoeléctricos de las betalactamasas se estimaron mediante enzimas de pI conocido (TEM-1, SHV-5, CTX-M-2 y PER-2) y marcadores de pI comerciales (Pharmacia).
Determinación del perfil de hidrólisis enzimático
Se evaluó la actividad enzimática de los extractos crudos por el método yodométrico, en placas de 150 mm de diámetro con 50 ml de agar almidón al 1,5% y 800 μl de una solución I2/IK con los siguientes antibióticos betalactámicos como sustrato: AMP (500 μg/ml), AMC (500/4 μg/ml), CEF (1.000 μg/ml), CTX (1.000 μg/ml), CAZ (1.000 μg/ml) e IMP (500 μg/ml). Se sembraron por triplicado 20 μl de cada extracto e incubaron las placas a 37 °C durante no menos de 30 min.
Detección de genesbla
Se realizó mediante reacción en cadena de la polimerasa (PCR) utilizando ADN plasmídico obtenido por el método de lisis alcalina de Birnboim y Doly modificado 14. Los genes bla se amplificaron utilizando como cebadores los que se detallan en la tabla 1 con el siguiente protocolo: 5 min a 95 °C, 30 ciclos (1 min de desnaturalización a 94 °C, 1 min de anneling a 52 °C, 1,5 min de extensión a 72 °C) y 10 min finales de extensión a 72 °C.
Resultados
Aislados clínicos y resistencia
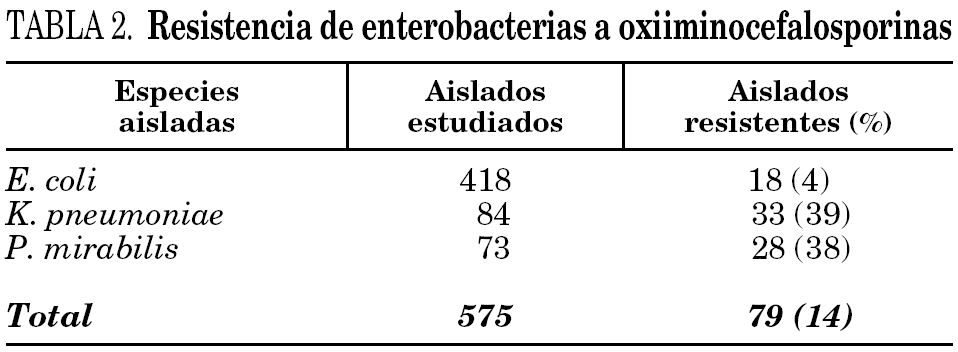
Sobre un total de 575 aislados de E. coli, K. pneumoniae y P. mirabilis recuperadas en el período en estudio, el 14% (79 aislados) resultó resistente a oxiiminocefalosporinas, tanto en los ensayos de susceptibilidad por difusión como por dilución. La distribución de especies y el porcentaje de resistencia a estas sustancias se muestran en la tabla 2.
Todos los aislados resistentes a oxiiminocefalosporinas lo fueron para CTX, pero no todos lo fueron para CAZ. No se detectaron aislados resistentes a CAZ y sensibles a CTX, ni resistentes a carbapenemes. En ningún caso se observó resistencia a CXT.
Métodos microbiológicos para la detección de BLEE
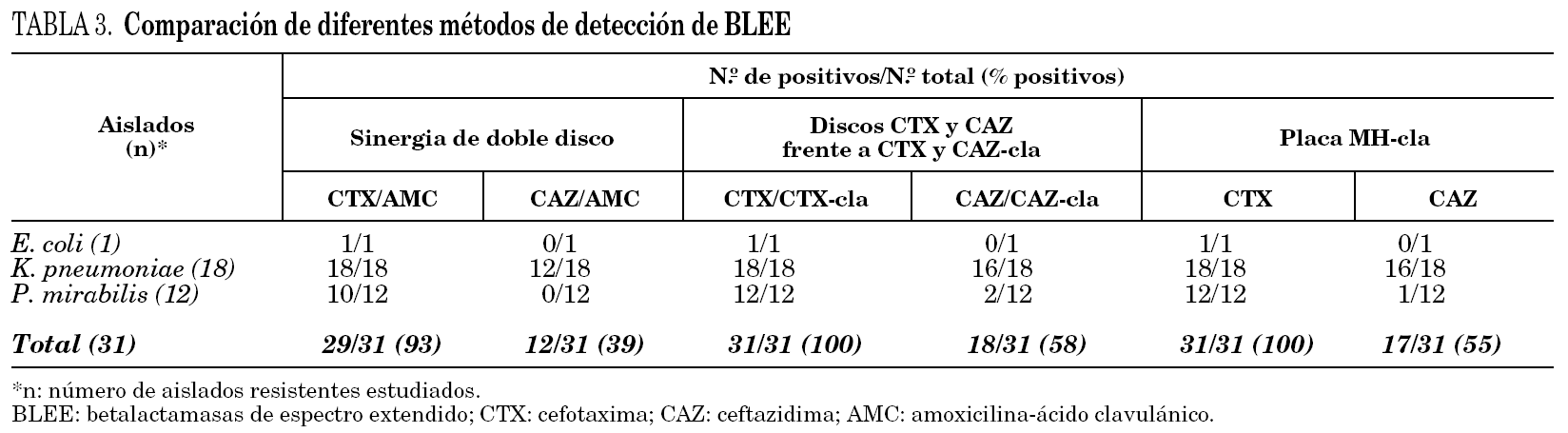
Se analizaron 31 aislados resistentes a oxiiminocefalosporinas: K. pneumoniae (18), P. mirabilis (12) y E. coli (1) seleccionados al azar, con diferencia en el perfil de resistencia a antibióticos no betalactámicos.
El método de sinergia de doble disco utilizando la combinación CTX/AMC detectó la producción de BLEE en el aislado de E. coli y en todos los aislados de K. pneumoniae, pero falló en 2 de los 12 aislados de P. mirabilis. Utilizando la combinación CAZ/AMC se detectó la producción de BLEE en 12 de los 18 aislados de K. pneumoniae, y también falló en el aislado de E. coli y en todos los aislados de P. mirabilis.
Aplicando el método propuesto por el NCCLS y utilizando discos de CTX/CTX-cla se detectó la presencia de BLEE en todos los aislados estudiados, mientras que CAZ/ CAZ-cla la detectó en 16 de los 18 aislados de K. pneumoniae, 2 de los 12 para P. mirabilis y falló en la detección de E. coli.
La placa de MH-cla y discos de CTX reveló la presencia de BLEE en todos los aislados; sin embargo, utilizando el disco de CAZ sólo se detectó la presencia de BLEE en 16 de los 18 aislados de K. pneumoniae y en 1 de los 12 aislados de P. mirabilis (tabla 3).
Perfil de hidrólisis enzimático
Los extractos crudos de todas las especies analizadas revelaron una potente actividad de hidrólisis frente a AMP, CEF y CTX. La mayor parte de los aislados de P. mirabilis no presentaron actividad hidrolítica frente a CAZ. En ningún aislado se comprobó actividad de hidrólisis frente a AMC o IMP (datos no mostrados).
Distribución de BLEE en los aislados clínicos estudiados
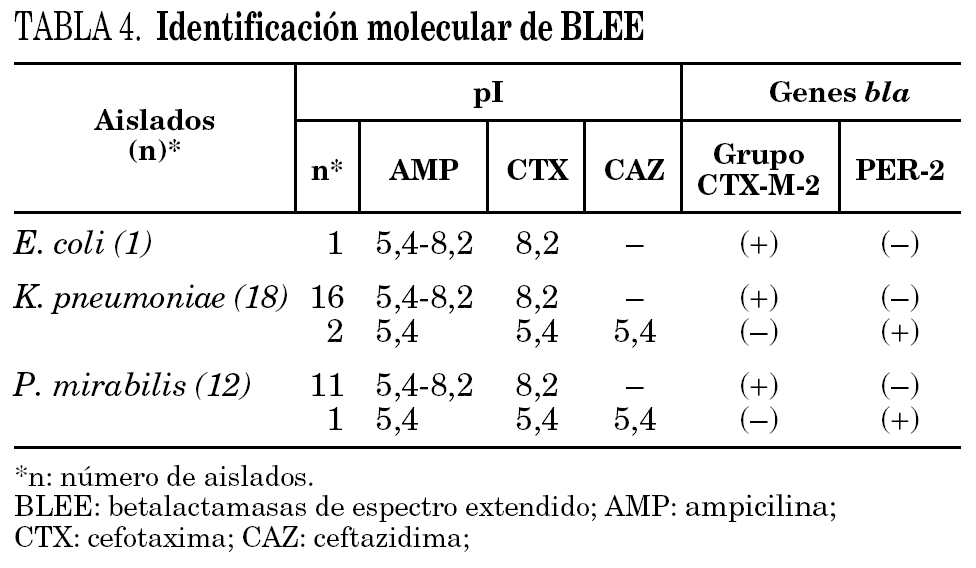
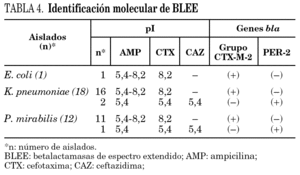
Mediante isoelectroenfoque de las BLEE presentes en los extractos crudos y amplificación por PCR de los genes codificantes, pudieron caracterizarse dos tipos de BLEE: el grupo CTX-M-2 (28 aislados: 1 para E. coli, 16 para K. pneumoniae y 11 para P. mirabilis), con un pI 8,2 y PER-2 (3 aislados: 2 para K. pneumoniae y 1 para P. mirabilis), con un pI 5,4 (tabla 4). La presencia de enzimas de pI 5,4 con actividad de hidrólisis frente a AMP pero no frente a CTX y CAZ probablemente se deba a la presencia de la betalactamasa de amplio espectro TEM-1, ampliamente distribuida en enterobacterias. Las amplificaciones realizadas fueron específicas para PER-2 (primers 1 y 2) y para el grupo CTX-M-2 (primers 3 y 4). No hubo amplificación de genes tipo SHV (primers 5 y 6) y no se detectó la presencia de más de una BLEE en un mismo aislado.
Discusión
La correcta elección de una o más cefalosporinas de espectro extendido para los ensayos de disco es de capital importancia a la hora de detectar la presencia de BLEE en aislados clínicos.
La gran diseminación de mecanismos de resistencia en enterobacterias y el amplio predominio de CTX-M-2 en nuestro país obligó no sólo a modificar los puntos de corte de sensibilidad, sino también al desarrollo y la puesta a punto de métodos de detección con sustratos de hidrólisis que se ajustasen a esta particular situación epidemiológica molecular de las BLEE en nuestro medio.
El método de sinergia de doble disco demostró una buena sensibilidad cuando se combinó CTX y AMC, comparables a los obtenidos con los discos de CTX-cla propuestos por el NCCLS con valores de 93 y 100%, respectivamente. En este caso, la no detección mediante la técnica de sinergia de doble disco corresponde a dos aislados de P. mirabilis, siendo uno de ellos productor de la enzima PER-2, con actividad sobre CAZ en el perfil de hidrólisis de sustratos. Sin embargo, no ocurrió lo mismo cuando se utilizó la combinación CAZ y AMC o discos de CAZ-cla (NCCLS), donde pudo observarse un importante descenso en la sensibilidad (del 39 y el 58%, respectivamente).
Al investigar las BLEE presentes en los aislados de nuestra región siempre hubo correspondencia entre la amplificación para BLEE por PCR y la diferencia mayor o igual a los 5 mm en los diámetros de halo al utilizar las placas de MH/MH-cla con al menos uno de los antibióticos ensayados.
El disco de CTX en placas de MH-cla fue muy sensible respecto al disco de CAZ, y detectó la presencia de BLEE en todos los aislados de P. mirabilis, además fue equivalente a la combinación de discos de CTX/CTX-cla propuesto por el NCCLS. Para este mismo método, el disco de CAZ ensayado en placas de MH-cla tuvo una sensibilidad comparable a la combinación de discos CAZ/CAZ-cla y fue más sensible que el test de sinergia de doble disco con CAZ y AMC.
En general, todos los métodos que utilizaron CTX como sustrato fueron más sensibles para la detección de las BLEE de nuestro medio, tal y como describieron Quinteros et al 7.
Para la detección de las BLEE presentes en los aislados de P. mirabilis, K. pneumoniae y E. coli de nuestra ciudad (predominantemente cefotaximasas), la placa de MH-cla y los discos de CTX mostraron una sensibilidad comparable a la de los discos de CTX-cla propuestos por el NCCLS, además de una elevada especificidad, ya que no se detectaron resultados falsos positivos al ensayarlos en aislados de este estudio sensibles a oxiiminocefalosporinas y con resultados negativos para PCR dirigidas a los genes bla (considerados no productores de BLEE; datos no mostrados).
Finalmente, cabe destacar la presencia de la enzima PER-2 como única BLEE en P. mirabilis, dada la absoluta prevalencia de la enzima CTX-M-2 demostrada previamente en esta especie 7.
Agradecimientos
El trabajo realizado en la UBA fue financiado por ANPCyT, SECyT y Beca Carrillo Oñativia al Dr. Gabriel Gutkind y por la Fundación Roemmers a la Dra. Marcela Radice.