Introducción
El tratamiento antirretroviral de gran actividad (TARGA) ha demostrado reducir drásticamente la morbilidad y mortalidad en pacientes con infección por virus de la inmunodeficiencia humana tipo 1 (VIH-1) y, por tanto, los costes sanitarios y los relacionados con la pérdida de productividad laboral asociados a la enfermedad 1,2. Actualmente el tratamiento farmacológico es el capítulo más importante del gasto sanitario total relacionado con la infección por VIH-1 en países desarrollados 3,4. Sin embargo, el presupuesto total del tratamiento farmacológico de los pacientes infectados por VIH-1 aumenta constantemente debido a la prolongación de su esperanza de vida y al incremento constante de pacientes que acceden al TARGA 3,5. Por tanto, la mayoría de políticas de control del gasto sanitario en la infección por VIH se dirigen al control y optimización del TARGA.
La toma de decisiones sobre la elección de una alternativa terapéutica requiere evaluar la eficacia o efectividad de dichos tratamientos y sus acontecimientos adversos, así como el consumo de recursos y el coste asociado a los tratamientos 6. En los estudios sobre terapia antirretroviral, los factores clave que hay que considerar serían la adherencia, eficacia, toxicidad y el coste de los fármacos 7.
Los efectos secundarios relacionados con los antirretrovirales (lipodistrofia, neuropatía periférica, acidosis láctica, etc.) y las interacciones farmacológicas tienen una incidencia negativa sobre la adherencia o cumplimiento del tratamiento e implican un mayor riesgo de fracaso virológico 8,9. Así mismo aumentan el riesgo de acumular resistencias que limitan futuras opciones de tratamiento. Por último, contribuyen a incrementar de forma importante el coste total asociado a los TARGA 10.
La utilización de bases de datos con información sobre costes sanitarios puede resultar de gran utilidad para recoger información sobre la evolución clínica y la utilización de recursos sanitarios en pacientes infectados por el VIH-1 y facilitar así la toma de decisiones en la gestión clínica de los pacientes 11,12. Sin embargo, el uso de técnicas de extrapolación y análisis de decisión puede no adecuarse a la realidad si no han sido diseñadas por clínicos expertos en el manejo de los tratamientos antirretrovirales en la práctica clínica habitual 13.
Los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) son componentes esenciales del TARGA, constituyendo habitualmente 2 de los 3 fármacos que componen un tratamiento eficaz 14,15.
El análisis del impacto económico de la toxicidad asociada al TARGA ha sido muy escaso hasta la fecha y no se dispone de ninguna evaluación económica concluyente sobre el impacto de la sustitución de un ITIAN que causa toxicidad por otro.
El objetivo de este estudio ha sido estimar, en España, los costes totales asociados a la toxicidad producida por los ITIAN que más frecuentemente motiva su sustitución por tenofovir DF en la práctica clínica real, identificados a través de los acontecimientos adversos (AA) clínicos y anomalías de laboratorio descritos en los pacientes de un estudio multicéntrico prospectivo de ámbito nacional (Estudio Recover).
Métodos
Estimación de costes
Con el fin de evaluar los costes asociados al tratamiento de los AA relacionados con los ITIAN en pacientes infectados por el VIH-1 se ha diseñado un modelo económico de tipo análisis de costes que integra la información clínica y económica de los tratamientos considerados.
La metodología utilizada para la recogida de información sobre el consumo de recursos asociados a la toxicidad por ITIAN ha comprendido las siguientes fases de forma sucesiva: identificación, cuantificación y valoración económica de los recursos 16,17.
Identificación de los recursos
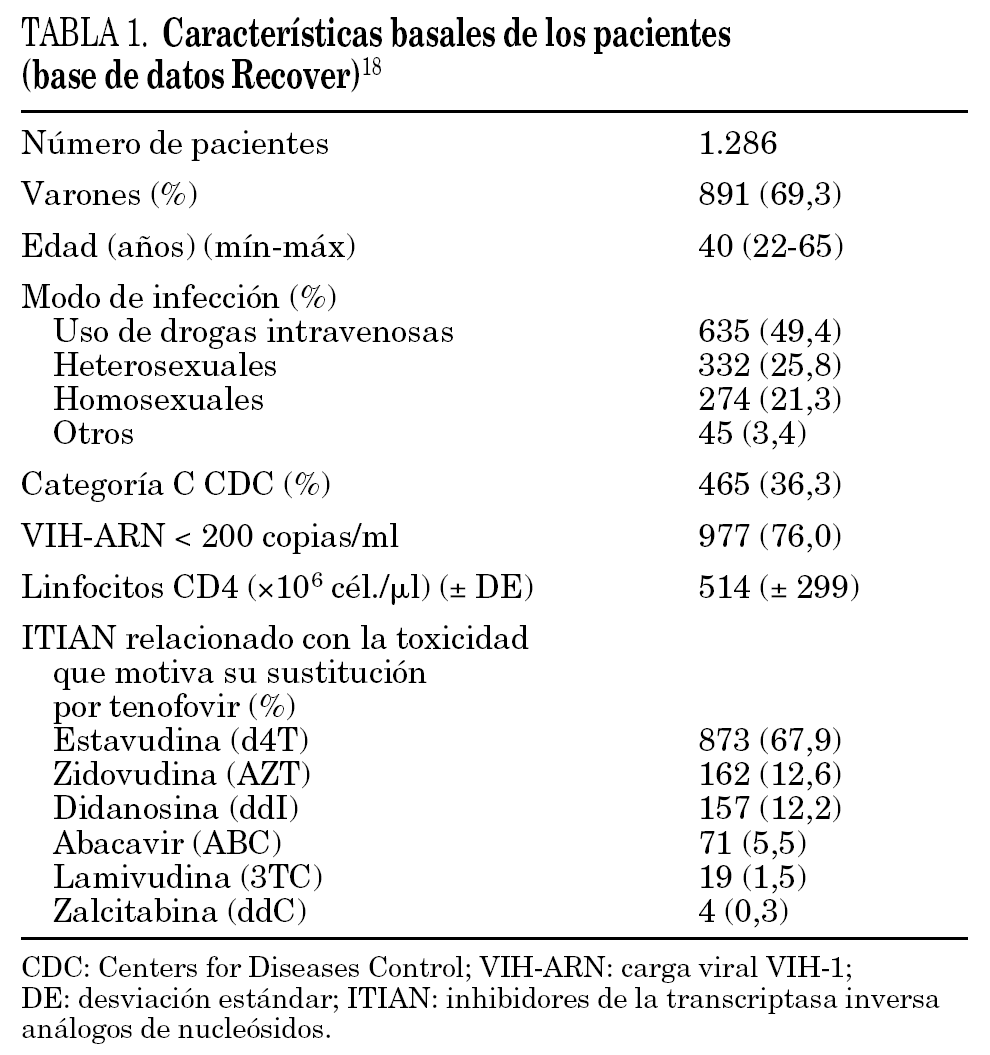
La información sobre el tipo y grado de la toxicidad de los ITIAN estudiados se ha obtenido a partir de los datos del registro de pacientes 12, del estudio Recover 18. El estudio Recover es un estudio prospectivo, observacional, multicéntrico de ámbito nacional (120 centros asistenciales de distintos tipos y de toda la geografía española), que ha evaluado 1.286 pacientes infectados por el VIH-1. Según el diseño del estudio, los pacientes seleccionados eran mayores de 18 años con infección por VIH-1 confirmada, con terapia TARGA en curso y que desarrollasen toxicidad asociada a un ITIAN que a juicio del investigador provocase en la práctica habitual su sustitución por otro fármaco antirretroviral con menor toxicidad. En la tabla 1 se muestran las características de los pacientes.
Para la identificación de los recursos se ha realizado un listado de todos los recursos sanitarios en la práctica habitual y no sanitarios, bajas laborales, requeridos ante toxicidades asociadas a ITIAN (a excepción de los efectuados en el seguimiento rutinario del paciente) considerando el mayor grado de detalle y precisión posible. Este proceso se ha realizado en dos fases:
1. En primer lugar, un grupo de expertos clínicos en atención de pacientes con infección por VIH-1 de distintas áreas geográficas de España y tipos de hospitales (desde hospitales de tercer nivel hasta hospitales comarcales) ha identificado de forma individual los recursos consumidos en el manejo habitual de cada AA clínico y cada anomalía de laboratorio según la gravedad de los mismos. Para ello se ha utilizado un cuestionario realizado en una base de datos en formato Excel.
2. A continuación se ha unificado y depurado la base llegando a un consenso por parte de los expertos clínicos en la identificación de una pauta común y real de actuación en el manejo clínico de los AA y anomalías de laboratorio en España.
Efectos adversos
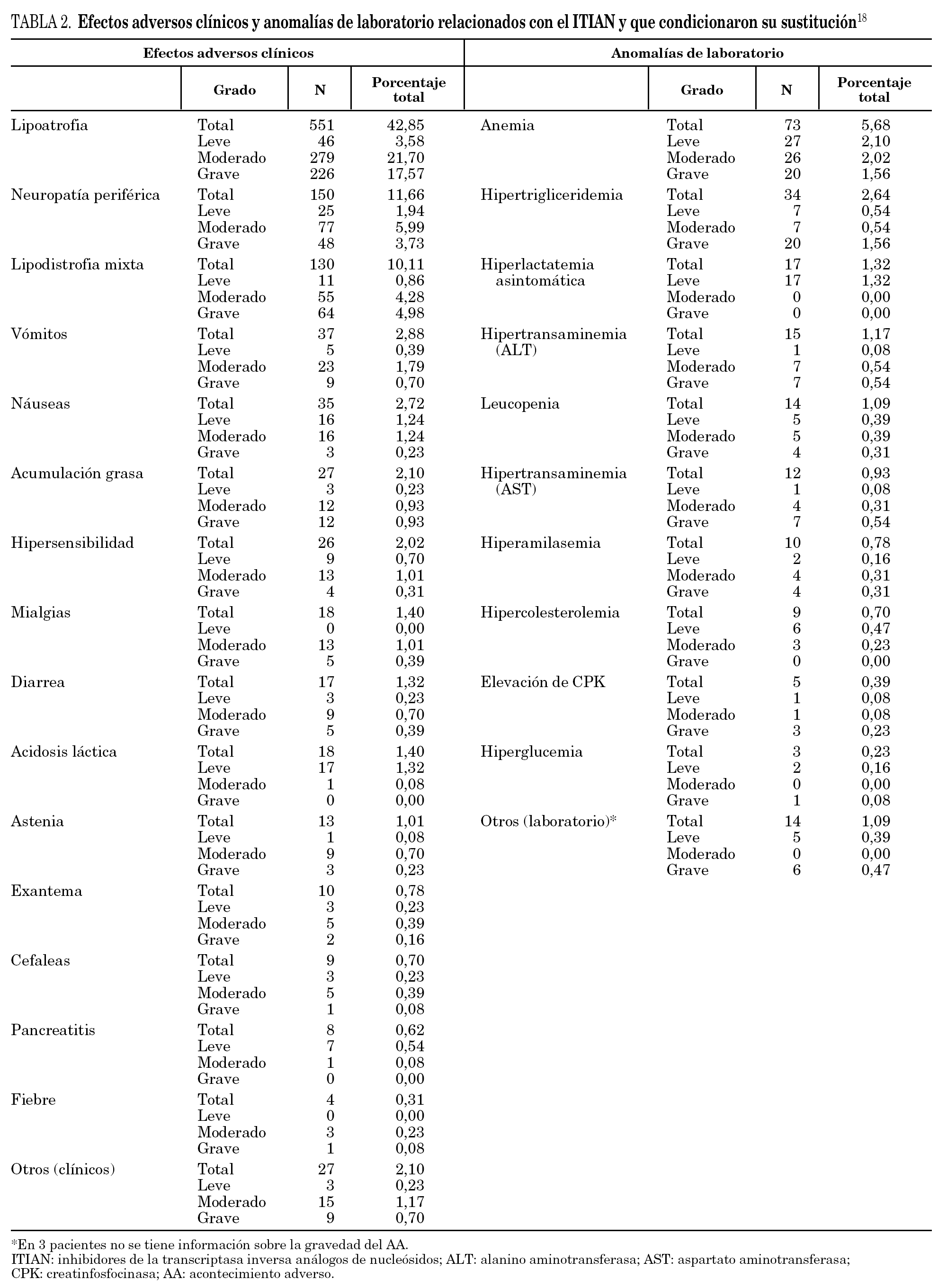
Los datos completos sobre toxicidad del estudio Recover han sido comunicados ya previamente 18,19. Con anterioridad hemos comunicado el impacto económico de la sustitución de un ITIAN que causa toxicidad por tenofovir DF 20,21. En el presente estudio se ha analizado la frecuencia y gravedad de 29 AA extraídos de la base de datos del estudio Recover (tabla 2):
1. AA clínicos: lipoatrofia, neuropatía periférica, lipodistrofia mixta, vómitos, náuseas, acumulación grasa, hipersensibilidad, mialgias, diarrea, acidosis láctica, astenia, exantema, cefalea, pancreatitis, fiebre y otros AA (agrupados debido a su baja incidencia).
2. Anomalías de laboratorio: anemia (hemoglobina < 9,5 g/dl), hipertrigliceridemia (triglicéridos > 250 mg/dl), hiperlactatemia asintomática (lactato > 2 mmol/l), hipertransaminemia-ALT [ > × 2,5 veces el límite superior de la normalidad (LSN)], leucopenia (leucocitos totales < 4000/μl), hipertransaminemia-AST (> × 2,5 LSN), hiperamilasemia (amilasas sérica > × 1,39 LSN), hipercolesterolemia (colesterol total > 220 mg/dl), elevación de CPK (> ×3 LSN), hiperglucemia (glucosa > 116 mg/dl), acidosis (pH < 7,35) y otras anomalías de laboratorio (agrupadas debido a su bajo nivel de incidencia).
La estimación de los recursos utilizados en el manejo de los AA en la práctica clínica habitual se ha realizado siguiendo la definición de gravedad desarrollada por el AIDS Clinical Trials Group para acontecimientos en adultos 22:
1. Leve: signos o síntomas notificados por los pacientes, pero fácilmente tolerados. El acontecimiento no interfiere en la salud o bienestar del paciente, y tiene poca relevancia clínica.
2. Moderado: las actividades diarias del paciente están alteradas por el suceso. Tiene influencia en la salud o bienestar del paciente y puede requerir intervención médica y/o finalización del tratamiento.
3. Grave: el AA interfiere considerablemente en las actividades diarias del paciente y puede poner en peligro su salud o bienestar. El suceso posiblemente requiera intervención médica y/o finalización del tratamiento y puede ser incapacitante o suponer una amenaza para la vida del paciente.
Costes
La perspectiva elegida en el estudio determina el rango de costes relevantes incluidos en el análisis. Cuando se utiliza la perspectiva más habitual, la de la sociedad, como en este caso, se deben incluir todos los costes con independencia de quién es el pagador final (sistema sanitario, paciente, mutuas de seguro privadas, etc.) 23. En el análisis se han incluido los siguientes costes:
1. Costes directos: consumo de recursos del sistema de atención sanitaria, es decir, atención hospitalaria (tanto en régimen de hospitalización como de atención ambulatoria en consultas externas), atención primaria y fármacos.
a)Consultas: urgencias, externas hospitalarias (incluidas las consultas adicionales al servicio de enfermedades infecciosas, unidades de VIH o generales de medicina interna), atención primaria y rehabilitación.
b)Procedimientos analíticos, biopsias, cultivos, ecografías, electrocardiogramas, broncoscopias, gasometrías, radiología, tomografía computarizada (TC), etc.
c)Ingresos (estancias hospitalarias): en planta de hospitalización normal o de corta estancia o en unidades de cuidados intensivos.
d)Intervenciones quirúrgicas.
e)Tratamientos farmacológicos para el manejo de los AA.
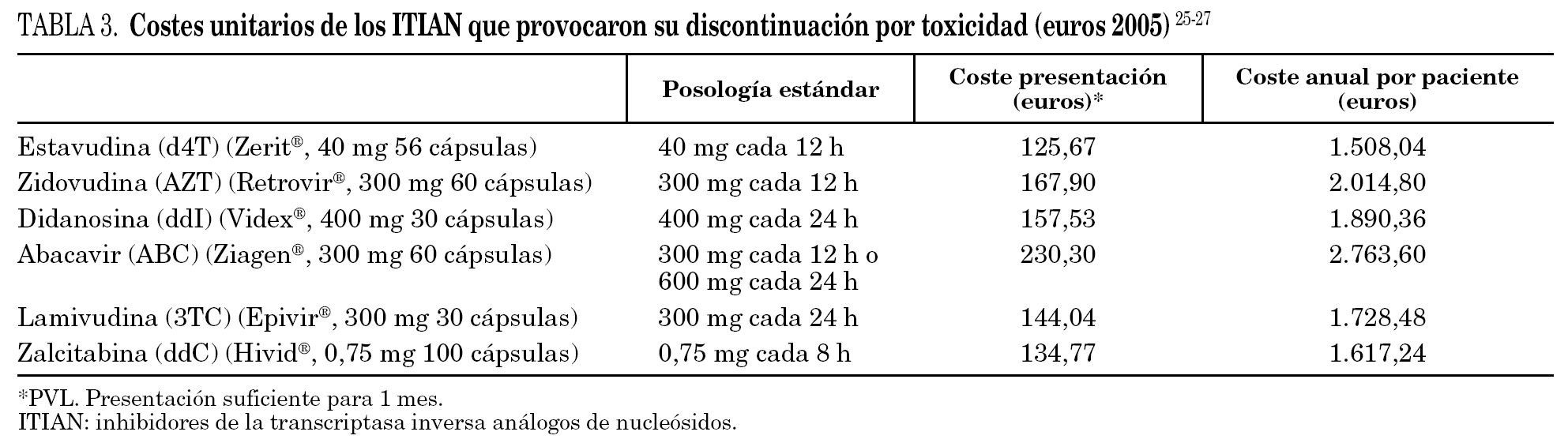
f)TARGA: coste de los ITIAN que son sustituidos por otros ITIAN con menor toxicidad (tabla 3).
2. Costes indirectos: disminución o pérdida de productividad laboral asociada a la morbilidad debida a la incapacidad laboral transitoria (bajas laborales) atribuible a los AA del TARGA.
Cuantificación de los recursos
Consiste en la medición en unidades físicas o naturales (no monetarias) de los cambios en todos los recursos utilizados (número de visitas, días de estancia hospitalaria, número de pruebas diagnósticas, de laboratorio y radiología, gasto farmacológico, etc.) en el manejo de los AA y anomalías de laboratorio según la estimación de consenso realizada por el panel de expertos en el tratamiento de los pacientes infectados por VIH-1. Por ejemplo, en el caso de hipersensibilidad de grado moderado se cuantificaron: una consulta extra a la Unidad de VIH (en el 100% de los pacientes), una analítica completa (en el 100% de los pacientes), una radiografía simple de tórax (en el 33% de los pacientes), un día de ingreso hospitalario (en el 10% de los pacientes) y medicación concomitante (antihistamínicos, antiinflamatorios no esteroideos [AINE], antidiarreicos, corticoides y broncodilatadores).
Valoración económica de los recursos
Es la asignación de un precio en unidades monetarias a los recursos utilizados para el manejo de los AA asociados al tratamiento con ITIAN. Los costes totales y por paciente se han obtenido multiplicando el precio estándar unitario de los recursos a precios constantes por las unidades de los recursos consumidos estimadas en la fase de cuantificación. Los cálculos se han realizado sin la aplicación de una tasa de descuento para los costes, dado que el horizonte temporal del presente análisis ha sido de 1 año. Esta fase ha sido realizada por un experto en evaluación económica de intervenciones sanitarias utilizando las fuentes de información más habituales en la realización de estudios farmacoeconómicos en España:
1. Para la valoración de los costes unitarios de recursos sanitarios no farmacológicos se ha utilizado la Base de Datos de Costes Sanitarios de SOIKOS 2005 24.
2. Para obtener la información relativa a los costes unitarios de los fármacos se han utilizado el Catálogo de Especialidades Farmacéuticas 2005 25, el Real Decreto 2402/2004, de 30 de diciembre, para las revisiones coyunturales de precios de especialidades farmacéuticas y la resolución de 15 de febrero de 2005 por la que se modifica el anejo del Real Decreto 2402/2004 26,27. Para calcular el coste promedio de un día de tratamiento se consideró la posología estándar establecida en la ficha técnica de cada especialidad (tabla 3).
3. Para la valoración de las bajas laborales, se ha considerado el precio de un día de pérdida de trabajo a partir del "Salario Mínimo Interprofesional" durante 2005 en España (Real Decreto 2388/2004, de 30 de diciembre, estableciendo el Salario Mínimo Interprofesional para 2005) 28.
Los costes se han presentado en euros del año 2005.
Resultados
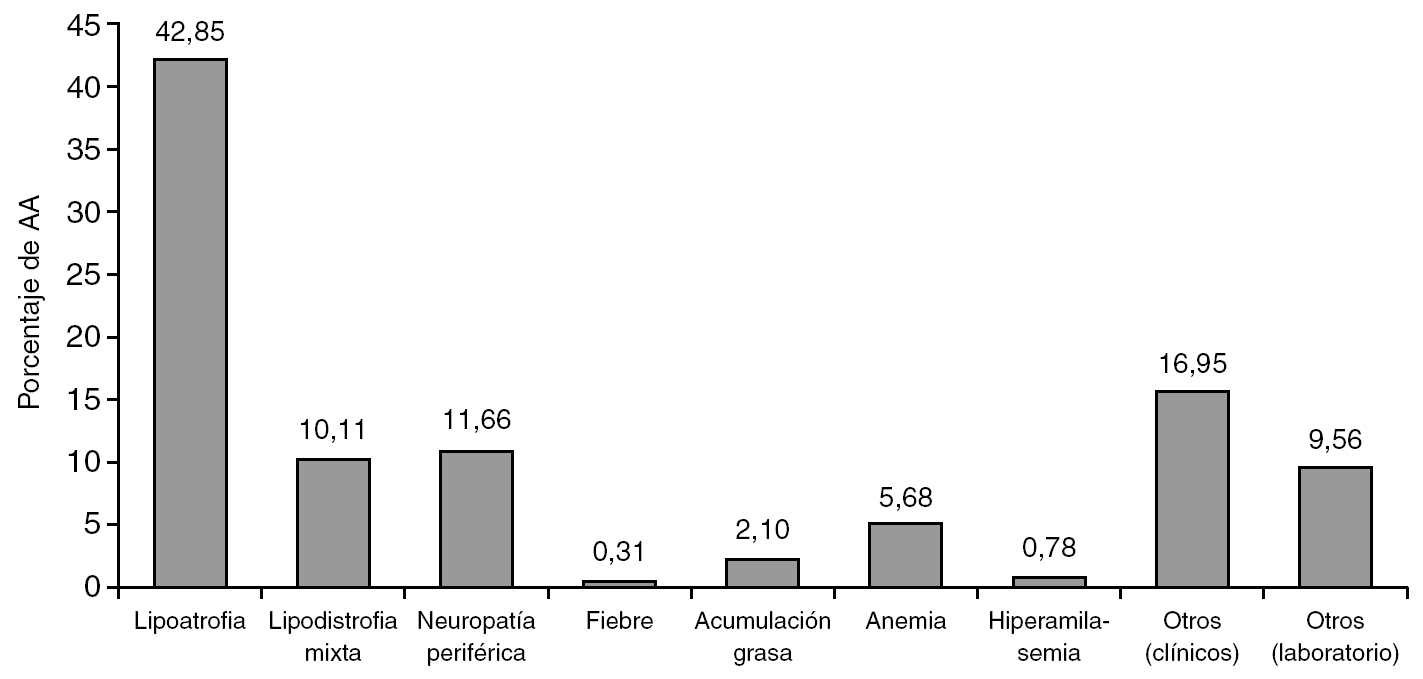
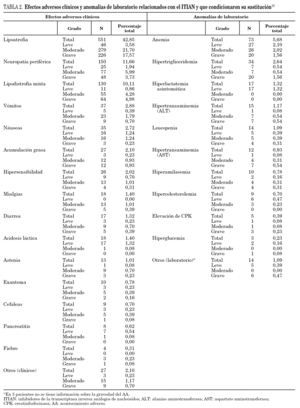
Los ITIAN sustituidos por toxicidad en la práctica clínica habitual en pacientes con infección por VIH-1 se han distribuido de la siguiente forma: estavudina (873 pacientes, 67,9%), zidovudina (162 pacientes, 12,6%), didanosina (157 pacientes, 12,2%), abacavir (71 pacientes, 5,5%), lamivudina (19 pacientes, 1,5%) y zalcitabina (4 pacientes, 0,3%) (tabla 1). Los AA más frecuentes (por encima del 5%) relacionados con el uso de estos ITIAN fueron: lipoatrofia (551 pacientes, 43%), neuropatía periférica (150 pacientes, 12%), lipodistrofia mixta (130 pacientes, 10%) y anemia (73 pacientes, 6%) (tabla 2 y fig. 1).
Figura 1. Distribución de los efectos adversos que producen discontinuación del tratamiento con ITIAN.
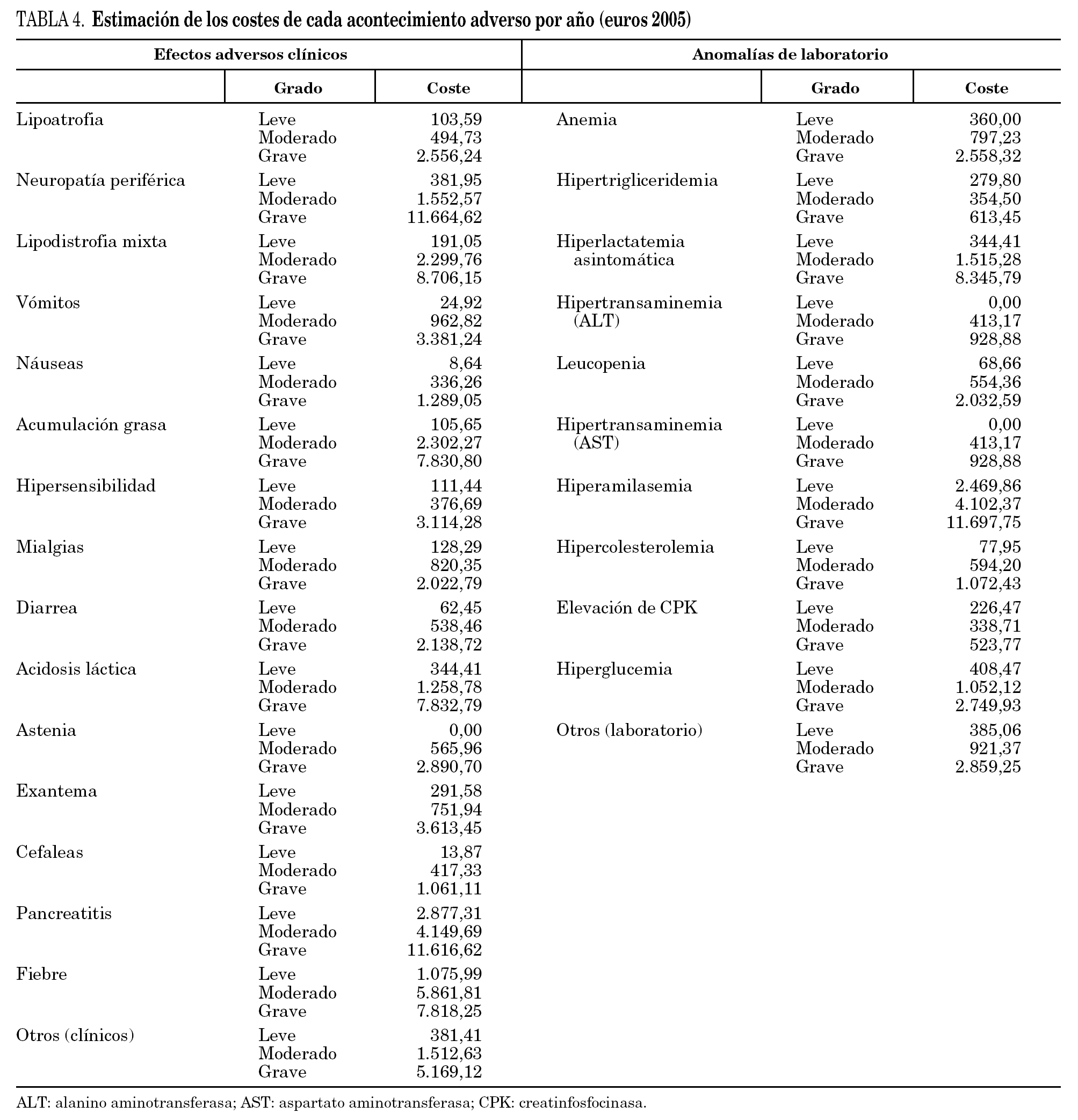
La tabla 4 muestra los resultados de la estimación de costes realizada en base a los recursos recomendados por el panel de expertos para el manejo de los AA correlacionados con el uso de los ITIAN, que motivaron su sustitución en la práctica clínica real, durante un período de 1 año. A medida que aumenta la intensidad del acontecimiento adverso, aumenta paralelamente el coste del tratamiento en todos los sucesos considerados.
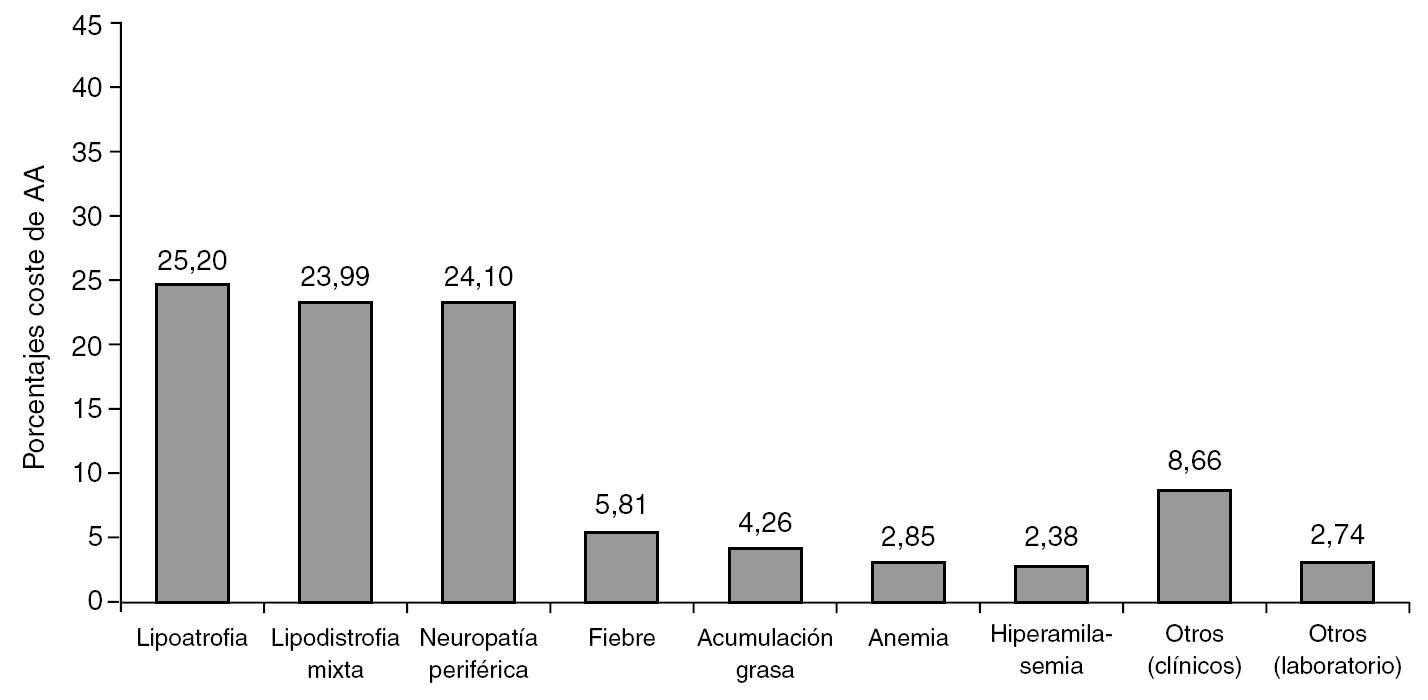
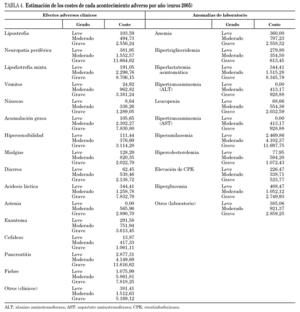
Los costes promedio totales de los AA principales durante un período de 12 meses ascendieron a 2.223 euros/ año (tabla 5). En relación a los AA producidos por los ITIAN, el 73% de los costes asociados a los mismos se deben a la lipoatrofia (560 €, 25%), lipodistrofia mixta (535 €, 24%) y neuropatía periférica (533 €, 24%) (fig. 2). La diferencia entre el peso relativo del número de AA y su gravedad en los pacientes frente al impacto financiero de los mismos se debe al mayor o menor coste de cada uno de ellos según su gravedad (leve, moderada o grave). Por ejemplo, la lipoatrofia a pesar de representar el 43% de los acontecimientos adversos, solamente representa el 25% de los costes. Sin embargo, la neuropatía periférica (12% de los acontecimientos adversos) supone un 24% de los costes asociados a los acontecimientos adversos.
Figura 2. Distribución de los costes anuales por paciente relacionados con los efectos adversos que producen discontinuación del tratamiento con ITIAN.
La lipoatrofia, lipodistrofia mixta, neuropatía periférica, fiebre, acumulación grasa, anemia e hiperamilasemia, representan casi el 90% de los costes totales debidos a AA de los ITIAN.
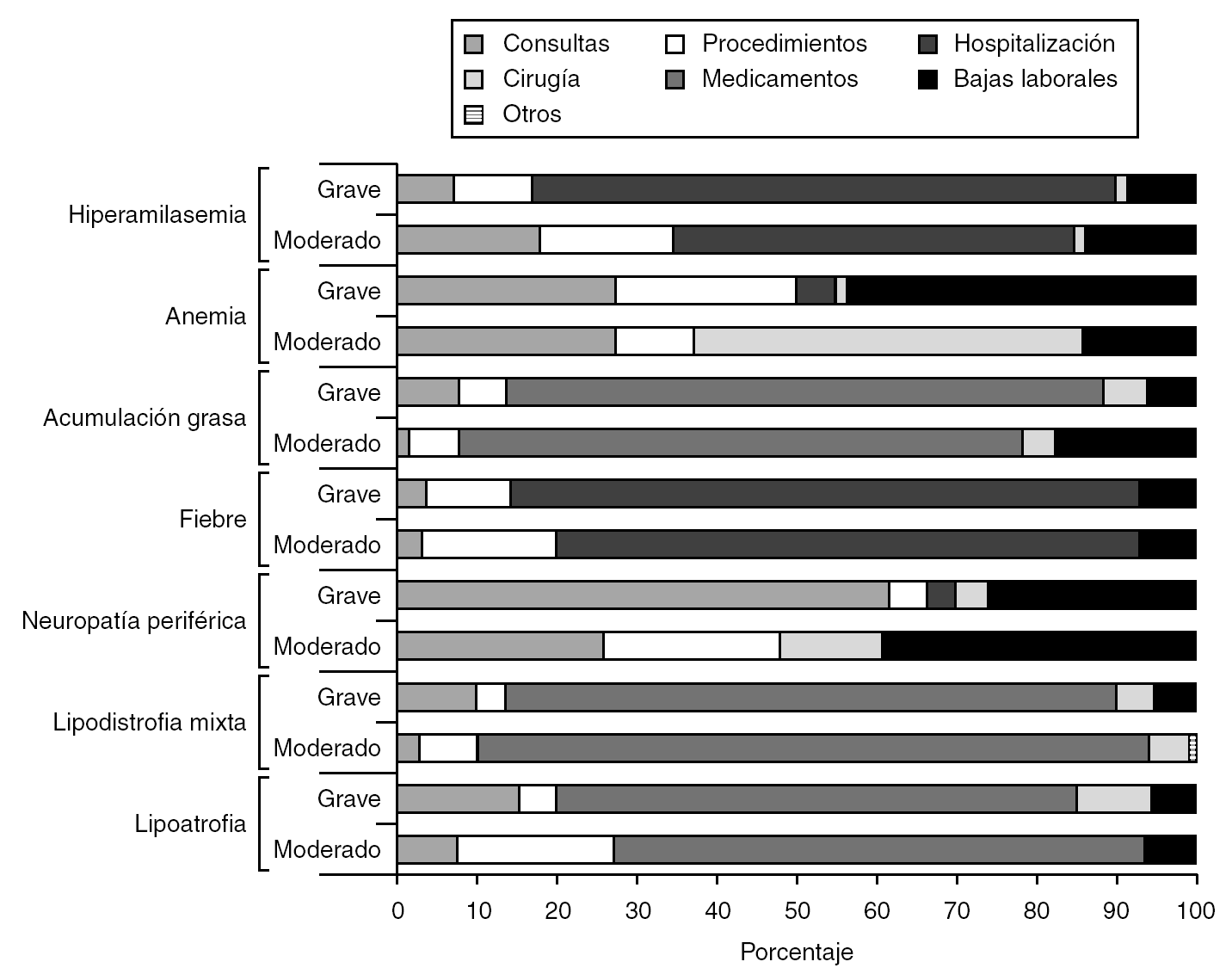
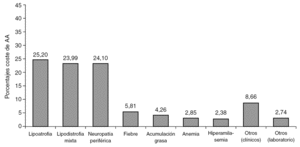
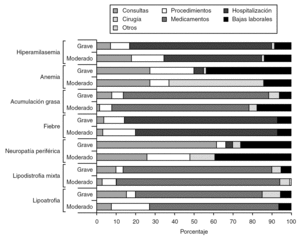
El peso relativo de los distintos tipos de costes varía en cada AA (fig. 3). Así, en la lipoatrofia grave el 65% de los costes se deben a la cirugía reparadora (especialmente facial), el 15% a las consultas, el 10% a los tratamientos farmacológicos, el 5% a las bajas laborales y el 5% restante a los procedimientos de diagnóstico y analíticas. Sin embargo, en el caso de la neuropatía periférica grave, el 62% se debe a las consultas y rehabilitación de los pacientes, el 26% a bajas laborales y el 12% restante a procedimientos diagnósticos, medicamentos y hospitalización. En cambio, en el caso de fiebre de intensidad grave, el 78% de los costes se deben a las estancias hospitalarias y el complejo estudio diagnóstico. En resumen, en el manejo de los AA moderados y graves, la cirugía representó el principal capítulo de gastos en el abordaje de la lipoatrofia (66-68%), la lipodistrofia mixta (77-84%) y la acumulación grasa (70-78%), la hospitalización en la fiebre (74-78%) e hiperamilasemia (49-76%), mientras que la atención ambulatoria suplementaria (27-72%) y las bajas laborales (27-40%) fue el principal capítulo de gastos en la neuropatía periférica. Con respecto a la anemia, los costes se encuentran repartidos entre las consultas (25%), los procedimientos diagnósticos (25%), los medicamentos (16-38%) y las bajas laborales (13-30%).
Figura 3. Distribución porcentual de los costes anuales de los 7 efectos adversos más relevantes (en cuanto al valor absoluto de coste) que producen suspensión de un ITIAN.
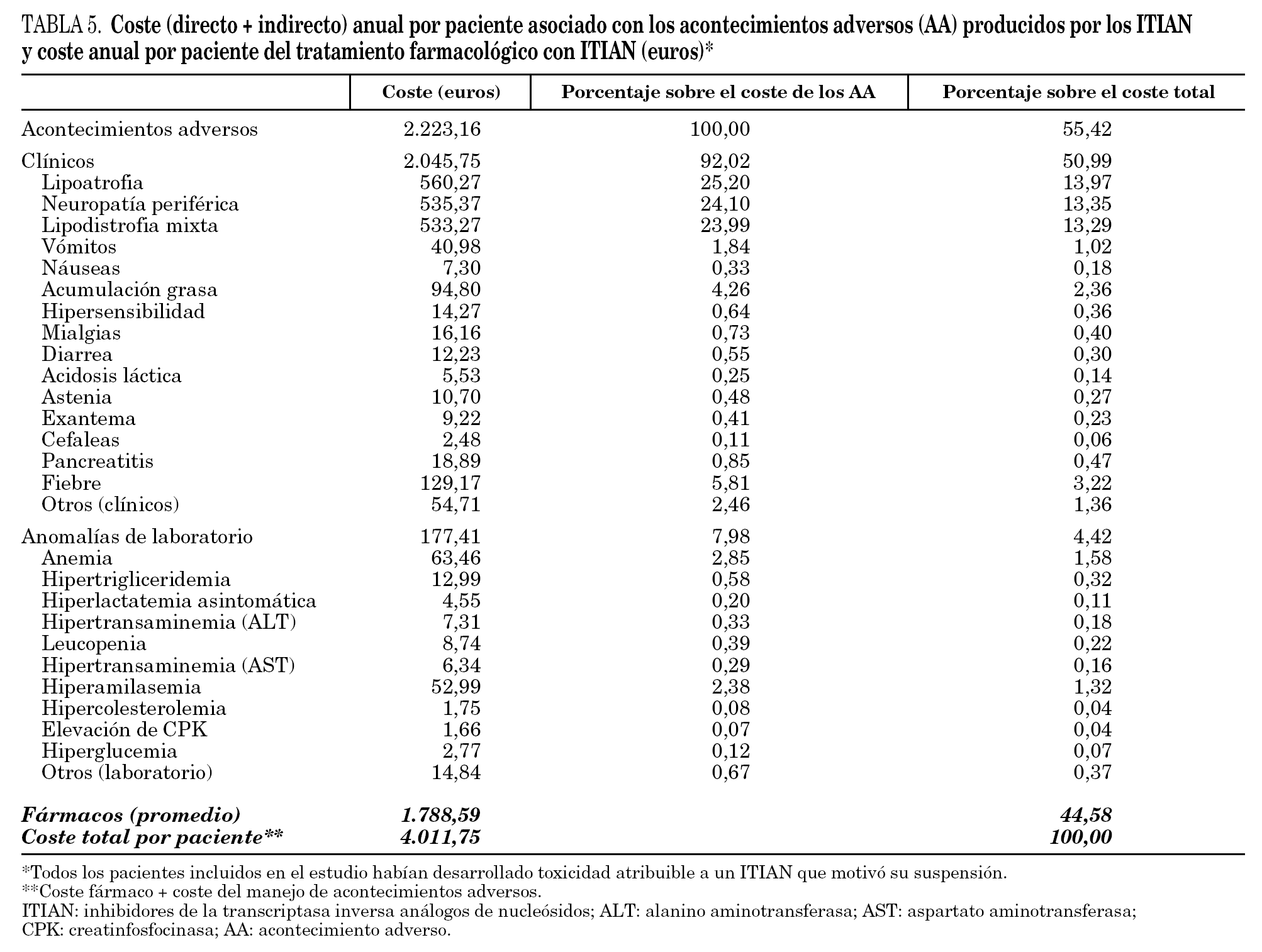
A modo de comparación, en el mismo período de 12 meses, el tratamiento farmacológico de los ITIAN asociados al efecto adverso fue de 1.789 €. Esto supone que el 55% de los costes totales del tratamiento de estos pacientes se debe a los AA principales que produjeron la suspensión de los ITIAN (tabla 5).
Si no consideramos los costes indirectos (bajas laborales), los costes directos sanitarios asociados a los efectos adversos de los ITIAN que produjeron una discontinuación de este tratamiento ascendieron a 1.942 €, lo que representa un 52% del total de los costes.
Discusión
La limitación del presupuesto sanitario determina que el coste invertido en un determinado recurso beneficiará a un grupo determinado de la población en detrimento de otros individuos que en contrapartida no podrán recibir unos servicios sanitarios alternativos 29.
El coste desde un punto de vista social es el valor de los recursos empleados (no exclusivamente monetarios) en la prestación de un servicio o intervención sanitaria. Por tanto, cuando estemos evaluando la eficiencia de una intervención sanitaria es necesario no solamente considerar los costes de adquisición o compra de dicha intervención, sino también tener en cuenta otros costes potencialmente evitados o incrementados por su administración (días de hospitalización, medicación concomitante, tratamiento de las reacciones adversas, pruebas diagnósticas complementarias, analíticas, etc.). De esta forma, la toxicidad asociada a los tratamientos farmacológicos es un factor clave en las evaluaciones económicas de intervenciones sanitarias 30, muy especialmente cuando se comparan tratamientos con eficacia similar 20,21.
Aunque el coste de la toxicidad farmacológica es elevado 30, a menudo es infravalorado en nuestro país, donde es absorbido por el sistema sanitario público. La evidencia científica demuestra que la reducción de los AA no solamente mejora la calidad de vida relacionada con la salud de los pacientes, sino que además contribuye a una disminución de los recursos sanitarios consumidos asociados a su manejo 31. Cuando realmente se calcula mediante un modelo apropiado puede arrojar resultados sorprendentes en la comparación de tratamientos cuyo coste es muy dispar si existen diferencias de toxicidad entre las diferentes alternativas evaluadas 32.
En las últimas décadas, la infección por VIH-1 se ha consolidado como uno de los problemas sociosanitarios de mayor importancia en España, debido a su elevada frecuencia (incidencia y prevalencia) y a las consecuencias que origina sobre la sociedad en términos de costes económicos y sociales. Así, el coste total de los recursos utilizados en los pacientes infectados por VIH-1 ha continuado creciendo a lo largo del tiempo a pesar de la aparición de nuevos tratamientos más efectivos 2. Esto es debido a la marcada prolongación de la esperanza de vida de los infectados por VIH-1, al incremento constante de pacientes que van accediendo al tratamiento antirretroviral, y al hecho de que estos tratamientos son indefinidos en la actualidad. Sin embargo, las consecuencias económicas de los AA de los tratamientos en España han sido poco estudiados y documentados.
El presente estudio demuestra que los costes de los AA asociados al uso de los ITIAN, cuando éstos aparecen, conlleva un impacto financiero asociado importante. Así, desde una perspectiva social el análisis de costes presentado muestra que cuando se produce un episodio de toxicidad por un ITIAN (excluido tenofovir DF) que obliga a la suspensión del fármaco, el coste generado por este AA, en algunos casos, puede ser superior al coste anual del propio ITIAN. Incluso algunos AA considerados como clínicamente menores se asocian un coste económico significativo y motivan la sustitución del ITIAN en la práctica clínica real. De hecho, en series recientes se demuestra que los AA que más frecuentemente conllevan la suspensión de un fármaco antirretroviral o una mala adherencia al tratamiento son en realidad AA considerados habitualmente como "menores" por los médicos responsables 33. Esto trae como consecuencia la necesidad de utilizar fármacos con un perfil de seguridad y tolerancia más favorable, que puedan suponer un ahorro de costes global con respecto a estos ITIAN, siempre y cuando su eficacia sea similar. Cuanto mayor sea la igualdad en eficacia entre 2 fármacos más importancia tiene las diferencias menores en cuanto a toxicidad. Afortunadamente, los nuevos ITIAN o análogos de nucleótido utilizados actualmente tienen cada vez un perfil de toxicidad más favorable.
El presente estudio no está exento de una serie de limitaciones metodológicas. Una de ellas es que se han utilizado en la medida y cuantificación de los recursos asociados a la toxicidad de los tratamientos datos de fuentes de información secundaria (base de datos), cuando lo ideal hubiese sido emplear métodos basados en la recopilación directa de datos primarios obtenidos con carácter prospectivo en el marco de un ensayo clínico o de un estudio de evaluación económica prospectiva de carácter pragmático o naturalístico (en unas condiciones similares a como se utilizaría en la práctica clínica) 34. En segundo lugar, los resultados económicos obtenidos en pacientes que han desarrollado toxicidad por ITIAN no pueden generalizarse al total de pacientes en tratamiento con ITIAN, muchos de los cuales no desarrollan toxicidad alguna.
Por otra parte, las guías y recomendaciones de cómo llevar a cabo esta estimación de costes son limitadas debido a la falta de guías de consenso sobre el manejo detallado de los AA producidos por los ITIAN. No obstante, para solventar esta limitación, se ha utilizado un panel de consenso de clínicos expertos en tratamientos antirretrovirales para el abordaje de pacientes con infección por VIH-1. La composición mediante miembros de distintos tipos de hospitales y áreas geográficas asegura la uniformidad de criterios. Además, se han depurado y detallado al máximo los recursos utilizados en el manejo de cada toxicidad según su grado. Por tanto, es difícil que el manejo de alguna toxicidad asociada a ITIAN analizada difiera significativamente de la utilizada en el presente estudio. A pesar de ello, y como se ha especificado anteriormente la valoración de los costes asociados al manejo de los AA, al no proceder de datos obtenidos de forma directa en el estudio Recover, pueden haber sido sobreestimados o, más probablemente, infraestimados.
Finalmente, en este estudio solamente se han considerado los costes sanitarios directos y los indirectos relacionados con la pérdida de productividad. Pero no se han incluido los costes intangibles relacionados con los cambios en la calidad de vida relacionada con la salud producidos por los efectos adversos del tratamiento 35, ni los costes de los cuidados informales prestados por cuidadores y familiares. Sería de esperar que si se incluyesen estos costes, el impacto económico de los acontecimientos adversos correlacionados con los ITIAN fuese todavía mayor.
Estos datos ponen de manifiesto la necesidad de crear bases de datos o registros de pacientes que identifiquen, cuantifiquen y valoren el coste de los acontecimientos adversos relacionados con la utilización de los tratamientos antirretrovirales, y por tanto, el ahorro de costes potencial al utilizar otras terapias con un perfil de seguridad más favorable que pueden resultar más eficientes 36. La disponibilidad de bases de datos con datos clínicos y de utilización de recursos contribuiría a mejorar la exactitud de la estimación de los costes sociosanitarios de los efectos adversos relacionados con el tratamiento con los ITIAN y, por tanto, permitiría la utilización del criterio de eficiencia (relación entre costes y consecuencias) de las distintas alternativas terapéuticas como elemento de priorización en la toma de decisiones 29.
En conclusión, además del coste de adquisición de los ITIAN, estos fármacos producen un impacto económico considerable cuando aparecen AA, que puede representar más del 50% del coste total del tratamiento. Estos resultados deberían ser considerados por los gestores sanitarios y los clínicos prescriptores para diseñar las estrategias más eficientes en el tratamiento de los pacientes infectados por VIH-1.
Agradecimientos
Los autores agradecen a Luis Herrera y Manuel Cotarelo su invaluable aportación en la revisión técnica del manuscrito.
Conflicto de Intereses
Este estudio ha sido financiado parcialmente a través de una ayuda no condicionada de Gilead Sciences, SL. Los autores han tenido independencia para el diseño, análisis e interpretación de los datos, y redactar el manuscrito con independencia de los resultados. Dos de los autores (RSR) y (MLA) son empleados de Gilead Sciences, su afiliación aparece claramente detallada en el apartado de autores del manuscrito. Ambos autores son Doctores en Medicina y laboran en el Departamento Médico de la citada compañía como expertos en investigación clínica y resultados finales en investigación en ciencias de la salud.
Correspondencia:
Dr. J.M. Llibre-Codina.
Servicio de Medicina Interna. Hospital Sant Jaume.
08370 Calella. Barcelona. España.
Correo electrónico: jmllibre@salutms.org
Manuscrito recibido el 9-12-2005; aceptado el 7-7-2006.