El Comité Español del Antibiograma (COESANT) presenta en este documento una sencilla «hoja de ruta» en forma de decálogo de recomendaciones cuya finalidad es facilitar la transición de la normativa del Clinical and Laboratory Standards Institute (CLSI) a la del European Committee on Antimirobial Susceptibility Testing (EUCAST) en los Servicios y Unidades de Microbiología Clínica que aún emplean los criterios del CLSI. Su objetivo es adaptar las directrices europeas, más próximas a la realidad clínico-epidemiológica española, y conseguir una implantación de los criterios del EUCAST en la totalidad de los laboratorios de Microbiología en España.
The Spanish Antibiogram Committee (Comité Español del Antibiograma, COESANT) presents in this document a simple “roadmap” or decalogue of recommendations, with a view to facilitating the transition from the Clinical and Laboratory Standards Institute (CLSI) to the European Committee on Antimicrobial Susceptibility Testing (EUCAST) antimicrobial susceptibility testing regulations to the Clinical Microbiology Spanish laboratories that still use the CLSI guidelines. The objectives are to adapt the closer European regulations to the Spanish clinical and epidemiological reality and to fully implement the EUCAST recommendations in all microbiology laboratories in Spain.
Desde hace casi cincuenta años los estudios de sensibilidad a los antimicrobianos en los laboratorios españoles se han guiado fundamentalmente por los estándares recomendados desde el Clinical and Laboratory Standards Institute, o CLSI (antiguamente conocido como National Committee for Clinical Laboratory Standards, o NCCLS). En 1991 se creó la Mesa Española de la Normalización de la Sensibilidad y Resistencia a los Antimicrobianos (MENSURA), que se centró en aspectos técnicos concretos relacionados con el antibiograma, a imagen de otros comités nacionales europeos como el Comité de l’Antibiogramme de la Société Française de Microbiologie (CA-SFM) o el Susceptibility Testing Standing Committee de la British Society for Antimicrobial Chemotherpy (BSAC). Ambos comités, junto con los de otros países del norte de Europa, fueron el germen del actual European Committee on Antimicrobial Susceptibility Testing (EUCAST), que se organizó en 1997 bajo el auspicio del European Centre for Diseases Prevention and Control (ECDC, www.ecdc.europa.eu) y de la European Society for Clinical Microbiology and Infectious Diseases (ESCMID, https://www.escmid.org). Actualmente el EUCAST está aceptado como el comité de puntos de corte de la European Medicines Agency (EMA) (http://www.ema.europa.eu) y del ECDC, garantizando este hecho la independencia de criterios respecto a la industria farmacéutica y del diagnóstico, que solo actúan de forma consultiva.
En un momento en el que España está plenamente integrada en Europa, no parece lógico que, en una de las actividades centrales de los Servicios y Unidades de Microbiología, como es el estudio de la sensibilidad a los antimicrobianos, existan aún laboratorios en los que los documentos de referencia sigan siendo estadounidenses (documentos del CLSI), sobre todo cuando la realidad epidemiológica que nos rodea presenta importantes diferencias. Actualmente, ambos comités establecen puntos de corte clínicos basándose en aspectos microbiológicos, incluido el análisis poblacional de las concentraciones mínimas inhibitorias, o CMI, en parámetros farmacocinéticos y farmacodinámicos y en resultados clínicos (http://www.eucast.org/clinical_breakpoints/eucast_setting_breakpoints). Además, el EUCAST aporta puntos de corte epidemiológicos, o ECOFF, que permiten clasificar al microorganismo en función de si presenta o no algún mecanismo de resistencia adquirida para un mayor número de combinaciones microorganismo-antimicrobiano que el CLSI. Con independencia de las recomendaciones de la EMA y del ECDC, otras diferencias que apoyarían la definitiva implementación de la normativa del EUCAST en España es la ya mencionada independencia de la industria farmacéutica por parte del EUCAST, así como el hecho de que todas las guías y la documentación técnica de este comité sean de acceso libre en su página web (http://www.eucast.org/). En el caso del estudio de la sensibilidad a antifúngicos con el método de referencia EUCAST, cabe destacar que la aplicación de una lectura espectrofotométrica de la CMI elimina la variabilidad derivada de la lectura visual. Aunque el EUCAST no dispone a día de hoy de puntos de corte para todos los antimicrobianos comercializados en España necesarios para abarcar por completo la tarea asistencial (a expensas sobre todo de algunas carencias que afectan a microorganismos poco frecuentes), sí se dan recomendaciones sobre cómo proceder cuando ocurre esta circunstancia1. Además, esta deficiencia implica una repercusión mínima en el día a día que se solventa conforme se dispone de suficiente información como para establecer con garantía estos puntos de corte.
El Comité Español del Antibiograma (COESANT, http://coesant-seimc.org), auspiciado por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y la Agencia Española de los Medicamentos y Productos Sanitarios (AEMPS), tiene como eje central la promoción de la implementación de la normativa del EUCAST en los Servicios y Unidades de Microbiología Clínica en España colaborando en todos aquellos requerimientos que puedan facilitar la tarea de cambiar de referente en cuanto a las pruebas de sensibilidad antibiótica se refiere2. Cabe destacar, además, que uno de los objetivos del Plan Nacional frente a la Resistencia a los Antibióticos (PRAN) es promover e implementar de forma homogénea el uso de pruebas de sensibilidad con criterios EUCAST. Este Comité se encarga, entre otras funciones, de revisar los documentos y propuestas del EUCAST, así como de canalizar y gestionar las consultas específicas en el campo del estudio de la sensibilidad antimicrobiana entre los microbiólogos expertos en esta tarea y el comité europeo. De esta forma, se detectan necesidades y se establecen tareas prioritarias, como es el caso del documento que se expone a continuación. El objeto de esta sencilla «hoja de ruta» no es más que, desde la experiencia de haber superado el proceso, solventar las dudas iniciales que surgen al plantearse migrar del CLSI al EUCAST y tratar de simplificar las acciones a realizar con el único fin de facilitar en la medida de lo posible esta transición.
En estos momentos, y según datos de una encuesta sobre la situación de los Servicios y Unidades de Microbiología en España (datos no publicados), del Control de Calidad de la SEIMC y de estudios multicéntricos3, en torno al 50-65% de los Servicios/Unidades de Microbiología en España ya han implementado la normativa del EUCAST como referencia única o complementada con algunos criterios del CLSI.
El documento guía que se presenta se ha simplificado en forma de decálogo (tabla 1), intentando que realmente sea un documento más práctico que teórico, y citando las fuentes de origen para que quienes quieran profundizar en el tema puedan hacerlo a partir de la bibliografía proporcionada.
Diez pasos fundamentales para adoptar la normativa del EUCAST como referencia en la lectura de antibiogramas
| 1. Revisar el manual de puntos de corte y las reglas de interpretación del EUCAST |
| 2. Comunicar a los proveedores de los sistemas de soporte comercial para planificar los cambios de los programas informáticos necesarios |
| 3. Prestar atención a las recomendaciones específicas para la técnica de disco-difusión |
| 4. Prever el cambio de carga de algunos discos y de medio de cultivo para algunos microorganismos |
| 5. Decidir qué puntos de corte se adoptarán en los casos en que el EUCAST no ha establecido criterios específicos |
| 6. Verificar que se dispone de las cepas control adecuadas |
| 7. Adaptar la información documental y el sistema de soporte informático del laboratorio |
| 8. Informar a los facultativos responsables del paciente y a las Comisiones pertinentes de las posibles variaciones de interpretación de la sensibilidad |
| 9. Tener en cuenta las diferencias en el análisis de los informes de sensibilidad acumulada |
| 10. Consultar al COESANT todas aquellas dudas que puedan surgir |
1. Revisión del manual de puntos de corte y las reglas de interpretación del EUCAST4-6.
En este primer paso se deben tener en cuenta algunos aspectos como los que, a modo de ejemplo, se refieren a continuación:
- •
Para el EUCAST la categoría resistente (R) se define como un valor «mayor de» (>), mientras que el CLSI lo define como «mayor o igual a» (≥).
- •
EUCAST no refiere de forma individualizada la categoría de sensibilidad intermedia (I) simplemente por simplificar las tablas. Obviamente, esta categoría existe y se refiere a la zona que queda entre las concentraciones mínimas inhibitorias o los diámetros de halos de inhibición comprendidos entre los puntos de corte de sensible (S) y resistente (R). Recientemente, el EUCAST ha propuesto una redefinición de la categoría «intermedia» (Susceptible, increased exposure) que refleja únicamente los aspectos relacionados con la exposición del microorganismo al antibiótico (por ajuste del régimen de dosificación o por concentración en el sitio de la infección), y no los técnicos derivados del propio estudio de sensibilidad en el laboratorio7. Se propone la interpretación de la categoría I como «Sensible, cuando se incrementa la exposición».
- •
Un punto de corte de S ≥50mm es una escala arbitraria para aquellas situaciones en las que las cepas salvajes se categorizan como intermedias; por ejemplo, trimetoprim-sulfametoxazol y Enterococcus spp.
- •
Para la evaluación de la CMI de las combinaciones de amoxicilina-ácido clavulánico y de ampicilina-sulbactam, la concentración del inhibidor está fijada para el ácido clavulánico en 2mg/l y para el sulbactam en 4mg/l y no es una proporción (2:1) como en el caso del CLSI. Para piperacilina-tazobactam, ceftolozano-tazobactam y ceftazidima-avibactam la concentración es fija en ambos comités (2mg/l en el primer caso y 4mg/l en el resto de combinaciones)8. Este hecho implica un mayor porcentaje de resistencia, pero una mejor correlación clínica. Debe tenerse asimismo en cuenta que los puntos de corte del EUCAST para amoxicilina-ácido clavulánico son diferentes en la infección urinaria y en la infección sistémica.
- •
En cuanto a las quinolonas, los puntos de corte del EUCAST son más restrictivos que los definidos por el CLSI. En Salmonella enterica se debe determinar la CMI de ciprofloxacino, levofloxacino u ofloxacino para detectar la presencia de cepas con bajo nivel de resistencia a quinolonas, incluidas las cepas que producen proteínas Qnr o con la variante de la enzima bifuncional AAC(6’)-Ib-cr8,9. El COESANT considera que esta recomendación debería extenderse al resto de enterobacterias, al menos cuando producen infecciones invasivas. En los Servicios/Unidades que utilizan mayoritariamente el método de disco-difusión, el estudio de la sensibilidad al ácido nalidíxico ayuda al reconocimiento fenotípico de parte de estos mecanismos de resistencia frente a quinolonas.
- •
Los puntos de corte del imipenem y del meropenem del EUCAST en enterobacterias son menos restrictivos en cuanto a su traducción en la categoría clínica; no así el punto de corte de cribado de carbapenemasas, que pretende aumentar la sensibilidad en la detección de las mismas10-12. Si se confirma la presencia de este mecanismo de resistencia, es obligado dar el resultado de la CMI de los carbapenémicos dada la posibilidad de usarlos en combinación (menor tasa de fracaso que otras alternativas) siempre que la CMI sea ≤8mg/l según modelos Pk/Pd y resultados clínicos13,14.
- •
Para trimetoprim-sulfametoxazol en proporción 1:19, los valores de CMI se expresan como concentración de trimetoprim.
- •
Existen grandes variaciones en cuanto a los puntos de corte establecidos por el EUCAST y el CLSI para antibióticos como el aztreonam15 o la fosfomicina.
- •
Los puntos de corte de los azoles y las equinocandinas son específicos de especie y dependen de las diferentes combinaciones de antifúngico y especie de Candida/Aspergillus16-18. El EUCAST no recomienda por el momento el estudio de la sensibilidad antifúngica a caspofungina frente a aislados de Candida spp. debido a la elevada variabilidad que existe en los resultados obtenidos entre diferentes laboratorios. La sensibilidad a caspofungina frente a Candida spp. se puede extrapolar de los resultados del estudio de anidulafungina y micafungina, recomendándose evaluar ambas equinocandinas para detectar fenotipos infrecuentes de cepas resistentes solo a una u otra de forma individual.
2. Comunicación de la intención de implementar la normativa del EUCAST a los proveedores de los sistemas comerciales de antibiograma para planificar los cambios de programas informáticos necesarios.
Si se dispone de un sistema comercial para el estudio de la sensibilidad a los antimicrobianos, se recomienda comunicar con antelación al proveedor la intención de adoptar los criterios del EUCAST para programar la adaptación del programa informático y la configuración de los paneles (actualmente en revisión)19. Si se utiliza un lector semiautomático de pruebas de disco-difusión debe comunicarse igualmente al proveedor la necesidad de que adapte los sistemas expertos y los puntos de corte a los criterios del EUCAST.
3. Revisar las recomendaciones específicas para la técnica de disco-difusión.
Se han de tener en cuenta las recomendaciones específicas del EUCAST para la técnica de disco-difusión20,21 (por ejemplo, no incubar las placas ni menos de 16h ni más de 20h, salvo excepciones concretas, como es el caso de Corynebacterium spp.).
4. Prever el cambio de carga de algunos discos y de medio de cultivo para algunos microorganismos.
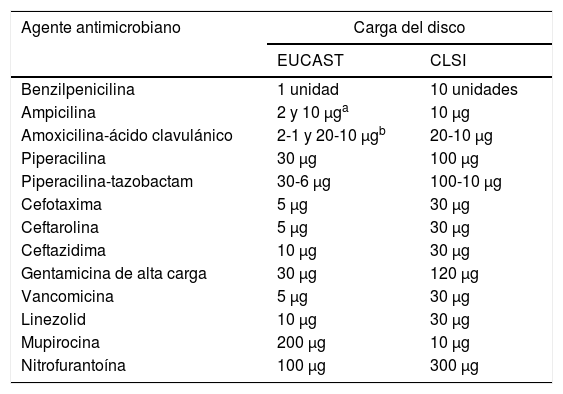
En la técnica de disco-difusión se ha de tener presente que cambia la carga del antibiótico en algunos discos (tabla 2). Además, en el caso de los estreptococos y otras especies bacterianas, como Moraxella catarrhalis, Listeria monocytogenes, Pasteurella multocida, Campylobacter jejuni, Campylobacter coli, Corynebacterium spp., Aerococcus sanguinicola y Aerococcus urinae, así como Kingella kingae, se recomienda utilizar agar Mueller-Hinton suplementado con un 5% de sangre de caballo desfibrinada y 20mg/l de β-nicotinamida adenina dinucleótido (NAD)22.
Diferencias en la carga de los discos entre el EUCAST y el CLSI
| Agente antimicrobiano | Carga del disco | |
|---|---|---|
| EUCAST | CLSI | |
| Benzilpenicilina | 1 unidad | 10 unidades |
| Ampicilina | 2 y 10 μga | 10 μg |
| Amoxicilina-ácido clavulánico | 2-1 y 20-10 μgb | 20-10 μg |
| Piperacilina | 30 μg | 100 μg |
| Piperacilina-tazobactam | 30-6 μg | 100-10 μg |
| Cefotaxima | 5 μg | 30 μg |
| Ceftarolina | 5 μg | 30 μg |
| Ceftazidima | 10 μg | 30 μg |
| Gentamicina de alta carga | 30 μg | 120 μg |
| Vancomicina | 5 μg | 30 μg |
| Linezolid | 10 μg | 30 μg |
| Mupirocina | 200 μg | 10 μg |
| Nitrofurantoína | 100 μg | 300 μg |
5. Decidir los puntos de corte a adoptar en los supuestos en que el EUCAST no se ha pronunciado.
Cada Servicio/Unidad de Microbiología debe decidir qué puntos de corte se aplican en aquellos casos en los que el EUCAST aún no tenga criterios. Para ello, debe tenerse en cuenta el documento del EUCAST antes referido1.
- •
Puntos de corte Pk/Pd no relacionados con la especie microbiana.
- •
En ausencia de puntos de corte Pk/Pd, interpretar el resultado en función de su pertenencia a la población salvaje (sensible) o a la población que pueda tener un mecanismo de resistencia (resistente).
- •
Para dudas concretas, recurrir al COESANT.
6. Verificar que se dispone de las cepas control adecuadas.
Verificar que se dispone de las principales cepas control adecuadas en el laboratorio tanto para los controles rutinarios (Escherichia coli ATCC 25922, Escherichia coli ATCC 35218, Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 29213, Enterococcus faecalis ATCC 29212, Streptococcus pneumoniae ATCC 49619, Haemophilus influenzae ATCC 49766, Campylobacter jejuni ATCC 33560, Candida krusei ATCC 6258; Candida parapsilosis ATCC 22019) como para la detección de los principales mecanismos de resistencia6.
- a.
Betalactamasas de espectro extendido (BLEE) y resistencia de algunas combinaciones de betalactámico-inhibidor de betalactamasas como ceftazidima-avibactam, ceftolozano-tazobactam y piperacilina-tazobactam: Klebsiella pneumoniae ATCC 700603 productora de SHV-18.
- b.
Staphylococcus aureus resistente a meticilina (gen mecA): Staphylococcus aureus NCTC 12493.
- c.
Enterococo resistente a vancomicina (fenotipo VanB): Enterococcus faecalis ATCC 51299.
- d.
Enterococo con resistencia de alto nivel a la gentamicina: Enterococcus faecalis ATCC 51299.
- e.
Haemophilus influenzae con disminución de la sensibilidad a la ampicilina debida a mutaciones en las PBP: Haemophilus influenzae ATCC 49247.
- f.
Resistencia a colistina: Escherichia coli NCTC 13846 (mcr-1).
7. Adaptar la información documental y el sistema de soporte informático del laboratorio.
Realizar todos los cambios necesarios en los documentos o procedimientos de trabajo disponibles en el laboratorio (documentación técnica y manuales de calidad) así como en el sistema de soporte informático del laboratorio y en los resultados que se envíen en su caso a la historia clínica del paciente.
8. Información de los diferentes niveles de las posibles variaciones de interpretación de la sensibilidad.
Informar a los facultativos responsables del paciente y a las Comisiones de Infecciones y/o Política de Antimicrobianos y de Farmacia de las posibles variaciones de interpretación de la sensibilidad23. Comunicar también si se decide dejar de informar el antibiograma interpretado en el caso de determinados mecanismos de resistencia como las cepas que expresan BLEE; en estos casos, añadir un comentario al respecto en el informe del laboratorio tal y como recomienda el EUCAST en sus documentos.
9. Considerar las diferencias en el análisis de los informes de sensibilidad acumulada.
Este dato se debe tener presente al analizar los resultados de los informes acumulados de sensibilidad, que pueden variar en algunos aspectos respecto a los de otros años (disminución de la sensibilidad en las combinaciones especie-antimicrobiano en las que existe variación en los puntos de corte) y elaborar estos según las directrices del EUCAST23-27 y las recomendadas en los Procedimientos en Microbiología Clínica de la SEIMC28.
10. Consultar dudas o dificultades al COESANT.
Consultar cualquier cuestión derivada del proceso de transición del CLSI al EUCAST con el COESANT (http://coesant-seimc.org/).
FinanciaciónPara la realización de este documento no se ha contado con financiación específica. Las actividades del COESANT están parcialmente financiadas por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). La investigación de MNL, RC, FFC, AO y LMM está financiada por el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 y el Instituto de Salud Carlos III, Subdirección General de Redes y Centros de Investigación Cooperativa, Ministerio de Ciencia, Innovación y Universidades, Red Española de Investigación en Patología Infecciosa (REIPI RD16/0016/0003; RD16/0016/0011; RD16/0016/0001; RD16/0016/0004; RD16/0016/0008) cofinanciadas por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa», Programa Operativo Crecimiento Inteligente 2014-2020.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.