La profilaxis antirretroviral en exposiciones accidentales al virus de la inmunodeficiencia humana (VIH) no ocupacionales es muy utilizada, a pesar de que las evidencias científicas de su efectividad son insuficientes. El objetivo de este estudio es describir las características de los individuos expuestos, tipos de exposición, tratamiento antirretroviral prescrito y resultados de la infección por el VIH en las exposiciones accidentales no ocupacionales en España.
MétodoSe han utilizado los datos de las exposiciones accidentales al VIH entre enero de 2001 y diciembre de 2005 notificadas al Sistema de Información Epidemiológica Estatal sobre la profilaxis postexposición (PPE) no ocupacional al VIH. Se definió una exposición no ocupacional como aquella situación en la que se produce contacto con sangre y/o otros fluidos biológicos de manera accidental fuera del ámbito estrictamente sanitario.
ResultadosSe notificaron un total de 993 exposiciones; 569 fueron hombres (57,3%) con una mediana de edad de 30 años (rango intercuartil: 1-87). En el 53,1% fue una exposición sexual, en el 39,8% parenteral y en el 7,2% fueron otras exposiciones. La persona fuente se identificó en el 82,7% de los casos. En 528 (53,2%) se administró tratamiento antirretroviral (TAR) y triple terapia en el 68,2% de los casos. Entre los que recibieron TAR acudieron para revisión a los 6 meses el 54,2% y el 61,1% entre los que no (p < 0,05). En 135 casos (32,4%) se produjo algún efecto secundario y se produjeron 18 interrupciones del tratamiento (4,3%). Se notificaron tres seroconversiones al VIH (0,3%).
ConclusionesEl elevado número de casos notificados, los efectos secundarios y las dificultades de seguimiento hacen necesario continuar monitorizando la práctica de la PPE no ocupacional al VIH a través de un registro nacional.
Non-occupational post-exposure prophylaxis for human immunodeficiency virus (HIV) infection is widely used, although there is little available scientific evidence to support its effectiveness. The aim of this study is to describe the characteristics of the persons exposed, types of exposures, antiretroviral treatment prescribed, and outcome of HIV infection in cases of non-occupational exposure in Spain.
MethodThe data used included all cases of accidental HIV exposure notified to the Non-occupational Post-exposure Prophylaxis Information System between January 2001 and December 2005. Non-occupational exposure to HIV was defined as accidental contact with blood and/or other biological fluids outside the healthcare setting.
ResultsA total of 993 cases of exposure were notified (569 men [57.3%]); median age was 30 years (range: 1-87). Exposure was sexual in 53.1%, parenteral in 39.8%, and other types in 7.2%. The source person was identified in 82.7% of cases. Antiretroviral treatment (ART) was prescribed in 528 cases (53.2%), with triple therapy in 68.2%. A total of 54.2% returned for the 6-month visit among patients receiving ART and 61.1% among those without this therapy (P<0.05). One or more side effects developed in 135 (32.4%) cases, and there were 18 treatment interruptions (4.3%). Three seroconversions to HIV were notified (0.3%).
ConclusionsA national registry for monitoring non-occupational post-exposure prophylaxis to HIV is needed because of the high number of cases notified, the considerable incidence of side effects, and the difficulties of follow-up.
La profilaxis postexposición (PPE) para el virus de la inmunodeficiencia humana (VIH) es el estándar de actuación cuando un trabajador sanitario sufre una exposición accidental al VIH1,2. Por otro lado, no existen datos científicos suficientes que hayan demostrado la efectividad de la PPE en el ámbito no ocupacional. Sin embargo, diferentes factores justifican el uso de esta profilaxis. En primer lugar, la plausibilidad biológica3; en segundo lugar, la eficacia demostrada científicamente del tratamiento antirretroviral (TAR) usado en la profilaxis postexposición en animales4–6 y en exposiciones ocupacionales en humanos7, y en tercer lugar, la efectividad de la zidovudina (AZT) en la prevención de la transmisión perinatal8. Finalmente, se ha apreciado un incremento tanto en la demanda de esta profilaxis como en el número de prescripciones9.
De manera similar a lo acontecido en otros países10,11 y con la finalidad de describir la demanda y uso de la PPE no ocupacional y eventualmente su efectividad, la Comisión Europea financió un proyecto europeo de exposiciones accidentales no ocupacionales al VIH con la participación de 14 países europeos (2001–2003)12, coordinados por el Centro de Estudios Epidemiológicos sobre el Sida de Cataluña. Algunos de estos países ya tenían implementado su propio registro desde hacía algunos años13–15.
El objetivo de este estudio es describir las características de los individuos potencialmente expuestos al VIH, tipos y grado de riesgo de la exposición, TAR prescrito, tolerancia y adherencia al mismo a partir de los casos declarados en España durante el período entre 2001 y 2005.
MétodosEn 2001, en España se puso en marcha un proyecto de ámbito estatal sobre la PPE no ocupacional al VIH, financiado por la Fundació La Marató de TV3 y como parte integrante del proyecto europeo12 (sistema de información epidemiológica estatal sobre la PPE no ocupacional). En este proyecto han participado de forma voluntaria 25 centros. En cada uno se designó un responsable, el cual se encargó de la recogida y el envío de los datos a través de un formulario específico que recogía información de tres períodos: la visita inicial, al mes y a los 6 meses de la misma.
La población de estudio consiste en todos los individuos que acuden a distintos servicios de los centros participantes de manera voluntaria por consultas relacionadas con estas exposiciones.
La exposición no ocupacional se definió como aquella situación en la que se produce contacto con sangre y/u otros fluidos líquidos biológicos por vía sexual o parenteral fuera del ámbito estrictamente sanitario16,17.
El registro incluye exposiciones no ocupacionales al VIH, hayan recibido o no TAR, y se recoge de forma anónima y voluntaria información sobre las características de los individuos expuestos y fuente de contagio, características de la exposición, riesgo de contagio según categorías (bajo, medio, alto)17, serologías y seguimiento clínico, TAR prescrito y tolerancia y adherencia al mismo.
Las variables incluidas en este estudio fueron sexo, edad, tipo de exposición categorizada en parenteral, sexual u otras, tiempo entre la exposición y la primera consulta, persona fuente identificada o no, estado serológico frente a la infección por el VIH de la persona fuente y de la persona expuesta, evaluación del grado de riesgo de la exposición por parte del médico notificante del caso, indicación de TAR, pautas de TAR administradas, presentación de efectos adversos y tipos de efectos presentados, cumplimiento de TAR y motivos del abandono del tratamiento.
En el análisis descriptivo las variables cuantitativas se expresaron con medias y su desviación típica, o medianas y rangos intercuartiles, según tipo de distribución, y las variables cualitativas con porcentajes. Para la comparación de las variables cuantitativas se utilizó el test de la t de Student, comprobando previamente la hipótesis de homogeneidad de varianzas mediante el test de Levene, cuando la distribución era normal y, en su defecto, la prueba no paramétrica de Mann-Whitney. La tendencia en las proporciones a lo largo del tiempo para alguna de las características estudiadas se analizó mediante el test de Mantel. Los datos se analizaron con el paquete estadístico SPSS versión 13.0 para Windows.
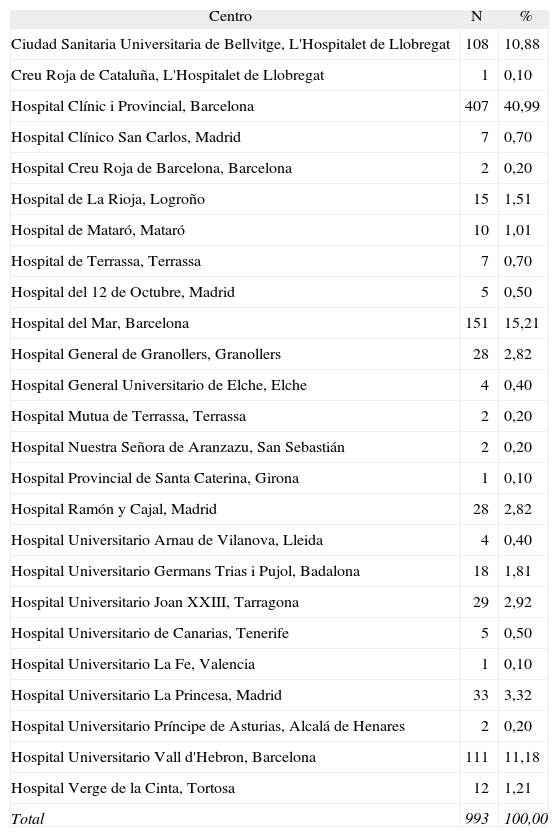
ResultadosSe incluyeron un total de 993 exposiciones declaradas por centros españoles del total de los 3.487 casos notificados al registro europeo para el período entre enero de 2001 y diciembre de 2005. Se observó un incremento paulatino en el número de notificaciones anuales pasando de 139 en 2001 a 282 en 2005. En la tabla 1 se puede ver el número de casos notificados por cada centro participante para el período estudiado.
Distribución de los casos notificados según centro, 2001–2005
| Centro | N | % |
| Ciudad Sanitaria Universitaria de Bellvitge, L'Hospitalet de Llobregat | 108 | 10,88 |
| Creu Roja de Cataluña, L'Hospitalet de Llobregat | 1 | 0,10 |
| Hospital Clínic i Provincial, Barcelona | 407 | 40,99 |
| Hospital Clínico San Carlos, Madrid | 7 | 0,70 |
| Hospital Creu Roja de Barcelona, Barcelona | 2 | 0,20 |
| Hospital de La Rioja, Logroño | 15 | 1,51 |
| Hospital de Mataró, Mataró | 10 | 1,01 |
| Hospital de Terrassa, Terrassa | 7 | 0,70 |
| Hospital del 12 de Octubre, Madrid | 5 | 0,50 |
| Hospital del Mar, Barcelona | 151 | 15,21 |
| Hospital General de Granollers, Granollers | 28 | 2,82 |
| Hospital General Universitario de Elche, Elche | 4 | 0,40 |
| Hospital Mutua de Terrassa, Terrassa | 2 | 0,20 |
| Hospital Nuestra Señora de Aranzazu, San Sebastián | 2 | 0,20 |
| Hospital Provincial de Santa Caterina, Girona | 1 | 0,10 |
| Hospital Ramón y Cajal, Madrid | 28 | 2,82 |
| Hospital Universitario Arnau de Vilanova, Lleida | 4 | 0,40 |
| Hospital Universitario Germans Trias i Pujol, Badalona | 18 | 1,81 |
| Hospital Universitario Joan XXIII, Tarragona | 29 | 2,92 |
| Hospital Universitario de Canarias, Tenerife | 5 | 0,50 |
| Hospital Universitario La Fe, Valencia | 1 | 0,10 |
| Hospital Universitario La Princesa, Madrid | 33 | 3,32 |
| Hospital Universitario Príncipe de Asturias, Alcalá de Henares | 2 | 0,20 |
| Hospital Universitario Vall d'Hebron, Barcelona | 111 | 11,18 |
| Hospital Verge de la Cinta, Tortosa | 12 | 1,21 |
| Total | 993 | 100,00 |
N: número absoluto.
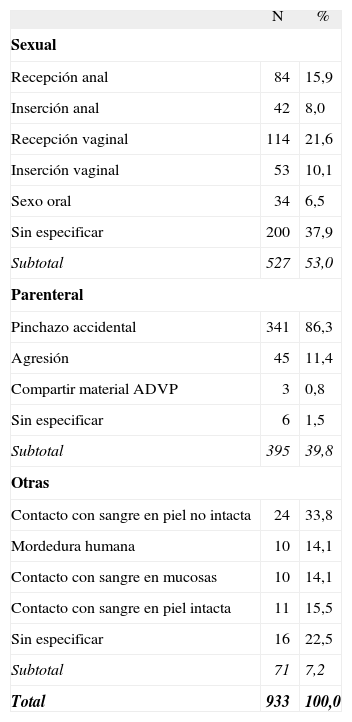
Del total de las exposiciones notificadas, 569 (57,3%) fueron en hombres. La mediana de edad fue de 30 años (rango intercuartil: 1–87). La mediana del tiempo entre la exposición y la primera consulta fue de 19,2 h (rango intercuartil: 6–84 h). En 528 casos (53,2%) se prescribió PPE. Se encontró una diferencia estadísticamente significativa entre las personas que recibieron TAR con una mediana de 12,2 h (rango intercuartil: 6–52,6 h) desde la exposición hasta la consulta, y las que no lo recibieron con una mediana de 36 h (rango intercuartil: 6–156 h). En el 53,1% (527) la exposición accidental fue por vía sexual, en el 39,8% (395) por vía parenteral y en el 7,2% (71) por otros tipos de exposición (tabla 2). En el análisis de tendencias se observó que la proporción de exposiciones sexuales declaradas se incrementaron a lo largo de los años pasando del 38,8% en 2001 al 72,7% en 2005 (p < 0,05). De las 527 exposiciones accidentales de origen sexual, 135 (25,6%) fueron relaciones esporádicas consentidas con personas conocidas, 116 (22%) fueron agresiones sexuales, 110 (20,9%) con la pareja estable, 3 (0,6%) relaciones consentidas con personas desconocidas y en 163 (30,9%) se desconocía el tipo de pareja sexual.
Distribución de los tipos de exposición notificadas
| N | % | |
| Sexual | ||
| Recepción anal | 84 | 15,9 |
| Inserción anal | 42 | 8,0 |
| Recepción vaginal | 114 | 21,6 |
| Inserción vaginal | 53 | 10,1 |
| Sexo oral | 34 | 6,5 |
| Sin especificar | 200 | 37,9 |
| Subtotal | 527 | 53,0 |
| Parenteral | ||
| Pinchazo accidental | 341 | 86,3 |
| Agresión | 45 | 11,4 |
| Compartir material ADVP | 3 | 0,8 |
| Sin especificar | 6 | 1,5 |
| Subtotal | 395 | 39,8 |
| Otras | ||
| Contacto con sangre en piel no intacta | 24 | 33,8 |
| Mordedura humana | 10 | 14,1 |
| Contacto con sangre en mucosas | 10 | 14,1 |
| Contacto con sangre en piel intacta | 11 | 15,5 |
| Sin especificar | 16 | 22,5 |
| Subtotal | 71 | 7,2 |
| Total | 933 | 100,0 |
ADVP: adicto a drogas por vía parenteral; N: número absoluto.
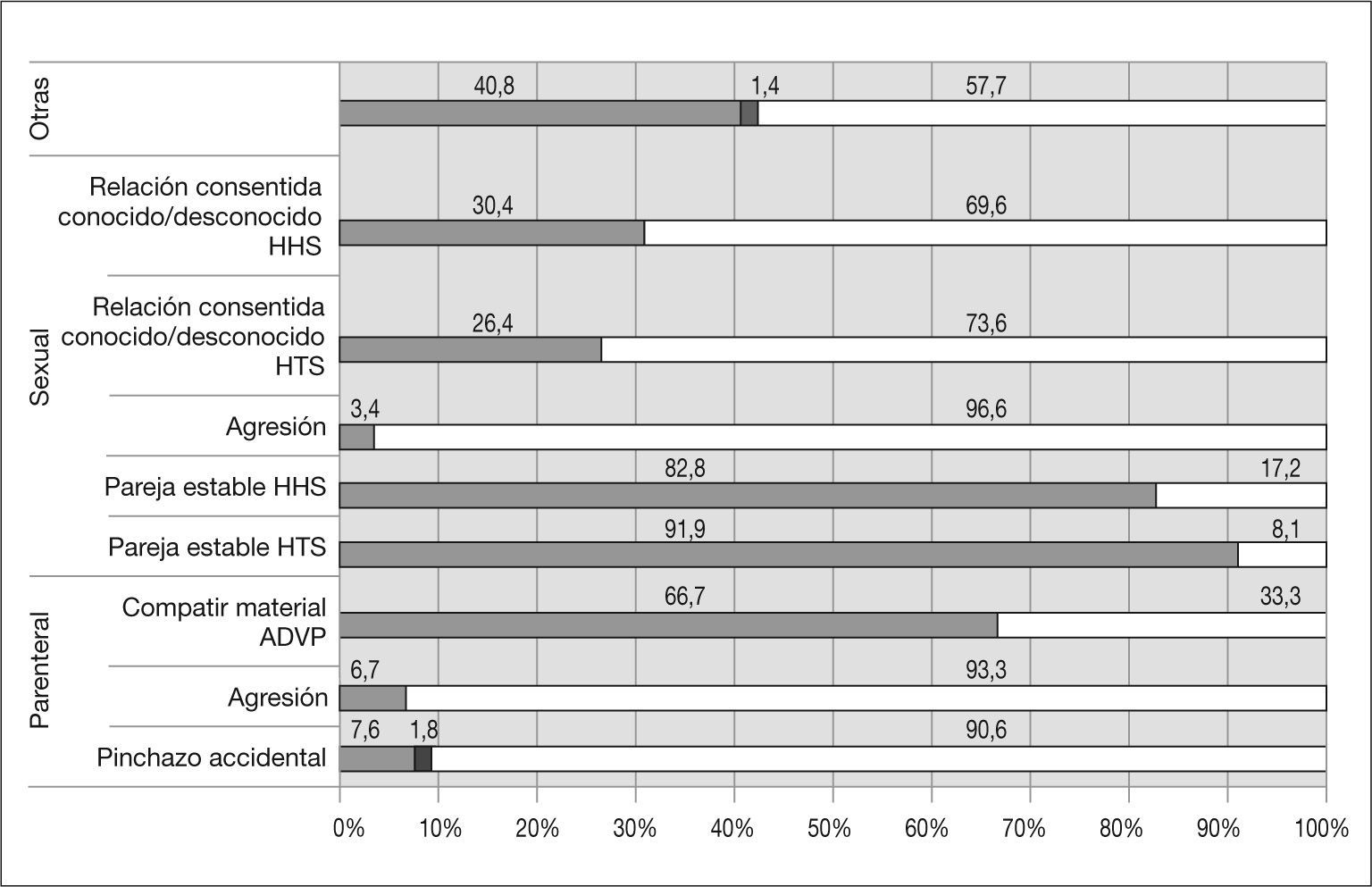
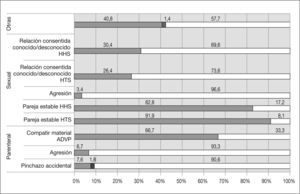
La persona fuente fue identificada en 821 casos (82,7%). De éstos, en el 73,9% el estado serológico inicial respecto al VIH era desconocido. En la figura 1 se representa el estado serológico inicial respecto al VIH de la persona fuente para los diferentes tipos de exposiciones accidentales. Entre las exposiciones en que el estado serológico del VIH de la persona fuente era desconocido destacan las agresiones sexuales, las agresiones con agujas y los pinchazos accidentales (el 96,6, el 93,3 y el 90,6%, respectivamente).
Del total de exposiciones, en 814 (82%) constaba la evaluación sobre el grado de riesgo de la exposición realizada por el médico notificante. La distribución fue la siguiente: 447 casos de bajo riesgo (45%), 241 casos de riesgo medio (24,3%) y 126 casos de riesgo alto (12,7%).
La mayoría de las profilaxis se prescribieron después de una exposición sexual (61,6%), seguidas de una exposición parenteral (33,1%) y de otras exposiciones (5,3%). Cabe destacar que de las 341 exposiciones parenterales por pinchazo accidental (tabla 2), se recibió el riesgo evaluado por los médicos que atienden el caso en 260 (76,2%), y de éstas 16 se catalogaron de alto riesgo. No obstante, en 142 de los pinchazos accidentales (41,6%) se prescribió TAR con 32 solicitudes expresas de la persona expuesta y 2 pacientes que rehusaron tomarlo.
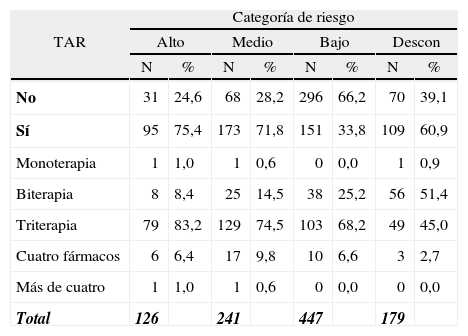
Las pautas de TAR prescritas incluían: 3 fármacos en el 68,2% de los casos, 2 en el 24,1%, 4 en el 6,8% y 1o más de 4 en el resto de los casos. Los TAR con 3 fármacos más frecuentes combinaban AZT y lamivudina (Combivir®) con nelfinavir (Viracept®) o atazanavir (Reyatar®). En la tabla 3 se puede ver la distribución de las pautas de tratamiento según el grado de riesgo. Cabe destacar que el 60,9% de los casos en que no constaba la evaluación de riesgo, se prescribió TAR, y que en el 33,8% de los casos clasificados como de bajo riesgo también se prescribió TAR. El test de tendencias mostró que la proporción de casos clasificados de bajo riesgo a los que se les prescribió TAR se incrementó a lo largo de los años, pasando del 34,8% en 2001 al 40,2% en 2005 (p < 0,05).
Distribución de tratamientos y pautas según la categoría de riesgo de la exposición
| TAR | Categoría de riesgo | |||||||
| Alto | Medio | Bajo | Descon | |||||
| N | % | N | % | N | % | N | % | |
| No | 31 | 24,6 | 68 | 28,2 | 296 | 66,2 | 70 | 39,1 |
| Sí | 95 | 75,4 | 173 | 71,8 | 151 | 33,8 | 109 | 60,9 |
| Monoterapia | 1 | 1,0 | 1 | 0,6 | 0 | 0,0 | 1 | 0,9 |
| Biterapia | 8 | 8,4 | 25 | 14,5 | 38 | 25,2 | 56 | 51,4 |
| Triterapia | 79 | 83,2 | 129 | 74,5 | 103 | 68,2 | 49 | 45,0 |
| Cuatro fármacos | 6 | 6,4 | 17 | 9,8 | 10 | 6,6 | 3 | 2,7 |
| Más de cuatro | 1 | 1,0 | 1 | 0,6 | 0 | 0,0 | 0 | 0,0 |
| Total | 126 | 241 | 447 | 179 | ||||
Descon: desconocido; N: número absoluto; TAR: terapia antirretroviral.
Acudieron a la visita de seguimiento al mes 756 de los casos (76,1%), el 79% de los que recibieron TAR y el 72,9% de los no tratados (p < 0,05). A los 6 meses acudieron 570 casos (57,4%), el 54,2 y el 61,1% entre los que recibieron TAR y los que no, respectivamente (p < 0,05).
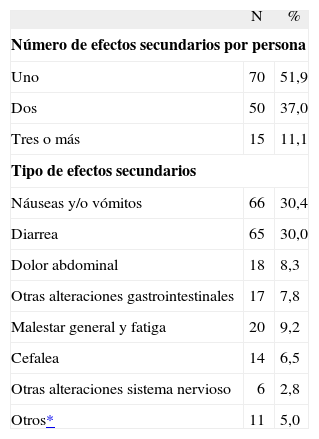
En relación con la adherencia al TAR, entre los tratados y con constancia de alguna visita posterior, en 18 casos (4,3%) se interrumpió el tratamiento. Los motivos fueron, en primer lugar, la presentación de efectos adversos en 7 personas (38,9%), y en segundo lugar, 6 personas decidieron suspender el TAR por propia elección, en 2 casos se constató que la persona fuente era VIH negativa con posterioridad al inicio de la profilaxis y, finalmente, 3 casos abandonaron el TAR por otros motivos no especificados. Entre las personas expuestas que recibieron tratamiento y vinieron a alguna visita posterior, 135 (32,4%) presentaron algún efecto adverso, ninguno de los cuales requirió ingreso hospitalario ni tratamiento específico. Los síntomas gastrointestinales fueron los más frecuentes (76,5%), seguidos de síntomas inespecíficos como malestar general y fatiga (9,2%) y de la afectación del sistema nervioso (9,2%). El resto de efectos adversos (5,1%) se manifestaron como fiebre, alteraciones de la piel y alteraciones de las pruebas de laboratorio y del sistema genitourinario (tabla 4).
Número y tipos de efectos secundarios en las personas con TAR que acuden a una visita posterior
| N | % | |
| Número de efectos secundarios por persona | ||
| Uno | 70 | 51,9 |
| Dos | 50 | 37,0 |
| Tres o más | 15 | 11,1 |
| Tipo de efectos secundarios | ||
| Náuseas y/o vómitos | 66 | 30,4 |
| Diarrea | 65 | 30,0 |
| Dolor abdominal | 18 | 8,3 |
| Otras alteraciones gastrointestinales | 17 | 7,8 |
| Malestar general y fatiga | 20 | 9,2 |
| Cefalea | 14 | 6,5 |
| Otras alteraciones sistema nervioso | 6 | 2,8 |
| Otros* | 11 | 5,0 |
N: número absoluto; TAR: tratamiento antirretroviral.
Durante el período estudiado, se han identificado 3 seroconversiones al VIH (0,3%), en los años 2003, 2004 y 2005, respectivamente. Se han producido en hombres con una relación homosexual desprotegida, que presentaron resultado negativo previo al TAR para las pruebas serológicas de anticuerpos anti-VIH en el momento de la consulta.
Los 3 pacientes recibieron la triple combinación de AZT + lamivudina + nelfinavir durante 4 semanas sin interrupciones del tratamiento. El tiempo transcurrido entre la exposición motivo de consulta y el inicio de la profilaxis fue de 2, 24 y 40 h, respectivamente. Todos ellos habían tenido otras exposiciones, uno de ellos antes y dos antes y después de la que motivó la consulta. En los 3 casos se desconocía el estado serológico respecto al VIH de la persona fuente, aunque estaban identificadas en todos ellos. Ninguna fuente acudió, a pesar de que se requirió, para realizar pruebas de secuenciación del virus.
DiscusiónConforme a los resultados mostrados, y aun teniendo en cuenta el carácter voluntario y no exhaustivo de las notificaciones, el número de casos recogidos es similar al de otros registros de nuestro entorno en períodos similares13,18,19. A pesar de que el número de notificaciones a lo largo del período se ha incrementado ligeramente, no se ha podido establecer si este incremento es significativo por el carácter voluntario del registro y desconocimiento de número total de exposiciones de riesgo producidas cada año en España. Tampoco parece que la aparición en 2002 de las recomendaciones estatales17 hayan incrementado de una manera significativa la demanda de esta profilaxis, corroborando otros estudios anteriores20,21 y contrariamente a lo que otros habían sugerido22,23.
Cabe destacar que el porcentaje de exposiciones de carácter sexual (61,6%) es el más elevado, aunque también es elevado el de exposiciones parenterales (33,1%), que es mayor al de otros registros europeos13,18,19.
Si tenemos en cuenta que en la mayoría de las ocasiones el estado de la persona fuente respecto al VIH es desconocido, muchas de las prescripciones notificadas no cumplen con las recomendaciones17, destacando en nuestros resultados el 33,8% de casos clasificados como de bajo riesgo a los que se ha prescrito TAR (tabla 3). Este hecho tiene màs relevancia cuando vemos que, contrariamente a lo esperado, esta proporciòn no decrece, sino que aumenta a lo largo de perìodo de estudio. Estos resultados nos pueden indicar que, o bien los mèdicos no conocen las recomendaciones o bien no son aceptadas y no las aplican. En la pràctica, en la decisiòn de los mèdicos para prescribir TAR tambièn tiene en cuenta la ansiedad y la demanda de los pacientes. Algunos estudios sobre el impacto de las polìticas sanitarias y recomendaciones oficiales en Francia23, Columbia Britànica24 y Nueva York25 sugieren que la PPE es frecuentemente prescrita tras exposiciones de muy bajo riesgo como respuesta a la insistencia de los pacientes.La PPE con antirretrovirales se deberìa empezar tan pronto como fuera posible y no màs tarde de las 72 h para obtener los màximos beneficios26. En nuestro estudio, la mediana de tiempo desde la exposiciòn hasta el inicio de TAR es de 12,2 h, con un rango intercuartil entre las 6 y las 84 h. Estos datos son similares a los de otros registros no ocupacionales en los que la mediana de tiempo entre la exposiciòn y el inicio de TAR està alrededor de 25 h13,19 o màs del 75% son tratados antes de 48 h18.La mayorìa de las personas tratadas con TAR ha recibido la combinaciòn de tres fàrmacos (68,2%). De todas maneras, la amplia disponibilidad de fármacos antirretrovirales en nuestro país se refleja en la gran variedad de pautas prescritas (datos no mostrados). La individualización del tratamiento está justificada cuando la persona fuente es VIH positiva, ha recibido TAR y se sospecha o se sabe de la resistencia a algún fármaco. Estos resultados son similares a los notificados en otros registros13 y, a pesar de que no existen ensayos clínicos controlados y aleatorizados que comparen diferentes pautas de tratamiento, sí que hay estudios comparativos de toxicidad, interrupción de tratamiento y de resistencia tanto a favor de la doble terapia27 como de la triple terapia28.
Aunque un alto porcentaje de individuos realiza una visita de control pasado un mes de la consulta, fundamentalmente entre los que se prescribió profilaxis para un control de la TAR recibida, casi la mitad de los casos no vuelve a los 6 meses de la consulta, y este dato es menor incluso entre los que recibieron TAR. Esto supone un grave inconveniente para evaluar la eficacia de los tratamientos prescritos en su caso y de la efectividad de la profilaxis a través del registro en general, y ha sido ya descrito anteriormente14,18,19,21.
Entre las personas a las que se les prescribió TAR y se tuvo información sobre el seguimiento, el 32,4% presentó algún efecto secundario. Los síntomas gastrointestinales (náuseas, diarrea, vómitos), el malestar general y la fatiga fueron los más frecuentes. Aunque la frecuencia de presentación de efectos secundarios es relativamente alta, ésta ha sido inferior a la encontrada en otros registros28–30. La presentación de estos síntomas y su relación con los antirretrovirales prescritos es bien conocida, sin afectación grave de marcadores lipídicos, hepáticos ni inmunológicos31. La intolerancia a TAR hizo que sólo en el 1,7% se abandonara el tratamiento por este motivo. La prescripción de la PPE debería restringirse a situaciones en las que el riesgo de transmisión del VIH está bien documentado y los beneficios superan claramente la posibilidad de efectos secundarios.
Debido a que las notificaciones de las exposiciones accidentales al VIH son voluntarias y que éstas provienen sobre todo de unos pocos hospitales, los más activos en las notificaciones, los casos representan tan sólo una parte del total de exposiciones no ocupacionales en nuestro país, con una infradeclaración muy alta y, por tanto, no es representativo de lo que ocurre en la población general. En este sentido, un trabajo presentado por el grupo de Correll et al32 estableció que la proporción de contactos accidentales de tipo no ocupacional en la región de Nueva Gales del Sur (Australia) sobre el total de exposiciones accidentales fue del 95%, lo cual nos da una idea del uso potencial de la PPE en el ámbito no ocupacional.
Del total de notificaciones recibidas para el período estudiado se han confirmado 3 casos de seroconversiones al VIH y, aunque como se ha expuesto, en todos se cumplió el TAR, en ninguno de los casos, la seroconversión se ha podido atribuir a un fallo de la profilaxis antirretroviral debido a las exposiciones previas o posteriores a la que motivó la prescripción de la profilaxis. Este hecho ya se ha descrito anteriormente y, con frecuencia, no es posible determinar el origen de la seroconversión con certeza en estos individuos33. También cabe señalar que debido a las pérdidas de seguimiento (acudieron a la visita de seguimiento de los 6 meses sólo el 57,4%) la estimación de seroconversiones puede ser inferior a la real.
Este estudio ha demostrado la viabilidad, pertinencia y aplicabilidad de un registro de PPE no ocupacional al VIH en nuestro país. Los resultados presentados confirman que, a pesar de la falta de evidencia científica sobre su eficacia, y al igual que ha pasado en otros países, en España tanto la demanda como la dispensación de PPE no ocupacional están aumentando y, además, muchas veces se utiliza en escenarios no previstos en las recomendaciones existentes. En primer lugar, es esencial recordar que esta práctica debe usarse en situaciones de excepcionalidad y que en ningún momento puede desplazar a la prevención primaria del VIH, la cual debe seguir siendo una prioridad tanto en intervenciones comunitarias como individuales. En segundo lugar, es necesario que las administraciones sanitarias actualicen y evalúen las recomendaciones clínicas del uso de la PPE no ocupacional. La monitorización de la práctica de la PPE no ocupacional es relevante, pues, tanto para mejorar los criterios de prescripción como el acceso a la misma por parte de las poblaciones que más pueden beneficiarse de ella.
AgradecimientosLos autores quieren expresar su agradecimiento a todos los profesionales que han participado en este estudio, que ha sido financiado por la Fundació Marató de TV3 en su convocatoria de 2001, además de recibir financiación parcial del Departamento de Salud de la Generalitat de Cataluña y la Dirección General de Investigación (2001/SGR/00402) del Departamento de Universidades, Investigación y Sociedad de la Información de la Generalitat de Cataluña. Asimismo, este trabajo se ha realizado en el marco del Centro de Investigación Biomédica en Red de Epidemiología y Salud Pública (CIBERESP) y la Red Temática Cooperativa de Investigación en SIDA (RETIC RD06/0006) del Instituto de Salud Carlos III, Ministerio de Sanidad y Consumo.
Grupo NONOPEPJ. Almeda, J. Casabona, C. Contreras, B. Marincovich, G. Simon, A. Esteve, N. Vives (CEEISCAT), F. García, E. Fumero, A. León, M. Nomdedeu (Hospital Clínic i Provincial, Barcelona), M. Campins, X. Martínez (Hospital Universitario Vall d'Hebron, Barcelona), J.M. Ramon, L. Gavaldá (Hospital Universitario de Bellvitge, L'Hospitalet de Llobregat), I. Santos (Hospital Universitario La Princesa, Madrid), A. Guelar (Hospital del Mar, Barcelona), J. del Romero (Centro Sanitario Sandoval, Madrid), F. Vidal (Hospital Universitario Joan XXIII, Tarragona), E. Pedrol, E. Deig (Hospital General de Granollers), F. Dronda, M. Fernández (Hospital Ramón y Cajal, Madrid), C. Tural, C. Fumaz, C. Miranda (Hospital Universitario Germans Trias i Pujol, Badalona), J. Oteo, J. Blanco (Hospital de la Rioja, Logroño), A. Orti (Hospital Verge de la Cinta, Tortosa), L. Force (Hospital de Mataró), M.J. Téllez, J. Vergas (Hospital Clínico San Carlos, Madrid), F. Bella (Hospital de Terrassa), F. Pulido (Hospital 12 de Octubre, Madrid), G. Sirvent (Hospital General de Canarias, Santa Cruz de Tenerife), F. Gutiérrez (Hospital General Universitario de Elche), E. Barbe (Hospital Universitario Arnau de Vilanova, Lleida), I. García (Hospital Creu Roja, Barcelona), D. Dalmau (Hospital Mutua de Terrassa), J. Iribarren, X. Goicoechea (Hospital Nuestra Señora de Aranzazu, San Sebastián), A. Arranz (Hospital Universitario Príncipe de Asturias, Alcalá de Henares), L. Ferrer (Creu Roja de Cataluña, L'Hospitalet de Llobregat), J. Colomer (Hospital Provincial de Santa Caterina, Girona), J. López (Hospital Universitario de la Fe, Valencia).