El SARS-CoV-2 es un nuevo virus emergente, causante de la actual pandemia de COVID-19. La detección de material genético del virus en muestras respiratorias mediante métodos moleculares constituye la herramienta principal para el diagnóstico. La medida de la respuesta de anticuerpos específicos puede ser una ayuda en determinadas circunstancias. En un breve espacio de tiempo, se han comercializado múltiples técnicas serológicas, pero no todas ofrecen resultados óptimos en términos de sensibilidad y especificidad y es limitada la bibliografía que avale su uso en el contexto clínico. Por ello es importante realizar estudios de validación con muestras clínicas antes de su aplicación en la práctica.
Las pruebas de ELISA fueron las primeras en aparecer y han proporcionado buenos resultados1. El método ELISA de Euroimmun Medizinische Labordiagnostika® (Lübeck, Alemania) fue el primer test del mercado para la evaluación cuantitativa de IgG e IgA, dirigida contra la proteína S12. Otras técnicas como las de quimioluminiscencia (CLIA) ofrecen un mayor grado de automatización y pueden proporcionar resultados más rápidos con menor consumo de recursos humanos. Liaison® SARS-CoV-2 S1/2 IgG Diasorin (Saluggia, Italia) detecta anticuerpos frente a las proteínas S1 y S2 del SARS-CoV-2, mediante CLIA en un equipo automatizado, que ha sido poco evaluado en la práctica clínica. Nos propusimos conocer el rendimiento de este equipo utilizando muestras de suero provenientes del banco de sangre de pacientes recuperados de COVID-19, potenciales donantes de plasma hiperinmune.
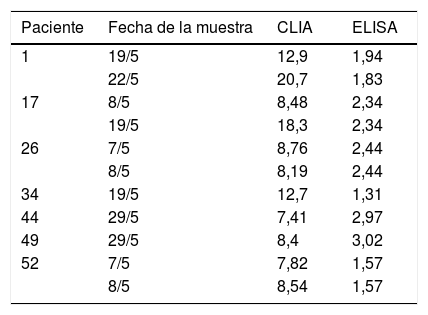
Estudiamos un set de 91 sueros de 57 pacientes, todos ellos con RT-PCR positiva. Treinta y un pacientes tuvieron varias extracciones de sucesivas donaciones. Todas las muestras tuvieron un resultado positivo para IgG mediante ELISA (Euroimmun), con valores que oscilaron entre 1,31 y > 13 (cut off > 1,1). Con el punto de corte > 15 indicado por el fabricante, hubo nueve muestras con resultados discrepantes, siendo siete muestras negativas y dos con resultado dudoso por CLIA (tabla 1). Con estos datos, la sensibilidad obtenida para la prueba IgG CLIA de Diasorin fue del 90,1%. En dos de los pacientes con resultados falsos negativos se observó que la recogida de la muestra fue más próxima al momento de la infección.
Para estudiar la especificidad utilizamos 11 muestras de la seroteca, que presentaban títulos altos para otros patógenos respiratorios (siete Mycoplasma pneumoniae, uno Chlamydophila pneumoniae, uno Coxiella burnetii) y otros dos de pacientes con neumonía sin diagnóstico etiológico, todos ellos obtenidos antes de noviembre de 2019. Todas estas muestras fueron negativas, tanto por CLIA (con valores < 3,80 en todas), como por ELISA. Por lo tanto, la especificidad obtenida en nuestra serie fue del 100%.
En los escasos trabajos disponibles hasta la fecha, la sensibilidad y la especificidad han oscilado entre 43,8 y 84%, y entre 94,9 y 97,9%, respectivamente3–5, y la sensibilidad aumenta cuando han transcurrido más de 15 días tras la aparición de los síntomas o de la positividad de la PCR, alcanzando el 87,5%5. Por otra parte, algunos autores han señalado la posibilidad de bajar el punto de corte para mejorar la sensibilidad2,6, sugiriendo que al adaptar el cut off, el Liaison® SARS-CoV-2 S1/2 IgG muestra al menos el mismo rendimiento, si no mejor, que la prueba ELISA2. Un reciente trabajo patrocinado por el propio fabricante (Diasorin) propone el uso de un punto de corte de nueve, con incremento de la sensibilidad, pasando de 88,2 a 91,3%, cuando se reduce el punto de corte, sin que la especificidad disminuya significativamente7. Aplicando este valor, la sensibilidad en nuestra serie aumentaría a 93,4%, sin pérdida de especificidad.
En conclusión, el equipo Liaison® de Diasorin resulta de fácil manejo y buena adaptabilidad al laboratorio clínico. Encontramos que la prueba SARS-CoV-2 S1/2 IgG tiene una sensibilidad del 90,1% en sueros de pacientes con infección pasada por SARS-CoV-2. No hemos hallado reacciones cruzadas con otros patógenos respiratorios. El uso de un punto de corte inferior al propuesto por el fabricante podría ser recomendable para aumentar la sensibilidad.
A pesar de que el número de muestras analizadas es reducido, creemos interesante aportar los resultados de nuestro estudio, dada la limitada información sobre este equipo disponible hasta la fecha.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.