Proporcionar unas recomendaciones prácticas para el manejo de la enfermedad metabólica ósea en pacientes con virus de la inmunodeficiencia humana (VIH).
ParticipantesMiembros de diferentes sociedades científicas relacionadas con el metabolismo óseo y con la enfermedad VIH: Grupo de Estudio de Sida (GeSIDA), Sociedad Española de Endocrinología y Nutrición (SEEN), Sociedad Española de Investigación Ósea y del Metabolismo Mineral (SEIOMM) y Sociedad Española de Fractura Osteoporótica (SEFRAOS).
MétodosSe realizó una búsqueda sistemática en PubMed de la evidencia disponible para cada aspecto, y se revisaron artículos escritos en inglés y en castellano con fecha de inclusión hasta 28 de mayo de 2013. Las recomendaciones se formularon según el sistema GRADE (Grading of Recommendations, Assessment, Development, and Evaluation) para establecer tanto la fuerza de las recomendaciones como el grado de evidencia. Los autores trabajaron por grupos en la formulación de cada apartado de las recomendaciones y posteriormente el documento global se discutió en una reunión conjunta. Todos los autores revisaron el documento escrito final y lo consensuaron.
ConclusionesEl documento establece unas recomendaciones prácticas basadas en la evidencia acerca de la evaluación y el tratamiento de la enfermedad metabólica ósea en pacientes con VIH.
To provide practical recommendations for the evaluation and treatment of metabolic bone disease in human immunodeficiency virus (HIV) patients.
ParticipantsMembers of scientific societies related to bone metabolism and HIV: Grupo de Estudio de Sida (GeSIDA), Sociedad Española de Endocrinología y Nutrición (SEEN), Sociedad Española de Investigación Ósea y del Metabolismo Mineral (SEIOMM), and Sociedad Española de Fractura Osteoporótica (SEFRAOS).
MethodsA systematic search was carried out in PubMed, and papers in English and Spanish with a publication date before 28 May 2013 were included. Recommendations were formulated according to GRADE system (Grading of Recommendations, Assessment, Development, and Evaluation) setting both their strength and the quality of supporting evidence. Working groups were established for each major part, and the final resulting document was later discussed in a face-to-face meeting. All the authors reviewed the final written document and agreed with its content.
ConclusionsThe document provides evidence-based practical recommendations on the detection and treatment of bone disease in HIV-infected patients.
La mejoría de la esperanza de vida en la infección por el virus de la inmunodeficiencia humana (VIH) aumenta el riesgo de padecer enfermedades crónicas, entre las cuales se encuentra la osteoporosis1. La fisiopatología de la enfermedad ósea en el paciente con VIH es compleja, ya que en ella intervienen tanto factores de riesgo comunes a la población general como factores propios de la infección VIH, entre los que se incluyen los efectos de VIH y el efecto osteotóxico de algunos antirretrovirales2. La información disponible en este campo ha aumentado progresivamente, pero una gran parte se ha generado de forma reciente. Esta circunstancia obliga a los profesionales sanitarios encargados de la atención médica de pacientes con VIH a estar familiarizados con el diagnóstico, el seguimiento y el tratamiento de la enfermedad metabólica ósea y a disponer de una información fundamentada y actualizada que sustente sus criterios de actuación.
En este contexto, diferentes sociedades científicas relacionadas con el metabolismo óseo y con la enfermedad VIH (Grupo de Estudio de Sida [GeSIDA], Sociedad Española de Endocrinología y Nutrición [SEEN], Sociedad Española de Investigación Ósea y del Metabolismo Mineral [SEIOMM] y Sociedad Española de Fractura Osteoporótica [SEFRAOS]) decidieron desarrollar un documento de consenso acerca del manejo de la enfermedad metabólica ósea en pacientes con VIH.
Las recomendaciones se formularon según el sistema GRADE (Grading of Recommendations, Assessment, Development, and Evaluation) para establecer la fuerza de las recomendaciones y el grado de evidencia3. Este sistema establece una descripción gráfica de la calidad de la evidencia disponible y de la fuerza de la recomendación que se realiza en base a esta evidencia. Así, en términos de fuerza de recomendación se distinguen recomendaciones fuertes, expresadas como «Recomendamos» y el número 1, y recomendaciones débiles expresadas como «Sugerimos» y el número 2. La calidad de la evidencia se expresa con símbolos: ⊕○○○ indica evidencia muy baja; ⊕⊕○○, evidencia baja; ⊕⊕⊕○, evidencia moderada, y ⊕⊕⊕⊕, evidencia alta. Junto a cada recomendación se describe la evidencia que sustenta dicha recomendación.
Se realizó una búsqueda sistemática en PubMed de la evidencia disponible para cada aspecto. Se revisaron artículos escritos en inglés y castellano con fecha de inclusión hasta 28 de mayo de 2013. Tras la formulación de las recomendaciones, estas se discutieron en una reunión conjunta del grupo.
Cribado de osteoporosisDetección de pacientes con virus de la inmunodeficiencia humana con alto riesgo de fractura óseaInterpretación de medios diagnósticosRecomendación- -
Recomendamos considerar la presencia de osteoporosis densitométrica (T-score <–2,5) o la historia de fractura por fragilidad como situaciones asociadas a un alto riesgo de fractura en varones de más de 50años de edad y en mujeres posmenopáusicas (1⊕⊕⊕⊕).
- -
No se recomienda la determinación de marcadores de remodelado en el cribado de la enfermedad ósea en pacientes con VIH (1⊕⊕⊕○).
Existen varios métodos disponibles para la medición de la densidad mineral ósea (DMO), de los cuales el que presenta mayor coste-efectividad para el diagnóstico de osteoporosis y para predecir el riesgo de fractura es la absorciometría dual de rayosX (DXA). La medición de la DMO por DXA permite establecer 3 categorías en función de los criterios de la Organización Mundial de la Salud (OMS), basados en los valores de DMO expresados en desviaciones estándar con relación a la media de adultos jóvenes de igual sexo (tabla 1). Para el diagnóstico de osteoporosis es necesario evaluar la presencia de fractura por fragilidad, que se define como aquella que ocurre tras un mínimo traumatismo o tras una caída desde la propia altura. Las más frecuentes son las fracturas vertebrales, del tercio distal de radio, del húmero y de cadera, y se excluyen las fracturas de tobillo, cráneo y macizo facial.
Utilidad de escalas de riesgo, factores de riesgo, densitometría ósea y marcadores de remodelado óseoRecomendación- -
Recomendamos la medida de DMO mediante DXA y considerando un T-score <–2,5 en columna o cadera como diagnóstico de osteoporosis y riesgo aumentado de fractura (1⊕⊕⊕⊕).
- -
Recomendamos el uso de escalas de riesgo de fractura para la toma de decisiones terapéuticas, considerando como alto riesgo cuando el riesgo absoluto de fractura calculado por FRAX para fractura de cadera es mayor de 3%, o para fractura mayor es mayor de 10% a partir de los 50años (1⊕⊕○○).
- -
Recomendamos considerar otros factores independientes de la DMO, como edad superior a 65años en la mujer o 70 en el varón (1⊕⊕⊕○), el uso de ciertas terapias antirretrovirales con mayor efecto osteotóxico (tenofovir) o la duración de la infección VIH (1⊕⊕○○).
La presencia de un T score inferior a –2,5 en la columna lumbar o en la cadera, acompañado o no de la presencia de fractura por fragilidad, supone un aumento del riesgo de fractura. Además, la población VIH tiene factores de riesgo adicionales que pueden contribuir a este riesgo, entre los que destacan la duración prolongada de la infección VIH, recuento de CD4 bajo (inferior a 200/mm3), exposición prolongada a tenofovir, hipogonadismo y existencia de hábitos tóxicos2. Por otra parte, en la infección VIH existe un envejecimiento prematuro que supone una incidencia precoz de la enfermedad cardiovascular y probablemente también de afectación ósea, lo que justifica el cribado de esta en edades más jóvenes.
El acceso limitado a la DXA ha motivado el desarrollo de numerosas escalas para calcular el riesgo de osteoporosis y de fractura. De ellas, la que ha tenido mayor difusión es la escala FRAX (http://www.shef.ac.uk/FRAX/tool.aspx?country=4). Sin embargo tiene algunas limitaciones, ya que no incluye algunos factores de riesgo potentes como la frecuencia de caídas y no permite considerar la cuantificación de algunas variables importantes, como el número de fracturas o la dosis de glucocorticoides. Además existen datos que podrían indicar que el cálculo subestima el riesgo de fractura para la población española4.
Esta escala no está validada para la población VIH, y algunos estudios señalan que su sensibilidad en este grupo de pacientes es muy baja5, pero que puede mejorarse considerando la presencia de otros factores de riesgo como hipogonadismo6. Al no existir recomendaciones específicas en pacientes con VIH, recomendamos adoptar los puntos de corte de acuerdo a lo propuesto en las Guías Europeas de 2013 para la osteoporosis posmenopáusica en personas de entre 50 y 60años7. Así, consideramos que el riesgo de fractura es alto cuando es superior al 3% para fractura de cadera y del 10% para fractura mayor (vértebra, antebrazo, húmero, cadera)7.
En qué pacientes deben emplearse estos u otros medios de cribadoRecomendación- -
Recomendamos la evaluación en todos los pacientes de la presencia de factores de riesgo de baja DMO y fractura, con especial interés al antecedente de fractura por fragilidad a partir de los 50años (1⊕⊕○○).
- -
Recomendamos la medida de DMO en mujeres posmenopáusicas con VIH y en varones a partir de los 50años (1⊕⊕○○).
- -
Sugerimos realizar radiografía lateral de columna dorsal y lumbar para detectar fracturas vertebrales asintomáticas en estos pacientes a partir de los 50años de edad (2⊕○○○).
- -
Sugerimos la determinación de marcadores de remodelado óseo en los pacientes que inicien tratamiento para la osteoporosis (2⊕⊕○○).
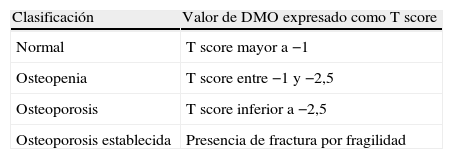
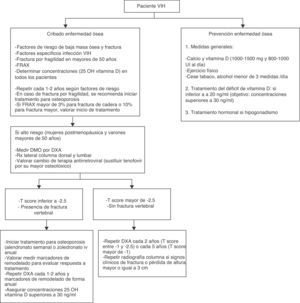
En el caso de los pacientes con VIH el aumento de las fracturas se ve principalmente a partir de los 50años8. En cuanto al riesgo de fractura de cadera, un estudio reciente muestra que la infección VIH es un factor de riesgo de fractura de cadera independientemente de la edad, el sexo u otras comorbilidades8. Por este motivo parece más adecuado iniciar la evaluación del riesgo de fractura a los 50años en el varón o tras la menopausia en la mujer, salvo en caso de fractura o de presencia de varios factores de riesgo, en cuyo caso podría ser recomendable evaluar la masa ósea en edades más jóvenes, con especial atención en la búsqueda y corrección de causas secundarias de osteoporosis2 (fig. 1).
Las fracturas vertebrales con frecuencia son asintomáticas y pasan desapercibidas, por lo que está indicada la realización de radiografía lateral de columna dorsal y lumbar para detectarlas. En población VIH se ha reportado una prevalencia aumentada de fracturas vertebrales (30% en VIH respecto a 4% en controles) incluso en pacientes que no presentan osteoporosis9, lo que justifica su cribado a través de radiología.
Aunque la determinación de marcadores de remodelado no se recomienda de forma rutinaria, puede ser útil en pacientes que inicien tratamiento para la osteoporosis para evaluar la adherencia al tratamiento y la respuesta a este, considerando que existe respuesta cuando se observa un descenso del 50% sobre el valor basal10. Los marcadores a determinar deben elegirse según la disponibilidad de cada centro, teniendo en cuenta que los más validados son la isoenzima ósea de la fosfatasa alcalina (Bone Specific Alkaline Phosphatase, BSAP) y el propéptido amino-terminal del procolágeno tipo1 (P1NP) como marcadores de formación y el telopéptido carboxi-terminal del colágeno tipo1 (CTX) como marcador de resorción.
¿Cuándo repetir estos u otros medios de cribado?Recomendación- -
Recomendamos reevaluar periódicamente (al menos anualmente) la presencia de factores de riesgo y la presencia de fracturas (1⊕○○○).
- -
Recomendamos repetir la DXA cada 2años salvo en casos de DMO normal, en los que puede diferirse y realizarse cada 5 años (1⊕○○○).
- -
Recomendamos repetir el cálculo de FRAX cada 2años, y siempre que aparezcan nuevos factores de riesgo de osteoporosis (1⊕○○○).
- -
Recomendamos repetir la radiología lateral de columna dorsal y lumbar en casos de clínica compatible con fractura vertebral o pérdida relevante de altura (≥3cm) (1⊕⊕○○).
- -
Sugerimos determinar los marcadores de remodelado óseo antes del inicio del tratamiento antirresortivo y periódicamente durante el seguimiento (en la primera visita tras iniciar el tratamiento y de forma anual posteriormente) (2⊕○○○).
Durante el seguimiento es importante detectar la aparición de nuevos factores de riesgo de baja masa ósea o de fractura durante la evolución de la enfermedad, ya que pueden determinar la necesidad de una evaluación más frecuente con DXA. Dentro de estos factores merece una consideración especial por su asociación con un mayor riesgo de fractura el tratamiento crónico con corticoides (más de 3meses a una dosis equivalente a 5mg de prednisolona al día o superior). Así mismo, la aparición de una fractura por fragilidad obliga a considerar la necesidad de tratamiento para la osteoporosis independientemente de la masa ósea7,11.
En cuanto a la periodicidad con la que se debe repetir la evaluación de DMO, existen datos en población VIH que muestran una evolución de la DMO en función de los valores basales de esta12. Así, los autores sugieren repetir la DXA en 1-2 años en aquellos pacientes en el tercio más bajo de DMO, mientras que en aquellos en el tercio más alto de DMO sería suficiente con repetirla a los 6años (fig. 1).
Tras la evaluación inicial de la presencia de fracturas vertebrales asintomáticas, es recomendable repetir la radiografía lateral de columna dorsal y lumbar en caso de síntomas sugerentes de fractura vertebral clínica o pérdida de altura superior a 3cm. La estatura debe medirse periódicamente, ya que la pérdida de altura ha demostrado ser un claro predictor de la presencia de fractura vertebral. En mujeres posmenopáusicas, la pérdida de altura superior a 3cm aumenta el riesgo de fractura vertebral en 5 veces13, hallazgo que ha sido confirmado posteriormente en diferentes estudios.
Factores de riesgoRecomendación- -
Recomendamos evaluar los factores de riesgo tradicionales de fractura osteoporótica (1⊕⊕○○)
- -
Recomendamos valorar los factores de riesgo de osteoporosis relacionados con la infección por VIH, la coinfección de hepatitisC, la duración prolongada de la infección VIH, el recuento de CD4 y ciertos tratamientos osteotóxicos, como tenofovir (1⊕⊕○○).
En la población general diferentes estudios han confirmado los factores que se asocian a un mayor riesgo de osteoporosis y fracturas osteoporóticas, entre los que destacan: edad mayor de 65años, sexo femenino, historia de fracturas por fragilidad bien personal o de cadera en familiar de primer grado, índice de masa corporal bajo (inferior a 20kg/m2), deficiencia de vitaminaD, tabaco, inactividad física, alcohol, tratamiento glucocorticoideo durante más de 3meses, hipogonadismo7,11 (tabla 2). En la población con infección por VIH existen otros factores de riesgo adicionales que también es necesario considerar2 (tabla 3). El índice Veterans Aging Cohort Study (VACS) es un marcador de fragilidad que se asocia con la mortalidad en pacientes con VIH. Recientemente se ha demostrado su asociación con un mayor riesgo de fractura por fragilidad (RR: 1,15; IC95%: 1,11-1,19)14.
Factores de riesgo generales de baja masa ósea y/o fractura
| Edad | Mayor de 65 años en la mujer y de 70 años en el varón |
| Factores hormonales | Menopausia precoz (menor 45 años)Hipogonadismo primario o secundarioAmenorrea de duración superior a 1 año |
| Tratamiento corticoideo crónico | Más de 3 meses a una dosis equivalente a 5mg de prednisolona al día o superior |
| Historia familiar | Antecedente materno de fractura de cadera |
| Bajo peso | Índice de masa corporal menor de 19 kg/m2 |
| Hábitos tóxicos | Tabaco, alcohol |
| Otros | Anorexia nerviosaSíndrome de malabsorciónPostrasplanteInsuficiencia renal crónicaHipertiroidismoDiabetes mellitus |
- -
Recomendamos la evaluación del estado del sistema hormonal D a través de la determinación en sangre de 25-hidroxivitaminaD (25OH vitaminaD), considerando niveles suficientes aquellos superiores a 30ng/ml y déficit de vitaminaD cuando los niveles son inferiores a 20mg/ml (1⊕⊕⊕○).
- -
Recomendamos la determinación de vitaminaD en todos los pacientes con infección por VIH, dada la alta frecuencia de deficiencia en vitaminaD en esta población (1⊕○○○).
- -
Recomendamos medir los niveles de 25OH vitaminaD al inicio del tratamiento (1⊕⊕○○).
- -
Sugerimos considerar que es probable que exista déficit de vitaminaD en población VIH cuando no se puedan determinar sus concentraciones (2⊕○○○).
- -
Sugerimos control anual en los pacientes en tratamiento de mantenimiento, teniendo en cuenta la estacionalidad (2⊕○○○).
La mejor estimación del estado del sistema hormonal de la vitaminaD es la determinación de las concentraciones séricas de 25OH vitaminaD15. En el momento actual no se considera indicado el cribado universal, aunque la elevada prevalencia de déficit de vitaminaD en población VIH y su posible repercusión sobre la masa ósea hace necesaria su evaluación, especialmente en caso de baja DMO o alteraciones tubulares (hiperfosfaturia, baja reabsorción tubular de fosfato), donde además estaría indicada la medición de PTH junto con la de vitaminaD16,17. En caso de no poder determinar las concentraciones de vitaminaD podría asumirse que existen niveles bajos, teniendo en cuenta su elevada prevalencia en la población VIH18-20.
El punto de corte para definir el déficit de vitaminaD está actualmente en debate. Mientras que la European AIDS Clinical Society (EACS) considera que 20 y 30ng/ml son los puntos de deficiencia e insuficiencia de vitaminaD, respectivamente21, el Institute of Medicine (IOM) en un reciente informe considera que en población aparentemente sana no se obtienen beneficios óseos por encima de 20ng/ml22.
Las guías de la EACS de 201221 recomiendan el cribado del déficit de vitaminaD en pacientes con baja DMO o historia de fracturas, con alto riesgo de fractura o enfermedad renal crónica, y considerar su determinación en pacientes con factores de riesgo para hipovitaminosisD (obesidad, toma de antirretrovirales [efavirenz], enfermedad renal crónica, deficiencias en la dieta, falta de exposición solar o piel oscura). La Endocrine Society recomienda cribado solo en pacientes con alto riesgo de déficit (grupo en el que se incluye a pacientes con tratamiento antirretroviral por su efecto inductor del catabolismo de la vitaminaD)15.
Se ha demostrado una prevalencia de hiperparatiroidismo secundario de 25-35% en los pacientes con VIH en tratamiento antirretroviral, generalmente asociados a deficiencia de vitaminaD, alteración renal y, de forma menos consistente, tratamiento con tenofovir21.
¿Existen factores que permitan identificar los pacientes con hipovitaminosis D?RecomendaciónRecomendamos considerar en mayor riesgo de hipovitaminosisD a los sujetos con infección VIH de larga duración, en tratamiento antirretroviral (especialmente efavirenz), hepatopatía crónica, deficiencias en la dieta, malabsorción, baja exposición al sol, enfermedad renal crónica o piel oscura (1⊕⊕○○).
EvidenciaDistintos estudios transversales han descrito los factores de riesgo para hipovitaminosisD en pacientes con infección por VIH18–20. Los factores más frecuentes suelen ser los factores tradicionales, tales como la piel oscura, la obesidad, deficiencias en la dieta, la escasa exposición al sol o la insuficiencia renal crónica, a los que se suma el tratamiento antirretroviral (especialmente efavirenz) y, de forma menos consistente, la hepatopatía crónica por virusC. En este sentido, en un estudio español de 352pacientes se identificaron como factores de riesgo de hipovitaminosisD la baja exposición solar, la obesidad, la presencia de viremia detectable y el tratamiento con efavirenz23. Además, identificó como factor de riesgo adicional la vía de transmisión del VIH distinta a la drogadicción parenteral23. En estudios en pacientes con VIH con hepatopatía crónica se ha demostrado que el grado de fibrosis hepática es un factor independiente asociado a disminución de 25OH vitaminaD24.
IntervenciónPrevención del riesgo de fracturaMedidas generalesRecomendación- -
Recomendamos una correcta ingesta de calcio (1.000-1.500mg/día) y vitamina D (800-1.000UI/día) en los pacientes con VIH (1⊕○○○).
- -
Recomendamos favorecer la ingesta de calcio con la dieta, restringiendo el uso de suplementos a aquellos casos en los que no se consiga la ingesta recomendada (1⊕○○○).
- -
Recomendamos la realización de ejercicio físico (al menos 30min 3veces por semana), así como de ejercicios de fortalecimiento muscular y equilibrio para prevenir caídas (1⊕○○○).
- -
Recomendamos el cese de hábito tabáquico y limitar la ingesta de alcohol a 3 medidas o menos (1⊕○○○).
No existen estudios que hayan evaluado la efectividad de estas medidas generales y de estilo de vida sobre la masa ósea y/o el riesgo de fractura específicamente en pacientes con VIH. Sin embargo, la alta prevalencia de baja masa ósea justifica la prevención con dosis adecuadas de calcio y vitaminaD. El escaso contenido en vitaminaD de los alimentos hará necesaria la suplementación en la mayoría de los casos (las dosis y preparados se detallan en el siguiente apartado). En cuanto al aporte de calcio, es preferible aumentar su ingesta dietética, ya que su absorción es mejor al no depender del pH gástrico y algunos estudios indican que el efecto sobre la DMO puede ser superior al del calcio en suplementos25. En los casos en que no se alcancen las cantidades recomendadas (tabla 4) será necesario completar dicho aporte a través de suplementos. Si se usa carbonato cálcico se debe procurar administrarlo de forma fraccionada y junto con alimentos para mejorar su absorción (500mg/toma)26.
Contenido en calcio de diferentes alimentos (mg de calcio por 100 g)
| Alimentos | Contenido en calcio |
| Queso gruyere, emmental, roquefort, bola… | 560-850 |
| Queso manchego fresco | 470 |
| Sardinas en aceite | 400 |
| Almendras, avellanas | 240 |
| Cigalas, langostinos, gambas… | 220 |
| Queso de Burgos | 186 |
| Yogur | 180-127 |
| Higos secos | 180 |
| Garbanzos | 145 |
| Natillas y flanes | 140 |
| Pistachos | 136 |
| Leche de vaca | 130 |
| Judías blancas, habas secas | 130 |
| Almejas, berberechos, chirlas… | 120 |
| Chocolate con leche | 120 |
| Batidos lácteos | 120 |
| Acelgas, cardo, espinacas, puerro… | 114-87 |
| Queso en porciones | 98 |
| Nueces, dátiles, pasas… | 70 |
| Aceitunas | 63 |
| Requesón y cuajada | 60 |
| Lentejas | 56 |
| Huevo de gallina | 51 |
| Bacalao | 51 |
| Pasteles y pastas | 48 |
| Sardinas | 43 |
| Alcachofas, coles, repollo, judías verdes… | 40 |
La práctica de ejercicio físico ha demostrado un efecto positivo sobre la masa ósea en mujeres posmenopáusicas27 y reduce el número de caídas en pacientes ancianos28, por lo que debe recomendarse a todos los pacientes con VIH, ya que además supone efectos beneficiosos sobre parámetros de riesgo cardiovascular29. De igual modo debe recomendarse evitar una ingesta de alcohol excesiva (superior a 3 medidas)30 y el consumo de tabaco31 por sus efectos deletéreos sobre la masa ósea. Según FRAX, una medida equivale a una caña de cerveza (285ml), una copa de licor (30ml), una copa de vino de tamaño mediano (120ml) o una copa de aperitivo (60ml).
Suplementación con vitamina DRecomendación- -
Recomendamos iniciar tratamiento con vitaminaD en pacientes con hipovitaminosisD (25OH vitaminaD<20ng/ml) (1⊕○○○).
- -
Recomendamos corregir el déficit de vitaminaD previamente al inicio de terapia con bisfosfonatos para reducir el riesgo de hipocalcemia, especialmente los de administración intravenosa (1⊕○○○), y para maximizar su eficacia (1⊕⊕○○).
La prevalencia de hipovitaminosisD en pacientes con VIH oscila entre el 60 y el 88%32-34, por lo que constituye una causa de osteoporosis secundaria en un elevado porcentaje de pacientes.
En cuanto a la pauta necesaria para el tratamiento del déficit de vitaminaD, la EACS recomienda administrar entre 800 y 2.000UI/día, con objeto de alcanzar niveles de 25OH vitaminaD superiores a 20ng/ml y mantener concentraciones normales de PTH1. Otros autores16 proponen adoptar los criterios de la Endocrine Society15 y suplementar según los niveles de vitaminaD. Los pacientes tratados con efavirenz pueden requerir la dosis de suplementación más alta (2.000UI/día)16. La determinación de niveles de 25OH vitaminaD al final del intervalo entre dosis debe considerarse para evaluar si la suplementación es correcta2.
En pacientes que inicien tratamiento con bisfosfonatos es especialmente importante corregir el déficit de vitaminaD si está presente y asegurar niveles de 25OH vitaminaD superiores a 30ng/ml, ya que diferentes estudios en mujeres con osteoporosis posmenopáusica muestran una mejor respuesta tanto en DMO como en marcadores de remodelado35,36. Además, niveles adecuados de vitaminaD pueden reducir la probabilidad de desarrollar hipocalcemia tras el inicio de tratamiento con bisfosfonatos37.
Medidas específicasSuplementación hormonalRecomendaciónRecomendamos tratamiento con terapia de reemplazo estrogénico en mujeres con menopausia precoz (1⊕○○○).
Recomendamos tratamiento sustitutivo con testosterona en varones con hipogonadismo (1⊕○○○).
EvidenciaDiferentes autores han observado que la menopausia se produce a una edad menor en mujeres con VIH38,39, lo que tiene claras repercusiones sobre la salud ósea, ya que el descenso de estrógenos en la mujer aumenta el riesgo de baja masa ósea y de fracturas por fragilidad40. Aunque no existen estudios específicos en población VIH, recomendamos la terapia de reemplazo estrogénico en mujeres con menopausia precoz hasta llegar a una edad próxima a los 50años.
En varones con VIH tratados el déficit de testosterona es frecuente, de entre el 20 y el 30% según los estudios41,42, y se observa con una prevalencia superior a la observada en la población general y a edades más jóvenes43. Se ha demostrado también una asociación entre el hipogonadismo y la presencia de baja DMO en la columna lumbar en varones VIH sin tratamiento antirretroviral44.
Aunque para el diagnóstico de hipogonadismo en la población general es suficiente la determinación de las concentraciones séricas de testosterona total, estableciendo el diagnóstico de hipogonadismo si existen al menos 2 determinaciones por debajo del límite inferior45, en los pacientes con infección por VIH suele haber niveles elevados de globulina ligadora de hormonas sexuales (SHBG) que pueden dar lugar a niveles de testosterona total aparentemente normales cuando en realidad la testosterona libre está baja46. Por ello, se recomienda medir niveles de testosterona libre para el diagnóstico de hipogonadismo en varones seropositivos. La adiposidad visceral, la edad y el índice de masa corporal están inversamente relacionados con las concentraciones de testosterona43.
Modificación del tratamiento antirretroviralRecomendaciónEn pacientes con riesgo alto (baja DMO y/o fracturas por fragilidad), recomendamos valorar la retirada de tenofovir (1⊕○○○).
EvidenciaNo existen recomendaciones sólidas sobre el cambio de la pauta antirretroviral en los pacientes con infección por el VIH y osteopenia/osteoporosis. Tras el inicio de tratamiento antirretroviral se produce un descenso de DMO, que es mayor con tenofovir47-49 y con inhibidores de proteasa50. En pacientes ya tratados previamente con terapia antirretroviral, el tratamiento con tenofovir se ha relacionado también con disminución de DMO51,52. Respecto a los cambios de masa ósea tras el cambio de pauta antirretroviral, se ha observado una mejoría en los marcadores de remodelado tras la sustitución de emtricitabina/tenofovir por abacavir/lamivudina53, mejoría de la DMO a nivel de cadera (2,1%) tras la sustitución de emtricitabina/tenofovir por abacavir/lamivudina54 y mejoría de la DMO y marcadores óseos tras la sustitución de tenofovir por raltegravir55. El cambio de inhibidores de la proteasa por raltegravir se asoció a un incremento de la DMO en cadera en un estudio56, pero la evidencia del impacto de la introducción y de la retirada de los inhibidores de proteasa sobre la DMO es escasa en comparación con la de tenofovir.
Tratamiento farmacológico de la osteoporosisRecomendación- -
Recomendamos iniciar tratamiento específico para la osteoporosis en los pacientes con infección por VIH y alto riesgo de fractura (1⊕○○○):
- ∘
Osteoporosis densitométrica en varones de más de 50años y mujeres posmenopáusicas.
- ∘
Antecedentes de fractura por fragilidad después de los 50años.
- ∘
Puntuación en la escala FRAX superior a 3% para fractura de cadera o >10% para fracturas osteoporóticas mayores.
- ∘
- -
Sugerimos considerar la posibilidad de tratamiento en pacientes más jóvenes en caso de valores extremos de baja DMO (2⊕○○○).
- -
Recomendamos el uso de bisfosfonatos (alendronato o zoledronato) en los casos en los que sea necesario iniciar tratamiento para la osteoporosis (1⊕⊕○○).
La evidencia disponible acerca del tratamiento de la osteoporosis en los pacientes con infección por VIH es escasa. Los estudios realizados son mayoritariamente con bisfosfonatos (alendronato o zoledronato) y en grupos reducidos de pacientes. Todos ellos demuestran la mejoría de la DMO y la seguridad de dichos fármacos en esta población57-62, aunque no existen datos sobre fracturas (fig. 1). La seguridad y la eficacia de otros tratamientos para la osteoporosis no han sido evaluadas en pacientes con VIH.
En cuanto a la duración del tratamiento, no existen recomendaciones específicas en esta población. En el momento actual se propone realizar tratamiento durante 3años en el caso de zoledronato y 5años para alendronato, reevaluando posteriormente la necesidad o no de continuar con el tratamiento según la evolución de la DMO y la presencia o no de fracturas63.
Cuándo remitir al especialista en osteoporosisRecomendaciónRecomendamos remitir al especialista en osteoporosis a los pacientes que hayan iniciado tratamiento y no respondan a este (por aparición de nuevas fracturas o ausencia de aumento de DMO), así como en los que presenten causas secundarias (1⊕○○○).
EvidenciaLas alteraciones de la DMO son prevalentes en los pacientes con infección por VIH y es previsible que con el envejecimiento de esta población adquieran mayor protagonismo en un futuro no lejano. Por tanto, los especialistas que tratan a pacientes con infección por VIH deberán formarse para ofrecer tratamiento de esta patología a sus pacientes. Aunque no existen evidencias en la literatura sobre si la intervención de un especialista en patología ósea puede optimizar el manejo de los pacientes con alteraciones de la DMO e infección por VIH, consideramos que deberá intervenir en el manejo de estos pacientes al menos en las circunstancias recogidas en la recomendación, así como cuando el médico no esté familiarizado con el tratamiento y el seguimiento a realizar en pacientes con osteoporosis.
Tratamiento de la hipovitaminosis D¿A partir de qué niveles se debe tratar?Recomendación- -
Recomendamos iniciar tratamiento con suplementos de vitaminaD en pacientes con VIH y concentraciones de 25OH vitaminaD inferiores a 20ng/ml (1⊕⊕○○).
- -
Sugerimos alcanzar un objetivo de al menos 30ng/ml de 25OH vitaminaD en pacientes con alto riesgo de fractura, tratamiento con determinados antirretrovirales o presencia de comorbilidades (2⊕○○○).
Los niveles óptimos de vitamina D en función de las circunstancias clínicas son discutidos. El IOM considera en un informe reciente que concentraciones de 25OH vitaminaD entre 20 y 50ng/ml es el objetivo deseable para la mayoría de la población22. El informe señala que valores de 25OH vitaminaD superiores a 30ng/ml no se asocian de forma consistente con beneficios para la salud y que valores superiores a 50ng/ml pueden asociarse a riesgos significativos. Sin embargo, la guía de práctica clínica de la Endocrine Society considera niveles óptimos (suficiencia) los situados entre 30-100ng/ml64. El impacto sobre la absorción intestinal de calcio, la calidad ósea y la reducción de las concentraciones de PTH son argumentos para situar el mínimo deseable en 30ng/ml64. Los beneficios, más allá de la salud ósea, de valores de 25OH vitaminaD superiores a 30ng/ml son por el momento limitados. Existen pocos ensayos clínicos aleatorizados (ECA) con suplementos de vitaminaD en pacientes con VIH. Un ECA con un pequeño tamaño muestral ha observado que en pacientes con VIH y baja DMO (T-score –1,5DE) la suplementación con vitaminaD (400-600UI/día) y calcio se asocia a modestos aumentos de la DMO (1-1,5%)65. En relación con los beneficios cardiovasculares, un ECA con 45 pacientes y corta duración (12semanas) tratados con 4.000UI/día no ha mostrado cambios significativos en marcadores de lesión vascular65. Estudios observacionales han mostrado que pacientes con VIH y niveles bajos de 25OH vitaminaD presentan un peor pronóstico de enfermedad. Los resultados de la cohorte EuroSIDA obtenidos a partir de 1.985 pacientes con seguimiento durante 5años han mostrado que aquellos con valores de 25OH vitaminaD en el tercio más bajo (menos de 12,1ng/ml) presentaron un riesgo aumentado de progresión de la enfermedad y muerte66.
¿Qué pauta de tratamiento utilizar?Recomendación- -
Recomendamos la administración de suplementos de vitaminaD3 (50.000UI mensuales) en pacientes con VIH y concentraciones de 25OH vitaminaD inferiores a 20ng/ml (1⊕⊕○○).
- -
Sugerimos como pauta alternativa la administración de 16.000UI mensuales de calcifediol (2⊕○○○).
Las pautas de tratamiento o suplementación con vitaminaD o análogos en pacientes con VIH no se encuentran adecuadamente establecidas y las recomendaciones de la sociedades científicas no son uniformes. El IOM recomienda una ingesta diaria de vitaminaD entre 600 y 800UI/día para población general adulta22. Sin embargo, la guía de práctica clínica de la Endocrine Society indica que en pacientes con riesgo de deficiencia los requerimientos de vitaminaD aumentarían a 1.500-2.000UI/día64. Los pacientes con VIH en tratamiento farmacológico se consideran en riesgo de deficiencia de vitaminaD en este documento. La guía de la EACS propone un tratamiento de mantenimiento en pacientes con deficiencia de vitaminaD (menos de 10ng/ml) con suplementos entre 800-2.000UI/día21. La EACS considera indicada la suplementación con vitaminaD en pacientes con VIH y concentraciones de 25OH vitamina D inferiores a 20ng/ml en los casos con osteoporosis, osteomalacia y aumento de PTH.
La mayoría de los datos disponibles y las recomendaciones de las sociedades científicas se basan en la administración de suplementos orales de vitaminaD3 (colecalciferol) o D2 (ergocalciferol). No obstante, las formulaciones disponibles en cada país son diferentes. Un estudio reciente en 204 pacientes de entre 18 y 24años con tratamiento antirretroviral estable ha evaluado la eficacia y la seguridad de la administración de 50.000UI/mensuales de vitaminaD3 durante 3 meses en un ensayo clínico aleatorizado frente a placebo67. En el conjunto de pacientes evaluables, el 95% de los tratados con vitaminaD3 alcanzaron concentraciones superiores a 20ng/ml y el 86% valores entre 20-50ng/ml. En los pacientes en el grupo placebo las concentraciones de vitaminaD no se modificaron. En este estudio no se identificaron efectos adversos significativos. Estos datos coinciden con otros estudios realizados en población general mayor de 65años68. Un estudio que utiliza un modelo farmacocinético en pacientes con VIH entre 38 y 52años muestra que una dosis de 100.000UI/mes de vitaminaD3 es la apropiada para obtener concentraciones de 25OH vitaminaD entre 30-80ng/ml69. Con esta pauta, menos del 1% de los casos alcanzaron valores superiores a 100ng/ml.
No existen datos disponibles en pacientes con VIH utilizando calcifediol, calcitriol u otros análogos de vitaminaD. En sujetos sanos se ha comprobado que el calcifediol es entre 4 y 5 veces más efectivo que la vitaminaD3 para aumentar las concentraciones séricas de 25OH vitaminaD70. Una aproximación práctica podría ser la administración de una ampolla mensual de 16.000UI que está comercialmente disponible en España. La eficacia y la seguridad de esta pauta no están comprobadas.
¿Se ha de monitorizar el efecto de la vitamina D?RecomendaciónSugerimos control anual en los pacientes en tratamiento de mantenimiento, teniendo en cuenta la estacionalidad (2⊕○○○).
EvidenciaSi se está tratando la deficiencia de vitaminaD debemos conocer la respuesta al tratamiento, con vistas al cambio de régimen o a su intensificación. Es necesario tener en cuenta la variabilidad estacional y el uso de fármacos antirretrovirales por parte del paciente, que pueden alterar la tasa de respuesta71,72. El control anual está indicado para ajustar la pauta de tratamiento.
¿Cuánto tiempo ha de durar el tratamiento con vitamina D?RecomendaciónRecomendamos mantener el tratamiento con vitamina D mientras persistan los factores de riesgo de déficit, garantizando un aporte de vitamina D de 800-1.000UI/día utilizando suplementos en la mayoría de los casos (1⊕○○○).
EvidenciaPor los beneficios sobre la salud ósea está indicado mantener el tratamiento con vitaminaD mientras persistan los factores predisponentes al desarrollo de este déficit, lo que en la mayoría de los casos supondrá un tratamiento indefinido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.