Pneumocystis jirovecii es un hongo y se lo reconoce como una especie que infecta exclusivamente a seres humanos; es el agente causante de la PCP (Pneumocystis pneumonia ‘neumonía por Pneumocystis’). La utilización de técnicas de biología molecular como herramienta diagnóstica ha permitido detectar la presencia de este hongo en individuos que se encuentran solamente colonizados por el microorganismo. Esta colonización, observada en diversos grupos de población, puede actuar como un reservorio del hongo para el ser humano. Varios estudios también han demostrado la presencia de P. jirovecii con mutaciones asociadas a resistencia a sulfamidas en pacientes colonizados; éstos podrían transmitir este genotipo mutante a individuos susceptibles al desarrollo de una PCP. El creciente interés respecto a la colonización por P. jirovecii conducirá a diseñar nuevas estrategias para la prevención y el tratamiento de la neumonía causada por este patógeno.
Pneumocystis jirovecii, the fungal agent that causes Pneumocystis pneumonia (PCP), is known to exclusively infect humans. Molecular studies have enabled detection of this fungus in individuals who have been colonized by P. jirovecii. Such colonization, found in several populations, seems to act as a human reservoir for the fungus. Various studies have reported mutations associated with sulfa resistance in P. jirovecii strains isolated from colonized patients, who can transmit the mutant genotype to PCP-susceptible individuals. The growing interest in P. jirovecii colonization may prompt the design of new prevention and management strategies for PCP.
La PCP (Pneumocystis pneumonia ‘neumonía por Pneumocystis’) se mantiene todavía como un importante problema de salud pública con una alta morbimortalidad entre los pacientes inmunodeprimidos, sobre todo en los infectados por el virus de la inmunodeficiencia humana (VIH), en los que aún es la primera causa definitoria de sida1.
El conocimiento sobre la biología de los organismos conocidos como Pneumocystis ha estado plagado de confusiones, desacuerdos y controversias motivados, en gran parte, por la imposibilidad para lograr su cultivo in vitro. Esto hizo que durante mucho tiempo se lo considerase como un protozoo pero recientemente, con la utilización de técnicas de biología molecular, se ha podido establecer que es un hongo atípico, que no crece en los medios de cultivo habituales ni responde a los tratamientos clásicos frente a hongos2.
La aplicación de la reacción en cadena de la polimerasa (PCR) para la amplificación del ácido desoxirribonucleico (ADN) de Pneumocystis3 en los estudios epidemiológicos ha incorporado avances significativos en la comprensión de los mecanismos de transmisión de este patógeno.
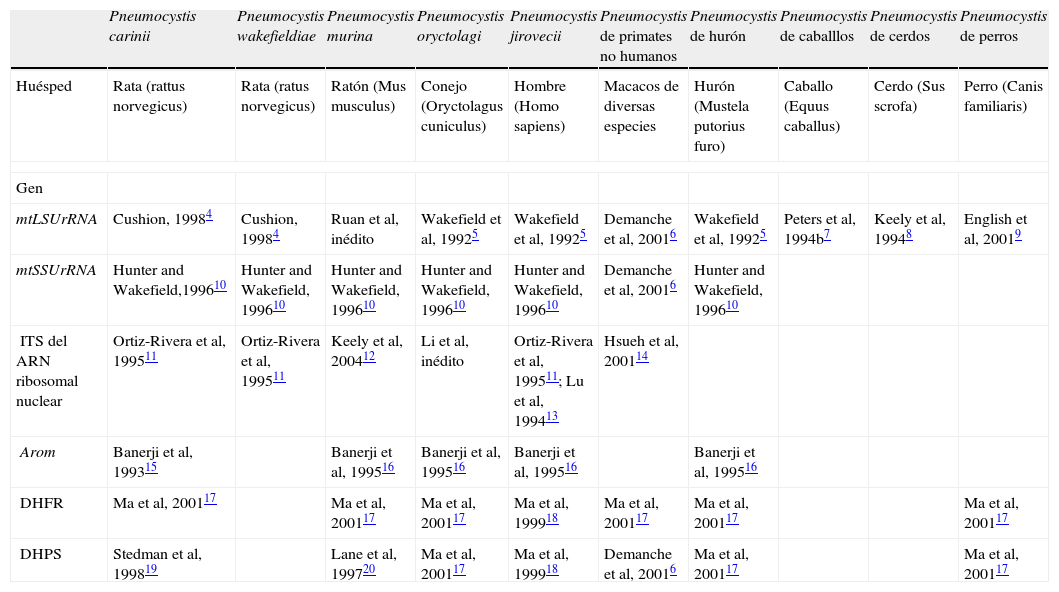
Inicialmente se pensaba que había una sola especie de Pneumocystis que infectaba a todos los mamíferos y, por tanto, se creía que la PCP en la especie humana podía ser una zoonosis y que cualquiera de los mamíferos con los que puede cohabitar el hombre de forma habitual podía ser su reservorio. Sin embargo, el estudio comparativo del ADN de aislados de Pneumocystis procedentes de diferentes mamíferos ha demostrado que se trata de especies distintas (tabla 1)4–20. Esta alta especificidad entre el huésped y el microorganismo que lo infecta es lo que se denomina estenoxenismo. Este hecho ha motivado un cambio de denominación de la especie de Pneumocystis que infecta a los seres humanos, que ha pasado a denominarse Pneumocystis jirovecii21, y la denominación de Pneumocystis carinii ha quedado reservada para la especie causante de las infecciones en ratas. Por tanto, la PCP no es una zoonosis, como se creía, sino una antroponosis (reservorio exclusivamente humano).
Diferencias genéticas de Pneumocystis entre diversos mamíferos (modificado de Aliouat-Denis CM, Infection, Genetics and Evolution, 2008)
| Pneumocystis carinii | Pneumocystis wakefieldiae | Pneumocystis murina | Pneumocystis oryctolagi | Pneumocystis jirovecii | Pneumocystis de primates no humanos | Pneumocystis de hurón | Pneumocystis de caballlos | Pneumocystis de cerdos | Pneumocystis de perros | |
| Huésped | Rata (rattus norvegicus) | Rata (ratus norvegicus) | Ratón (Mus musculus) | Conejo (Oryctolagus cuniculus) | Hombre (Homo sapiens) | Macacos de diversas especies | Hurón (Mustela putorius furo) | Caballo (Equus caballus) | Cerdo (Sus scrofa) | Perro (Canis familiaris) |
| Gen | ||||||||||
| mtLSUrRNA | Cushion, 19984 | Cushion, 19984 | Ruan et al, inédito | Wakefield et al, 19925 | Wakefield et al, 19925 | Demanche et al, 20016 | Wakefield et al, 19925 | Peters et al, 1994b7 | Keely et al, 19948 | English et al, 20019 |
| mtSSUrRNA | Hunter and Wakefield,199610 | Hunter and Wakefield, 199610 | Hunter and Wakefield, 199610 | Hunter and Wakefield, 199610 | Hunter and Wakefield, 199610 | Demanche et al, 20016 | Hunter and Wakefield, 199610 | |||
| ITS del ARN ribosomal nuclear | Ortiz-Rivera et al, 199511 | Ortiz-Rivera et al, 199511 | Keely et al, 200412 | Li et al, inédito | Ortiz-Rivera et al, 199511; Lu et al, 199413 | Hsueh et al, 200114 | ||||
| Arom | Banerji et al, 199315 | Banerji et al, 199516 | Banerji et al, 199516 | Banerji et al, 199516 | Banerji et al, 199516 | |||||
| DHFR | Ma et al, 200117 | Ma et al, 200117 | Ma et al, 200117 | Ma et al, 199918 | Ma et al, 200117 | Ma et al, 200117 | Ma et al, 200117 | |||
| DHPS | Stedman et al, 199819 | Lane et al, 199720 | Ma et al, 200117 | Ma et al, 199918 | Demanche et al, 20016 | Ma et al, 200117 | Ma et al, 200117 | |||
ARN: ácido ribonucleico; Arom: gen asociado a biosíntesis de aminoácidos aromáticos; DHFR; dihidrofolato reductasa; DHPS: dihidropteroato sintasa; ITS: internal transcribed spacer ‘espaciador transcrito interno’; mtLSUrRNA: subunidad mayor del ARN ribosómico mitocondrial; mtSSUrRNA: subunidad menor del ARN ribosómico mitocondrial.
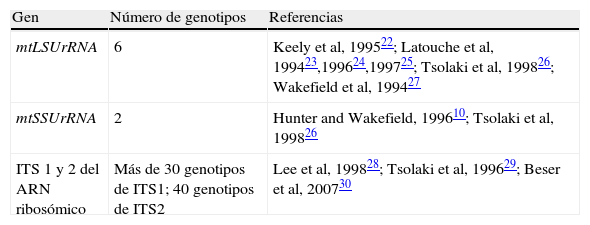
El análisis molecular de P. jirovecii ha permitido también identificar variaciones en su propio genoma. En la tabla 2 se muestran los genes de P. jirovecii que se han empleado para la investigación en estudios epidemiológicos22–30.
Genotipos de Pneumocystis jirovecii (modificado de Aliouat-Denis CM, Infection, Genetics and Evolution, 2008)
| Gen | Número de genotipos | Referencias |
| mtLSUrRNA | 6 | Keely et al, 199522; Latouche et al, 199423,199624,199725; Tsolaki et al, 199826; Wakefield et al, 199427 |
| mtSSUrRNA | 2 | Hunter and Wakefield, 199610; Tsolaki et al, 199826 |
| ITS 1 y 2 del ARN ribosómico | Más de 30 genotipos de ITS1; 40 genotipos de ITS2 | Lee et al, 199828; Tsolaki et al, 199629; Beser et al, 200730 |
ARN: ácido ribonucleico; ITS: internal transcribed spacer ‘espaciador transcrito interno’; mtLSUrRNA: subunidad mayor del ARN ribosómico mitocondrial; mtSSUrRNA: subunidad menor del ARN ribosómico mitocondrial.
Durante años se consideró que la PCP se producía por reactivación de una infección latente ante una situación de inmunosupresión en el huésped. Esta hipótesis se apoyaba en la alta seroprevalencia encontrada en estudios epidemiológicos realizados en niños. No obstante, otros trabajos que utilizaron técnicas moleculares permitieron evidenciar que las recurrencias de PCP en pacientes con sida se producían por subtipos diferentes de P. jirovecii, como lo demostraba el hecho de que sus genotipos no fueran iguales, al analizar tanto el gen mitocondrial como las regiones ITS (internal transcribed spacer ‘espaciador transcrito interno’) del ácido ribonucleico ribosómico nuclear; esto apoya la existencia de infecciones de novo31. En esta misma línea, la hipótesis de una latencia prolongada también se cuestionó luego de que se observara en modelos animales que el microorganismo desaparecía de los pulmones tras la curación de una neumonía32. Por otra parte, se ha descrito la existencia de variaciones geográficas en los genotipos de P. jirovecii en el hombre. Así, en un estudio realizado en 5 ciudades de EE. UU. se encontró relación entre el genotipo de Pneumocystis y el lugar de residencia, pero no con el lugar de nacimiento de los sujetos con PCP, lo que apoya la idea de una transmisión persona a persona en contra de la hipótesis de la reactivación de una infección latente33.
A partir de la consideración de la neumocistosis humana como una infección adquirida de novo surge la pregunta de cuál es el reservorio de este microorganismo. Algunos estudios han demostrado la presencia de fragmentos de ADN de Pneumocystis en muestras de agua de diferentes procedencias así como en el aire, pero no se ha podido comprobar que estos medios sean reservorios o fuentes de infección para este patógeno34,35. Los pacientes con PCP pueden actuar como fuentes de infección, así como los niños en los que los estudios seroepidemiológicos han mostrado altas tasas de exposición desde edades muy tempranas. Se evidencia, además, la presencia de genotipos similares en ambas poblaciones36–38. Sin embargo, en los últimos años muchas pruebas han revelado que P. jirovecii está presente de forma más extendida entre los seres humanos.
La colonización en el hombreLa identificación de Pneumocystis con un método sensible como es la PCR ha permitido demostrar la presencia de este microorganismo en diferentes muestras biológicas tales como lavado broncoalveolar, esputo, lavado orofaríngeo o material nasofaríngeo en sujetos sin manifestaciones clínicas ni radiológicas de neumonía. Esta situación ha sido denominada con diferentes términos, como colonización, estado de portador asintomático (carrier) o infección subclínica39,40 y se ha observado en distintos grupos poblacionales que se comentan a continuación:
- a)
La colonización por P. jirovecii es frecuente en pacientes con infección por VIH. Un estudio reciente realizado en una cohorte de 172 sujetos infectados por el virus encontró una prevalencia de colonización del 68% y se identificaron como factores de riesgo las concentraciones de linfocitos CD4 inferiores a 50×106/l y la ausencia de quimioprofilaxis con cotrimoxazol41. En otro estudio que incluyó a 91 pacientes con infección por VIH, el tabaquismo y la ciudad de residencia fueron los factores asociados a la colonización por Pneumocystis que apareció en el 46% de los casos42. El período durante el que los pacientes con infección por VIH pueden permanecer colonizados se desconoce en la actualidad, pero se sospecha que puede ser prolongado43. Este hecho, junto con la alta prevalencia de colonización, convierte a estos pacientes en un grupo importante como posible reservorio y fuente de transmisión para otros sujetos susceptibles.
- b)
El segundo grupo de interés corresponde a pacientes con enfermedades pulmonares crónicas. Algunos de éstos, al ser expectoradores crónicos habituales, podrían ser un eslabón importante en la transmisión de P. jirovecii a otros individuos. De hecho, se han identificado genotipos similares del hongo entre pacientes con enfermedades pulmonares crónicas y pacientes con PCP44. Entre los pacientes con enfermedad pulmonar crónica se ha descrito una prevalencia de colonización del 40,5% en los casos con enfermedad pulmonar obstructiva crónica (EPOC)45 y del 21,5% en los casos de fibrosis quística46. En pacientes con enfermedad intersticial pulmonar, la colonización observada es del 33,8%, con variaciones entre las distintas entidades: el 37,8% en la neumopatía intersticial idiopática; el 19,8% en la sarcoidosis, y el 37% en otras enfermedades intersticiales pulmonares47. Se considera que el uso de corticoides puede ser un factor de riesgo independiente para la colonización en estos sujetos48. Está bien establecido que la PCP desencadena una intensa respuesta inflamatoria, de tal forma que la gravedad del cuadro clínico es independiente de la cantidad de hongo en los pulmones49. En esta misma línea, se ha observado en modelos animales que la colonización produce también una respuesta inflamatoria que sucede desde etapas muy iniciales de la infección. En monos portadores del virus de la inmunodeficiencia del simio, la colonización por Pneumocystis provoca inflamación de las vías aéreas, con aumento de citocinas proinflamatorias y neutrófilos en el lavado broncoalveolar, así como deterioro de la función pulmonar50,51. En pacientes con EPOC se ha descrito una prevalencia de colonización más elevada entre aquéllos con estadios más avanzados de la enfermedad. Así, la prevalencia de colonización fue del 36,7%, en pacientes en estadio iv de la clasificación GOLD (Global Initiative for Chronic Obstructive Lung Disease) frente al 10% en los estadios ii o iii de la clasificación GOLD. Estos datos demuestran un papel de la colonización por P. jirovecii como cofactor en la progresión de la EPOC52.
- c)
El personal sanitario constituye otro grupo de población que ha sido motivo de estudio para la colonización por Pneumocystis. El primer trabajo sobre el tema no logró detectar la presencia de P. jirovecii en el lavado orofaríngeo de una pequeña muestra de profesionales en contacto con pacientes con PCP53. Sin embargo, estudios posteriores en los que se utilizaron frotis nasal54 y aspirado nasal o esputo inducido55 comprobaron la existencia de colonización transitoria en profesionales sanitarios, como médicos y enfermeras, que atendían a pacientes con PCP. Un amplio estudio que evaluó la presencia de colonización mediante la utilización de muestras de enjuague orofaríngeo de 164 profesionales sanitarios que desarrollaban su trabajo en diferentes áreas de un hospital universitario encontró una prevalencia de colonización del 8% entre los trabajadores que atendían a pacientes inmunodeprimidos y niños, los que podrían ser la fuente de infección para estos profesionales56. A su vez, el personal sanitario colonizado puede convertirse también en una fuente de transmisión del hongo para individuos susceptibles dentro del ambiente hospitalario, como indica la reciente demostración de la capacidad de transmisión de Pneumocystis desde sujetos inmunocompetentes colonizados57.
- d)
En las mujeres embarazadas también se ha estudiado la colonización por P. jirovecii y se ha descrito una prevalencia del 15% en un estudio que evaluó a 33 gestantes en el tercer trimestre de embarazo58. La colonización en esta población se ha relacionado con las alteraciones de la inmunidad celular y humoral que ocurren durante el embarazo y que podrían provocar algún grado de «leve deficiencia del sistema inmune»59. Un punto importante para resaltar es que la colonización en las mujeres gestantes puede representar un reservorio con especial riesgo para transmisión al recién nacido. En este sentido, se demostró en un modelo animal que Pneumocystis podía detectarse en el frotis oral del 80% de los ratones 2 h después de su nacimiento y prácticamente en todos a las 48h60. En seres humanos se han descrito genotipos iguales del hongo en cuadros concomitantes de PCP de una madre y de su hijo de un mes de edad, lo que apoya la hipótesis de la transmisión maternofilial61.
Los datos de estudios recientes demuestran que los individuos sanos pueden ser colonizados y servir como reservorio para el hongo. En el modelo animal se demostró mediante PCR y estudios histológicos que Pneumocystis puede proliferar en el pulmón de ratones inmunocompetentes que actúan como reservorios y fuentes de infección62. En seres humanos, un único estudio ha detectado la presencia de ADN de P. jirovecii en el 20% de los lavados orofaríngeos de una muestra de 50 individuos sanos63. Se necesitan estudios más amplios que establezcan la prevalencia de la colonización por Pneumocystis en la población general y sus implicaciones epidemiológicas.
La prevalencia de las infecciones oportunistas en los pacientes con sida cayó considerablemente después de la introducción del tratamiento antirretrovírico de alta eficacia64. Por otro lado, la población de individuos susceptibles a PCP por otras causas de inmunosupresión parece estar aumentando, en virtud de los nuevos tratamientos que están surgiendo para diversas enfermedades, como ocurre en los pacientes trasplantados, que representan una de las poblaciones susceptibles con más riesgo65. Más recientemente, varios estudios han observado la PCP como una infección oportunista con elevada mortalidad en pacientes con enfermedades reumatológicas y con enfermedad inflamatoria intestinal que han recibido tratamiento con agentes inmunosupresores, especialmente los agentes biológicos antifactor de necrosis tumoral α66,67. La detección de la colonización por Pneumocystis en estos pacientes puede ser una buena estrategia para identificar sujetos con mayor riesgo de PCP. En este sentido, se ha propuesto la utilización de técnicas moleculares en enjuagues orofaríngeos como método de cribado para identificar la presencia de colonización antes de iniciar el tratamiento inmunosupresor68,69.
Colonización y transmisión de un genotipo mutanteLa asociación de trimetoprim con sulfametoxazol (TMS) es la primera opción para el tratamiento y la profilaxis de la infección por P. jirovecii70. Ambos fármacos inhiben la síntesis del folato: la sulfamida interfiere en la acción de la dihidropteroato sintasa (DHPS) y el trimetoprim interfiere en la acción de la dihidrofolato reductasa. Según se ha demostrado en el modelo animal, la acción del TMS sobre Pneumocystis se debe a la actividad de la sulfamida71.
Se ha descrito la existencia de mutaciones puntuales de regiones conservadas del gen de la DHPS de diferentes microorganismos, como Streptococcus pyogenes o Plasmodium falciparum, que confieren resistencia a las sulfamidas72,73. Mutaciones de este tipo se han identificado en aislados de P. jirovecii procedentes de pacientes con PCP, pero dado que P. jirovecii no puede cultivarse in vitro, los métodos tradicionales para medir la resistencia a fármacos no han podido emplearse. Estas mutaciones consisten en cambios puntuales de nucleótidos, que se traducen en sustituciones de aminoácidos en la enzima: 55 Thr→Ala y 57 Pro→Ser. La presencia de ambas mutaciones a la vez se ha vinculado a un mayor grado de resistencia74. Los resultados de los estudios clínicos disponibles no han podido demostrar en todos los casos una peor respuesta al tratamiento de la PCP en los sujetos portadores de mutaciones75,76, lo que parece indicar que las altas dosis de TMS utilizadas para el tratamiento de la PCP son capaces de superar el grado de resistencia conferido por estas mutaciones; sin embargo, el surgimiento de nuevas mutaciones podría cambiar esta situación77.
Se ha descrito que hay diferencias geográficas en la prevalencia de estas mutaciones. En países desarrollados se ha observado la presencia de mutaciones hasta en un 91% de los sujetos con PCP que recibían quimioprofilaxis con sulfamidas78. Por el contrario, en los países en vías de desarrollo la prevalencia en pacientes con PCP es muy baja, oscila entre un 0 y un 13,3% en estudios realizados en Asia, África y Sudamérica77–80. No obstante, a pesar de la baja prevalencia referida, el avance en la epidemia de sida (especialmente en África) obliga a mantener la alerta para detectar un posible crecimiento de la resistencia de P. jirovecii a sulfamidas81.
Un aspecto importante para tener en cuenta es la posibilidad de que individuos colonizados por un genotipo mutante puedan transmitirlo a otros individuos susceptibles al desarrollo de PCP. En este sentido, los estudios que han vinculado la presencia de mutaciones de la DHPS con el lugar de residencia (y no con el lugar de nacimiento) apoyarían la hipótesis de la transmisión persona a persona33. Entre los pacientes expuestos a profilaxis con TMS de 3 ciudades norteamericanas se observaron prevalencias de mutaciones del 54,2, el 77,8 y el 81,2%, respectivamente82. Un trabajo ha mostrado de forma preocupante que la transmisión de las mutaciones viene ocurriendo de manera significativa en la ciudad de San Francisco (EE. UU.), en la que el 71% de los casos de PCP en individuos con diagnóstico reciente de sida ya presentaban Pneumocystis con mutaciones de la DHPS83. También se ha descrito la presencia de mutaciones en pacientes con EPOC, que podrían ser un importante reservorio para estos genotipos de P. jirovecii con mutaciones vinculadas a la resistencia a sulfamidas45.
Perspectivas futurasLa colonización del ser humano por P. jirovecii ha despertado el interés de los investigadores que buscan comprender mejor el comportamiento de este hongo atípico. Es posible que estudios futuros en el área de la epidemiología molecular de P. jirovecii aporten más información en relación con la duración de la colonización en las diversas poblaciones citadas y con el papel que este microorganismo puede tener en la patogénesis de algunas enfermedades pulmonares crónicas, como la EPOC. La utilización de métodos no invasivos como el lavado orofaríngeo, que ha demostrado ser comparable al esputo o al lavado broncoalveolar para la detección de la colonización, ayuda a la realización de nuevos estudios que permitan profundizar en el conocimiento de la epidemiología de este patógeno.
Este microorganismo coloniza frecuentemente diversos grupos de población, y es posible erradicarlo con sulfamidas u otros fármacos. Se necesitan nuevas pruebas para comprobar la utilidad clínica de administrar tratamiento antimicrobiano para la colonización por Pneumocystis, pero es posible que sea beneficioso tratar con éstos a los individuos colonizados con riesgo de desarrollo de PCP (pacientes trasplantados, infectados por VIH, con neoplasias, enfermedades reumatológicas o digestivas) o para reducir daños potenciales en sujetos con enfermedades pulmonares crónicas. Por otra parte, los datos epidemiológicos disponibles hacen aconsejable plantear el aislamiento respiratorio de los pacientes con PCP para evitar el contagio de sujetos susceptibles de desarrollo de neumonía por parte de este patógeno; sin embargo, no hay estudios en la actualidad que hayan evaluado la eficacia de esta medida.
Este trabajo forma parte del proyecto ERA-NET “Pneumocystis-PathoGenoMics: Unravelling the Colonization-to-Disease Shift”. El Dr. Wissmann ha contado con la ayuda de una Beca de formación posdoctoral otorgada por el Ministerio de Ciencia y Tecnología de Brasil (Conselho Nacional de Desenvolvimento Científico e Tecnológico-CNPq).